6 січня, 2024
Ведення пацієнтів із простатитом при ДГПЗ: можливості протизапальної терапії
 Запалення є загальновизначеною детермінантою, яка лежить в основі патогенезу й прогресування захворювань передміхурової залози (ПЗ), зокрема доброякісної гіперплазії та раку простати. Численні епідеміологічні, гістопатологічні та молекулярно-патологічні дослідження підтверджують тісний зв’язок між інтенсивністю запалення ПЗ і прогресуванням доброякісної гіперплазії передміхурової залози (ДГПЗ), асоційованої із симптомами нижніх сечових шляхів (СНСШ) [1]. Екстракт плодів американської карликової пальми Serenoa repens є найбільш вивченим фітотерапевтичним препаратом, який широко використовується для лікування СНСШ [2]. Доведені фармакодинамічні ефекти, які проявляє Serenoa repens in vitro та in vivo, зокрема антиандрогенна активність [3], взаємодія з медіаторами запалення [4], пригнічення проліферації та індукування апоптозу як в епітелії, так і в стромі ПЗ [5], є вагомим обґрунтуванням для застосування екстракту Serenoa repens як головного протизапального агента у пацієнтів із простатитом та ДГПЗ.
Запалення є загальновизначеною детермінантою, яка лежить в основі патогенезу й прогресування захворювань передміхурової залози (ПЗ), зокрема доброякісної гіперплазії та раку простати. Численні епідеміологічні, гістопатологічні та молекулярно-патологічні дослідження підтверджують тісний зв’язок між інтенсивністю запалення ПЗ і прогресуванням доброякісної гіперплазії передміхурової залози (ДГПЗ), асоційованої із симптомами нижніх сечових шляхів (СНСШ) [1]. Екстракт плодів американської карликової пальми Serenoa repens є найбільш вивченим фітотерапевтичним препаратом, який широко використовується для лікування СНСШ [2]. Доведені фармакодинамічні ефекти, які проявляє Serenoa repens in vitro та in vivo, зокрема антиандрогенна активність [3], взаємодія з медіаторами запалення [4], пригнічення проліферації та індукування апоптозу як в епітелії, так і в стромі ПЗ [5], є вагомим обґрунтуванням для застосування екстракту Serenoa repens як головного протизапального агента у пацієнтів із простатитом та ДГПЗ.
Ключові слова: доброякісна гіперплазія передміхурової залози, симптоми нижніх сечових шляхів, запалення, екстракт Serenoa repens, фітопрепарат, Простамол® Уно.
Запалення як ключова ланка патогенезу ДГПЗ
Проведене впродовж останніх десятиліть лонгітюдне та крос-секційне спостережне дослідження кількох великих когорт пацієнтів підтвердило, що хронічне запалення є вирішальним компонентом патогенезу ДГПЗ (Roehrborn C.G. et al., 2005; 2007). Автори дослідження Medical Therapy of Prostatic Symptoms (MTOPS), у якому оцінювали прогресування ДГПЗ за результатами біопсій ПЗ 1197 чоловіків, що знаходилися під спостереженням протягом більш ніж чотирьох років, продемонстрували, що пацієнти із групи плацебо з гістологічно підтвердженим запаленням ПЗ значно частіше страждали від погіршення симптомів ДГПЗ і мали вищий ризик гострої затримки сечі або хірургічного втручання, пов’язаного із ДГПЗ, порівняно з тими, хто не мав ознак запалення в біоптатах [6].
Тісний взаємозв’язок між ступенем прогресування ДГПЗ та запаленням був також підтверджений аналізом підгрупи 8224 чоловіків у дослідженні Reduction by Dutasteride of Prostate Cancer Events (REDUCE). Учені доповіли, що гістологічні зміни запального характеру були діагностовані у понад 78% чоловіків із ДГПЗ, а також встановили лінійну залежність між тяжкістю СНСШ та інтенсивністю запалення [7].
F. Di Silverio et al. (2003) провели ретроспективний аналіз біоптатів ПЗ 3942 пацієнтів із ДГПЗ, за результатами якого 43% чоловіків мали ознаки запалення простати (69% із них – хронічного); крім того, було встановлено, що запалення значно посилюється зі збільшенням об’єму залози та з віком [8].
J. Li et al. (2022) виявили, що специфічна роль запалення в розвитку ДГПЗ проявляється перш за все в сильному зв’язку між гістологічним простатитом, клінічними симптомами та об’ємом ПЗ [9]. Гістологічні ознаки простатиту часто визначаються у тканинах ПЗ пацієнтів, які страждають на ДГПЗ [10]. Згідно з даними наукових публікацій, наявність запального інфільтрату призводить до ушкодження тканин ПЗ і хронізації процесу, що згодом може спричинити збільшення об’єму простати. Внаслідок ушкодження епітелію ПЗ перигландулярні тканини піддаються впливу секрету простати, який має високу протеолітичну активність. Ці виділення можуть руйнувати клітини сполучної тканини, а також сприяти глибокому проникненню молекул аутоантигену в імунну систему ПЗ. Крім того, такі несприятливі чинники, як інфекційні агенти, сечовий рефлюкс, метаболічний синдром, зміни рівнів статевих гормонів, процес старіння та аутоімунна відповідь, беруть участь у виникненні запальної інфільтрації тканини ПЗ через різні молекулярні шляхи та викликають імунні розлади у залозі. Таким чином, ДГПЗ може бути імунним запальним захворюванням, а її розвиток і прогресування, швидше за все, пов’язані з хронічним запаленням.
Результати дослідження S. Fujikawa et al. (2005) продемонстрували, що лімфоцити вперше можна ідентифікувати в структурі ПЗ уже в ранньому віці (у 10 років), у 30‑річному віці спостерігаються розширення залоз і вузлова гіперплазія, і вже до 40 років формуються гістологічні зміни, характерні для ДГПЗ. У пацієнтів цієї категорії має місце тенденція до збільшення об’єму ПЗ та розвитку запального процесу, що посилюється з віком. Так, збільшення об’єму (р<0,01) спостерігалося в усіх структурах залозистого епітелію, просвіту залози та її строми починаючи з четвертого десятиліття життя, що супроводжувалося динамічними змінами активності клітинної проліферації [11].
Патофізіологія запального процесу у тканинах ПЗ
У ПЗ містяться кілька класів імунокомпетентних клітин (лімфоцитів, макрофагів і гранулоцитів), які формують простат-асоційовану лімфоїдну тканину (PALT). Активація внутрішньозалозистої імунної системи PALT є звичайною відповіддю на інфекцію. Однак вважається, що початкове гостре запалення може перейти у хронічний процес, який зберігається за наявності гормональних і метаболічних порушень, впливу факторів навколишнього середовища та дієти, а також за відсутності адекватної фармакологічної терапії [12].
Активована PALT стимулює проліферацію інших імунокомпетентних клітин, що призводить до підвищення синтезу прозапальних хемокінів і цитокінів [13]. Стромальні клітини ПЗ, які виступають у якості мішеней бактеріальних або вірусних агоністів toll-подібних рецепторів (TLR), а пізніше як антигенпрезентуючі клітини (APC), відіграють вирішальну роль в індукції запальних реакцій. Вони фактично активують CD4+-лімфоцити та сприяють їх диференціюванню до ефекторних субгруп Th1 і Th17 [14]. Крім того, активація TLR сприяє індукції прозапальних цитокінів (інтерлейкін [IL] 6) і хемокінів (IL‑8 і CXCL10), здатних залучати до запального процесу CXCR1- і CXCR2‑позитивні лейкоцити та CD15+-нейтрофіли й додатково сприяти гіперплазії клітин ПЗ шляхом прямої дії IL‑8 або вивільнення інших інтрапростатичних факторів росту, таких як основний фактор росту фібробластів (FGF) [15].
Стромальні клітини ПЗ здатні секретувати IL‑8, CXCL‑10 та IL‑6 не лише у відповідь на специфічні прозапальні стимули (тобто вплив фактора некрозу пухлини α або агоніста TLR4 – ліпополісахариду), а й на метаболічні порушення, зокрема на окислені ліпопротеїди низької щільності та інсулін. Це підтверджує гіпотезу про те, що ліпіди можуть індукувати й підтримувати запальну реакцію в клітинах ПЗ людини. Загалом, це вказує на багатофакторність патогенезу ДГПЗ і важливу роль у ньому метаболічного синдрому.
Виникнення СНСШ на фоні ДГПЗ класично вважалося звичним наслідком процесу старіння та збільшення ПЗ в об’ємі, що супроводжується стисненням уретри [16]. Однак ця гіпотеза була заперечена понад десять років тому, і наразі ДГПЗ розглядається не лише як гідравлічне порушення, яке можна усунути хірургічним шляхом, а й як метаболічна проблема, яку слід вирішувати за допомогою мультидисциплінарного підходу, враховуючи складну мультифакторну патофізіологію, провідна роль у якій належить запаленню.
Serenoa repens: багатовекторний механізм дії та клінічно доведена протизапальна активність
Serenoa repens проявляє лікувальний ефект щодо симптомів ДГПЗ шляхом багатьох різних механізмів:
- інгібування 5α-редуктази [17];
- пригнічення зв’язування 5α-дигідротестостерону з рецепторами андрогенів [18];
- зниження регуляції ядерних і цитозольних андрогенних рецепторів [19];
- інгібування 17‑гідроксистероїддегідрогенази, яка є зворотним окислювачем тестостерону [20];
- антиестрогенний ефект (естрогени сприяють розвитку ДГПЗ, пригнічуючи гідроксилювання та елімінацію 5α-дигідротестостерону) [21];
- пригнічення проліферації ПЗ, індукованої фактором росту фібробластів [22];
- пригнічення росту ПЗ, індукованого пролактином [23];
- протизапальна та протинабрякова дія [24].
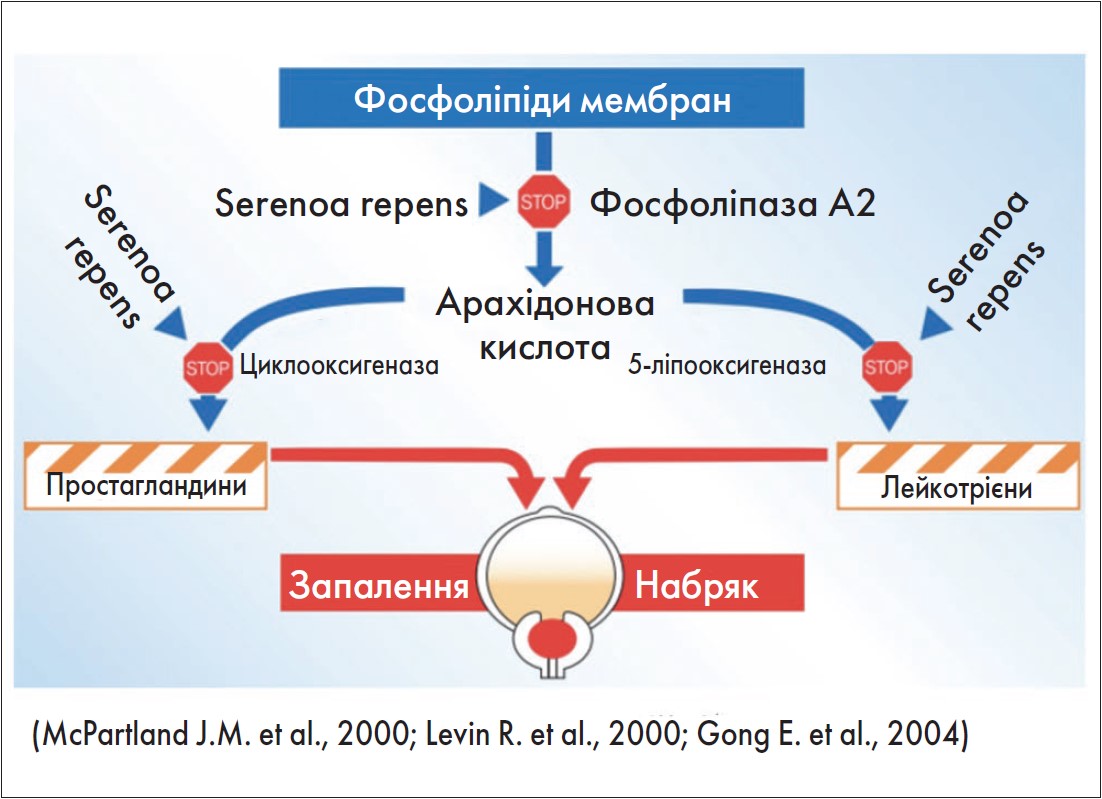
Результати дослідження I. Silvestri et al. (2013) підтвердили гіпотезу про те, що Serenoa repens має інгібуючий вплив на експресію генів, пов’язаних із запаленням [25]. W. Breu et al. (1992) та J.P. Tarayre et al. (1983) довели, що Serenoa repens in vitro є подвійним інгібітором циклооксигенази і 5‑ліпоксигеназного шляху трансформації арахідонової кислоти, метаболіти якої сприяють запаленню [26, 27] (рисунок).
Рис. Комплексна протизапальна дія Простамол® Уно у клітинах передміхурової залози
У дослідженні S. Gravas et al. (2019) пацієнти із запаленням ПЗ, гістологічно підтвердженим за допомогою біопсії під контролем трансректального ультразвукового дослідження, були рандомізовані у дві групи: прийому препарату на основі екстракту Serenoa repens (320 мг/добу) або відсутності лікування [28]. Друга біопсія була виконана через 6 міс відповідно до стандартів клінічної практики. Запалення оцінювали за шкалою Irani та шляхом імуногістохімічного фарбування з використанням антитіл CD3, CD4 і CD8 (для Т-лімфоцитів), CD20 (для В-лімфоцитів) і CD163 (для макрофагів). Результати дослідження продемонстрували, що у групі Serenoa repens середній бал оцінки простатичного запалення та його агресивності значно зменшився – з 1,55 та 1,55 на початку дослідження до 0,79 (p=0,001) та 0,87 (p=0,001) після другої біопсії відповідно. Середнє зниження всіх показників запалення було статистично більш вираженим у пацієнтів, які отримували препарат на основі екстракту Serenoa repens, порівняно з контрольною групою. Крім того, за результатами імуногістохімічного фарбування, зміна експресії кожного аналізованого антитіла у групі Serenoa repens була статистично значущою порівняно з групою контролю.
A. Latil et al. (2015) доповіли про результати найбільшого рандомізованого клінічного дослідження, метою якого було вивчення протизапальних ефектів медикаментозного лікування пацієнтів із хронічним запаленням ПЗ, пов’язаним із ДГПЗ. За допомогою неінвазивного методу вивчалася експресія генів маркерів запалення епітеліальних клітин ПЗ, що десквамуються у просвіт залоз і сім’яну плазму після ректального цифрового дослідження (DRE) [29]. Сприятлива протизапальна активність екстракту Serenoa repens спостерігалася у 73,3% мРНК маркерів (включаючи номінально значущу різницю для одних із 15 найбільш часто експресованих генів – HIF1A [р=0,008] і PTGES3 [р=0,0038]) порівняно із 26,6% — при застосуванні тамсулозину. Середня експресія білків MCP‑1/CCL2 (хемотаксичний білок, який відіграє вирішальну роль в активації моноцитів і макрофагів при запальних захворюваннях та стимулює збільшення проліферації клітин, що потенційно призводить до збільшення ПЗ) і IP‑10/CXCL10 (відіграє важливу роль у транспортуванні моноцитів і активованих Т-клітин) була значно знижена на фоні лікування екстрактом Serenoa repens, тоді як після прийому тамсулозину фіксувалося її підвищення. Учені зазначили, що у 50% пацієнтів, які отримували лікування екстрактом Serenoa repens, було зареєстровано значне зниження рівня Т-клітинного плейотропного запального цитокіну – інгібітора фактора міграції макрофагів (MIF). Стромальні фібробластичні клітини ПЗ можуть секретувати цитокіни MCP‑1/CCL2 та IP‑10/CXCL10 [30], які здатні активувати CD4+-клітини у запаленій ПЗ, тим самим генеруючи імунну відповідь, що призводить до розвитку хронічного імуноопосередкованого руйнування тканини та індукції фіброміоматозу, як це спостерігається в патогенезі ДГПЗ [31]. Таким чином, пригнічення MCP‑1/CCL2 та IP‑10/CXCL10 за допомогою екстракту Serenoa repens у пацієнтів із вираженим хронічним запаленням ПЗ може запобігти прогресуванню симптомів СНСШ на фоні ДГПЗ.
Оптимальна фармакологічна стратегія при ДГПЗ: актуальні європейські рекомендації
Згідно з позиціями гайдлайну Європейської асоціації урології (EAU, 2023), гексановий екстракт Serenoa repens (HESr) рекомендовано для лікування СНСШ, асоційованих із ДГПЗ, як фітопрепарат із доведеним профілем ефективності та низьким ризиком несприятливих явищ, зокрема з боку статевої функції. Аналіз усіх доступних опублікованих даних щодо HESr продемонстрував середнє значуще покращення СНСШ за Міжнародною шкалою оцінки простатичних симптомів (IPSS) на 5,73 бала порівняно з вихідним рівнем (95% ДІ 6,91-4,54) [32].
Варто зазначити, що фітохімічне дослідження СО2-, гексанового та етанольного екстрактів Serenoa repens не встановило істотної різниці між ними за складом. Виявлені відмінності були менш значущими, ніж відмінності від партії до партії одного й того екстракту, пов’язані з природними чинниками. Тому спиртовий екстракт Serenoa repens – Простамол® Уно еквівалентний за ефективністю гексановому екстракту [33].
I. Sinescu et al. (2011) оцінювали довгострокову ефективність лікування Простамолом Уно у пацієнтів із СНСШ, асоційованими із ДГПЗ. Учені дійшли висновку, що тривалий прийом фітопрепарату в дозі 320 мг чинить сприятливий ефект щодо покращення оцінки за шкалою IPSS (на 5,5 бала), індексу якості життя (QoL) (на 1,8 бала), Qmax (на 5,6 мл/с) та зменшення об’єму залишкової сечі. Середній об’єм простати через 24 міс становив 36 мл порівняно із 39,8 мл на початку дослідження. Крім того, прийом Простамолу Уно позитивно позначався на статевій функції, про що свідчило статистично значуще збільшення Міжнародного індексу еректильної функції (IIEF) (на 6,4 бала) [34]. Простамол® Уно довів свою клінічну ефективність у купіруванні СНСШ у пацієнтів із тривалою ДГПЗ та хронічним абактеріальним простатитом у дослідженні, проведеному на базі ДУ «Інститут урології ім. академіка О.Ф. Возіанова НАМН України» (Гурженко Ю.М. та співавт., 2005).
Результати десятирічного спостережного дослідження Yu.G. Alyaev et al. (2013), у якому вивчалась ефективність безперервного лікування Простамолом Уно в дозі 320 мг/добу у пацієнтів із симптомами ДГПЗ та ризиком її прогресування, показали що прийом препарату сприяє зниженню ризику прогресування захворювання як за суб’єктивними (сума балів за шкалами IPSS, QoL), так і за об’єктивними (розміри ПЗ, Qmax, об’єм залишкової сечі) критеріями [35].
Переваги препарату також були доведені в ході багатоцентрового відкритого популяційного рандомізованого порівняльного дослідження A.Z. Vinarov et al. (2010). Автори встановили, що прийом Простамолу Уно в дозі 320 мг протягом трьох років пацієнтами із симптомами ДГПЗ асоціювався з покращенням об’єктивних критеріїв захворювання (купірування симптомів за шкалою IPSS та зменшення розмірів ПЗ), а також підвищенням якості життя [36].
У свою чергу F.K. Habib et al. виявили, що Простамол® Уно не впливає на концентрацію простат-специфічного антигену (ПСA) у пацієнтів із ДГПЗ [37]. Оскільки ПСA є основним сироватковим маркером для діагностики та прогресування раку ПЗ [38], вкрай важливо, щоб лікування не перешкоджало виробленню антигену простатою для відображення у ній патологічних змін. На відміну від інших інгібіторів 5α-редуктази, які знижують експресію гену ПСA та секрецію його всередині клітини, препарати на основі екстракту Serenoa repens блокують активність 5α-редуктази епітеліальних клітин ПЗ, не перешкоджаючи їхній здатності виділяти ПСA [39].
У ході відкритого обсерваційного дослідження безперервного застосування екстракту Serenoa repens у дозі 320 мг/добу протягом 15 років було встановлено, що цей засіб є безпечним й ефективним у запобіганні прогресуванню ДГПЗ, що було підтверджено як за суб’єктивними (сума балів за шкалами IPSS і QoL), так і за об’єктивними (розміри простати, частота сечовипускання, об’єм залишкової сечі) критеріями. Крім того, терапія фітопрепаратом не була пов’язана із жодним побічним явищем, включаючи рак простати [40].
Результати дослідження ПРОСПЕКТ IV (ПРОСтамол: ПЕрспективи Комбінованої Терапії), метою якого була оцінка клінічної ефективності та безпеки дев’ятирічної терапії хворих на ДГПЗ комбінацією Флосін® + Простамол® Уно, продемонстрували, що ця фармакологічна комбінація сприяє купіруванню СНСШ та покращенню об’єктивних даних урологічного статусу, а також підвищенню якості життя пацієнтів (Гурженко Ю.М., Спиридоненко В.В., 2020). Водночас L. Boeri et al. (2017) встановили, що комбінація α1‑блокатора з HESr сприяє більш клінічно значущому зменшенню проявів СНСШ у пацієнтів із ДГПЗ порівняно з монотерапією α1‑блокатором [41]. За висновками дослідження, частка пацієнтів із групи HESr + α1‑блокатор, які мали значне полегшення симптомів ДГПЗ, становила 69,9% – порівняно із 30,1% тих, хто отримував тільки α1‑блокатор. Крім того, покращення оцінки за шкалою IPSS більш ніж на 25% було відзначено у 68,8 і 31,2% пацієнтів у групах комбінованої та монотерапії відповідно.
Екстракт Serenoa repens (Простамол® Уно) успішно використовується для терапії ДГПЗ та хронічного простатиту в усьому світі. Завдяки доведеній протизапальній та протинабряковій активності препарат діє на ключові ланки патогенезу ДГПЗ, запобігаючи прогресуванню захворювання та полегшуючи СНСШ. Простамол® Уно має сприятливий профіль безпеки, не змінює концентрацію ПСA й не позначається на статевій функції чоловіків із ДГПЗ та простатитом.
Література
- Alcaraz A., Hammerer P., Tubaro A., Schroder F. H., Castro R. Is there evidence of a relationship between benign prostatic hyperplasia and prostate cancer? Findings of a literature review. Eur Urol. 2009;55:864-875. doi: 10.1016/j.eururo.2008.11.011.
- Silvestri I., Cattarino S., Aglianò A., Nicolazzo C., Scarpa S., Salciccia S., Frati L., Gentile V., Sciarra A. Effect of Serenoa repens (Permixon®) on the expression of inflammation-related genes: analysis in primary cell cultures of human prostate carcinoma. J Inflamm (Lond). 2013 Mar 14;10:11. doi: 10.1186/1476-9255-10-11.
- Carilla E., Briley M., Fauran F., Sultan C., Duvilliers C. Binding of Permixon, a new treatment for prostatic benign hyperplasia, to the cytosolic androgen receptor in the rat prostate. J Steroid Biochem. 1984;20(1):521-523. doi: 10.1016/0022-4731(84)90265-6.
- Vela Navarrete R., Garcia Cardoso J. V., Barat A., Manzarbeitia F., Lуpez F. A. BPH and inflammation: pharmacological effects of Permixon on histological and molecular inflammatory markers. Results of a double blind pilot clinical assay. Eur Urol. 2003;44(5):549-555. doi: 10.1016/S0302-2838(03)00368-3.
- Vacherot F., Azzouz M., Gil-Diez-De-Medina S. Induction of apoptosis and inhibition of cell proliferation by the lipido-sterolic extract of Serenoa repens (LSESr, Permixon®) in benign prostatic hyperplasia. Prostate. 2000;45(3):259-266. doi: 10.1002/1097-0045(20001101)45:3<259: AID-PROS9>3.0.CO;2-G.
- Roehrborn C.G., Nuckolls J.G., Wei J.T., Steers W. The benign prostatic hyperplasia registry and patient survey: study design, methods and patient baseline characteristics. British Journal of Urology International. 2007;100(4):813-819.
- Nickel J.C., Roehrborn C.G., O’Leary M.P., Bostwick D.G., Somerville M.C., Rittmaster R.S. The relationship between prostate inflammation and lower urinary tract symptoms: examination of baseline data from the REDUCE trial. European Urology. 2008;54(6):1379-1384.
- Di Silverio F., Gentile V., de Matteis A. et al. Distribution of inflammation, pre-malignant lesions, incidental carcinoma in histologically confirmed benign prostatic hyperplasia: a retrospective analysis. European Urology. 2003;43(2):164-175.
- Li J., Li Y., Cao D., Huang Y., Peng L., Meng C., Wei Q. The association between histological prostatitis and benign prostatic hyperplasia: a single-center retrospective study. Aging Male. 2022 Dec;25(1):88-93. doi: 10.1080/13685538.2022.2050360.
- Robert G., Descazeaud A., Nicolaïew N. et al. Inflammation in benign prostatic hyperplasia: a 282 patients’ immunohistochemical analysis. Prostate. 2009;69(16):1774-1780.
- Fujikawa S., Matsuura H., Kanai M., Fumino M., Ishii K., Arima K., Shiraishi T., Sugimura Y. Natural history of human prostate gland: Morphometric and histopathological analysis of Japanese men. Prostate. 2005 Dec 1;65(4):355-64. doi: 10.1002/pros.20208.
- Vignozzi L., Rastrelli G., Corona G., Gacci M., Forti G., Maggi M. Benign prostatic hyperplasia: a new metabolic disease? Journal of Endocrinological Investigation. 2014.
- Adorini L., Penna G., Fibbi B., Maggi M. Vitamin D receptor agonists target static, dynamic, and inflammatory components of benign prostatic hyperplasia: annals of the New York Academy of Sciences. Annals of the New York Academy of Sciences. 2010;1193:146-152.
- Penna G., Fibbi B., Amuchastegui S. et al. Human benign prostatic hyperplasia stromal cells as inducers and targets of chronic immuno-mediated inflammation. Journal of Immunology. 2009;182(7):4056-4064.
- Vignozzi L., Gacci M., Cellai I. et al. Fat boosts, while androgen receptor activation counteracts, BPH-associated prostate inflammation. Prostate. 2013;73(8):789-800.
- Corona G., Vignozzi L., Rastrelli G., Lotti F., Cipriani S., Maggi M. Benign prostatic hyperplasia: a new metabolic disease of the aging male and its correlation with sexual dysfunctions. Int J Endocrinol. 2014;2014:329456. doi: 10.1155/2014/329456.
- Bayne C.W., Grant E.S., Chapman K. et al. Characterisation of a new co-culture model for BPH which expresses 5 alpha-reductase types I and II: the effects of Permixon on DHT formation. J Urol 1997;157(suppl 4):19.
- Briley M., Carilla E., Roger A. Inhibitory effect of Permixon on testosterone 5α-reductase activity of the rat ventral prostate. Br J Pharmacol 1984;83:401.
- Ravenna L., Di Silverio F., Russo M.A., Salvatori L., Morgante E., Morrone S. et al. Effects of the lipidosterolic extract of Serenoa repens (Permixon) on human prostatic cell lines. Prostate 1996;29:219-230.
- Tуth I., Szйcsi M., Julesz J., Faredin I., Behnke B. In vitro inhibition of testicular delta 5-3-hydroxysteroid dehydrogenase and prostatic 5α-reductase activities in rats and humans by Strogen forte extract. Int Urol Nephrol 1996;28: 337-48.
- Paubert-Braquet M., Richardson F.O., Servent-Saez N., Gordon W.C., Monge M.C., Bazan N.G. et al. Effect of Serenoa repens extract (Permixon) on estradiol/testosterone-induced experimental prostate enlargement in the rat. Pharmacol Res 1996;34:171-17.
- Paubert-Braquet M.P., Cousse H., Raynaud J. P., Mencia-Huerta J.M., Braquet P. Effect of the lipidosterolic extract of Serenoa repens (Permixon) and its major components on basic fibroblast growth factor-induced proliferation of cultures of human prostate biopsies. Eur Urol 1998;33:340-347.
- Vacher P., Prevarskaya N., Skryma R., Audy M.C., Vacher A.M., Odessa M.F. et al. The lipidosterolic extract from Serenoa repens interferes with prolactin receptor signal transduction. J Biomed Sci 1995;2:357-365.
- Ragab A., Ragab-Thomas J.M.F., Delhon A., Tisne-Versailles J., Gassama-Diagne A., Fauvel J. et al. Effects of Permixon (Sereprostat in Spain) on phospholipase A2 activity and on arachidonic acid metabolism in cultured prostatic cells. Acta Medica (Edizioni e Congressi Roma) 1987;1:293-296.
- Silvestri I., Cattarino S., Aglianò A., Nicolazzo C., Scarpa S., Salciccia S., Frati L., Gentile V., Sciarra A. Effect of Serenoa repens (Permixon®) on the expression of inflammation-related genes: analysis in primary cell cultures of human prostate carcinoma. J Inflamm (Lond). 2013 Mar 14;10:11.doi: 10.1186/1476-9255-10-11
- Breu W., Hagenlocher M., Redl K., Tittel G., Stadler F., Wagner H. Antiphlogistische Wirkung eines mit hyperkritischem Kohlendioxid gewonnenen Sabalfrucht-Extraktes. In-vitro-Hemmung des Cyclooxygenase- und 5-Lipoxygenase-Metabolismus [Anti-inflammatory activity of sabal fruit extracts prepared with supercritical carbon dioxide. In vitro antagonists of cyclooxygenase and 5‑lipoxygenase metabolism]. Arzneimittelforschung. 1992 Apr;42(4):547-51.
- Tarayre J.P., Delhon A., Lauressergues H., Stenger A., Barbara M., Bru M., Villanova G., Caillol V., Aliaga M. Action anti-oedйmateuse d’un extrait hexanique de drupes de Serenoa repens Bartr [Anti-edematous action of a hexane extract of the stone fruit of Serenoa repens Bartr]. Ann Pharm Fr. 1983;41(6):559-70.
- Gravas S., Samarinas M., Zacharouli K., Karatzas A., Tzortzis V., Koukoulis G., Melekos M. The effect of hexanic extract of Serenoa repens on prostatic inflammation: results from a randomized biopsy study. World J Urol. 2019 Mar;37(3):539-544. doi: 10.1007/s00345-018-2409-1.
- Latil A., Pйtrissans M. T., Rouquet J., Robert G., de la Taille A. Effects of hexanic extract of Serenoa repens (Permixon® 160 mg) on inflammation biomarkers in the treatment of lower urinary tract symptoms related to benign prostatic hyperplasia. Prostate. 2015 Dec;75(16):1857-67. doi: 10.1002/pros.23059.
- McDowell K.L., Begley L.A., Mor-Vaknin N., Markovitz D.M., Macoska J.A. Leukocytic promotion of prostate cellular proliferation. The Prostate 2010; 70: 377-389.
- Penna G., Fibbi B., Amuchastegui S., Cossetti C., Aquilano F., Laverny G., Gacci M., Crescioli C., Maggi M., Adorini L. Human benign prostatic hyperplasia stromal cells as inducers and targets of chronic immuno-mediated inflammation. J Immunol 2009; 182: 4056-4064.
- Vela-Navarrete R. et al. Efficacy and safety of a hexanic extract of Serenoa repens (Permixon®) for the treatment of lower urinary tract symptoms associated with benign prostatic hyperplasia (LUTS/BPH): systematic review and meta-analysis of randomised controlled trials and observational studies. BJU Int, 2018. 122: 1049.
- de Combarieu E., Martinelli E.M., Pace R., Sardone N. Metabolomics study of Saw palmetto extracts based on 1H NMR spectroscopy. Fitoterapia. 2015 Apr;102:56-60. doi: 10.1016/j.fitote.2015.02.007.
- Sinescu I., Geavlete P., Multescu R., Gangu C., Miclea F., Coman I., Ioiart I., Ambert V., Constantin T., Petrut B., Feciche B. Long-term efficacy of Serenoa repens treatment in patients with mild and moderate symptomatic benign prostatic hyperplasia. Urol Int. 2011;86(3):284-9. doi: 10.1159/000322645
- Alyaev Yu.G., Vinarov A.Z., Demidko Yu.L., Spivak L.G. The results of the 10‑year study of efficacy and safety of Serenoa repens extract in patients at risk of progression of benign prostatic hyperplasia. Urologiia. 2013 Jul-Aug;(4):32-36.
- Vinarov A.Z., Aliaev Iu.G., Apolikhin O.I., Mazo E.B., Darenkov S.P., Demidko Iu.L., Lokshin K.L., Medvedev A.A., Permiakova O.V., Spivak L.G., Shkol’nikov M.E. Results of three-year clinical study of prostamol uno efficacy and safety in patients with initial symptoms of prostatic adenoma and risk of its progression. Urologiia. 2010 Nov-Dec;(6):3-10.
- Habib F.K., Ross M., Ho C.K., Lyons V., Chapman K. Serenoa repens (Permixon) inhibits the 5alpha-reductase activity of human prostate cancer cell lines without interfering with PSA expression. Int J Cancer. 2005 Mar 20;114(2):190-4. doi: 10.1002/ijc.20701
- Polascik T.J., Oesterling J.E., Partin A.W. Prostate specific antigen: a decade of discovery – what we have learnt and where we are going. J Urol 1999; 162: 293-306.
- Bayne C., Donnelly F., Ross M., Habib F.K. Serenoa repens (Permixon): a 5α-reductase types I and II inhibitor – new evidence in a co-culture model of BPH. Prostate 1999; 40: 232-41.
- Vinarov A.Z., Spivak L.G., Platonova D.V., Rapoport L.M., Korolev D.O. 15 years’ survey of safety and efficacy of Serenoa repens extract in benign prostatic hyperplasia patients with risk of progression. Urologia. 2019 Feb;86(1):17-22. doi: 10.1177/0391560318772466.
- Boeri L. et al. Clinically Meaningful Improvements in LUTS/BPH Severity in Men Treated with Silodosin Plus Hexanic Extract of Serenoa Repens or Silodosin Alone. Sci Rep, 2017. 7: 15179.