7 червня, 2024
Менопаузальна гормональна терапія у жінок з онкологічними захворюваннями в анамнезі: виклики та перспективи
 Менопауза є важливим етапом у житті кожної жінки, що характеризується припиненням менструальної функції та зниженням рівня естрогенів в організмі. Цей період супроводжується низкою фізіологічних і психологічних змін, які можуть суттєво впливати на якість життя. Менопаузальна гормональна терапія (МГТ) є ефективним методом корекції клімактеричних симптомів та покращення загального самопочуття жінок у постменопаузі. Однак призначення МГТ пацієнткам з онкологічними захворюваннями в анамнезі залишається складним і дискусійним питанням, яке потребує ретельного аналізу потенційної користі та ризиків.
Менопауза є важливим етапом у житті кожної жінки, що характеризується припиненням менструальної функції та зниженням рівня естрогенів в організмі. Цей період супроводжується низкою фізіологічних і психологічних змін, які можуть суттєво впливати на якість життя. Менопаузальна гормональна терапія (МГТ) є ефективним методом корекції клімактеричних симптомів та покращення загального самопочуття жінок у постменопаузі. Однак призначення МГТ пацієнткам з онкологічними захворюваннями в анамнезі залишається складним і дискусійним питанням, яке потребує ретельного аналізу потенційної користі та ризиків.
У рамках онлайн-вебінару «Менопауза: онкоризики в майбутньому і онкологія в анамнезі», який відбувся 28 лютого, старший науковий співробітник відділу репродуктивного здоров’я ДНУ «Центр інноваційних медичних технологій НАН України», доктор медичних наук Ольга Олексіївна Єфіменко та лікар онколог-гінеколог науково-клінічного відділу новоутворень жіночої репродуктивної системи ДНП «Національний інститут раку» Аліна Сергіївна Рекута представили спільну доповідь, у якій висвітлили сучасні підходи до призначення гормональної терапії пацієнткам менопаузального віку, зокрема з обтяженим онкологічним анамнезом.
Ключові слова: менопауза, клімактеричні симптоми, менопаузальна гормональна терапія, рак грудної залози, носійство мутацій генів BRCA1/2, рак яєчників, рак шийки матки.
О.О. Єфіменко представила клінічні випадки, що стосуються ведення жінок менопаузального віку, з акцентуванням уваги на глибшому розумінні проблем, з якими стикаються пацієнтки цього профілю, та визначенням потенційних недоліків в існуючих підходах до їх менеджменту.
Клінічний випадок 1
Пацієнтка, 49 років, звернулася зі скаргами на тяжкий перебіг клімактеричного синдрому. Незважаючи на відсутність патологічних змін за даними мамографії та ультразвукового дослідження органів малого таза, лікарі відмовили їй у призначенні МГТ через підвищений рівень D-димеру в крові.
На думку спікера, даний клінічний випадок демонструє недостатнє розуміння медичними фахівцями принципів призначення МГТ та необхідність більш глибокого аналізу індивідуальних показань і протипоказань до її застосування.
Клінічний випадок 2
Пацієнтка, 52 років, успішно отримувала МГТ комбінованим препаратом естрадіолу та дидрогестерону, що дозволило ефективно контролювати симптоми менопаузи. Однак згодом лікар необґрунтовано замінив цей препарат дидрогестероном, що не відповідає сучасним рекомендаціям із ведення менопаузи.
Цей випадок наголошує на важливості регулярного оновлення знань лікарів і дотримання міжнародних стандартів при призначенні МГТ.
Клінічний випадок 3
Пацієнтка, 40 років, якій у 17‑річному віці було проведено радикальне хірургічне лікування з приводу раку яєчників. Незважаючи на відсутність будь-якої гормональної терапії протягом наступних 23 років, жінка зберегла молодість і красу, що свідчить про потужні компенсаторні механізми організму. Водночас тривала естрогенна недостатність призвела до розвитку остеопорозу та інших обмінних порушень.
Цей випадок наочно демонструє необхідність індивідуального підходу до призначення МГТ, навіть у пацієнток з онкологічним анамнезом, з урахуванням співвідношення потенційних ризиків і користі.
А.С. Рекута у своїй доповіді «МГТ після лікування онкогінекологічних захворювань» акцентувала увагу на сучасних підходах до призначення МГТ із позицій лікаря-онколога.
У сучасній медичній спільноті спостерігається тенденція до більш прийнятного ставлення до призначення МГТ пацієнткам після лікування онкогінекологічних захворювань. Це пов’язано з появою нових результатів досліджень, які свідчать про потенційну безпечність та ефективність МГТ у певних групах онкологічних пацієнток. Однак, незважаючи на ці дані, питання призначення МГТ у таких випадках потребує індивідуального підходу та ретельного аналізу потенційних ризиків і користі.
В Україні питання призначення МГТ регулюються двома основними нормативними документами: Уніфікованим клінічним протоколом первинної, вторинної (спеціалізованої), третинної (високоспеціалізованої) медичної допомоги «Менопаузальні порушення та інші розлади в перименопаузальному періоді» (2022) та клінічною настановою, заснованою на доказах, «Менопаузальні симптоми та гормональна терапія» (2017). Слід зазначити, що в протоколі відсутня інформація про застосування МГТ у пацієнток онкологічного профілю, тоді як клінічна настанова містить більш детальні рекомендації з цього питання. Ознайомлення лікарів-практиків з інформацією, наведеною в клінічній настанові, є важливим для прийняття обґрунтованих рішень щодо призначення МГТ пацієнткам з онкологічним анамнезом.
Окрім вітчизняних нормативних документів, важливу роль у прийнятті рішень щодо призначення МГТ відіграють міжнародні рекомендації, зокрема рекомендації Європейського товариства з менопаузи та андропаузи (European Menopause and Andropause Society, EMAS) і Міжнародного товариства онкогінекологів (International Gynecologic Cancer Society, IGCS). Ці документи, що знаходяться у вільному доступі, є цінним джерелом інформації для лікарів-практиків.
Рак грудної залози та МГТ
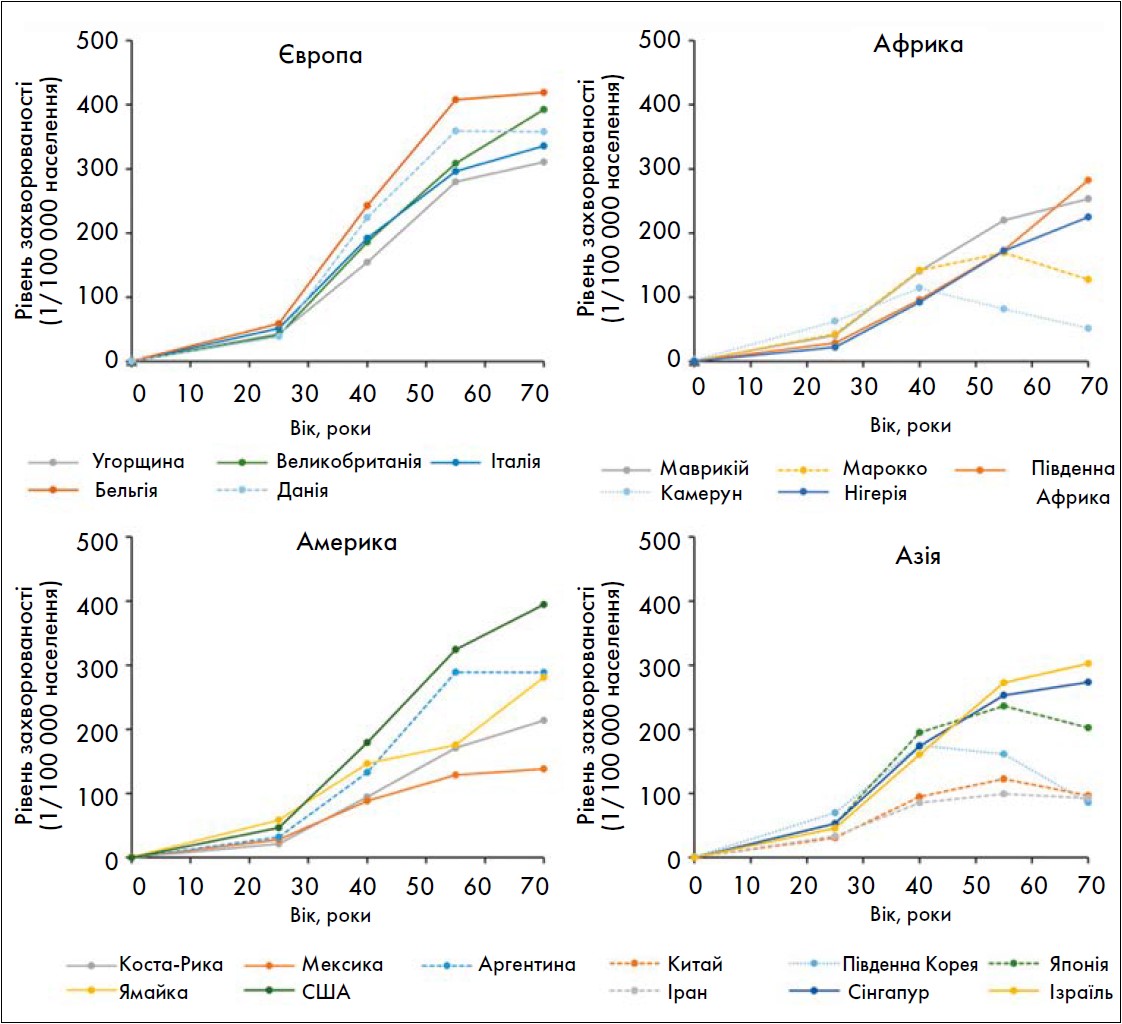
Рак грудної залози (РГЗ) є одним із найбільш поширених злоякісних процесів у жінок із піком захворюваності у віці близько 50 років, що припадає на період перименопаузи (рис. 1). Дослідження «Ініціатива в ім’я здоров’я жінок» (Women’s Health Initiative, WHI), проведене у США з 1993 по 1998 рік, стало одним із найбільш резонансних у контексті вивчення ризиків МГТ (Rossouw J.E., 2022). У дослідженні взяли участь понад 16,5 тис. здорових жінок у менопаузі віком від 50 до 79 років, які отримували комбіновану МГТ або плацебо. Після 5 років спостереження автори дійшли висновку, що прийом комбінованої МГТ пов’язаний із підвищеним ризиком виникнення інвазивного РГЗ (в 1,26 раза), а також порушень мозкового кровообігу та інфаркту міокарда. Ці результати спричинили значне скорочення призначень МГТ (Collaborative Group On Epidemiological Studies Of Ovarian Cancer, 2015).
Рис. 1. Вікова структура захворюваності на РГЗ у світі (Lei S., 2021)
У 2015 році дослідницька група WHI також оцінювала вплив естрогенної монотерапії на здоров’я жінок, які перенесли пангістеректомію з неонкологічних причин (Roehm E., 2015). Протягом 13 років спостереження було виявлено, що у цих пацієнток спостерігалося достовірне зниження ризику виникнення інвазивного РГЗ, а прийом естрогенів не впливав на ризик розвитку інфаркту міокарда, ішемічної хвороби серця та венозного тромбоемболізму. Ці результати свідчать про те, що ключовим фактором, який впливає на ризики МГТ, є наявність гестагенного компоненту.
О.О. Єфіменко зазначила, що в дослідженні WHI у якості гестагенного компоненту використовувався медроксипрогестерону ацетат, який не застосовується в складі МГТ в Україні та Європі. Цей факт став предметом широкого обговорення в науковій спільноті, й американські дослідники неодноразово вибачалися за екстраполяцію даних, отриманих при використанні медроксипрогестерону ацетату, на всі види МГТ. Адже медроксипрогестерону ацетат вважається дуже небезпечним компонентом, і його застосування могло вплинути на результати дослідження.
Результати дослідження WHI спричинили значний резонанс і призвели до того, що багато жінок в усьому світі почали відмовлятися від МГТ через страх перед потенційними ризиками. Це явище отримало назву «втрачене покоління», оскільки відмова від МГТ призвела до зростання захворюваності та смертності від серцево-судинних захворювань у жінок. Саме кардіологи першими забили на сполох, звернувши увагу на цю проблему.
Незважаючи на суперечливі результати дослідження WHI мало важливе значення для розуміння оптимальних строків призначення МГТ, оскільки показало, що вона має цілий ряд переваг, якщо розпочата вчасно. У дослідженні WHI середній вік учасниць становив 63 роки, а максимальний – 89, тобто досліджувані жінки вже мали серцево-судинну патологію та змінені судини внаслідок атеросклеротичних процесів. Саме на базі цього випробування було сформульовано концепцію «вікна можливостей» для призначення МГТ – чим раніше розпочато терапію, тим кращий профілактичний ефект. Оптимальним вважається призначення МГТ не пізніше 10 років після настання менопаузи й у віці не старше 60 років.
А.С. Рекута акцентувала увагу на тому, що з моменту публікації результатів дослідження WHI минуло багато років, і в цей період було проведено п’ять великих досліджень за участю близько 800 тис. жінок, які спростували негативний вплив МГТ (Franke H.R., 2003; Fournier A., 2009; Lyytinen H., 2009; Baber R.J., 2016; Chlebowski R.T., 2020).
Питання призначення МГТ жінкам, які перенесли лікування РГЗ, було предметом двох ідентичних досліджень HABITS та Stockholm, проведених у Швеції в період з 1997 по 2003 рік (Holmberg L., 2004; von Schoultz E., 2005). У цих дослідженнях жінки отримували комбіновану МГТ або монотерапію естрогенами, у тому числі з використанням медроксипрогестерону ацетату, протягом у середньому двох років. Результати дослідження HABITS показали майже триразове підвищення ризику рецидиву у жінок, які приймали МГТ, тоді як дослідження Stockholm не виявило таких змін. Проте обидва дослідження були передчасно припинені через результати HABITS. Пізніше було встановлено, що групи в цих дослідженнях були неоднорідними, що могло вплинути на результати.
Дослідження D.A. Decker et al. (2003) включало в себе вибірку із 277 пацієнток, які мали діагностований РГЗ різних стадій. Учасниці випробування розпочали прийом МГТ у середньому через 3,5 року після встановлення діагнозу РГЗ. Тривалість застосування МГТ у середньому становила 5 років. Гістологічний аналіз пухлин показав, що більше 50% із них характеризувалися високим рівнем експресії естрогенових рецепторів. Результати дослідження продемонстрували відсутність статистично значущої різниці в ризику рецидиву РГЗ між групою пацієнток, які отримували МГТ, та контрольною групою. Також не було виявлено залежності ризику рецидиву від типу застосовуваної МГТ. Утім відмічалося, що загальна виживаність у групі МГТ була вищою (р=0,02) порівняно з контрольною групою, що пояснювалося зниженням частоти кардіоваскулярних подій на фоні гормональної терапії.
Дослідження LIBERATE було проведено з метою оцінки ефективності та безпеки застосування тиболону у жінок, які перенесли лікування РГЗ (Speroff L., 2009). У ньому взяли участь 3098 пацієнток віком від 40 до 79 років (середній вік – 52 роки) із РГЗ I-III стадії за класифікацією TNM. Учасниці були рандомізовані у дві групи: 1556 жінок отримували тиболон, а 1542 – плацебо. Тривалість прийому препарату становила до 5 років. В анамнезі 66,8% пацієнток мав місце прийом тамоксифену, а 6,5% – інгібіторів ароматази. У 57,8% жінок було виявлено метастатичне ураження лімфатичних вузлів, а у 70% – РГЗ II стадії. Гормонозалежні пухлини були діагностовані у 77,8% випадків (2808 пацієнток). Результати дослідження продемонстрували, що використання тиболону в жінок із гормонозалежним РГЗ асоціювалося зі статистично значущим підвищенням ризику рецидиву захворювання порівняно з групою плацебо. Ці дані викликали розчарування в медичній спільноті, оскільки тиболон розглядався як перспективний засіб для лікування клімактеричного синдрому в пацієнток після РГЗ.
Зважаючи на обмеження щодо застосування МГТ у жінок після лікування РГЗ, альтернативними опціями є використання антидепресантів, таких як габапентин, прегабалін, есциталопрам та венлафаксин (Leon-Ferre R.A., 2017). Проте слід враховувати потенційні побічні ефекти цих препаратів, зокрема підвищений ризик суїцидів при застосуванні венлафаксину. Перспективним напрямком є розробка нових негормональних молекул, таких як фезолінетант, для лікування клімактеричних проявів.
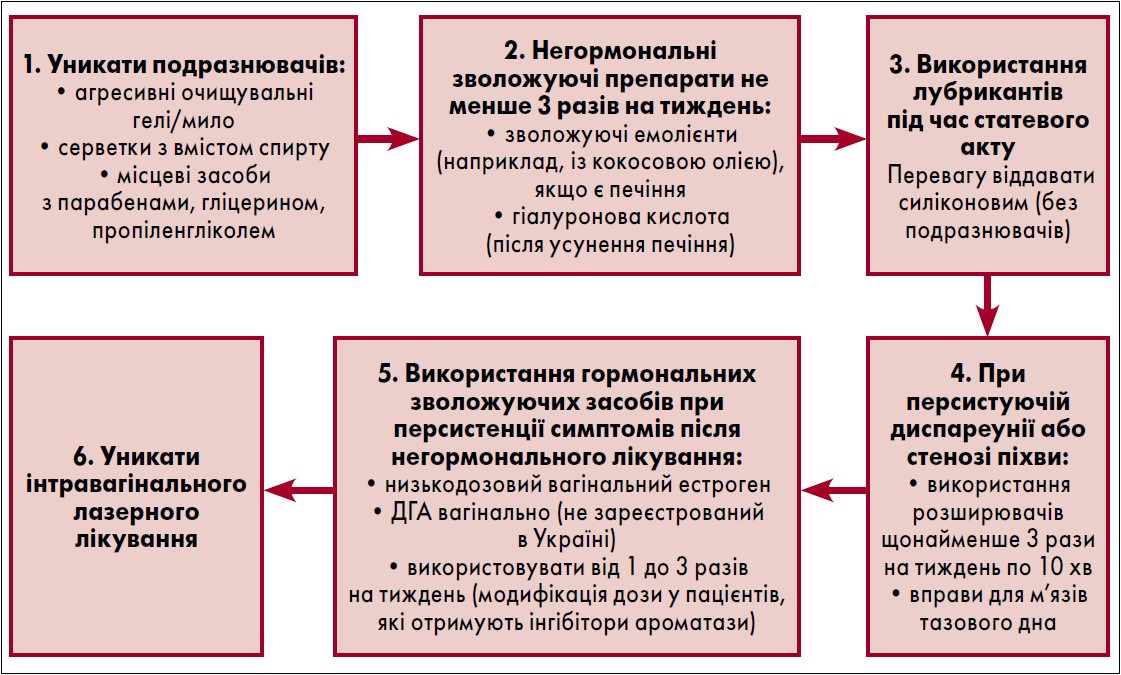
Особливу увагу слід приділяти лікуванню генітоуринарного синдрому в жінок після РГЗ. Згідно з рекомендаціями Американської асоціації клінічної онкології (American Society of Clinical Oncology, ASCO), першою лінією терапії є використання негормональних зволожуючих засобів, лубрикантів і супозиторіїв (рис. 2). При персистенції симптомів після негормонального лікування можливе обережне застосування низьких доз вагінальних естрогенів. Перспективним, але недоступним в Україні є використання вагінального дегідроепіандростерону (ДГА).
Рис. 2. Рекомендації щодо менеджменту генітоуринарного синдрому після лікування РГЗ (Lambertini M., 2023)
Носійство мутацій генів BRCA1/2 та МГТ
Носійство мутацій генів BRCA1/2 асоціюється з підвищеним ризиком розвитку РГЗ та раку яєчників (РЯ). У носіїв мутації BRCA1 ризик РГЗ становить до 65%, а ризик РЯ – до 60%, тоді як у носіїв мутації BRCA2 ці показники становлять 45 і 35% відповідно. Захворюваність на РГЗ у жінок – носіїв мутації BRCA1 стрімко зростає у віці 30-40 років, а в носіїв мутації BRCA2 – після 40 років.
Згідно з рекомендаціями Національної комплексної онкологічної мережі (National Comprehensive Cancer Network, NCCN), для зниження ризику РЯ носіям мутацій BRCA1/2 рекомендована профілактична сальпінгооваріоектомія у віці 35-40 років (для BRCA1) та 40-45 років (для BRCA2). Після хірургічної менопаузи цим пацієнткам може бути рекомендована циклічна комбінована МГТ (наприклад, естрадіол/дидрогестерон у дозуванні 2 мг/10 мг із поступовим переходом на 1 мг/10 мг до досягнення середнього віку природної менопаузи). У носіїв мутацій BRCA1/2, які відмовляються від профілактичної сальпінгооваріоектомії, короткотривала МГТ для корекції менопаузальних симптомів може розглядатися в індивідуальному порядку, оскільки достовірного впливу МГТ на ризик РЯ у цієї категорії пацієнток не виявлено.
Рак яєчників та МГТ
Близько 17% випадків РЯ діагностується у жінок віком до 40 років. Приблизно у 80% епітеліальних пухлин яєчників (серозних, муцинозних, ендометріоїдних) визначається експресія рецепторів до естрогенів. Дані досліджень in vitro щодо впливу естрогенів на проліферацію клітин РЯ суперечливі. Метааналіз Collaborative Group On Epidemiological Studies Of Ovarian Cancer (2015), у який були включені дані 52 досліджень за участю понад 12 тис. жінок, показав, що прийом МГТ в анамнезі асоціювався зі збільшенням ризику РЯ в 1,37 раза, переважно за рахунок серозного та ендометріоїдного гістологічних типів. Підвищення ризику спостерігалося за тривалості МГТ понад 5 років, а після припинення прийому ризик поступово знижувався, але залишався дещо підвищеним навіть через 10 років. Примітно, що жінки, які отримували МГТ, мали кращі показники загальної виживаності та частоти оптимальної циторедукції порівняно із жінками, які не використовували МГТ.
Дані щодо безпечності МГТ після лікування РЯ обмежені. У дослідженні R. Guthrie et al. (2015) за участю 150 пацієнток із РЯ I-IV стадії, половина з яких отримували МГТ, показано достовірне покращення загальної виживаності в групі МГТ (8,5 року проти 5,7 року). Аналогічні результати були отримані в дослідженні X. Liang et al. (2012) за участю 75 пацієнток із серозною та муцинозною аденокарциномою яєчника I-III стадії.
При прийнятті рішення щодо призначення МГТ після лікування РЯ слід враховувати гістологічний тип пухлини. Згідно з класифікацією Всесвітньої організації охорони здоров’я, виділяють епітеліальний РЯ низького (low-grade) та високого (high-grade) ступенів злоякісності. У пацієнток із low-grade серозною та муцинозною карциномою призначення МГТ може бути обмежене, оскільки ці пухлини є гормонозалежними. Водночас при high-grade серозній, ендометріоїдній та світлоклітинній аденокарциномі використання комбінованої або монотерапії естрогенами може розглядатися незалежно від стадії захворювання.
Рак шийки матки та МГТ
Рак шийки матки (РШМ) є однією з найпоширеніших гінекологічних злоякісних пухлин, яка часто діагностується у жінок репродуктивного віку. За даними статистики, 80-90% випадків РШМ представлені плоскоклітинною карциномою, а 10-20% – аденокарциномою. Пік захворюваності припадає на вік 35-44 роки, що відповідає активному репродуктивному періоду життя жінки. В умовах війни спостерігається збільшення кількості пацієнток із занедбаними формами РШМ, що пов’язано з обмеженим доступом до медичної допомоги та відтермінуванням діагностичних процедур.
Незважаючи на успіхи в діагностиці та лікуванні РШМ, питання призначення МГТ після перенесеного захворювання залишається недостатньо вивченим. Аналіз 10 публікацій, присвячених дослідженню зв’язку між застосуванням МГТ та ризиком розвитку РШМ, показав, що МГТ не підвищує ризик виникнення плоскоклітинної карциноми шийки матки. У деяких випробуваннях навіть спостерігалося зниження цього ризику. Водночас в одному з досліджень було виявлено підвищення ризику розвитку аденокарциноми шийки матки на фоні монотерапії естрогенами, що може бути пов’язано з подібністю епітелію цервікального каналу до ендометрія та наявністю в ньому рецепторів до естрогенів і прогестерону.
Дані щодо безпечності застосування МГТ після лікування РШМ обмежені й переважно базуються на результатах єдиного дослідження Ploch (1987), у якому взяли участь 120 пацієнток із плоскоклітинною карциномою шийки матки I-II стадії. Учасниці отримували комбіновану МГТ або входили до групи контролю. Період спостереження становив від 2 до 6 років. Результати дослідження продемонстрували кращі показники 5‑річної безрецидивної виживаності в групі МГТ порівняно з контролем, при цьому різниці в загальній виживаності між групами не було. Дані щодо безпечності МГТ після лікування аденокарциноми шийки матки вкрай обмежені й базуються на двох невеликих ретроспективних дослідженнях, у яких застосовувалася монотерапія естрогенами або тиболоном. У досліджуваних не було виявлено підвищення ризику рецидиву в групі МГТ порівняно з контролем, однак слід враховувати методологічні обмеження цих досліджень.
Таким чином, призначення МГТ жінкам після лікування онкогінекологічних патологій потребує індивідуального підходу й ретельної оцінки співвідношення користі та ризиків. Рішення має ухвалюватися колегіально, з урахуванням усіх факторів, які можуть впливати на прогноз захворювання та якість життя пацієнтки.
Підготувала Анна Сочнєва