29 жовтня, 2024
Посттравматичний біль у м’язах і суглобах: оптимальне лікування з погляду балансу ефективності та безпечності
Різноманітні травматичні ушкодження належать до провідних причин смерті та інвалідизації у всьому світі. В більшості осіб, які потребують стаціонарного лікування через травми, спостерігаються довгострокові наслідки травматизації. Одним із таких наслідків є хронічний біль, що розвивається в ≈⅔ таких хворих. Оскільки вдосконалення невідкладної медичної допомоги при травмах значно покращило показники виживаності, зростання кількості випадків посттравматичного болю (ПТБ) у клінічній практиці не уникнути (Evans D.W. et al., 2022).
Механізм трансформації обумовленого травмою гострого болю в хронічний ПТБ дотепер остаточно не з’ясований. Існують 3 основні відмінності травматичних ушкоджень від поширених нетравматичних м’язово-скелетних станів із больовим синдромом. Насамперед ПТБ завжди є наслідком причинної події; натомість причина ⅔ випадків нетравматичного м’язово-скелетного болю, наприклад у нижній ділянці спини, залишається невідомою. Травма завжди асоціюється з ушкодженням тканин, локалізація та обсяг якого є відомими, а за нетравматичного болю зв’язок больових відчуттів із безпосереднім ушкодженням тканин невідомий. Травми зазвичай супроводжуються стресом, який може відігравати важливу роль у виникненні та підтримці хронічного ПТБ (Evans D.W. et al., 2022). Стрес може проявлятися різними шляхами, в т. ч. відчуттями занепокоєння, тривожності, безпомічності та/або депресії. У контексті травми стрес асоціюється з катастрофізацією болю, неспроможністю подолати цей біль, а також негативними очікуваннями щодо лікування. Хоча певний рівень стресу одразу після травми є фізіологічним, тяжкий або стійкий стрес через тижні та місяці після травми асоціюється з гіршим відновленням, що проявляється вищою імовірністю інвалідизації, відтермінуванням відновлення працездатності, підвищенням ризику розвитку хронічного больового синдрому (Sim A. et al., 2024).
М’язово-скелетним болям властиве формування больового циклу, котрий (якщо його не перервати) зумовлює центральну сенсибілізацію, а також хронізацію (рис.). Біль є не лише сенсорним, а й емоційним досвідом, що чинить різноманітний вплив на різних людей. Статистичні дані свідчать, що 30-60% осіб із хронічним болем страждають також і на депресію. Між депресією та хронічним болем існує двоспрямований зв’язок (Bonanni R. et al., 2022).
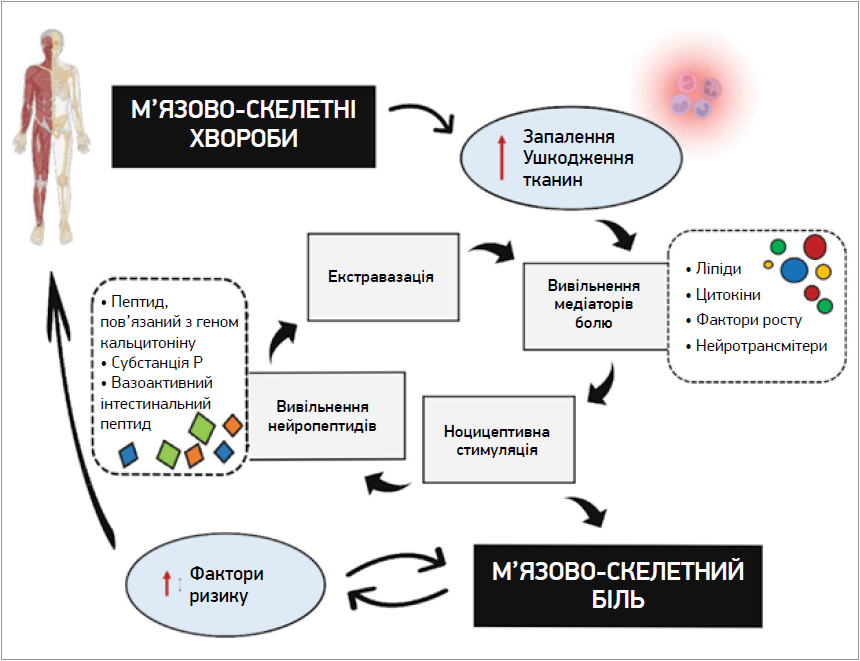
Рис. Цикл м’язово-скелетного болю (Bonanni R. et al., 2022)
Предиктори несприятливого перебігу ПТБ – висока інтенсивність больового синдрому під час початкового обстеження, значний обсяг болісної ділянки, кількість попередніх епізодів больових відчуттів, посттравматичний стресовий розлад, наявність соматичних коморбідностей та страх руху (Alkassabi O. et al., 2022; Evans D.W. et al., 2022). Так, у проспективному обсерваційному когортному дослідженні D.W. Evans і співавт. (2022) взяли участь 124 пацієнти, госпіталізовані з гострою м’язово-скелетною травмою. Стан учасників оцінювали за допомогою анкети самооцінки та шкали хронічного болю (Chronic Pain Grade Scale, CPGS) через 6 та 12 міс після госпіталізації. За шкалою CPGS біль розподіляли на 5 ступенів: 0 – відсутній, І – низька інтенсивність болю, низький ступінь інвалідизації, II – висока інтенсивність болю, низький ступінь інвалідизації, ІІІ – біль, який помірно обмежує життєдіяльність, високий ступінь інвалідизації, IV – біль, що значно обмежує життєдіяльність, високий ступінь інвалідизації. Показники на рівні ІІ ступеня та вище вважалися несприятливими. Через 6 міс лише в 23,2% учасників спостерігався 0 або І ступінь больового синдрому; ІІ-IV ступінь фіксувався в 76,8%. Через 12 міс ситуація поліпшилася: ІІ-IV ступінь хронічного болю спостерігався в 38,6% хворих. Пацієнтам, у яких ПТБ виявився інтенсивним через 6 та 12 міс після госпіталізації, були притаманні більша тривалість стаціонарного лікування, значна вираженість посттравматичного стресу, вища суб’єктивна інтенсивність болю на момент початку дослідження, значніша кількість переломів. На ймовірність розвитку тривалого ПТБ не впливали больовий поріг, локалізація травми та вміст відомого маркера запалення – С-реактивного білка. F.P. Rivara та співавт. (2008) отримали песимістичніші результати: в їхньому дослідженні біль через 12 міс після травми спостерігали 62,7% пацієнтів; середня інтенсивність ПТБ становила 5,5 бала.
За легкого та помірного болю найчастіше призначають безрецептурні знеболювальні засоби. Відповідно до сучасних рекомендацій, фармакотерапією першої лінії у разі м’язово-скелетних болів є топічні нестероїдні протизапальні препарати (НПЗП), яким притаманна така сама ефективність, як і пероральним, але вони мають значно кращі показники безпечності (Bannuru R. et al., 2019; Kolasinski S.L. et al., 2021; Massey T. et al., 2010). За даними метааналізу 207 досліджень, топічні НПЗП сприяли зменшенню болю (через ≤2 год і через 1-7 днів), відновленню фізичної функції та полегшенню супутніх симптомів травми в пацієнтів із гострим м’язово-скелетним ПТБ. У хворих, що лікувалися топічними НПЗП, спостерігалася висока задоволеність лікуванням, а побічні явища виникали вкрай рідко. Водночас автори зазначають, що пероральні НПЗП хоча і є ефективними в усуненні болю, однак характеризуються частим розвитком таких несприятливих побічних ефектів, як шлунково-кишкові кровотечі, біль у шлунку / животі, закрепи, нудота, блювання, диспепсія. Саме тому в клінічних настановах Американської колегії лікарів (ACP), Американської академії сімейних лікарів (AAFP) щодо лікування гострого болю при травмах опорно-рухового апарату (розтягнення, вивихи, ушкодження м’яких тканин, хлистова травма, нехірургічні переломи, забої, інші стани) в дорослих містяться рекомендації стосовно призначення особам із гострим болем травматичного генезу топічних НПЗП із ментолом чи без нього як терапії першої лінії (McMahon S.B. et al., 2020).
Відповідно до Кокранівського систематичного огляду, топічні НПЗП, що найчастіше використовуються (кетопрофен, диклофенак), достовірно зменшують вираженість больового синдрому в ≈⅔ пацієнтів із хронічним м’язово-скелетним болем (Derry S. et al., 2017). Кінетика всмоктування та фармакодинамічні ефекти топічних НПЗП значно відрізняються залежно від обраної молекули та лікарської форми (Haroutiunian S. et al., 2010), тому слід обдумано підійти до вибору препарату.
Кетопрофен – ефективний НПЗП, що добре переноситься; використовується в лікуванні гострого та хронічного болю ревматичного, травматичного й післяопераційного походження. Топічний кетопрофен часто застосовується в клініці: так, за період 1998-2008 рр. лікування кетопрофеном у формі гелю було призначене >140 млн пацієнтів. Місцева доставка діючої речовини забезпечує знеболювальний і протизапальний ефекти, а завдяки низькій системній біодоступності рідше спричиняє побічні ефекти порівняно із системними засобами. Кетопрофен є одним із найпотужніших інгібіторів циклооксигенази; завдяки інгібуванню синтезу простагландинів забезпечує виражену протизапальну, знеболювальну й антипіретичну дію.
Крім того, кетопрофен демонструє допоміжні фармакологічні ефекти: зменшує надмірну активність брадикініну (медіатора болю та запалення), запобігає вивільненню лізосомальних ферментів, які беруть участь у деструкції тканин при запальних реакціях. Продемонстровано, що 2,5% гель кетопрофену забезпечував зниження концентрації простагландину Е2, аналогічне пероральному кетопрофену. Ефективність топічного кетопрофену в формі 2,5% гелю вивчено в широкій популяції хворих із гострими та хронічними больовими станами (спортивними травмами, болем у спині, тендинітом, остеоартритом, ревматичним болем у м’яких тканинах). У цих дослідженнях гель кетопрофену наносили 2 р/день у дозах 40-600 мг (зазвичай 100-300 мг) упродовж 2-42 днів (здебільшого 7-20 днів). Застосування топічного кетопрофену зумовлювало достовірне зменшення спонтанного болю та болю під час пальпації, а також зниження вираженості ознак запалення й болю в суглобах під час активних і пасивних рухів. Проведені метааналізи підтвердили переваги топічного кетопрофену над плацебо в полегшенні болю при гострих і хронічних станах (Coaccioli S., 2011). Метааналіз L. Mason і співавт. (2004, n=2853) виявив, що 2,5% гель кетопрофену є значно ефективнішим у лікуванні гострого болю порівняно з усіма іншими топічними НПЗП.
Відповідно до узагальнення 13 кокранівських оглядів (206 досліджень; ≈30 700 учасників), топічні аналгетики (здебільшого НПЗП) застосовувалися в разі гострого м’язово-скелетного (розтягнення, надриви зв’язок, тендинопатії, м’язові болі), а також хронічного болю (остеоартрити, нейропатичний біль). При гострому м’язово-скелетному болю кількість пацієнтів, яку потрібно пролікувати для запобігання одному додатковому несприятливому наслідку (number-needed-to-treat), для топічного кетопрофену становила 2,6. Для гелю піроксикаму та пластирів із диклофенаком ці показники були гіршими і складали 4,4 й 3,2-4,7 відповідно. За хронічного болю ефективність було доведено для топічних препаратів кетопрофену та диклофенаку; доказова база інших засобів (гелів і кремів на основі ібупрофену, певних брендів гелю диклофенаку, топічних препаратів індометацину, пластирів кетопрофену, засобів на основі саліцилатів тощо) була незадовільною. Під час дослідження доказової бази з безпечності різних топічних НПЗП автори виявили докази помірної якості щодо відсутності додаткових несприятливих побічних явищ при застосуванні топічного кетопрофену за хронічного болю порівняно з плацебо (Derry S. et al., 2017).
Гель кетопрофену вважається оптимальною лікарською формою для місцевого застосування; його перевагою є високий ступінь проникнення крізь шкіру, що забезпечує ефективну абсорбцію діючої речовини та реалізацію її протизапальних властивостей у необхідній ділянці. Крім того, застосування гелю є гігієнічнішим й економічнішим порівняно з мазями та кремами, оскільки в разі використання гелю крізь шкірний бар’єр проходить максимальна кількість нанесеного препарату (Derry S. et al., 2016; Худобін В.Ю. та співавт., 2013).
Популярним топічним препаратом кетопрофену на вітчизняному фармацевтичному ринку є Фастум® гель («А. Менаріні Мануфактурінг Логістікс енд Сервісес С.р.Л.», Італія). Фастум® гель містить наступні допоміжні речовини: карбомер, який покращує адгезивні та косметичні властивості препарату; триетаноламін, що розчиняє шкірний жир, а також забезпечує оптимальний pH; етанол, котрий підсилює трансдермальну абсорбцію, крім того, поліпшує текстуру гелю, а також неролієвий і лавандиновий ароматизатори, які надають препарату приємних органолептичних характеристик. Слід зауважити, що Фастум® гель (2,5% гель кетопрофену для місцевого застосування) є оригінальним препаратом – топічна форма кетопрофену вперше була розроблена та запатентована компанією Menarini й зареєстрована в Італії у 1978 р., тобто через 5 років після впровадження першого засобу на основі кетопрофену в європейську медичну практику. Ця нова лікарська форма, яка передбачала розчинення активної речовини у водно-спиртовій основі, забезпечувала раціональне застосування препарату при топічному нанесенні (Kantor T.G., 1986). Фастум® гель, згідно з чинною інструкцією для медичного застосування, слід наносити тонким шаром (3-5 см) на уражені ділянки 1-3 р/добу; для кращого проникнення можна робити легкі масажні рухи.
Висновки
Ефективне лікування ПТБ – запорука швидкого відновлення та профілактики хронізації болю і психічних розладів. Першою лінією фармакотерапії ПТБ є НПЗП, однак оральним препаратам притаманний високий шлунково-кишковий ризик; натомість топічні засоби мають зіставну ефективність та кращі показники безпечності. Високоефективним топічним НПЗП є гель кетопрофену (2,5%), що добре вивчений у клінічних дослідженнях за різних типів болю. Топічний кетопрофен створює високу концентрацію активної речовини безпосередньо в осередку запалення й болю на тлі мінімального її рівня в системному кровотоку. Фастум® гель забезпечує оптимальний баланс ефективності та безпечності, що робить його засобом вибору в лікуванні ПТБ.




