29 жовтня, 2024
Засноване на доказах використання пробіотика Saccharomyces boulardii CNCM I‑745 для пом’якшення клінічних ефектів дисбактеріозу, пов’язаного з прийомом антибіотиків
Дисбактеріоз кишечнику являє собою порушення стабільності й функціональної повноцінності мікробіоти, що може мати серйозні короткострокові та довгострокові наслідки для здоров’я. Антибіотик-асоційована діарея (AAД) є яскравим прикладом дисбактеріозу, що спостерігається в 10‑40% пацієнтів (Goldenberg J.Z. et al., 2017). Це явище також відоме як «дисбіоз, пов’язаний з антибіотиками» або «антибіотик-індукований дисбіоз».
Антибіотики та мікробіота кишечнику
Попри обґрунтоване занепокоєння щодо зростання загрози мікробної резистентності, антибіотики залишаються одними з найбільших досягнень сучасної медицини, демонструючи високу ефективність і безпеку. Однак потенційно негативні ефекти антибіотиків на склад мікробіоти, які проявляються втратою цілих мікробних спільнот, зростанням патогенних видів (наприклад, Clostridioides difficile) та поширенням генів резистентності до антибіотиків, часто недооцінюються (Konstantinidis T. et al., 2020; Langdon A. et al., 2016). Загалом антибіотикотерапія підвищує рівні Enterobacteriaceae, Bacteroidaceae, ентерококів і резистентних штамів Escherichia coli, водночас знижуючи рівні біфідобактерій, лактобактерій та ін. (Patangia D.V. et al., 2022; Petersen C. et al., 2014). Проте існують значні відмінності між класами антибіотиків у цьому контексті.
Короткострокові наслідки антибіотикотерапії: ААД
ААД є поширеною та серйозною клінічною проблемою. Наприклад, у дослідженні, проведеному в чотирьох лікарнях Бельгії, серед 743 госпіталізованих пацієнтів, які отримували антибіотики, майже в 10% відзначався розвиток діареї (між 1-м і 16-м днями лікування) (Elseviers M.M. et al., 2016). До чинників ризику ААД належать вік понад 70 років, прийом кількох антибіотиків, використання інгібіторів протонної помпи, проведення ендоскопії, наявність цукрового діабету, патологія нирок і госпіталізація в нефрологічне відділення.
Особливо значущі наслідки ААД має для вразливих пацієнтів, що потребують інтенсивної терапії. У зазначених умовах вплив антибіотиків на мікробіоту посилюється такими чинниками, як використання вазопресорів, уживання високооброблених ентеральних харчових продуктів, хірургічні втручання на шлунково-кишковому тракті, старший вік і тривале використання опіатів (Xiang Y. et al., 2020; Zhou H. et al., 2020). Слід зауважити, що в 90% людей, які не мають явних проявів ААД, можна визначити зміни у складі мікробіоти (Anthony W.E. et al., 2022).
Важливо зазначити, що ААД може свідчити про наявність або призводити до розвитку інфекції C. difficile в кишечнику, прояви якої варіюють від легкої діареї до небезпечного для життя псевдомембранозного коліту. C. difficile виявляють майже в 50% зразків, отриманих у немовлят без клінічних симптомів, близько 10% госпіталізованих пацієнтів і 1-5% здорових дорослих (Baron S.W. et al., 2022; Jolivet S. et al., 2023). C. difficile здатна розмножуватися в умовах дисбактеріозу кишечнику, а стандартне лікування цієї інфекції антибіотиками може призвести до подальших порушень мікробіоти. Тому відновлення стійкої мікробіоти кишечнику є необхідною умовою для одужання (Piccioni A. et al., 2022; Theriot C.M. et al., 2015).
Дисбактеріоз у немовлят і довгострокові наслідки антибіотикотерапії
Відомо, що «доросла» мікробіота формується приблизно в 3-5 років, а перші 1000 днів після народження становлять критичний і відносно нестабільний період її розвитку (Robertson R.C. et al., 2019). Вважається, що мікробіота майбутньої дитини починає формуватися ще до народження: бактеріальна ДНК була виявлена в біопсіях плаценти й амніотичній рідині, а також у меконії (Aagaard K.M. et al., 2014; Collado M.C. et al., 2016).
Протягом перших років життя мікробіота кишечнику чутлива до дисбактеріозу, індукованого або посиленого різними чинниками навколишнього середовища, як-от спосіб розродження, раціон матері, антибіотики, інші лікарські препарати, харчування, вакцинація й інші медичні втручання. Дослідження вказують на те, що антибіотики в немовлят можуть знижувати якість мікробіоти, впливаючи на ріст і метаболізм, а також підвищуючи ризик розвитку ожиріння, цукрового діабету, бронхіальної астми й атопічних захворювань (Parkin K. et al., 2021; Trasande L. et al., 2013). Високі дози антибіотиків у перші роки життя здатні спричиняти тривалі зміни у структурі та функції мікробіоти, що, своєю чергою, може бути пов’язане з підвищеним ризиком розвитку неінфекційних хвороб, імунодефіциту та психічних захворювань надалі (Murphy R. et al., 2014; Gerber J.S. et al., 2016). Однак механізми, що лежать в основі – можливо, метаболічного характеру, – ще належить ідентифікувати та/або повністю охарактеризувати.
Стійкість здорової мікробіоти
Однією з ключових характеристик здорової мікробіоти є стійкість (Gibson M.K. et al., 2014; Lange K. et al., 2016). Після перших кількох років життя мікробіота людини досягає гомеостатичної композиції. Однак практична проблема з оцінюванням функціональної стабільності полягає в тому, що клінічні дослідження пацієнтів рідко включають будь-які дані про базову мікробіоту до госпіталізації або початку серйозної хвороби. Хоча стійкість, здається, пов’язана передусім з функціональним різноманіттям наявних видів, існують постійні метаболічні, імунологічні й навіть неврологічні взаємодії між мікробіотою та тканинами господаря (Damiani F. et al., 2023; Piccioni A. et al., 2022). Наприклад, лікування антибіотиками в мишей пов’язане з порушенням кишкового бар’єра, зниженням експресії білка щільного з’єднання, активацією запалення й автофагією, а також залежним від макрофагів посиленням запальних Т-хелперів 1 типу (Feng Y. et al., 2019; Scott N.A. et al., 2018).
ААД і зміни у видовому різноманітті здатні модифікувати епітеліальний гомеостаз шляхом змін на рівні сигнальних шляхів Toll-подібних рецепторів й імунорегуляції (Preidis G.A. et al., 2009). Дослідження на тваринних моделях показують, що антибіотики мають як коротко-, так і довготерміновий вплив на моторику шлунково-кишкового тракту, в деяких випадках зумовлений змінами в експресії та метаболізмі генів господаря (Bernabe G. et al., 2023; Ge X. et al., 2017). Усі ці чинники можуть призводити до виникнення діареї, спричиненої прийомом антибіотиків.
Профілактика та лікування ААД: роль пробіотиків
У контексті ААД відновлення нормальної (функціональної) мікробіоти кишечнику потребує завершення призначеного курсу антибіотиків, часу (тобто відновлення через природну стійкість мікробіоти) та відповідної підтримки, включаючи пробіотики. Пробіотики були визначені як «живі мікроорганізми, які при введенні в адекватних кількостях приносять користь здоров’ю господаря».
Систематичні огляди та метааналіз клінічних випробувань підтвердили штамоспецифічну ефективність деяких пробіотиків у лікуванні та/або профілактиці ААД у дітей і дорослих (Szajewska H. et al., 2015, 2022). Особливо це стосується дріжджів S. boulardii CNCM I‑745. На підставі цих висновків Європейське товариство дитячої гастроентерології, гепатології та харчування (ESPGHAN) рекомендувало на початку лікування антибіотиками вводити достатні дози (щонайменше 5×109 колонієутворювальних одиниць на день) конкретних штамів пробіотиків дітям, які мають чинники ризику діареї, пов’язаної з прийомом антибіотиків. Глобальні рекомендації Всесвітньої гастроентерологічної організації (WGO) містять ту саму вказівку. У настановах 2020 року Американська гастроентерологічна асоціація (AGA) запропонувала використання певних штамів пробіотиків і їх комбінацій для профілактики інфекції C. difficile як умовну рекомендацію, але підкреслила неясний або високий ризик упередженості в більшості розглянутих досліджень (Su G.L. et al., 2020).
S. boulardii CNCM I‑745 є еукаріотом; це нехарактерно для пробіотиків, тому антибіотики не впливають на нього безпосередньо, що робить його особливо придатним для призначення при діареї, пов’язаній із застосуванням антибіотиків (Bin Z. et al., 2015; Kazmierczak-Siedlecka K. et al., 2020). S. boulardii, який природно відсутній у кишковій мікробіоті людини, досягає стабільних рівнів популяції після 3 днів прийому та більше не виявляється в калі через 2-5 днів після припинення його застосування (More M.I. et al., 2015). Вважається, що цей пробіотик має кілька механізмів дії: пряме зв’язування з патогенами, зменшення місцевого запалення, антитоксичний ефект, вплив на травні ферменти, стимуляція синтезу коротколанцюгових жирних кислот, а також формування захисного середовища для корисних видів у слизовому шарі кишечнику (рис.) (More M.I. et al., 2018; Stier H. et al., 2016).
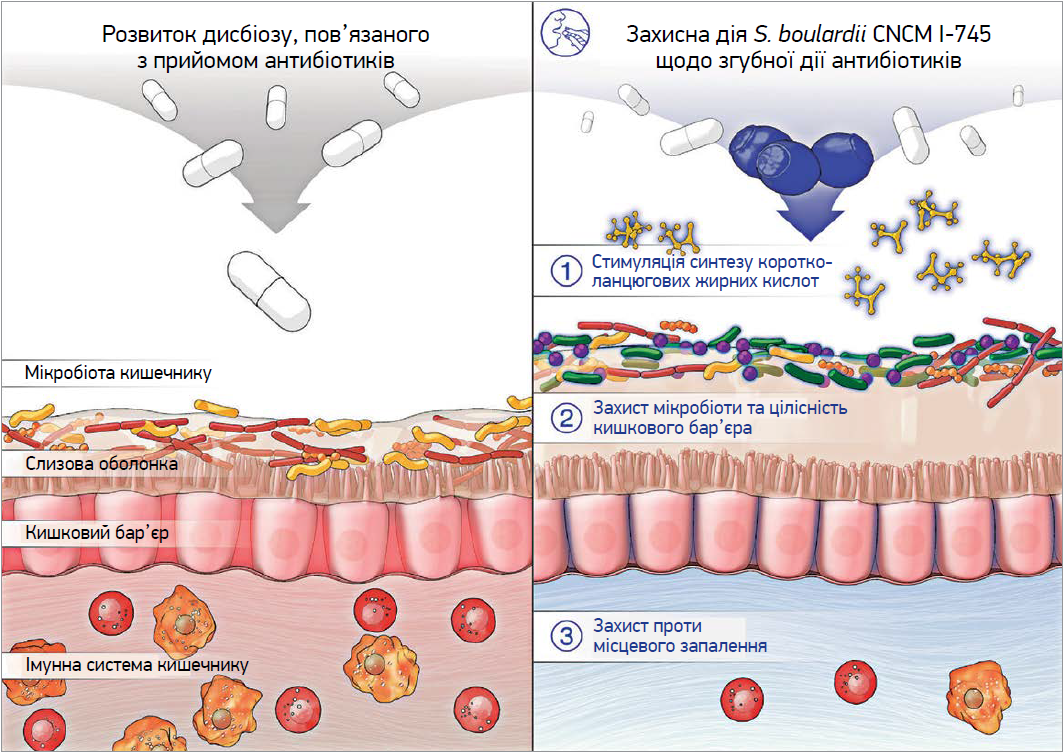 Рис. Механізми дії пробіотика Saccharomyces boulardii CNCM I‑745 у контексті антибіотик-асоційованого дисбактеріозу
Рис. Механізми дії пробіотика Saccharomyces boulardii CNCM I‑745 у контексті антибіотик-асоційованого дисбактеріозу
Метааналіз Szajewska та Kolodziej (2015) показав, що порівняно з плацебо або відсутністю лікування пробіотиками застосування S. boulardii зменшувало ризик ААД у дорослих і дітей (у контексті ерадикації Helicobacter pylori) на 8,5-18,7% (відношення ризиків (ВР) 0,47; 95% довірчий інтервал (ДІ) 0,38-0,57). У дітей призначення S. boulardii також було пов’язане зі значно нижчим ризиком C. difficile-асоційованої діареї (ВР 0,25; 95% ДІ 0,08-0,73).
Незважаючи на доведену користь пробіотиків для профілактики ААД (особливо в тих, хто вже стикався з цією проблемою), лише 10-60% призначень антибіотиків супроводжуються призначенням пробіотиків (Fernández-Alonso M. et al., 2022; Zhang J. et al., 2021).
Ставлення лікарів до спільного призначення антибіотиків і пробіотиків значно відрізняється від однієї країни до іншої (Ghoshal U.C. et al., 2021). На підставі результатів систематичного огляду можна стверджувати, що для запобігання або пом’якшення ААД, потрібно розпочинати лікування пробіотиками одночасно з початком антибіотикотерапії або (враховуючи швидкість дії антибіотиків) протягом наступних 48 год. Зазвичай рекомендована доза S. boulardii CNCM I‑745 для профілактики та лікування діареї, спричиненої прийомом антибіотиків, становить 250 мг 1 раз на день у дітей і 500 мг 1 раз на день (або 250 мг двічі на день) у дорослих (Szajewska H. et al., 2016, 2022).
Висновки
- Використання пробіотика S. boulardii CNCM I‑745 є науково обґрунтованим методом профілактики та лікування ААД й інфекції, спричиненої C. difficile, завдяки його здатності нормалізувати мікробіом кишечнику та послаблювати запальні процеси через модулювання імунної відповіді.
- Прийом S. boulardii CNCM I‑745 під час антибіотикотерапії значно знижує ризик розвитку діареї шляхом пригнічення патогенних бактерій і підтримки симбіотичної мікрофлори, що підтверджено численними клінічними дослідженнями.
- Механізм дії S. boulardii CNCM I‑745 включає зниження проникності кишкового бар’єра та зменшення секреції прозапальних цитокінів, що сприяє швидшому відновленню гомеостазу кишкової флори.
- Початок застосування пробіотика в перші 48 год після старту антибіотикотерапії забезпечує оптимальну профілактику розвитку ААД, оскільки на ранніх етапах терапії підтримується більший рівень захисних мікроорганізмів.
Waitzberg D., Guarner F., Hojsak I., et al. Can the evidence-based use of probiotics (notably Saccharomyces boulardii CNCM I‑745 and Lactobacillus rhamnosus GG) mitigate the clinical effects of antibiotic-associated dysbiosis? Adv. Ther. 2024; 41: 901-914.
https://doi.org/10.1007/s12325-024-02783-3.
Реферативний огляд підготувала Юлія Котикович
Довідка «ЗУ»
На вітчизняному фармацевтичному ринку представлені пробіотичні препарати, які містять ліофілізовані клітини S. boulardii CNCM I‑745, Ентерол® та Ентерол® Імуно («Біокодекс», Франція). Вони продемонстрували свою ефективність у профілактиці та лікуванні ААД, а також у відновленні кишкової мікробіоти.
S. boulardii має декілька механізмів дії, включно з інгібуванням адгезії патогенних мікроорганізмів до епітелію кишечнику, стимуляцією імунної відповіді, покращенням епітеліальної гомеостазу. Дослідження свідчать, що пробіотичні засоби, до складу яких входить S. boulardii, можуть знижувати запальні процеси в кишечнику, покращуючи загальний стан пацієнтів під час і після антибіотикотерапії.
Ентерол® Імуно фокусується на підтриманні імунної системи, що є особливо важливим для пацієнтів з ослабленим імунітетом або в періоди підвищеного ризику кишкових інфекцій. Клінічні дослідження підтверджують позитивний вплив пробіотиків на відновлення нормальної мікробіоти та зниження ризику виникнення дисбактеріозу.
Ентерол® та Ентерол® Імуно загалом характеризуються доброю переносимістю. Разом із тим їх призначення потребує обґрунтованого клінічного підходу, особливо в пацієнтів з імуносупресією або тяжкими захворюваннями, з урахуванням індивідуальних особливостей і можливих протипоказань.
Медична газета «Здоров’я України 21 сторіччя» № 18 (579), 2024 р



