1 листопада, 2020
Аміодарон в епоху COVID‑19: препарат тільки для лікування симптоматичних хворих або для профілактики інфекції?
Терміновий пошук ефективних методів лікування коронавірусної хвороби (COVID‑19) виявив широкий спектр препаратів-кандидатів для внесення до переліку потенційних терапевтичних лікарських засобів; при цьому ендоцитарний шлях був обраний як терапевтична стратегія при COVID‑19. Різні групи вчених визначили аміодарон як препарат-кандидат для лікування тяжкого гострого респіраторного синдрому, індукованого SARS-CoV‑2. Деякі з них рекомендували профілактичне внутрішньовенне введення аміодарону з метою зниження ризику раптової серцевої смерті (РСС) у пацієнтів, інфікованих SARS-CoV‑2. Ініційовано проведення рандомізованого дослідження ReCOVery-SIRIO для вивчення впливу аміодарону на стан симптоматичних хворих, госпіталізованих із підтвердженим діагнозом COVID‑19, порівняно зі стандартною терапією.
Аміодарон є одним із найзастосовуваніших протиаритмічних препаратів у світі для лікування як шлуночкових, так і суправентрикулярних аритмій, який здатен підтримувати синусовий ритм у разі фібриляції передсердь (ФП). Незважаючи на те що він не знижує рівень смертності від усіх причин у популяції хворих, які отримують цей препарат із метою первинної профілактики, аміодарон визнаний одним із найефективніших протиаритмічних засобів у запобіганні РСС. Окрім цього, препарат має протизапальні й антиоксидантні властивості, тобто чинить плейотропну дію, що може опосередковано пригнічувати суправентрикулярні аритмії. Однак аміодарон не позбавлений вторинних побічних дій, протипоказань і взаємодій з іншими ліками, включаючи потенційну здатність зумовлювати легеневий фіброз, аміодарон-індуковану легеневу токсичність (АІЛТ), ураження щитоподібної залози й печінки, підвищення рівня креатиніну, подовження інтервалу QT, брадіаритмію. Більшість із цих несприятливих ефектів зазвичай розвивається при тривалому застосуванні аміодарону. COVID‑19, імовірно, асоційована з високим ризиком виникнення аритмії, що існувала до інфікування коронавірусом, а також аритмії, що вперше з’явилася під час захворювання. Перебіг COVID‑19 асоційований зі значною достовірністю розвитку гострого респіраторного дистрес-синдрому (ГРДС); цей факт зменшує шанси застосування аміодарону, але вибір протиаритмічних препаратів у тяжких хворих на вірусну інфекцію значно обмежений. Отже, постає питання: чи можна використовувати аміодарон для лікування аритмії у хворих на COVID‑19? Аритмія (особливо ФП) часто реєструється в пацієнтів із COVID‑19, а аміодарон може бути ефективним додатковим антиаритмічним препаратом у таких хворих. У цій статті ми наводимо дані, що обґрунтовують застосування аміодарону при COVID‑19, а також, ґрунтуючись на даних доказової медицини, розглядаємо питання щодо того, чи є його призначення потенційною стратегією для профілактики інфекції SARS-CoV‑2, а не просто засобом для лікування хворих з ознаками та/або тяжким перебігом COVID‑19.
Раціональне застосування аміодарону. Аргументи за
Аміодарон для профілактики чи лікування інфекції
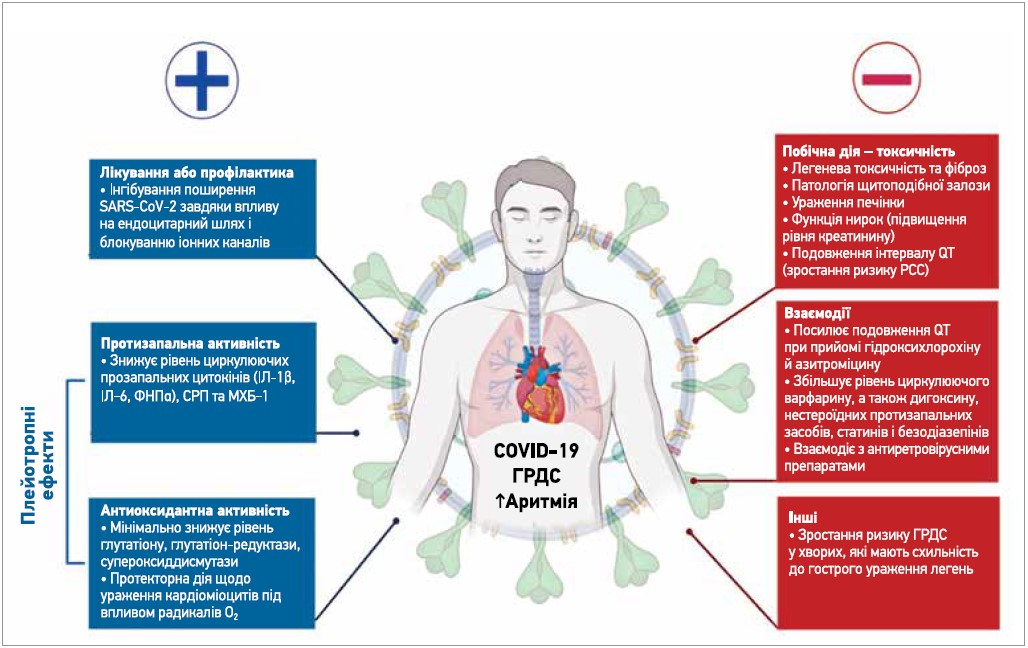
Існують думки стосовно доцільності дослідження катіонних амфіфільних препаратів (ліків, які одночасно мають ліофільні та ліофобні властивості) щодо можливого втручання в життєвий цикл РНК-вірусів. Зокрема, катіонний амфіфільний препарат аміодарон і його основний метаболіт N-дезетиламіодарон інгібують проникнення філовірусів (сімейство вірусів, до складу котрого входить вірус Ебола) в клітини в концентраціях, схожих на такі, що виявляють у крові пацієнтів, які приймають його з приводу аритмії. Аміодарон може перешкоджати проникненню й ампліфікації SARS-CoV‑2; також він здатний блокувати поширення SARS-CoV‑2 у культурі клітин, пригнічуючи інфекцію на постендосомальному рівні. Такий ефект досягається без зміни щільності рецепторів ангіотензинперетворювального ферменту на поверхні клітин і без перешкоди для прикріплення SARS-CoV‑2 до клітин. Отже, аміодарон визначається як інгібітор поширення SARS-CoV‑2 завдяки його здатності змінювати ендоцитарний шлях, блокуючи іонні канали, навіть якщо вірус зможе доставити свій геном у цитоплазму через цитоплазматичну мембрану, оминаючи тим самим ендоцитарний компартмент. Нещодавно Aimo та співавт. запропонували аміодарон як кандидата для лікування COVID‑19 як у вигляді монотерапії, так і в складі комбінованого лікування. Автори припустили, що аміодарон ефективніший у разі низького вірусного навантаження, тобто його призначення доцільніше в осіб, які зазнали впливу вірусу, але поки що не мають симптомів. Багатоцентрове дослідження ReCOVery-SIRIO вивчає вплив аміодарону на реплікацію вірусу шляхом інгібування іонних каналів у госпіталізованих пацієнтів із початковою стадією COVID‑19. Це дослідження може мати велике значення для послаблення надходження та реплікації вірусів іще до розвитку цитокінового шторму, зумовленого імунною відповіддю організму-хазяїна (рис.).
Рис. Раціональне застосування аміодарону у хворих на COVID‑19: аргументи за та проти
Протизапальні й антиоксидантні властивості
COVID‑19 асоціюється зі значною активністю запального процесу, що може спричинити запалення судин, розвиток міокардиту й аритмії. Існує припущення, що прийом аміодарону запобігає продукції цитокінів і виникненню окислювального стресу, тобто може захистити легені від каскаду реакцій, які розвиваються при сепсисі. Зокрема, інфекція SARS-CoV‑2 запускає активацію дендритних клітин і моноцитів/макрофагів, які активізують секрецію прозапальних цитокінів, як-от інтерлейкін‑6 (ІЛ‑6), моноцитарний хемоатрактантний білок‑1 (MХБ‑1), фактор некрозу пухлини (ФНП) тощо. Крім того, зменшується активність ангіотензину I-VII, що спричиняє вазоконстрикцію, запалення, розвиток окислювальних і фіброзних ушкоджень.
Щодо прозапальних цитокінів Polat і співавт. повідомили, що застосування аміодарону дозою 25-50 мг/кг знижує рівень циркулюючих запальних цитокінів ІЛ‑1β, ІЛ‑6 і ФНП, а також 8-ізопростагландину F2α в легенях щурів, які отримували аміодарон. У схожий спосіб відзначено збільшення активності супероксиддисмутази та сумарного рівня глутатіону в легенях. Ці дані узгоджуються з результатами, отриманими Matsumori та співавт., які показали, що аміодарон пригнічує синтез ІЛ‑1β, ІЛ‑6 і ФНП у людських мононуклеарах периферичної крові. Ґрунтуючись на даних експериментального дослідження на мишачій моделі вірусного міокардиту, індукованого вірусом енцефаломіокардиту, Ito та співавт. повідомили, що аміодарон (30 мг/кг/добу, що еквівалентно 2,5 мг/кг у людей) достовірно зменшував рівень ІЛ‑6 у міокарді та сприяв зростанню виживаності, проте не впливав на рівень ФНП. Важливо, що синтез цих цитокінів посилювався в разі прийому інших антиаритмічних препаратів, як-от хінідин і дизопірамід. Oral і співавт. вивчали вплив тривалого прийому аміодарону на рівень ФНП у хворих на ішемічну/неішемічну кардіоміопатію. Автори проаналізували початкові рівні циркулюючого ФНП та його вміст через 1 і 2 роки лікування у хворих із III функціональним класом за NYHA, які отримували плацебо (n=40) чи аміодарон (n=40). Достовірні зміни у хворих на неішемічну кардіоміопатію не зафіксовані, тоді як прийом аміодарону збільшував рівень ФНП у хворих на ішемічну кардіоміопатію через 1 рік лікування, але не через 2 роки терапії, що свідчить про наявність у цього препарату різних ефектів, поява яких залежить від тривалості застосування. Досліджуючи моноцити пацієнтів з ідіопатичною дилатаційною кардіоміопатією, Hirasawa та співавт. констатували, що 4-тижневий прийом аміодарону зменшував продукцію цитокінів і хемокінів (зокрема, ФНП та MХБ‑1) у відповідь на С-реактивний білок. Ці автори припустили, що аміодарон здатний покращувати роботу серця за рахунок власних протизапальних властивостей, хоча цей факт іще не є доведеним у людей.
З іншого боку, окислювальний стрес також відіграє важливу роль у патофізіології ішемічної хвороби серця та серцевої недостатності, тому поліпшення антиоксидантної здатності може мати велике значення в лікуванні цих пацієнтів. Halici та співавт. вивчали вплив аміодарону на рівні глутатіону й активність супероксиддисмутази, каталази, глутатіон-S-трансферази, глутатіонредуктази та мієлопероксидази в щурів із карагінан-індукованим набряком лап. У цьому дослідженні аміодарон зменшив вираженість карагінан-індукованого набряку лап, збільшив активність каталази та глутатіон-S-трансферази, дещо знизив рівень глутатіону й активність супероксиддисмутази, глутатіонредуктази, ампліфікував набряк-асоційовану активність мієлопероксидази. Ці результати дають змогу припустити, що протизапальна дія аміодарону може бути пов’язана з антиоксидантними властивостями. Ide та співавт. вивчали антиоксидантні властивості аміодарону та його вплив на вільні радикали кисню, здатність запобігати шкідливій дії кисневих радикалів на кардіоміоцити. Вони описали дозозалежне зменшення інтенсивності сигналів 5,5-диметил-піролін N-оксиду під впливом аміодарону, тоді як дизопірамід й атенолол не мали таких ефектів. Аміодарон дозою 10 ммоль/л також захищав неушкоджені кардіоміоцити дорослих собак від ОН-опосередкованого ушкодження міоцитів, що дає змогу припустити здатність препарату захищати кардіоміоцити від наслідків окислювального стресу шляхом безпосереднього видалення вільних кисневих радикалів.
Саме тому, незважаючи на відсутність точних даних щодо молекулярного механізму дії, за допомогою якого аміодарон набуває протизапальної та/або антиоксидантної активності, аміодарон-індуковане інгібування синтезу цитокінів, хемокінів поряд із поліпшенням антиоксидантних здібностей може стати вирішальним фактором, що визначає потенційні сприятливі ефекти цього препарату в лікуванні COVID‑19.
Аргументи проти застосування аміодарону
Використання аміодарону має суттєві обмеження. Протягом перших місяців пандемії комбінація гідроксихлорохіну й азитроміцину була широко рекомендована для лікування COVID‑19, але ця терапія залишається досить суперечливою з огляду на ефективність і здатність впливати на інтервал QT. Аміодарон може посилити це подовження QT, що пов’язано зі збільшенням ризику РСС. Окрім того, клінічне застосування аміодарону обмежене у зв’язку з його значною позакардіальною токсичністю; його прийом асоційований із підвищенням рівня печінкових трансаміназ, дисфункцією щитоподібної залози, легеневою токсичністю, хоча ці побічні дії безпосередньо пов’язані з тривалістю лікування (токсичність аміодарону є кумулятивною й дозозалежною). Йодовмісні фрагменти аміодарону та їх значна ліофільність підсилюють токсичність препарату. АІЛТ може розвинутися після короткого чи тривалого прийому та характеризується появою гострої гіперчутливості легень із неоднорідними інфільтратами чи хронічного інтерстиційного фіброзу легень. Важливо пам’ятати, що аміодарон-індукований фіброз легень є надзвичайно рідкісною побічною дією, що зазвичай розвивається через кілька місяців/років його прийому. До факторів, які спричиняють розвиток АІЛТ, належать пряма цитотоксична дія, фосфоліпідоз, імунологічні механізми й активація ангіотензинової системи; втім, точні механізми, що провокують виникнення АІЛТ, залишаються остаточно не вивченими.
Висновки та перспективи
Насамперед, незважаючи на вищезгадані позитивні ефекти, слід зазначити, що докази доцільності використання аміодарону у хворих на COVID‑19 нечисленні; ми повинні бути обережними та ретельно аналізувати очікувані результати клінічних досліджень, які тривають, із метою отримання обґрунтованих висновків. Профіль безпеки/ризику аміодарону добре відомий і, ймовірно, препарат є ще одним кандидатом для проведення клінічних випробувань із лікування COVID‑19. Короткотривала терапія аміодароном відносно добре переноситься. Можна припустити, що аміодарон ефективніший у разі низького вірусного навантаження та на ранніх стадіях COVID‑19, а отже, його клінічні дослідження варто проводити здебільшого в безсимптомних хворих або в пацієнтів, які перебувають на ранніх стадіях захворювання, а не в осіб із тяжким перебігом COVID‑19.
Поки ми чекаємо на появу нових даних доказової медицини, шлуночкові та суправентрикулярні аритмії у хворих на COVID‑19 слід лікувати так само, як у пацієнтів, які не інфіковані COVID‑19, а саме шляхом призначення антиаритмічних препаратів. Аритмія, особливо ФП, типова для COVID‑19 й асоційована з високим ризиком захворюваності та смерті. Аміодарон є ефективним протиаритмічним засобом для лікування госпіталізованих хворих, схильних до суправентрикулярних і шлуночкових аритмій.
Sanchis-Gomar F., Lavie C., Morin D. et al. Amiodarone in the COVID‑19 era: treatment for symptomatic patients only, or drug to prevent infection? Am. J. Cardiovasc. Drugs. 2020. https://doi.org/10.1007/s40256-020-00429-7.
Переклала з англ. Тетяна Можина
Медична газета «Здоров’я України 21 сторіччя» № 17 (486), 2020 р.