6 січня, 2023
Вибір антикоагулянтів у пацієнтів із фібриляцією передсердь: фокус на безпеку. Місце апіксабану
За матеріалами ХХІІІ Національного конгресу кардіологів України (20‑23 вересня 2022 р., м. Київ)
Чи слід розпочинати застосування антикоагулянтів, і якщо так, то яких саме і коли, у пацієнтів, які мають підвищений ризик кровотечі та тромбоемболії, зокрема з фібриляцією передсердь (ФП) і супутніми захворюваннями, порушенням функції нирок, неконтрольованою артеріальною гіпертензією (АГ), масивною кровотечею в анамнезі тощо? Зокрема, зазначені питання було розглянуто під час науково-практичного симпозіуму, що відбувся 20 вересня поточного року.
? Чи змінилися стратегії вибору антикоагулянтів у пацієнтів із неклапанною фібриляцією передсердь?
 Керівник відділу клінічної аритмології та електрофізіології ДУ ННЦ «Інститут кардіології ім. академіка М.Д. Стражеска» НАМНУ, д.мед.н., професор Олег Сергійович Сичов зазначив, що ризик тромбоемболій можна розрахувати за шкалою CHA2DS2-VASc, при цьому низький ризик інсульту відповідає 0 балам у чоловіків і 1 балу в жінок. Але наявність навіть 1 бала не виключає можливість розвитку несприятливих серцево-судинних (СС) подій і смерті. Крім того, не всі чинники ризику розвитку інсульту мають однакову вагу, наприклад, цукровий діабет (ЦД) підвищує ймовірність тромбоемболії у 2,5 раза, тоді як вік > 65 років підвищує ризик її розвитку більш ніж утричі як у чоловіків, так і в жінок (Chao et al., 2015).
Керівник відділу клінічної аритмології та електрофізіології ДУ ННЦ «Інститут кардіології ім. академіка М.Д. Стражеска» НАМНУ, д.мед.н., професор Олег Сергійович Сичов зазначив, що ризик тромбоемболій можна розрахувати за шкалою CHA2DS2-VASc, при цьому низький ризик інсульту відповідає 0 балам у чоловіків і 1 балу в жінок. Але наявність навіть 1 бала не виключає можливість розвитку несприятливих серцево-судинних (СС) подій і смерті. Крім того, не всі чинники ризику розвитку інсульту мають однакову вагу, наприклад, цукровий діабет (ЦД) підвищує ймовірність тромбоемболії у 2,5 раза, тоді як вік > 65 років підвищує ризик її розвитку більш ніж утричі як у чоловіків, так і в жінок (Chao et al., 2015).
Щодо ризику розвитку масивних кровотеч, то за даними 5-річного спостереження майже 59 тис пацієнтів із ФП, які отримували терапію прямими оральними антикоагулянтами (ПОАК), він лишається частою клінічною проблемою (Chao et al., 2019).
Врахування модифікованих чинників ризику кровотеч у цій популяції залишається важливим. Чинниками ризику розвитку масивних кровотеч під час терапії ПОАК, які не увійшли до традиційного оцінювання ризику, є чорна раса, анемія, рак, використання селективних інгібіторів зворотного захоплення серотоніну. Усі вони можуть мати вплив на прийняття рішення щодо потреби у запобіганні інсульту. Сьогодні незадоволеною є потреба в засобах профілактики інсульту з покращеними профілями безпеки.
Втім, що більший ризик за шкалою CHA2DS2-VASc, то вищим є ризик кровотеч. Це пов’язано з тим, що багато чинників ризиків інсульту і кровотеч, асоційованих із застосуванням антикоагулянтів, збігаються. Зокрема, йдеться про неконтрольовану АГ, ниркову недостатність, цереброваскулярні захворювання, інфаркт міокарда (ІМ) або ішемічну хворобу серця (ІХС) в анамнезі, старший вік. Одним із чинників ризику розвитку кровотеч є наявність її в анамнезі, при цьому ризик підвищується майже втричі.
Як відомо, чинники ризику можуть бути модифікованими і немодифікованими. Немодифікованими чинниками ризику кровотеч є вік ≥65 років, масивна кровотеча в анамнезі, захворювання нирок, що потребує діалізу або пересадки нирок, цироз печінки, злоякісне новоутворення, генетичні фактори. Щодо модифікованих чинників, то це зловживання алкоголем, яке підвищує ризик кровотеч в 1,5 раза.
Ризики розвитку інсульту і кровотеч динамічні. У великих дослідженнях доведено, що новий стан виникає дуже швидко.Так, у 80% пацієнтів, які мають супутні захворювання (серцеву недостатність (СН), АГ, ЦД чи судинні захворювання), новий стан з’явився через 4,2 місяця після діагностики ФП. Як зазначають дослідники, у 90% пацієнтів, які перенесли інсульт, час від виникнення супутньої патології до розвитку ішемічного інсульту становив понад 4,4 місяця (Chao et al., 2019).
Власне, як у вітчизняних, так і в міжнародних рекомендаціях зазначено, що слід періодично проводити повторне оцінювання ризиків розвитку інсульту і кровотечі для прийняття рішень щодо лікування (наприклад, призначення ОАК пацієнтам, у яких ризик інсульту більше не є низьким) і виявлення потенційно модифікованих чинників ризику кровотеч (клас І, рівень доказовості В). Зокрема, у пацієнтів із ФП і початковим низьким ризиком повторне оцінювання ризику інсульту має проводитись через 4‑6 міс. після первинного (клас ІІа, рівень доказовості В) (ESC, 2020).
Щодо вибору ОАК у пацієнтів із неклапанною ФП (нФП) і ризиком шлунково-кишкової (ШК) кровотечі, то як засіб першого вибору слід призначати апіксабан (Еліквіс) у дозі 5 мг двічі на добу або дабігатран у дозуванні 110 мг двічі на добу.
Як засіб другої лінії можна застосовувати дабігатран по 150 мг двічі на добу, едоксабан (60 мг) раз на добу або ривароксабан (20 мг) раз на добу.
Слід зазначити, що ШК-кровотеча, навіть на тлі приймання ОАК, зазвичай не призводить до смерті або постійної втрати працездатності.
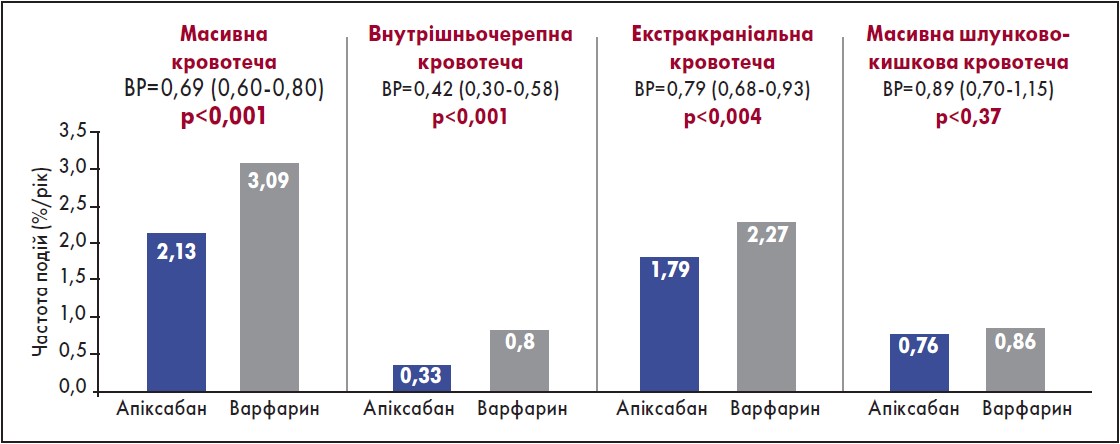
Отже, під час вибору ОАК слід керуватися переважно міркуваннями щодо запобігання інсульту. Своєю чергою, вираз «високий ризик ШК-кровотечі» є неточним. Наприклад, пацієнти з виразковою кровотечею, спричиненою H. pylori, можуть вже не мати високого ризику кровотечі після ерадикації інфекції. Також варто зауважити, що ризик ШК-кровотечі в разі застосування буль-якого антикоагулянту підвищується за одночасного приймання антитромбоцитарних засобів, зокрема ацетилсаліцилової кислоти (АСК) (Diener et al., 2017). Що стосується частоти кровотеч, то в дослідженнях за участю пацієнтів із нФП частота як масивних, так і внутрішньочерепних і екстракраніальних кровотеч була вірогідно меншою при застосуванні апіксабану порівняно з варфарином (Granger et al., 2011).
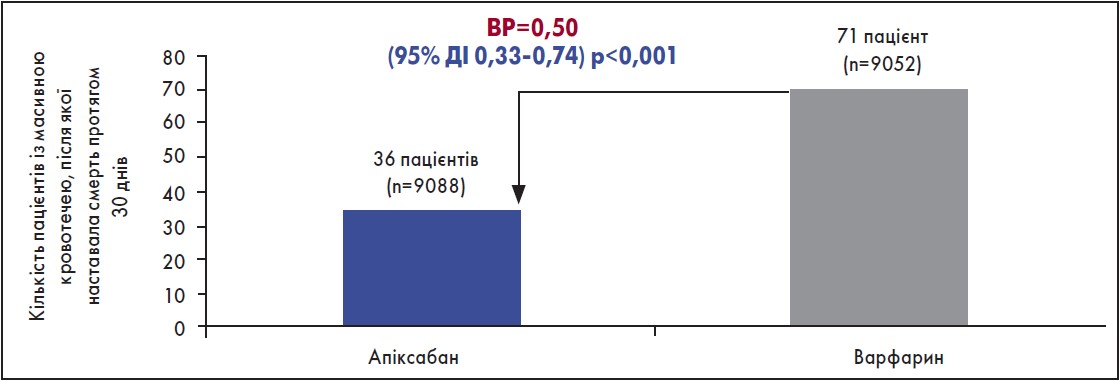
Щодо ШК-кровотечі, то різниці між препаратами не виявлено (рис. 1) (Granger et al., 2011). Також слід додати, що в дослідженні ARISTOTLE побічні реакції, пов’язані з екстракраніальною кровотечею, виникали рідше в групі застосування апіксабану порівняно з варфарином. Щодо випадків масивної кровотечі або смерті протягом 30 днів, то їх було вдвічі менше в разі застосування апіксабану порівняно з варфарином (рис. 2) (Hylek et al., 2014).
Рис. 1. Частота масивних кровотеч у пацієнтів із ФП (у разі застосування апіксабану порівняно з варфарином)
Адаптовано за C.B. Granger et al., 2011.
Рис. 2. Ризик масивної кровотечі та смерті протягом 30 днів на тлі застосуванння апіксабану і варфарину
Адаптовано за Е.М. Hylek et al., 2014.
Під час порівняння апіксабану з АСК у дослідженні AVERROES відмінностей між препаратами щодо виникнення масивних ШК і внутрішньочерепних кровотеч не виявлено (Conolly et al., 2011).
Якщо розглядати пацієнтів із порушенням функції нирок, то за результатами дослідження, про які доповідали на останньому конгресі Європейського товариства кардіологів (26‑29 серпня 2022 року, Барселона, Іспанія), серед 16 тис. пацієнтів із ФП фіксували різний ризик інсульту і кровотеч залежно від швидкості клубочкової фільтрації (ШКФ).
У дослідженні ARISTOTLE у пацієнтів віком ≥75 років (n=1898) із розрахунковою ШКФ (рШКФ) >30‑50 мл/хв/1,73м2 за ризиком масивних кровотеч апіксабан виявився значно безпечніший, ніж варфарин. У групі пацієнтів із рШКФ ≤30 мл/хв/1,73м2 (n=221) апіксабан також продемонстрував кращий профіль безпеки (Halvorsen et al., 2014).
У дослідженні ARISTOPHANES ефективність і безпека апіксабану в групі ниркових хвороб була більшими за такі варфарину (Lip et al., 2018).
Щодо дозування ПОАК, то, на жаль, спостерігається тенденція невідповідності між дозою препарату, що призначається в реальній клінічній практиці, і дозуванням, зазначеним в інструкції до застосування.
У дослідженні Orbit-AF II один із семи пацієнтів отримував знижену дозу ПОАК. Порівняно з пацієнтами, що застосовували належне стандартне дозування, хворі, які приймали невідповідні занижені дози, мали на 56% вищий ризик тромбоемболічних подій і на 161% вищий ризик смерті (Steinberg et al., 2018).
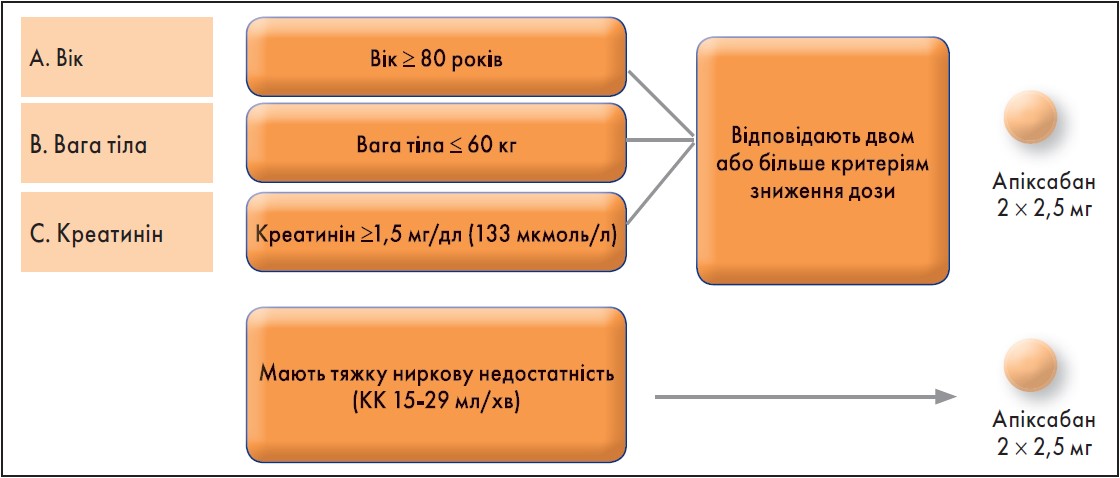
Є дуже просте і зручне правило застосування апіксабану: по 2,5 мг двічі на добу в пацієнтів, які відповідають критеріям АВС (А – вік, англ. «аge»;, В – вага тіла, англ. «вody weight»; С – креатинін, англ. «сreatinine»).
Якщо пацієнт відповідає двом або більше критеріям зниження дози (вік ≥80 років, вага тіла ≤60 кг і рівень креатиніну в сироватці ≥1,5 мг/дл (133 мкмоль/л), то апіксабан призначають у дозуванні 2,5 мг двічі на добу.
Також таке дозування апіксабану призначають пацієнтам із тяжкою нирковою недостатністю (кліренс креатиніну 15‑29 мл/хв) (рис. 3).
Рис. 3. Зниження дози апіксабану за критеріями АВС
Загалом індивідуальний ризик розвитку інсульту і кровотечі залежить від наявності конкретного чинника ризику і взаємодії між ними. Індивідуальний профіль ризику пацієнта є динамічним – він змінюється з часом і/або за конкретних клінічних умов.
? Якою має бути діагностика і лікувальна тактика у пацієнтів із високим ризиком розвитку серцево-судинних ускладнень?
 Старший науковий співробітник відділу аритмій серця ДУ ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМНУ, к.мед.н. Олена Миколаївна Романова зауважила, що поліморбідність (ПМ) передбачає наявність трьох і більше хронічних станів. Вона є маркером крихкості, який встановлюється на підставі моделі кумулятивного дефіциту (МКД), – методу виявлення підвищеного ризику, що враховує коморбідні стани (їхню суму використовують для ідентифікації осіб, які мають більшу ймовірність змін гомеостазу). ПМ збільшує ризик поліпрагмазії та є маркером підвищеного ризику небажаних явищ. Зокрема, за наявності ПМ у пацієнтів літнього віку з нФП антикоагулянтна терапія може бути пов’язана з тими чи іншими ризиками СС-ускладнень.
Старший науковий співробітник відділу аритмій серця ДУ ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМНУ, к.мед.н. Олена Миколаївна Романова зауважила, що поліморбідність (ПМ) передбачає наявність трьох і більше хронічних станів. Вона є маркером крихкості, який встановлюється на підставі моделі кумулятивного дефіциту (МКД), – методу виявлення підвищеного ризику, що враховує коморбідні стани (їхню суму використовують для ідентифікації осіб, які мають більшу ймовірність змін гомеостазу). ПМ збільшує ризик поліпрагмазії та є маркером підвищеного ризику небажаних явищ. Зокрема, за наявності ПМ у пацієнтів літнього віку з нФП антикоагулянтна терапія може бути пов’язана з тими чи іншими ризиками СС-ускладнень.
У субаналізі базового дослідження ARISTOTLE було проаналізовано інформацію щодо 17 різних коморбідних станів ендокринної, опорно-рухової, легеневої, серцево-судинної систем (ССС), захворювань шлунково-кишкового тракту (ШКТ), нирок, крові, порушень когнітивної функції тощо.
Після закінчення періоду лікування хворих класифікували за кількістю супутніх захворювань, про які повідомляли під час залучення пацієнтів до дослідження. Пацієнтів віком ≥55 років (n=16 800) розподілили на групи за кількістю коморбідних станів: декілька, 0‑2 (n=6143; 36,6%), середня кількість, 3‑5 (n=8461; 50,4%), найбільша кількість >6 (n=196; 13,1%). Середня тривалість спостереження становила 1,8 року (Alexander et al., 2017). Як відомо, ФП частіше виникає на тлі АГ, яка була наявна в пацієнтів усіх зазначених груп. Щодо пацієнтів із високою ПМ, то зазвичай вони мають ІХС, СН, ЦД, захворювання ШКТ і нирок. За даними дослідження, частота інсульту/системної емболії, смерті та масивних кровотеч на 100 пацієнто-років зростала разом із ПМ (≥3 коморбідні стани), що було суттєвим навіть після коригування за віком, статтю, расою і регіоном.
Своєю чергою, аналіз ризиків побічних явищ у кожній групі коморбідних станів засвідчив, що безпека й ефективність апіксабану і варфарину були постійними в усіх групах, із меншою кількістю кровотеч у разі застосування апіксабану в усіх групах. Частота внутрішньочерепної кровотечі була значно нижчою в разі застосування апіксабану в усіх групах із ПМ (≥6 супутніх захворювань).
Було зроблено висновок, що ПМ виникають у 63% пацієнтів із нФП як у дослідженні, так і в загальній популяції (Alexander et al., 2017). Вона асоціюється зі старшим віком, поліпрагмазією, застосуванням нестероїдних протизапальних засобів, антацидів, падінням у попередньому році та підвищеним ризиком інсульту за шкалою CHA2DS2-VASc. Хоча ПМ асоціюється з більшим ризиком інсульту/системної емболії, смерті та масивних кровотеч, ефективність і безпека апіксабану була постійною навіть серед пацієнтів із найбільшою кількістю коморбідних станів.
Такі висновки сприяють поширенню результатів досліджень пацієнтів із нФП, які часто мають більший показник ПМ, ніж у клінічних випробуваннях. Важливий аспект також стосується ФП й ожиріння, яке призводить до електрофізіологічних, структурних і гістологічних змін передсердь, що асоціюється з високим ризиком виникнення і прогресування ФП. Водночас доведено, що зниження ваги зменшує тривалість і виразність симптомів ФП, призводить до ремоделювання серця і знижує ризик рецидиву (Pathak et al., 2015). Саме тому ожиріння виокремлено як модифікований чинник ризику, що має вплив на перебіг ФП (ESC, 2020).
На останньому Конгресі Європейського товариства кардіологів у Барселоні також обговорювали вплив метаболічного синдрому (МС) на ризик ішемічного інсульту в пацієнтів із ФП, які не приймають антикоагулянти і мають низькі показники за шкалою CHA2DS2-VASc. Зазначалося, що додатковий ризик інсульту в пацієнтів із ФП через наявність МС є суперечливим (Ahn et al., 2022).
Так, за оцінки 0‑1 бал за шкалою CHA2DS2-VASc необов’язково призначати ОАК. Водночас, така кількість балів асоційована із широким діапазоном ризику інсульту: від 0% до 3,23%.
Своєю чергою, ризик збільшується до ≥2 балів через супутні захворювання, що виникли після діагностування ФП. Отже, ризик ішемічного інсульту є континуальною, а не дискретною системою класифікації, тож МС незалежно асоціюється з підвищеним ризиком інсульту. При цьому АГ є компонентом МС, що лідирує. Якщо йдеться про ризик виникнення ішемічного інсульту, то чим більше компонентів налічує МС, тим вищим є ризик ФП та її ускладнень. Зокрема, серед пацієнтів із ФП, які не приймали ОАК, із балом за шкалою CHA2DS2-VASc 0 або 1, МС асоціюється з підвищенням ризику ішемічного інсульту на 19%. Більше метаболічне навантаження пов’язане з лінійним підвищенням ризику ішемічного інсульту в 1,6 раза. Найпотужнішим чинником підвищення ризику інсульту був підвищений артеріальний тиск (Ahn et al., 2022).
Щодо ЦД, то дані проспективного багатоцентрового дослідження засвідчили, що пацієнти з інсулінозалежним ЦД мали в 2,5 раза вищий ризик інсульту чи системної емболії протягом року порівняно з інсулінонезалежним ЦД. Тобто загальні докази підтверджують зв’язок між діабетом і ФП, а наявність коморбідного діабету при ФП може суттєво погіршувати прогноз (Dublin et al., 2010; Qi et al., 2017).
Одними з найтяжчих пацієнтів у нашій практиці є хворі з нирковою недостатністю, для яких дуже актуальним є питання вибору препарату і його дозування. Щодо порівняння профілів ризику інсульту і кровотечі в пацієнтів із ФП і хронічною хворобою нирок (ХХН), то при ШКФ < 30 мл/хв/1,73м2 підвищення ризику масивної кровотечі було більшим, ніж підвищення ризику ішемічного інсульту, із негативним антикоагулянтним балансом (більше підвищення ризику кровотечі, ніж зменшення емболії). У цьому випадку оклюзія вушка лівого передсердя є альтернативою для розгляду (Barcia et al., 2022). Зазначені результати підтверджують нагальну потребу в рандомізованих клінічних дослідженнях для вивчення цього варіанта в пацієнтів із ХХН.
? Потрійна чи подвійна терапія при гострому коронарному синдромі: коли застосовувати і як довго?
 Старший науковий співробітник відділення реанімації та інтенсивної терапії ДУ ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМНУ, д.мед.н., Олег Ігоревич Іркін нагадав, що антикоагулянтна й антитромбоцитарна терапія – це невід’ємний компонент лікування хворих із ФП, гострим коронарним синдромом (ГКС) або стентуванням. Виключення АСК зі схеми лікування довело, що ризик кровотеч і смерті є достовірно нижчим у разі подвійної (ОАК +клопідогрель 75 мг), ніж потрійної (ОАК+клопідогрель 75 мг+80 мг АСК) терапії (Dewilde et al., 2012).
Старший науковий співробітник відділення реанімації та інтенсивної терапії ДУ ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМНУ, д.мед.н., Олег Ігоревич Іркін нагадав, що антикоагулянтна й антитромбоцитарна терапія – це невід’ємний компонент лікування хворих із ФП, гострим коронарним синдромом (ГКС) або стентуванням. Виключення АСК зі схеми лікування довело, що ризик кровотеч і смерті є достовірно нижчим у разі подвійної (ОАК +клопідогрель 75 мг), ніж потрійної (ОАК+клопідогрель 75 мг+80 мг АСК) терапії (Dewilde et al., 2012).
За даними метааналізу (n=7182), подвійна терапія є кращим вибором при ФП після черезшкірного коронарного втручання (ЧКВ). Так, антагоністи вітаміну К (АВК) у поєднанні з клопідогрелем асоціювалися зі зниженням кількості кровотеч і частоти смерті, ІМ, інсульту, реваскуляризації та тромбозу стента порівняно з потрійною терапією (D’Ascenza et al., 2015).
Усі молекули ПОАК (ривароксабан, дабігатран, апіксабан, едоксабан) у пацієнтів із ФП після ЧКВ і ГКС вивчали у великих дослідженнях: PIONEER AF-PCI, RE-DUAL PCI, AUGUSTUS ACS/PCI, ENTRUST AF-PCI (Gibson et al., 2016, Cannon et al., 2017). При цьому тільки в дослідженні AUGUSTUS ACS/PCI (n=4600) з АВК порівнювали не лише ПОАК (апіксабан), але і схему лікування, а саме подвійну і потрійну терапію із застосуванням як апіксабану, так і АВК (Lopes et al., 2018). Виключення АСК зі схеми лікування було достовірно безпечніше, ніж її застосування у схемі потрійної терапії. Відповідно до даних метааналізу, застосування подвійної терапії (без АСК) знижувало ризик як кровотеч, так і смерті хворих із ФП незалежно від ризику кровотечі та інсульту (Harskamp et al., 2022). При цьому найбезпечнішою схемою лікування виявилося застосування апіксабану в схемі саме подвійної терапії, що зовсім не мало впливу на ризик смерті, госпіталізації та ішемічних подій у пацієнтів із ФП і ГКС (Lopes et al., 2019).
За даними метааналізу, у якому вивчали результати подвійної й потрійної терапії (дослідження PIONEER AF-PCI, AUGUSTUS, ENTRUST AF-PCI, Re-DUAL PCI із загальною кількістю 10 234 пацієнти), подвійна терапія переважала над потрійною щодо ризику розвитку будь-якої кровотечі (Gargiulo et al., 2019). Щодо впливу на розвиток ішемічних подій, то різниці між подвійною і потрійною терапією не виявлено, хоча спостерігали тенденцію до незначного збільшення ризику розвитку ІМ і тромбозу стентів (Vranckx et al., 2019). У дослідженні AUGUSTUS аналізували, як часто розвивався тромбоз стента в пацієнтів із ФП і ГКС (стентування провели 3498 пацієнтам). Доведено, що всі випадки тромбозу стента розвивалися впродовж першого місяця стентування або після ГКС (Lopes et al., 2019).
Виключення зі схеми лікування АСК сприяло зниженню ризику кровотеч за перші 30 діб після ГКС і протягом 6 міс. Але подвійна терапія за перші 30 діб не забезпечує запобігання СС ішемічним ускладненням. Саме тому європейські й американські настанови з лікування хворих із ФП і ГКС без елевації сегмента ST містять єдиний алгоритм антитромботичної терапії.
Зокрема, вони рекомендують загальну стандартну стратегію застосування потрійної терапії тільки періопераційно (у 1-й тиждень після ГКС або стентування коронарної судини), після чого проводити терапію новим оральним антикоагулянтом (НОАК) і монотерапію антитромбоцитарним препаратом. Лише за наявності високого ішемічного ризику в пацієнта протягом 1-го місяця після ГКС або стентування слід застосовувати потрійну терапію (НОАК+АСК+інгібітор P2Y12-рецепторів), після чого переходити на подвійну терапію (Collet et al., 2020, Angolillo et al., 2021).
Висновки
Інсульт є важким ускладненням ФП, якому можна ефективно запобігти за допомогою ПОАК. При цьому не слід зважувати на терезах ризик розвитку кровотеч і користь антитромботичної терапії, тому що у хворих із ФП ризик тромбозів удвічі вищий, ніж ризик кровотеч. Отже, призначати ПОАК потрібно обов’язково, інша справа, що слід обирати молекулу не лише з доведеною ефективністю, а й з відповідним профілем безпеки, зокрема, апіксабан.
Застосування подвійної терапії (без АСК) з апіксабаном знижує ризик як кровотеч, так і смерті хворих із ФП незалежно від ризику кровотечі та інсульту.
Підготувала Олександра Демецька
Статтю надруковано за підтримки компанії «Пфайзер» PP-ELI-UKR-0225