15 січня, 2021
Органопротекторні можливості L-аргініну в лікуванні пацієнтів з артеріальною гіпертензією
.jpg) Незважаючи на досягнутий значний прогрес у діагностиці й лікуванні артеріальної гіпертензії (АГ), це захворювання залишається одним із головних чинників інвалідизації та смертності не тільки в Україні, а й у всьому світі [1], що пов’язано насамперед із зумовленим АГ ураженням органів-мішеней: головного мозку, серця та нирок.
Незважаючи на досягнутий значний прогрес у діагностиці й лікуванні артеріальної гіпертензії (АГ), це захворювання залишається одним із головних чинників інвалідизації та смертності не тільки в Україні, а й у всьому світі [1], що пов’язано насамперед із зумовленим АГ ураженням органів-мішеней: головного мозку, серця та нирок.
Згідно з рекомендаціями Європейського товариства гіпертензії (ЄТГ) і Європейського товариства кардіологів (ЄТК) 2018 р., ураження органів, спричинене гіпертензією, визначається як структурні чи функціональні зміни артерій або органів, які вони кровопостачають (серця, судин, головного мозку, очей та нирок), що обумовлені підвищеним артеріальним тиском (АТ) [2]. Ураження органів, обумовлене АГ, частіше зустрічається в разі тяжкої або тривало існуючої АГ, однак може виявлятися і за менш тяжкого перебігу захворювання, збільшуючи серцево-судинний ризик; при цьому за ураження декількох органів ризик зростає більшою мірою [3-5]. З іншого боку, зниження АТ на тлі антигіпертензивної терапії дозволяє досягти регресу чи уповільнити прогресування ураження органів-мішеней, знизити ризик розвитку серцево-судинних захворювань (ССЗ), покращуючи прогноз пацієнта [6-8].
Запобігти виникненню та розвитку ураження органів-мішеней може раннє їх виявлення та призначення ефективної антигіпертензивної терапії, причому інтенсивність антигіпертензивної терапії пов’язана не тільки з наявністю ураження органів-мішеней, а й додаткових факторів серцево-судинного ризику (цукрового діабету – ЦД, ожиріння, куріння) [9]. Крім того, існує багато доказів стосовно позитивних наслідків жорсткішого контролю АТ (систолічний АТ – САТ <130 проти 130-139 мм рт. ст.) щодо зниження ризику ССЗ і смерті від них (принаймні в пацієнтів віком <65 років) [10].
Окрім ступеня зниження АТ, важливим фактором органопротекції при АГ є швидкість його зниження. В останніх рекомендаціях ЄТГ/ЄТК зазначено, що 3 місяці – оптимальний строк для досягнення цільового АТ у пацієнтів з АГ [2].
Ще однією важливою умовою ефективного захисту органів-мішеней при АГ є використання лікарських засобів з доведеною органопротекторною дією, до яких належать антигіпертензивні препарати першої лінії: інгібітори ангіотензинперетворювального ферменту (ІАПФ), блокатори рецепторів ангіотензину ІІ (БРА), блокатори кальцієвих каналів (БКК), тіазидоподібні / тіазидні діуретики, β-адреноблокатори. Водночас, згідно з рекомендаціями ЄТГ/ЄТК 2018 р., ініціація антигіпертензивної терапії має ґрунтуватися на подвійній комбінації в складі блокатора ренін-ангіотензин-альдостеронової системи (ІАПФ чи БРА) та БКК або тіазидного / тіазидоподібного діуретика, що вважається оптимальною терапією для всіх проявів ураження органів, пов’язаних з АГ, не виокремлюючи переваг певного класу антигіпертензивних препаратів у органопротекції [2].
Проте, зважаючи на високий ризик серцево-судинних ускладнень АГ, триває пошук додаткових шляхів захисту органів-мішеней. Відомо, що одним із провідних патофізіологічних механізмів розвитку ураження органів-мішеней за АГ є дисфункція ендотелію та зниження біодоступності оксиду азоту (NO) [11, 12]. Дослідження демонструють, що втрата ендотеліального гомеостазу за АГ має ключову роль у формуванні міокардіальних, церебральних і ниркових ускладнень. У випробуванні G. Modena та співавт., які досліджували потік-залежну дилатацію плечової артерії в 400 жінок у постменопаузальний період із легкою та помірною АГ, показано, що відновлення ендотеліального гомеостазу може бути важливим фактором серцево-судинного захисту [13]. У цьому проспективному дослідженні продемонстровано, що неможливість покращити функцію ендотелію протягом 6-місячного періоду фармакологічної терапії передбачала гірший серцево-судинний результат (незалежно від методу лікування або величини зниження АТ). Загалом це дозволяє припустити, що усунення дисфункції ендотелію може бути важливою терапевтичною мішенню при захворюваннях, спричинених АГ.
Оскільки втрата біодоступності NO – основна особливість ендотеліальної дисфункції за АГ, введення додаткового субстрату для посилення продукції NO може дати додаткові переваги в органопротекції за АГ.
Амінокислота L-аргінін є основним субстратом для синтезу судинного NO. Численні дослідження (хоча й різною мірою) демонструють сприятливий вплив L-аргініну на продукцію NO та функцію ендотелію як при короткостроковому, так і при тривалому застосуванні. У низці клінічних досліджень введення L-аргініну покращувало ендотелійзалежну вазодилатацію (ЕЗВД) при гіперхолестеринемії й атеросклерозі [14, 15].
Метою дослідження було вивчення впливу препарату L-аргініну (Тівортін®, ТОВ «Юрія-Фарм») на показники церебральної гемодинаміки та структурно-функціонального стану нирок задля з’ясування можливостей додаткового органопротекторного впливу в пацієнтів з АГ.
Матеріали та методи
До випробування залучили 60 пацієнтів з неконтрольованою АГ, середній вік яких становив 59,6±1,6 року (18,5% – чоловіки, 81,5% – жінки).
Критерії залучення до дослідження:
- неконтрольована АГ І-ІІ стадій, 1-3 ступенів;
- вік від 18 до 80 років;
- згода пацієнта на участь у випробуванні.
До дослідження не залучали пацієнтів у разі відомої підвищеної чутливості до препарату L-аргінін або його компонентів; за наявності вторинної АГ, міокардиту, вад серця, тяжкої серцевої недостатності, ЦД у фазі декомпенсації та/або з епізодами гіпоглікемії в анамнезі, інфекційних захворювань; у разі вагітності та грудного вигодовування, печінкової і ниркової недостатності, злоякісних новоутворень, супутньої терапії з використанням лікарських засобів зі схожими із досліджуваним препаратом фармакологічними ефектами чи механізмом дії.
На етапі скринінгу щодо всіх пацієнтів були проведені реєстрація скарг, збір анамнезу, загальноклінічне обстеження, яке включало вимірювання офісного АТ і добове моніторування АТ за загальноприйнятими методиками, фізикальне та неврологічне обстеження, біохімічне дослідження крові та визначення альбумінурії в добовій сечі.
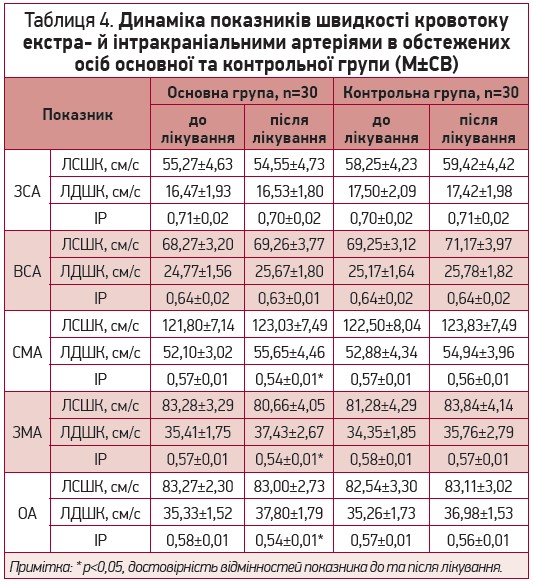
Стан церебрального кровотоку оцінювали за допомогою дуплексного сканування екстра- й інтракраніальних артерій, яке проводили на апараті Sonoline Omnia (Siemens, Німеччина) за стандартною методикою на початку та наприкінці дослідження [16].
Визначали діаметри загальної (ЗСА), внутрішньої (ВСА) і зовнішньої (ЗоСА) сонних артерій та товщину комплексу інтима-медіа (ТКІМ) в ділянці біфуркації ЗСА та бляшки, а також показники кровотоку за ЗСА, ВСА, ЗоСА, середньої (СМА), передньої, задньої (ЗМА) мозкових і основної (ОА) артерій, які включали максимальну систолічну (ЛСШК), мінімальну діастолічну (ЛДШК) швидкості кровотоку, а також розраховували індекс їхньої резистивності (ІР).
Для оцінки стану цереброваскулярної реактивності проводили тест із затримкою дихання; при цьому використовували усереднену за часом максимальну швидкість кровотоку в СМА із двох боків і обчислювали середній із двох боків показник до та після проведення проби (з подальшим розрахунком індексу реактивності).
Усім пацієнтам проведено доплерографію ниркових артерій із вимірюванням швидкісних параметрів кровотоку та розрахунком ниркового індексу резистивності (НІР). Доплерівський сигнал отримували від міжчасткових артерій із верхньої, середньої та нижньої третини обох нирок і розраховували середнє значення із шести вимірювань (по три виміри з кожної нирки).
Для оцінки ендотеліального механізму регуляції судинного тонусу використовували пробу з компресією плечової артерії, яку проводили за загальноприйнятою методикою, дотримуючись необхідних умов [17].
Усі пацієнти, залучені до випробування, отримували лікування відповідно до протоколу надання допомоги пацієнтам з АГ, затвердженого наказом Міністерства охорони здоров’я України № 384 від 24.05.2012 р., яке включало антигіпертензивну терапію, статини, антитромбоцитарні та цукрознижувальні препарати за наявності показань.
Пацієнти методом сліпих конвертів були розподілені на дві групи: основну – 30 хворих (з них 83,3% – жінки) та контрольну – 30 учасників (77,8% – жінки). Додатково до стандартної терапії АГ пацієнтам основної групи був призначений аргініну гідрохлорид (Тівортін® – розчин для інфузій, ТОВ «Юрія-Фарм») по 42 мг/мл 100 мл: внутрішньовенно крапельно (повільно) по 100 мл 1 р/добу – 10 днів із подальшим застосуванням внутрішньо під час прийому їжі L-аргініну аспартат (Тівортін® Аспартат – розчин оральний 200 мг/мл (флакон 200 мл), ТОВ «Юрія-Фарм») по 10 мл (2 мірні ложки) 2 р/добу впродовж 20 днів.
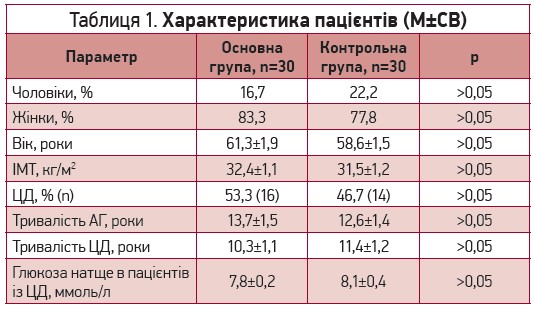 Пацієнти основної групи та групи контролю були зіставні за віком, статтю, рівнем АТ і тривалістю АГ, індексом маси тіла (ІМТ), частотою ЦД та рівнем глікемії (табл. 1).
Пацієнти основної групи та групи контролю були зіставні за віком, статтю, рівнем АТ і тривалістю АГ, індексом маси тіла (ІМТ), частотою ЦД та рівнем глікемії (табл. 1).
Усі учасники приймали антигіпертензивну терапію, що включала 4 (43% пацієнтів), 3 (37% хворих) і 2 препарати (20% осіб). В основній і контрольній групах розподіл частоти кількості застосованих препаратів був зіставним. В основній і контрольній групах більшість пацієнтів приймали статини (в основній – 82,1% хворих, у контрольній – 81,5% учасників).
Отримані дані обробляли за допомогою методів варіаційної статистики з використанням програми SPSS 10.0. Для кількісних змінних висновки про наявність неоднорідності зроблені на основі порівняння за допомогою критерію Стьюдента (з поправкою Уелча) для нормально розподілених даних або критерію Манна-Уітні, якщо дані хоча би в одній групі не підлягали нормальному розподілу. Кількісні показники наведено у вигляді середньої величини (М) з відповідним стандартним відхиленням від середньої величини (СВ).
Результати й обговорення
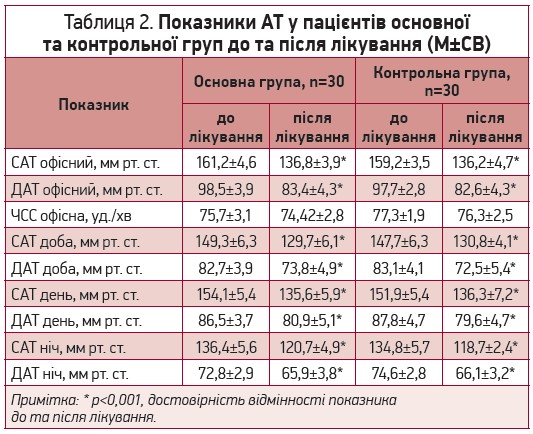 Пацієнти обох груп мали зіставний вихідний рівень офісного АТ (табл. 2). Аналіз динаміки показників САТ і діастолічного АТ (ДАТ) показав достовірне зниження АТ наприкінці періоду спостереження в обох групах, що свідчить про ефективність підібраної антигіпертензивної терапії; при цьому величина зниження АТ була зіставною між групами: зниження середньодобового САТ становило 13,1% в основній групі й 11,4% – у контрольній (р=0,18), середньодобового ДАТ – 10,8 та 12,8% відповідно (р=0,08). Такі самі тенденції спостерігалися й для ступеня зниження САТ і ДАТ у денний та нічний періоди доби. Достовірних змін частоти серцевих скорочень (ЧСС) за період спостереження не відбулося.
Пацієнти обох груп мали зіставний вихідний рівень офісного АТ (табл. 2). Аналіз динаміки показників САТ і діастолічного АТ (ДАТ) показав достовірне зниження АТ наприкінці періоду спостереження в обох групах, що свідчить про ефективність підібраної антигіпертензивної терапії; при цьому величина зниження АТ була зіставною між групами: зниження середньодобового САТ становило 13,1% в основній групі й 11,4% – у контрольній (р=0,18), середньодобового ДАТ – 10,8 та 12,8% відповідно (р=0,08). Такі самі тенденції спостерігалися й для ступеня зниження САТ і ДАТ у денний та нічний періоди доби. Достовірних змін частоти серцевих скорочень (ЧСС) за період спостереження не відбулося.
Відомо, що величина нічного зниження АТ пов’язана зі ступенем ураження органів-мішеней. У нашому дослідженні величина добового індексу САТ і ДАТ достовірно не змінилася. В основній групі довірчий інтервал (ДІ) САТ до лікування становив 11,5±1,8%, після – 10,9±1,7%, а в групі контролю – 11,3±1,8% та 12,9±1,8% відповідно.
 Отже, в обох групах на тлі проведеної антигіпертензивної терапії спостерігалося достовірне зіставне зниження показників АТ як офісних, так і середніх за добу (денний і нічний періоди).
Отже, в обох групах на тлі проведеної антигіпертензивної терапії спостерігалося достовірне зіставне зниження показників АТ як офісних, так і середніх за добу (денний і нічний періоди).
Відомо, що з підвищенням АТ пов’язані структурні зміни як великих, так і мілких судин. На макросудинному рівні це проявляється потовщенням комплексу інтима-медіа, збільшенням просвіту судин і жорсткості судинної стінки, на мікрорівні – вазоконстрикцією, еутрофічним ремоделюванням (збільшення співвідношення стінки до просвіту), порушенням здатності до розтягнення, зниженням вазодилататорного резерву. Такі зміни судин спричиняють пов’язані з гіпертензією зміни органів-мішеней [18]. Головними механізмами регуляції судинного тонусу й забезпечення сталого органного кровотоку (насамперед у таких органах, як мозок і нирки) є ендотеліальний, метаболічний і міогенний [11].
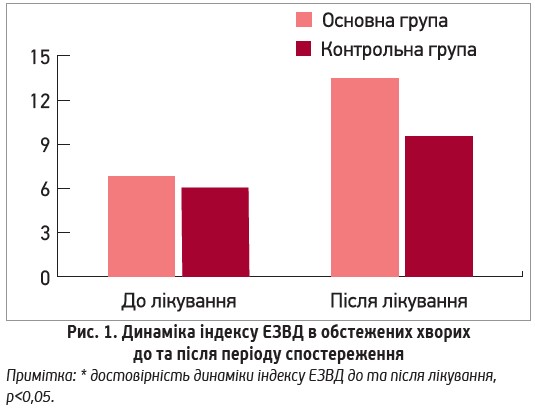
 Із метою вивчення впливу L-аргініну на функцію ендотелію пацієнтам обох груп до та після лікування було проведено пробу ЕЗВД. На початку періоду спостереження індекс ЕЗВД в основній групі становив 6,65±0,73%, що не відрізнялося від показника групи контролю 6,20±0,92% і засвідчувало порушення ендотеліальної функції (в нормі цей показник має бути >10%) у обстежених. Наприкінці періоду спостереження показник ЕЗВД зріс у пацієнтів обох груп, проте під впливом L-аргініну він збільшився удвічі та становив 13,59±0,61% (р=0,004); натомість у пацієнтів групи контролю його зростання було достовірним, проте менш виразним – до 9,51±0,89% (р=0,03) (рис. 1).
Із метою вивчення впливу L-аргініну на функцію ендотелію пацієнтам обох груп до та після лікування було проведено пробу ЕЗВД. На початку періоду спостереження індекс ЕЗВД в основній групі становив 6,65±0,73%, що не відрізнялося від показника групи контролю 6,20±0,92% і засвідчувало порушення ендотеліальної функції (в нормі цей показник має бути >10%) у обстежених. Наприкінці періоду спостереження показник ЕЗВД зріс у пацієнтів обох груп, проте під впливом L-аргініну він збільшився удвічі та становив 13,59±0,61% (р=0,004); натомість у пацієнтів групи контролю його зростання було достовірним, проте менш виразним – до 9,51±0,89% (р=0,03) (рис. 1).
 Аналіз показників ЕЗВД у пацієнтів із ЦД виявив, що додавання до антигіпертензивної терапії L-аргініну зумовлює не тільки значне покращення функції ендотелію, що проявлялося збільшенням індексу ЕЗВД з 5,00±0,5 до 11,3±0,6% (р=0,02), а й достовірне збільшення діаметра плечової артерії з 4,45±0,47 мм до лікування до 4,83±0,41 мм після нього (р=0,02).
Аналіз показників ЕЗВД у пацієнтів із ЦД виявив, що додавання до антигіпертензивної терапії L-аргініну зумовлює не тільки значне покращення функції ендотелію, що проявлялося збільшенням індексу ЕЗВД з 5,00±0,5 до 11,3±0,6% (р=0,02), а й достовірне збільшення діаметра плечової артерії з 4,45±0,47 мм до лікування до 4,83±0,41 мм після нього (р=0,02).
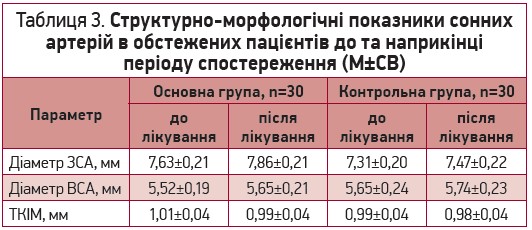
Із метою оцінки структурних параметрів і показників кровотоку пацієнтам з АГ було проведено дуплексне сканування магістральних екстра- й інтракраніальних артерій. За його результатами виявлено, що 58,8% учасників основної групи та 53,7% пацієнтів контрольної мали гемодинамічно незначимі атеросклеротичні бляшки.
У нашому дослідженні за період спостереження не було виявлено достовірних змін структурно-морфологічних показників сонних артерій (табл. 3), однак в основній групі спостерігалася тенденція до збільшення діаметра ЗСА.
Аналіз показників швидкості кровотоку екстра- й інтракраніальними артеріями в обох групах не виявив їх достовірних змін наприкінці періоду спостереження порівняно з такими на початку дослідження (табл. 4).
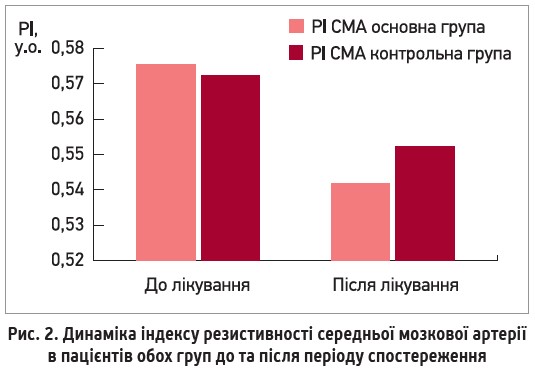
Однак на тлі додавання до стандартної терапії АГ L-аргініну спостерігалося достовірне зниження індексів периферичного судинного опору інтракраніальних артерій в основній групі, що свідчить про зменшення судинного опору дистальніше від місця локації (рис. 2).
 Із метою дослідження механізмів регуляції мозкового кровотоку була проведена метаболічна вазодилататорна проба із затримкою дихання. Для забезпечення сталого органного кровотоку (насамперед мозкового та ниркового) існує компенсаторна система, яку називають системою авторегуляції. Відомо, що низькі показники цереброваскулярної реактивності асоціюються з підвищеним ризиком розвитку порушень мозкового кровообігу. [19]. На початку дослідження реакція кровотоку на стимуляцію була негативною в пацієнтів обох груп, а індекс реактивності становив 0,90±0,01 у.о. в основній групі та 0,92±0,01 у.о. в групі контролю, що свідчить про напруження механізмів регуляції церебрального гомеостазу в пацієнтів з неконтрольованою АГ. Додавання L-аргініну до антигіпертензивної терапії сприяло покращенню реакції кровотоку на вазодилататорну метаболічну пробу в пацієнтів основної групи, що проявлялося достовірним збільшенням індексу реактивності та свідчить про відновлення резерву вазодилатації артеріол на гіперкапнію. Так, індекс реактивності в основній групі збільшився майже на ⅓ (29%) до 1,16±0,01 у.о. (р=0,02); натомість у контрольній – лише на 13% до 1,04±0,01 у.о. (р=0,03), а реакція стала позитивною найімовірніше за рахунок відновлення здатності артеріол до вазодилатації.
Із метою дослідження механізмів регуляції мозкового кровотоку була проведена метаболічна вазодилататорна проба із затримкою дихання. Для забезпечення сталого органного кровотоку (насамперед мозкового та ниркового) існує компенсаторна система, яку називають системою авторегуляції. Відомо, що низькі показники цереброваскулярної реактивності асоціюються з підвищеним ризиком розвитку порушень мозкового кровообігу. [19]. На початку дослідження реакція кровотоку на стимуляцію була негативною в пацієнтів обох груп, а індекс реактивності становив 0,90±0,01 у.о. в основній групі та 0,92±0,01 у.о. в групі контролю, що свідчить про напруження механізмів регуляції церебрального гомеостазу в пацієнтів з неконтрольованою АГ. Додавання L-аргініну до антигіпертензивної терапії сприяло покращенню реакції кровотоку на вазодилататорну метаболічну пробу в пацієнтів основної групи, що проявлялося достовірним збільшенням індексу реактивності та свідчить про відновлення резерву вазодилатації артеріол на гіперкапнію. Так, індекс реактивності в основній групі збільшився майже на ⅓ (29%) до 1,16±0,01 у.о. (р=0,02); натомість у контрольній – лише на 13% до 1,04±0,01 у.о. (р=0,03), а реакція стала позитивною найімовірніше за рахунок відновлення здатності артеріол до вазодилатації.
Отже, додавання L-аргініну до стандартної терапії АГ сприяло зниженню судинного тонусу, відновленню вазодилататорних механізмів авторегуляції мозкового кровотоку, покращенню функціонування церебрального ендотелію.
Із метою оцінки динаміки функціонального стану нирок досліджено динаміку швидкості клубочкової фільтрації (ШКФ), альбумінурії та ІР ниркових артерій на етапах випробування. Було проведено дослідження показників ниркового кровотоку до та після додавання L-аргініну до стандартної терапії АГ. Аналіз динаміки ШКФ показав, що в групі L-аргініну на тлі зниження АТ відбулося незначне (але достовірне) зростання ШКФ, тоді як у групі порівняння ШКФ залишалася практично незмінною (табл. 5). Аналіз у хворих із ЦД виявив ще значнішу різницю між групами: приріст ШКФ під впливом L-аргініну становив 4,1 мл/хв/1,73 м2 (із 68,8±2,9 до 72,9±2,3 мл/хв/1,73 м2; р=0,03), а в групі порівняння спостерігали незначне зниження ШКФ із 71,2±3,2 до 67,7±3,7 мл/хв/1,73 м2. У пацієнтів із ЦД також значнішою була динаміка альбумінурії, яка зменшилася в групі втручання на 32,0% (із 34,7 до 23,6 мг/дл; р=0,02); натомість у групі порівняння – на 24,4% (із 38,3 до 28,4 мг/дл; р=0,02). Альбумінурія, з одного боку, – ознака ураження нирок, з іншого, це є непрямим маркером ендотеліальної дисфункції. У нашому дослідженні паралельно з регресом альбумінурії спостерігали зростання індексу ЕЗВД, що підтверджує позитивний вплив L-аргініну на ендотеліальну функцію та функцію нирок зокрема. Регрес альбумінурії – важливий фактор, асоційований зі зменшенням серцево-судинних подій у пацієнтів з АГ [20]. У нашому випробуванні наприкінці періоду спостереження в пацієнтів з АГ відзначалося достовірне зменшення показника добової альбумінурії, значніше – під впливом L-аргініну. Вираженіша позитивна динаміка функції нирок у групі втручання супроводжувалася зниженням ІР ниркових артерій з 0,68±0,1 до 0,64±0,1 у.о. (р=0,04); водночас у групі стандартної терапії НІР залишився незмінним (табл. 5).
За даними літератури, ІР ниркових артерій асоціюється з гіршим прогнозом і корелює з артеріолосклерозом. Судини нирок є однією з основних мішеней АГ; вони дуже чутливі до змін функції ендотелію. В роботі, проведеній Y. Higashi та співавт., було показано, що зміни функції ендотелію нирок можуть бути причиною, а не наслідком гіпертензії [21].
Отже, нефропротекторний ефект L-аргініну в нашому дослідженні проявлявся відсутністю зниження ШКФ на тлі зниження АТ, регресом альбумінурії та зменшенням НІР, що свідчить про можливе покращення ниркової мікроциркуляції.
За даними літератури, L-аргінін збільшує швидкість кровотоку церебральними артеріями, тому деякі автори пропонують використовувати гострий тест із введенням L-аргініну для оцінки функції церебрального ендотелію [22]. У нашому дослідженні ми не виявили достовірного збільшення швидкості кровотоку такими магістральними інтракраніальними артеріями, як середня, передня, задня мозкова та основна. Це пов’язано насамперед з тим, що ми оцінювали тривалий (упродовж 30 днів) вплив L-аргініну на параметри кровотоку, не вдаючись до гострого тесту. С. Zimmerman і співавт. спостерігали збільшення середньої швидкості кровотоку по СМА, визначеній методом транскраніальної доплерографії, на тлі інфузії L-аргініну в здорових добровольців на 22%; таке середнє збільшення швидкості потоку підтримувалося протягом 30 хв інфузії L-аргініну [23]. Наші дані свідчать про те, що застосування L-аргініну впродовж 30 днів чинить позитивний вплив на параметри мозкового кровотоку. Це проявлялося зниженням індексів периферичного судинного опору внаслідок зменшення судинного тонусу дистальніше від місця локації та покращення кровотоку.
У нашому випробуванні ми не виявили додаткового впливу додавання L-аргініну на рівень АТ, що може бути пов’язане з оптимальною антигіпертензивною терапією та зниженням АТ до цільових рівнів. У нечисленних дослідженнях вивчався вплив L-аргініну на рівень АТ за АГ; їх результати неоднозначні. В одних показано, що додавання L-аргініну знижує САТ у межах 2,2-5,4 мм рт. ст., ДАТ – у межах 2,7-3,1 мм рт. ст. у пацієнтів з АГ, що супроводжується покращенням ЕЗВД [24]; в інших – зростання потік-залежної вазодилатації плечової артерії в пацієнтів з АГ не було пов’язане зі зниженням АТ. У пацієнтів зі щойно діагностованою легкою та помірною гіпертензією додавання L-аргініну знижувало АТ на 8% і зменшувало реноваскулярну резистивність [25]. З іншого боку, L-аргінін не сприяв зниженню АТ у пацієнтів зі злоякісною гіпертензією. Тривалість АГ, її тяжкість та ступінь ендотеліальної дисфункції можуть бути важливими факторами відповіді на L-аргінін [26]. Проте гемодинамічні ефекти показані в осіб з нормальним АТ, у яких виявлено дозозалежне зниження АТ під впливом L-аргініну.
Висновки
- Пацієнтам із неконтрольованою АГ притаманні ознаки гіпертензивної макро- та мікроангіопатії у вигляді зміни геометрії сонних артерій, їхнього атеросклеротичного ураження та підвищення судинного опору.
- Ураження органів-мішеней у пацієнтів із неконтрольованою АГ проявляється порушенням ендотеліальної функції, цереброваскулярної реактивності, підвищенням судинного тонусу та мікроальбумінурією.
- Додавання L-аргініну пацієнтам з АГ на етапі обрання антигіпертензивної терапії може сприяти покращенню функції ендотелію, мозкового та ниркового кровотоку, відновленню цереброваскулярної реактивності, зменшенню судинного тонусу та мікроальбумінурії.
- У пацієнтів із супутнім ЦД додавання L-аргініну на етапі обрання антигіпертензивної терапії на тлі покращення функції ендотелію може сприяти зменшенню ІР ниркових артерій, регресу мікроальбумінурії та зростанню ШКФ.
Література
1. Forouzanfar M.H, Liu P., Roth G. A. et al. Global burden of hypertension and systolic blood pressure of at least 110 to 115 mm Hg, 1990-2015. JAMA 2017 – Vol. 317 – p. 165-182.
2. Williams B., Mancia G. et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension. The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension. Journal of Hypertension: 2018 – Vol. 36 – Issue 10 – p. 1953-2041.
3. Perrone-Filardi P., Coca A., Galderisi M. et al. Noninvasive cardiovascular imaging for evaluating subclinical target organ damage in hypertensive patients: a consensus article from the European Association of Cardiovascular Imaging, the European Society of Cardiology Council on Hypertension and the European Society of Hypertension. J Hypertens, 2017 – Vol. 35 – p. 1727-1741.
4. Greve S. V., Blicher M. K., Sehestedt T. et al. Effective risk stratification in patients with moderate cardiovascular risk using albuminuria and atherosclerotic plaques in the carotid arteries. J Hypertens, 2015 – Vol. 33 – p. 1563-1570.
5. Volpe M., Battistoni A., Tocci G. et al. Cardiovascular risk assessment beyond systemic coronary risk estimation: a role for organ damage markers. J Hypertens, 2012 – Vol. 30 – p. 1056-1064.
6. Chowdhury E. K., Langham R. G., Ademi Z. et al. Rate of change in renal function and mortality in elderly treated hypertensive patients. Clin J Am Soc Nephrol, 2015 – Vol. 10 – p. 1154-1161.
7. Bang C. N., Devereux R. B., Okin P. M. Regression of electrocardiographic left ventricular hypertrophy or strain is associated with lower incidence of cardiovascular morbidity and mortality in hypertensive patients independent of blood pressure reduction – A LIFE review. J Electrocardiol, 2014 – Vol. 47 – p. 630-635.
8. Ettehad D., Emdin C. A., Kiran A. et al. Blood pressure lowering for prevention of cardiovascular disease and death: a systematic review and meta-analysis. Lancet, 2016 – Vol. 387 (10022) – p. 957-967. doi: 10.1016/S0140-6736(15)01225-8.
9. Banegas J. R., Lopez-Garcia E., Dallongeville J. et al. Achievement of treatment goals for primary prevention of cardiovascular disease in clinical practice across Europe: the EURIKA study. Eur Heart J, 2011 – Vol. 32 – p. 2143-2152.
10. Thomopoulos C., Parati G., Zanchetti A. Effects of blood pressure lowering on outcome incidence in hypertension: 7. Effects of more vs. less intensive blood pressure lowering and different achieved blood pressure levels – updated overview and meta-analysesof randomized trials. J Hypertens, 2016 – Vol. 34 (4) – p. 613-622. doi10.1097/HJH.0000000000000881.
11. Peterson E. C., Wang Z., Britz G. Regulation of cerebral blood flow. International J of Vascular Medicine, 2011. article ID823525. 8P. doi: 10.1155/2011/823525.
12. Versari D., Daghini E., Virdis A. et al. Endothelial dysfunction as a target for prevention of cardiovascular disease. Diabetes Care, https://www.ncbi.nlm.nih.gov/nlmcatalog?term=%22Diabetes+Care%22%5bTitle+Abbreviation%5dhttps://pubmed.ncbi.nlm.nih.gov/19875572/2009 – Vol. 32 (Suppl 2) – p. 314-321.doi: 10.2337/dc09-S330.
13. Modena M. G., Bonetti L., Coppi F. et al. Prognostic role of reversible endothelial dysfunction in hypertensive postmenopausal women. J. Am. Coll. Cardiol, 2002 – Vol. 40 – p. 505-510.
14. Quyyumi A. A., Dakak N., Diodati J. G. et al. Effect of l-arginine on human coronary endothelium-dependent and physiologic vasodilation. J. Am. Coll. Cardiol., 1997 – Vol. 30 – p. 1220-1227.
15. Lerman A., Burnett J. C.J., Higano S. T. et al. Long-term l-arginine supplementation improves small-vessel coronary endothelial function in humans. Circulation, 1998 – Vol. 97 – p. 2123-2128.
16. Valdueza J. M., Schreiber S. J., Roehl J.-E., Klingebiel R. Neurosonology and Neuroimaging of stroke. Thieme Second edition, 2016-768 P.
17. Corretti M. C., Anderson T. J., Benjamin E. J. et al. Guidelines for the ultrasound assessment of endothelial-dependent flow-mediated vasodilatation of the brachial artery. J Am Coll Cardiol, 2002 – Vol. 39 – p. 257-265.
18. Rizzoni D., Agabiti-Rosei E. Structural abnormalities of small resistance arteries in essential hypertension. Intern Emerg Med, 2012 – Vol. 7 – p. 205-12. doi: 10.1007/s11739-011-0548-0.
19. Vernieri F., Pasqualetti P., Passarelli F. et al. Outcome of carotid artery occlusion is predicted by cerebrovascular reactivity // Stroke, 1999, Vol. 30 (3) – p. 593-598.
20. Ibsen H., Olsen M. H., Wachtell K. et al. Reduction in albuminuria translates to reduction in cardiovascular events in hypertensive patients: losartan intervention for endpoint reduction in hypertension study. Hypertension, 2005 – Vol. 45 – p. 198-202.
21. Higashi Y., Chayama K. Renal endothelial dysfunction and hypertension. J Diabetes Complications, https://www.ncbi.nlm.nih.gov/nlmcatalog?term=%22J+Diabetes+Complications%22%5bTitle+Abbreviation%5dhttps://pubmed.ncbi.nlm.nih.gov/11872376/2002 – Vol. 16 (1) – p.103-107.
22. Pretnar-Oblak J. Cerebral endothelial function determined by cerebrovascular reactivity to L-Arginine. BioMed Reserch International, 2014, Article SD601515, 8 p. dx.doi.org/10.1155/2014/ 601515.
23. Zimmermann C., Wimmer M., Haberl R. L. L-arginine-mediated vasoreactivity in patients with a risk of stroke. Cerebrovascular Diseases, 2004 – Vol. 17, no. 2-3, p. 128-133.
24. Borghi C., Tsioufis K., Agabiti-Rosei E. et al. Nutraceuticals and blood pressure control: a European Society of Hypertension position document / J. Hypertens, 2020 – Vol. 38 – p. 799-812.
25. Higashi Y., Oshima T., Ozono R. et al. Effects of L-arginine infusion on renal hemodynamics in patients with mild essential hypertension // Hypertension, 1995 – Vol. 25 – p. 898-902.
26. Sato K., Kinoshita M., Kojima M. et al. Failure of L-arginine to induce hypotension in patients with a history of accelerated-malignant hypertension. // J Hum Hypertens, 2000 – Vol. 14 – p. 485-488.
Медична газета «Здоров’я України 21 сторіччя» № 23 (492), 2020 р.



