30 липня, 2021
Антитромбоцитарна терапія у пацієнтів з інфарктом міокарда: порівняльна оцінка клопідогрелю та тікагрелору
Антитромбоцитарна терапія є невід’ємною частиною ведення пацієнтів з ішемічною хворобою серця. Антагоніст рецепторів P2Y12 клопідогрель та ацетилсаліцилова кислота (АСК) є найчастіше використовуваними антиагрегантами для лікування серцево-судинних захворювань (ССЗ). Новий антагоніст P2Y12-рецепторів тікагрелор показав виразну антитромбоцитарну дію та запобігає розвитку ішемічних подій при гострих коронарних синдромах (ГКС). Пропонуємо до вашої уваги огляд результатів двох досліджень, які є вельми перспективними в контексті застосування антитромбоцитарної терапії у таких хворих. Одну з робіт було присвячено порівнянню клопідогрелю та тікагрелору в пацієнтів з інфарктом міокарда (ІМ) з елевацією сегмента ST (STEMI), яким проводили тромболізис. В іншому дослідженні вивчали ефективність та безпеку переходу з тікагрелору на менш агресивне лікування клопідогрелем у хворих на гострий ІМ протягом першого місяця після індексного черезшкірного коронарного втручання (ЧКВ) з імплантацією стентів із лікарським покриттям. Отримані дані опубліковані у виданні EuroIntervention (2021; 16: 1163‑1169 та 1170‑1176).
За наявними даними, було продемонстровано кращі загальні клінічні результати після проведення первинного ЧКВ як реперфузійної терапії при STEMI порівняно з тромболізисом (Ibanez et al., 2018; Valgimigli et al., 2018). Проте внутрішньовенна тромболітична терапія залишається цінним варіантом лікування для багатьох пацієнтів, особливо в першу годину від появи симптомів, або ж коли своєчасне проведення первинного ЧКВ неможливе. Поліпшення перфузії міокарда, що спостерігається після тромболітичної терапії, є сильним предиктором клінічних результатів (Gibson et al., 2000).
Сприятливі ефекти одночасного застосування АСК та клопідогрелю з фібринолітичною терапією в осіб зі STEMI добре відомі. Тож клопідогрель рекомендований як препарат вибору серед інгібіторів P2Y12-рецепторів у цій клінічній ситуації. Однак доказів щодо супутнього використання тікагрелору та тромболізису в пацієнтів зі STEMI наразі бракує. Тому M. Hamiloset al. (2021) вирішили дослідити, чи здатний тікагрелор при застосуванні разом з АСК покращувати мікросудинну перфузію та зменшувати постінфарктне пошкодження міокарда порівняно із клопідогрелем у хворих на STEMI, які отримують тромболізис.
Дослідження MIRTOS: порівняння клопідогрелю та тікагрелору в пацієнтів зі STEMI на тлі тромболізису
Матеріали й методи
MIRTOS – багатоцентрове проспективне рандомізоване відкрите сліпе дослідження із паралельними групами, до якого увійшли 335 пацієнтів, 259 з яких перенесли ЧКВ та були включені до первинного аналізу кінцевих точок. Хворі були розподілені на дві групи для отримання клопідогрелю та тікагрелору. В усіх учасників тромболізис фібрин-специфічним агентом являв собою варіант вибору як метод реперфузії, оскільки проведення первинного ЧКВ було неможливим протягом двох годин після першого звернення до лікаря. Рандомізація та застосування інгібітора P2Y12-рецепторів відбувалися безпосередньо перед тромболізом. Усі хворі отримували АСК у навантажувальній дозі 150‑300 мг перорально. Пацієнти групи клопідогрелю отримували навантажувальну дозу 300 мг та підтримувальну – 75 мг, а групи тікагрелору – 180 та 90 мг двічі на добу відповідно.
Після тромболізису хворих переводили на катетеризацію та ЧКВ до відповідного медичного центру. ЧКВ за показаннями виконували під час проведення коронарографії. Антикоагулянтна терапія передбачала застосування нефракціонованого/низькомолекулярного гепарину чи бівалірудину. Допускалося використання як стентів із лікарським покриттям, так і металевих.
У пацієнтів, які перенесли ЧКВ після діагностичної коронарогіографії, визначали ступінь перфузії міокарда до та після ЧКВ за шкалою оцінки тромболізису при ІМ (TIMI), скорегований ступінь антеградного кровотоку за кількістю кадрів (cTFC), ступінь потоку і тромбозу за ТІМІ, мінімальний діаметр просвіту, діаметр стенозу, а також проводили ангіографічну оцінку перфузії. Всі хворі мали регулярно відвідувати дослідні центри через один і три місяці. Під час кожного візиту в них проводили клінічну оцінку, стандартну електрокардіограму в 12 відведеннях та ехокардіографію. Випадки кровотечі аналізували за класифікацією Академічного дослідницького консорціуму щодо кровотеч (BARC) (Mehran et al., 2011).
Первинною кінцевою точкою дослідження був cTFC, вторинними – всі інші ангіографічні параметри, кровотечі та великі несприятливі серцево-судинні події (MACE), як-то смерть, ІМ, реваскуляризація та інсульт, протягом 3-місячного періоду спостереження.
Статистичний аналіз
Усі пацієнти були включені в аналіз первинних, вторинних наслідків та результатів безпеки на основі наміру лікуватися (ІТТ-популяція). Категоріальні змінні порівнювали між групами рандомізації за допомогою критеріїв хі-квадрат, а безперервні – t-критеріїв Ст’юдента або непараметричних тестів залежно від ситуації. Обчислення розміру вибірки базувалися на 5% двосторонньому рівні значущості, 80% потужності та різниці cTFC у п’ять одиниць.
Результати
Із 259 пацієнтів, що перенесли ЧКВ, за технічних причин аналіз cTFC як первинної кінцевої точки було виконано у 154 (85 – групи клопідогрелю, 69 – тікагрелору). Статистично значущої різниці у значеннях cTFC між групами клопідогрелю та тікагрелору не виявлено (рис. 1). Ангіограми 184 учасників оцінювали щодо ступеня тромбозу перед ЧКВ як вторинні кінцеві точки. Істотної різниці між групами клопідогрелю та тікагрелору не спостерігалося. Також при аналізі ангіограм 166 пацієнтів щодо ступеня тромбозу після ЧКВ суттєвих міжгрупових відмінностей не виявлено.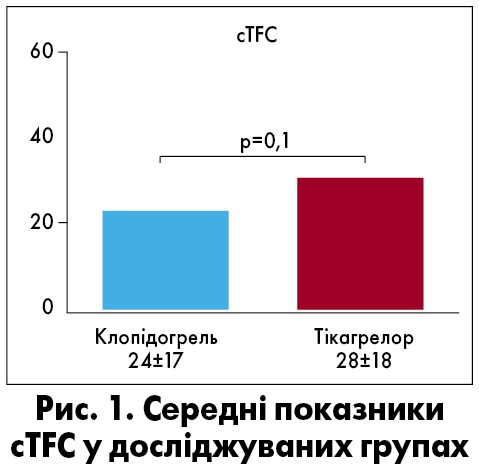
На додачу, при оцінці ангіограм 259 хворих щодо кровотоку за шкалою TIMI перед ЧКВ значущої різниці між досліджуваними групами не було, як і при вивченні ангіограм 245 осіб щодо даного показника після ЧКВ. Стосовно ступеня помутніння міокарда внаслідок аналізу ангіограм 119 пацієнтів, істотних розбіжностей між групами клопідогрелю та тікагрелору також не виявлено.
Окрім того, не спостерігалося суттєвої різниці між групами при аналізі великих кровотеч (BARC ≥3): по одному випадку при оцінці за BARC 3A у кожній групі. Частота випадків незначних кровотеч (BARC 1‑2) була вищою у групі тікагрелору, але результат не досяг статистичної значущості. Також упродовж дослідження всі пацієнти перебували під наглядом щодо будь-яких клінічних подій. Були зафіксовані випадки ІМ, інсультів, незапланованої реваскуляризації та смерті. Однак статистично значущих відмінностей між групами стосовно жодної із зазначених клінічних подій не спостерігалося (таблиця).
Обговорення
MIRTOS – перше рандомізоване дослідження, в якому порівнювали традиційну терапію на основі клопідогрелю та одночасне застосування тікагрелору з АСК у пацієнтів віком <75 років зі STEMI, які отримували тромболізис. Відповідно до основних результатів:
- Тікагрелор не перевершував клопідогрель у популяції пацієнтів після ЧКВ стосовно сTFC, що було основною кінцевою точкою дослідження.
- Не спостерігалося різниці щодо первинних та вторинних ангіографічних кінцевих точок між клопідогрелем і тікагрелором.
Автори MIRTOS припустили, що тікагрелор міг проявляти притаманні йому потужні антитромбоцитарний та плейотропний ефекти, що теоретично могло зменшити пошкодження мікросудин та міокарда. Однак отримані дані не підтвердили цю гіпотезу, можливо, через велику кількість ангіографій, які не було нагоди проаналізувати на предмет первинної кінцевої точки за технічних причин, що могло знизити статистичну силу дослідження.
Висновки
Таким чином, у випробуванні MIRTOS у пацієнтів <75 років тікагрелор виявився не кращим за клопідогрель з точки зору ураження та цілісності мікросудин на тлі тромболізису при аналізі різних ангіографічних кінцевих точок. Різниця між двома досліджуваними групами щодо MACE та великих кровотеч була відсутня. Необхідне проведення більш масштабних досліджень для отримання переконливих даних щодо порівняння цих препаратів.
Дослідження TALOS-AMI: порівняння ефективності й безпеки клопідогрелю та тікагрелору у стабілізованих пацієнтів із гострим ІМ після ЧКВ
За даними двох масштабних клінічних випробувань, інгібітори P2Y12-рецепторів тікагрелор та прасугрел значно знижували частоту ішемічних подій порівняно з клопідогрелем у пацієнтів із гострим інфарктом міокарда (ГІМ), які перенесли ЧКВ (Wallentin et al., 2009; Wiviott et al., 2007). Однак слід зауважити, що хоча ефект тікагрелору та прасугрелу стосовно ішемічних подій був незмінним протягом першого року після індексного ЧКВ, їх переваги над клопідогрелем щодо зниження тромботичного ризику були помітними лише в ранній період після ГКС (Velders et al., 2016; Morrow et al., 2009). Також на тлі лікування даними препаратами спостерігався вищий ризик кровотеч порівняно із клопідогрелем. Проте він був зіставним у ранньому періоді лікування, власне, більшість випадків кровотеч відбувалися переважно у підтримувальній фазі (Becker et al., 2011; Antman et al., 2008).
Як наслідок, для оптимізації чистої клінічної користі між раннім ефектом щодо зменшення ішемічних подій та пізнім ризиком кровотечі у хворих на ГІМ було розроблено стратегію деескалації подвійної антитромбоцитарної терапії (ПАТТ) шляхом використання потужних інгібіторів P2Y12-рецепторів переважно у гострій фазі (протягом перших 30 днів) та менш агресивного клопідогрелю на етапі підтримувального лікування (після перших 30 днів).
Деескалація ПАТТ після ГКС досить поширена у клінічній практиці (De Luca et al., 2017; Angiolillo et al., 2017; Zettler et al., 2017). Однак дані широкомасштабних клінічних випробувань щодо стратегії переходу з тікагрелору на клопідогрель у стабілізованих хворих на ГІМ є обмеженими (Cuisset et al., 2017). На додачу, не було проведено досліджень із деескалації антитромбоцитарної терапії за участю лише пацієнтів із ГІМ, які отримували ЧКВ з імплантацією стентів із лікарським покриттям нового покоління.
Тож метою M.-W. Park et al. (2021) було вивчити ефективність та безпеку стратегії переведення пацієнтів із ГІМ з тікагрелору на клопідогрель за відсутності несприятливих явищ протягом першого місяця після індексного ЧКВ при використанні стентів із лікарським покриттям нового покоління.
Матеріали й методи
TALOS-AMI – проспективне багатоцентрове рандомізоване відкрите дослідження IV фази з паралельними групами за участю 2600 стабілізованих пацієнтів із ГІМ після ЧКВ, що наразі триває.
Основні критерії включення: пацієнти з біомаркерами ГІМ (ІМ з/без підвищення сегмента ST), які перенесли ЧКВ зі встановленням стентів із лікарським покриттям; лікування АСК та тікагрелором протягом одного місяця після індексного ЧКВ; відсутність великих церебральних та кардіальних подій (MACCE) упродовж одного місяця після індексного ЧКВ; вік ≥18 років.
Критерії виключення: кардіогенний шок; активна внутрішня кровотеча, кровоточивий діатез або коагулопатія; шлунково-кишкова, сечостатева кровотеча, кровохаркання або крововиливи у склоподібне тіло протягом 2 місяців; велика операція впродовж 6 тижнів; внутрішньочерепна кровотеча / новоутворення / артеріовенозна мальформація / аневризма в анамнезі; анемія; супутнє лікування пероральними антикоагулянтами (як-то антагоністи вітаміну К або дабігатран, ривароксабан, апіксабан чи едоксабан); щоденне лікування нестероїдними протизапальними препаратами або інгібіторами циклооксигенази‑2; злоякісні новоутворення чи очікувана тривалість життя <1 рік; помірна/тяжка дисфункція печінки; симптомні пацієнти з синусовою брадикардією або атріовентрикулярною блокадою.
Перед ЧКВ пацієнтам, які раніше не проходили лікування, було призначено навантажувальну дозу АСК 250‑325 мг; всі учасники отримують навантажувальну дозу тікагрелору 180 мг. Усі пацієнти застосовують лікування АСК і тікагрелором протягом одного місяця після індексного ЧКВ (період скринінгу).
Через 30±7 днів хворих із показаннями для отримання терапії було випадковим чином розподілено на групи у співвідношенні 1:1:
- 100 мг АСК + 75 мг/добу клопідогрелю (група лікування)
- 100 мг АСК + 90 мг тікагрелору двічі на день (контрольна група).
У групі терапії при переході з тікагрелору на клопідогрель учасники отримують 75 мг клопідогрелю без навантажувальної дози після останнього приймання тікагрелору. Після рандомізації пацієнти продовжують використовувати ті самі ліки протягом 11 місяців відповідно до розподілу за групами. Хворих оцінюють через 3, 6 та 12 місяців після індексного ЧКВ із контролем наявності клінічних подій.
Блок-схему дослідження представлено на рисунку 2.
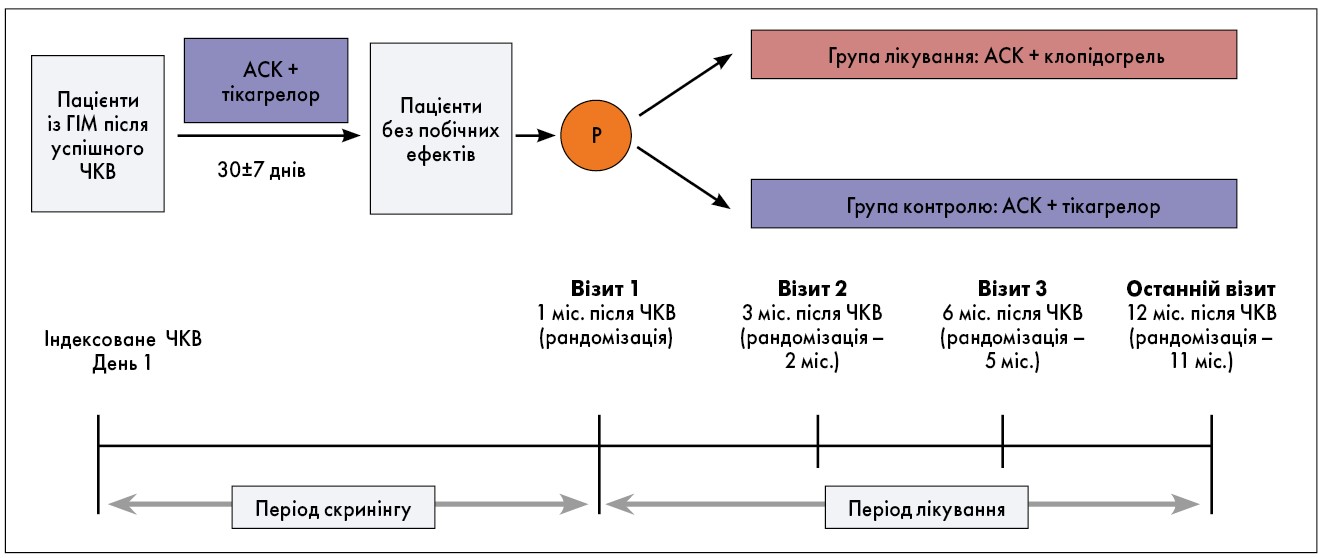 Рис. 2. Блок-схема дослідження
Рис. 2. Блок-схема дослідження
Кінцеві точки
Комбінована первинна кінцева точка включає ішемічні події та кровотечі (чиста клінічна користь), зокрема смерть через ССЗ, ІМ, інсульт (ішемічний, геморагічний або невідомої етіології) та кровотечі 2, 3 чи 5-го типу згідно з критеріями BARC за період 1‑12 місяців після індексного ЧКВ (Mehran et al., 2011). Основні вторинні кінцеві точки включають: кровотечі за BARC 2, 3 чи 5-го типу; комбіновану кінцеву точку – смерть через ССЗ, ІМ, інсульт або кровотечі за BARC 2, 3 чи 5-го типу; комбіновану кінцеву точку – смерть через ССЗ, ІМ або інсульт за період 1‑12 місяців після індексного ЧКВ.
Статистичний аналіз
Первинні аналізи проводитимуться на основі ІТТ-популяції. Безперервні змінні будуть представлені як середнє значення ± стандартне відхилення та порівняні за допомогою t-критерію Ст’юдента. Категорійні змінні постануть у вигляді частот (у відсотках) та зіставлятимуться за допомогою критерію хі-квадрат або точного критерію Фішера. Сукупну кількість подій для первинної кінцевої точки буде оцінено методом Каплана– Мейєра та порівняно за допомогою лог-рангових тестів. Відносний ризик та 95% довірчий інтервал розраховуватимуть за допомогою регресійного аналізу ризиків Кокса.
Основні аспекти дослідження
Мета TALOS-AMI полягає у підтвердженні неменшої ефективності лікування АСК + клопідогрель порівняно з контрольною групою АСК + тікагрелор. Розмір вибірки оснований на загальній частоті ішемічних подій та кровотеч за період 1‑12 місяців після ГІМ. За даними дослідників PLATO, частота подій первинної кінцевої точки, включно зі смертю через ССЗ, ІМ або інсульт, становила 5,28% у групі тікагрелору і 6,60% – клопідогрелю після аортокоронарного втручання (АКШ) (Wallentin et al., 2009). Беручи до уваги ці дані з огляду на можливу частоту кровотеч від 1 до 12 місяців після індексного ЧКВ, автори TALOS-AMI розрахували очікувану кількість кровотеч. Вони припустили, що співвідношення випадків не пов’язаної з процедурою великої кровотечі в перші 30 днів до таких після 30 днів і співвідношення випадків не пов’язаної з процедурою великої або малої кровотечі у перші 30 днів до таких через 30 днів може бути зіставним.
Таким чином, автори TALOS-AMI визначали частоту кровотеч за BARC 2, 3 або 5-го типу, асоційованих із тікагрелором, за період 1‑12 місяців після ГІМ на основі кількості випадків великих чи малих кровотеч протягом року терапії тікагрелором (8,7%) та великих кровотеч за перші 30 днів (2,47%) і через 30 днів (2,17%), що не були пов’язані з АКШ, у дослідженні PLATO. За тим самим принципом визначали частоту кровотеч, асоційованих із застосуванням клопідогрелю (Becker et al., 2011). Було виявлено, що очікувана кількість кровотеч 2, 3 або 5-го типу згідно з BARC становить 4,07% у групі тікагрелору та 2,99% – клопідогрелю, а очікувана частота подій первинної кінцевої точки за період 1‑12 місяців після індексного ЧКВ – 9,35% (ішемічна подія – 5,28% + кровотечі – 4,07%) у групі тікагрелору та 9,59% (ішемічна подія – 6,6% + кровотечі – 2,99%) у групі клопідогрелю.
Висновки
TALOS-AMI – це перше масштабне багатоцентрове рандомізоване дослідження, в якому вивчають ефективність та безпеку деескалації антитромбоцитарної терапії шляхом переходу з тікагрелору на клопідогрель у стабілізованих хворих на ГІМ, які перенесли ЧКВ. Попередні результати підтвердили, що лікування АСК та клопідогрелем має аналогічну ефективність порівняно з АСК і тікагрелором. Автори очікують, що майбутні результати дозволять отримати більш чітке уявлення щодо чистої клінічної користі від стратегії деескалації ПАТТ у пацієнтів із ГІМ.
Підготувала Олена Коробка
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 3 (76) 2021 р.