30 листопада, 2023
Ацетилсаліцилова кислота: можливі механізми профілактики серцево-судинних захворювань поза межами антитромбоцитарної дії
 Здатність ацетилсаліцилової кислоти (АСК) знижувати ризик тромбозів за рахунок антитромбоцитарної (антиагрегантної) дії було відкрито на початку 1970-х рр. У 1980 р. отримано докази її ефективності в профілактиці повторного інфаркту міокарда (ІМ), відносний ризик якого був на 21% нижчим у пацієнтів, які приймали АСК у низьких дозах. Згодом результати низки масштабних рандомізованих клінічних досліджень засвідчили ефективність стратегії застосування АСК для запобігання атеротромботичним ускладненням у пацієнтів з ішемічною хворобою серця (ІХС), ішемічним інсультом, транзиторною ішемічною атакою, захворюванням артерій нижніх кінцівок. Ці докази стали безсумнівним підґрунтям для використання АСК як золотого стандарту вторинної профілактики серцево-судинних захворювань (ССЗ). Окрім потужної доказової бази, суттєва перевага стратегії використання АСК для профілактики ССЗ – її доступність; вона є украй доступним медикаментозним засобом для зменшення ризику розвитку серцево-судинних катастроф (ІМ, інсульт), серцево-судинної смерті та навіть смерті від усіх причин [1].
Здатність ацетилсаліцилової кислоти (АСК) знижувати ризик тромбозів за рахунок антитромбоцитарної (антиагрегантної) дії було відкрито на початку 1970-х рр. У 1980 р. отримано докази її ефективності в профілактиці повторного інфаркту міокарда (ІМ), відносний ризик якого був на 21% нижчим у пацієнтів, які приймали АСК у низьких дозах. Згодом результати низки масштабних рандомізованих клінічних досліджень засвідчили ефективність стратегії застосування АСК для запобігання атеротромботичним ускладненням у пацієнтів з ішемічною хворобою серця (ІХС), ішемічним інсультом, транзиторною ішемічною атакою, захворюванням артерій нижніх кінцівок. Ці докази стали безсумнівним підґрунтям для використання АСК як золотого стандарту вторинної профілактики серцево-судинних захворювань (ССЗ). Окрім потужної доказової бази, суттєва перевага стратегії використання АСК для профілактики ССЗ – її доступність; вона є украй доступним медикаментозним засобом для зменшення ризику розвитку серцево-судинних катастроф (ІМ, інсульт), серцево-судинної смерті та навіть смерті від усіх причин [1].
Проте, незважаючи на високу ефективність та доступність, дослідження свідчать про недостатнє профілактичне використання АСК в усьому світі, особливо в країнах із низьким рівнем доходу [2]. Аналіз проведено в 2013-2020 рр. у 51 країні з рівнем доходів від низького до високого, який засвідчив, що застосування АСК для вторинної профілактики в осіб із ССЗ становить лише 40,3%, при цьому спостерігається значуща варіативність цього показника залежно від економічного стану: в країнах із низьким рівнем доходу – 16,6%, із середнім – 24,5% і високим – 65,0%. Отже, існує потужний потенціал покращення прогнозу пацієнтів з атеросклеротичними ССЗ, який може бути реалізований без значних витрат для зменшення тягаря ССЗ. Особливо важливим є задіяння цього механізму в країнах із низьким та середнім рівнями доходів, де домінувальною причиною смерті є ССЗ.
Основна перешкода для широкої імплементації вищезазначеної стратегії – прихильність та постійність лікування пацієнтів. Ця проблема стосується всіх країн світу (без винятків). Як демонструють результати аналізу датського дослідження із залученням 40 114 пацієнтів, які перенесли ІМ, прихильність до АСК із роками поступово знижується. Це неодмінно асоціюється зі зростанням ризику повторних серцево-судинних подій. Пацієнти з низькою прихильністю мали через 2, 4, 6 і 8 років на 29, 40, 31 та 20% відповідно вищий ризик комбінованої кінцевої точки (ІМ, інсульт, СС-смерть) порівняно із прихильними до лікування пацієнтами.
З огляду на доведену користь від застосування АСК у вторинній профілактиці ССЗ надзвичайно привабливою видавалася ідея її застосування з метою первинної профілактики в пацієнтів, котрі ще не мають атеросклеротичних ССЗ, але в яких спостерігається високий ризик їх розвитку. Найчастіше це пацієнти з артеріальною гіпертензією, цукровим діабетом за наявності інших факторів ризику чи безсимптомного ураження органів-мішеней. Проте на сьогодні за допомогою низки досліджень продемонстровано, що потенційний ризик кровотеч переважає над потенційною користю зниження ризику ССЗ. Однак індивідуальний підхід можливий у хворих із цукровим діабетом (ЦД) 2 типу. В оновленій настанові Європейського товариства кардіологів (2023) з лікування ССЗ у пацієнтів із діабетом можливо розглянути застосування АСК (75-100 мг/добу) в дорослих із ЦД 2 типу без анамнезу симптоматичного атеросклеротичного ССЗ або реваскуляризації для запобігання виникненню першого тяжкого судинного ураження за відсутності в пацієнта високого ризику кровотечі. Високим він вважається за наявності в анамнезі шлунково-кишкової кровотечі чи пептичної виразки протягом попередніх 6 міс, активного захворювання печінки (цироз, активний гепатит).
Окрім того, в США робоча група із профілактики ССЗ (USPSTF) у 2022 р. [3] дійшла висновку, що використання АСК надає незначну перевагу в первинній профілактиці ССЗ у дорослих віком 40-59 років із високим СС-ризиком (за шкалою ASCVD ≥10%), тому рішення про призначення низьких доз АСК для первинної профілактики ССЗ може бути ухвалено в індивідуальному порядку. З огляду на нейтральні результати дослідження ASPREE експерти не рекомендують АСК для первинної профілактики ССЗ в осіб віком ≥60 років. Привертають увагу результати субаналізу цього дослідження, в якому продемонстровано, що носійство гена rs3798220-C ліпопротеїну (a) асоціювалося зі збільшенням на 90% частоти серйозних несприятливих серцево-судинних подій у групі плацебо; натомість у групі АСК ризик МАСЕ не збільшувався. В усіх учасників дослідження використання АСК сприяло зменшенню MACE на 1,7 події на 1000 пацієнто-років, але і збільшувало клінічно значущу кровотечу на 1,7 події на 1000 пацієнто-років. Водночас у підгрупах носійства rs3798220-C і високого генетичного ризику LPA GRS призначення АСК супроводжувалося суттєвим зниженням частоти MACE (на 11,4 і 3,3 події відповідно на 1000 пацієнто-років) без значущого підвищення ризику кровотечі, тобто застосування АСК може бути ефективним у первинній профілактиці для осіб віком >70 років, котрі мають з підвищеним рівнем ліпопротеїну (a) на тлі вищезазначених генетичних особливостей [4]. У цьому самому дослідженні виявлено здатність АСК знижувати ризик розвитку ЦД 2 типу в досліджуваної категорії хворих. Установлено, що в групі пацієнтів, які приймали 100 мг АСК протягом 4,7 року (порівняно із плацебо), ризик розвитку нових випадків ЦД знизився на 15% [5], тобто потенціал АСК, імовірно, не вичерпується лише вторинною профілактикою ССЗ. Здатність АСК запобігати розвитку ССЗ потребує подальшого вивчення в різних категорій хворих для визначення можливостей індивідуалізованого підходу в первинній профілактиці.
Антитромбоцитарна дія АСК у низьких дозах зумовлена ацетилуванням ЦОГ‑1 у тромбоцитах із подальшим інгібуванням продукції тромбоксану A2, який сприяє агрегації тромбоцитів і вазоконстрикції. Крім того, пригнічується вивільнення низки прозапальних медіаторів, а також мітогенів, як-от Р-селектин, сфінгозин‑1-фосфат, судинний ендотеліальний фактор росту тощо. Інший тип ефектів АСК – результат модулювання активності індуцибельної форми ЦОГ‑2, яка експресується цитокінами, запальними стимулами та деякими факторами росту. Крім того, АСК також ацетилює ендотеліальну NO-синтазу з подальшим посиленням вироблення оксиду азоту. АСК проявляє значно вищу інгібувальну активність до ЦОГ‑1, ніж до ЦОГ‑2, який пригнічує продукцію тромбоксану A2 навіть у дозі 30 мг/добу. Незворотне пригнічення функції тромбоцитів спостерігається протягом 15 хв після прийому АСК. За використання кишковорозчинної форми препарату досягнення пікових концентрацій уповільнено та може тривати до 3-4 год. Незворотне пригнічення агрегації тромбоцитів зберігається 10-14 днів (типова тривалість життя тромбоцитів). Для вторинної профілактики доза АСК становить 75-100 мг/добу.
З огляду на описані додаткові ефекти АСК на кшталт модуляції синтезу оксиду азоту, можливого позитивного впливу на функцію ендотелію та системне запалення проведено дослідження МАГНАТ-СЗ, метою якого було вивчення впливу АСК (препарат Магнікор, АТ «Київський вітамінний завод») на активність тромбоцитів, функціональний стан ендотелію, інтенсивність системного запалення в пацієнтів зі встановленими ССЗ (верифікована ІХС, перенесений ішемічний інсульт, захворювання артерій нижніх кінцівок).
До випробування залучили 60 пацієнтів, середній вік котрих становив 61,7±1,2 року, більшість з яких були жінки (56,7%). Сформували 3 групи: перша – пацієнти, які приймали препарат Магнікор раніше та продовжували його використання протягом дослідження (n=20); друга – хворі, котрих після залучення до дослідження перевели з інших препаратів АСК на Магнікор (n=19), з них 11 – кишковорозчині форми, 8 – інші препарати АСК; третя – пацієнти, яким уперше призначався препарат АСК, а саме Магнікор (n=21). Пацієнти отримували Магнікор 75 мг/добу впродовж 6 міс. Усі хворі мали верифіковані ССЗ і АГ. На етапі скринінгу було скориговано антигіпертензивне лікування та статинотерапію.
Всім пацієнтам на початку дослідження та на завершальному візиті проводили рутинне клінічне обстеження, яке включало також визначення рівня креатиніну, калію, сечової кислоти, глюкози та ліпідів у крові. Оцінку активності тромбоцитів проводили за експресією на їхній поверхні глікопротеїну (Gp) IIb (CD61-РЕ), IIIa (CD41-РЕ) та Р-селектину (CD62Р-РЕ). Функцію ендотелію оцінювали за вмістом у крові клітин-попередників ендотеліоцитів (КПЕ) (фенотип CD45–CD31+CD133+) та злущених ендотеліальних клітин (ЗЕ) (фенотип CD45–CD31+CD133–) методом проточної цитометрії. Уміст у крові С-реактивного протеїну (СРП), цитокінів TNF та ІЛ‑10, асиметричного диметиларгініну (ADMA) проводили імуноферментними методами; добову екскрецію альбуміну із сечею (ЕАС) – на біохімічному аналізаторі. Для вивчення динаміки вазодилатувальної функції ендотелію проводили пробу з потік-залежною вазодилатацією плечової артерії. У всіх пацієнтів оцінювали переносимість та безпеку застосування препарату Магнікор, у т. ч. анкетуванням стану здоров᾽я за шкалою EQ‑5D‑5L.
Згідно з таблицею на етапі скринінгу між групами спостерігалася різниця щодо рівня активації тромбоцитів крові. В пацієнтів, які до початку дослідження не отримували АСК, рівень активності тромбоцитів у периферійному кровотоці виявився вищим, ніж у хворих, котрі приймали АСК (особливо Магнікор). Так, у пацієнтів, що не приймали АСК, рівень експресії GpIIb/GpIIІа був вищим: на 21,2% за експресією GpIIb (р<0,05), на 37,9% за експресією GpIIІа (р<0,05). Також у хворих, котрі не приймали АСК, був вищим рівень експресії Р-селектину (CD62Р) на 34,9% (р<0,05). Вони мали значно більший (на 25%) відсоток активованих тромбоцитів, які мали на поверхні Р-селектин (CD62Р), ніж у пацієнтів, що отримували АСК до залучення до дослідження, однак різниця не була достовірною.
Вміст у крові КПЕ в пацієнтів, що приймали АСК, виявився на 14% більшим, ніж у хворих, що до початку випробування не приймали АСК, проте різниця не була достовірною. Кількість ЗЕ в мкл крові в пацієнтів, які не отримували попередньо АСК, була на 38% (р<0,001) більшою, ніж у хворих, котрі попередньо приймали Магнікор. Отже, індекс співвідношення ЗЕ/КПЕ в третій групі виявився майже в 2 рази вищим, ніж у першій групі (р<0,001). Отже, на етапі скринінгу в пацієнтів, які отримували АСК (особливо Магнікор), виявлено меншу наявність у кровотоці активованих тромбоцитів, а також спостерігалися ознаки менш вираженої дисфункції ендотелію, ніж у пацієнтів, що не приймали препарати АСК до залучення до випробування або приймали інші (в т. ч. кишковорозчинні) форми АСК.
Під час первинного обстеження в пацієнтів обох груп спостерігалися ознаки системного запалення низької градації; крім того, в хворих, які приймали АСК до залучення до дослідження, спостерігалася відчутна тенденція до нижчого (на 15%; р>0,05) рівня СРП і вищого (на 11%; р>0,05) рівня протизапального цитокіну ІЛ‑10, ніж у пацієнтів другої групи. Натомість уміст прозапального цитокіну TNF виявився на 22% (р<0,05) меншим у пацієнтів першої групи, що свідчить про стійку тенденцію до меншої активності системного запалення в хворих, котрі тривало приймали АСК до залучення до випробування.
|
Таблиця. Динаміка показників ефективності лікування препаратом Магнікор (М±σ) |
||||
|
Показник |
Група |
Скринінг |
6 міс |
р |
|
СРП, мг/л |
І |
4,1±1,9 |
3,6±1,2 |
0,04 |
|
ІІ |
3,9±1,0 |
3,0±1,5 |
0,03 |
|
|
ІІІ |
4,8±2,5 |
3,9±3,5 |
0,04 |
|
|
ЕАС, мг/добу |
І |
27,2±26,9 |
21,8±18,8 |
0,03 |
|
ІІ |
24,9±12,1 |
18,3±8,9 |
нд |
|
|
ІІІ |
44,7±29,1 |
30,9±10,4 |
0,045 |
|
|
Рівень експресії CD41 на тромбоцитарній крові, ум. од. |
І |
15,1±1,1 |
10,3±1,4 |
0,01 |
|
ІІ |
16,3±1,1 |
13,7±3,1 |
нд |
|
|
ІІІ |
18,3±1,2 |
10,1±1,0 |
0,001 |
|
|
Рівень експресії CD61 на тромбоцитарній крові, ум. од. |
І |
6,6±0,6 |
5,6±0,3 |
0,01 |
|
ІІ |
7,6±0,9 |
5,7±0,3 |
нд |
|
|
ІІІ |
9,1±0,9 |
6,6±0, 3 |
0,05 |
|
|
Відсоток тромбоцитів, які експресують на поверхні CD62Р, % |
І |
3,2±0,3 |
0,7±0,01 |
0,01 |
|
ІІ |
3,1±0,5 |
1,6±0,5 |
нд |
|
|
ІІІ |
4,0±0,5 |
2,3±0,03 |
0,05 |
|
|
Рівень експресії CD62Р на тромбоцитах, ум. од. |
І |
4,3±0,3 |
4,0±0,5 |
нд |
|
ІІ |
4,9±0,3 |
4,3±0,4 |
нд |
|
|
ІІІ |
5,8±0,2 |
4,4±0,2 |
0,05 |
|
|
Вміст КПЕ, клітин/мкл |
І |
8,0±0,5 |
24,0±4,5 |
0,001 |
|
ІІ |
7,6±0,7 |
14,5±1,1 |
0,001 |
|
|
ІІІ |
7,0±0,8 |
15,8±1,2 |
0,001 |
|
|
Вміст у крові ЗЕ, |
І |
379,4±47,4 |
441,8±53,7 |
0,001 |
|
ІІ |
391,9±22,1 |
470,0±61,3 |
0,001 |
|
|
ІІІ |
523,9±50,2 |
492,5±20,3 |
0,001 |
|
|
ЗЕ/КПЕ, ум. од. |
І |
47,4±3,1 |
18,4±2,5 |
0,001 |
|
ІІ |
51,6±2,7 |
32,4±3,6 |
0,001 |
|
|
ІІІ |
74,8±5,9 |
31,2±2,8 |
0,001 |
|
|
TNF, пг/мл |
І |
13,9±1,6 |
6,9±1,9 |
0,001 |
|
ІІ |
15,2±1,8 |
5,6±1,1 |
0,001 |
|
|
ІІІ |
17,9±12,3 |
7,6±0,6 |
0,001 |
|
|
ІЛ‑10, пг/мл |
І |
4,7±0,2 |
3,9±0,3 |
нд |
|
ІІ |
3,6±0,4 |
3,9±0,4 |
нд |
|
|
ІІІ |
3,5±0,3 |
3,9±0,2 |
нд |
|
|
ADMA, мкмоль/л |
І |
0,52±0,01 |
0,50±0,01 |
нд |
|
ІІ |
0,51±0,01 |
0,50±0,01 |
нд |
|
|
ІІІ |
0,71±0,02 |
0,51±0,01 |
нд |
|
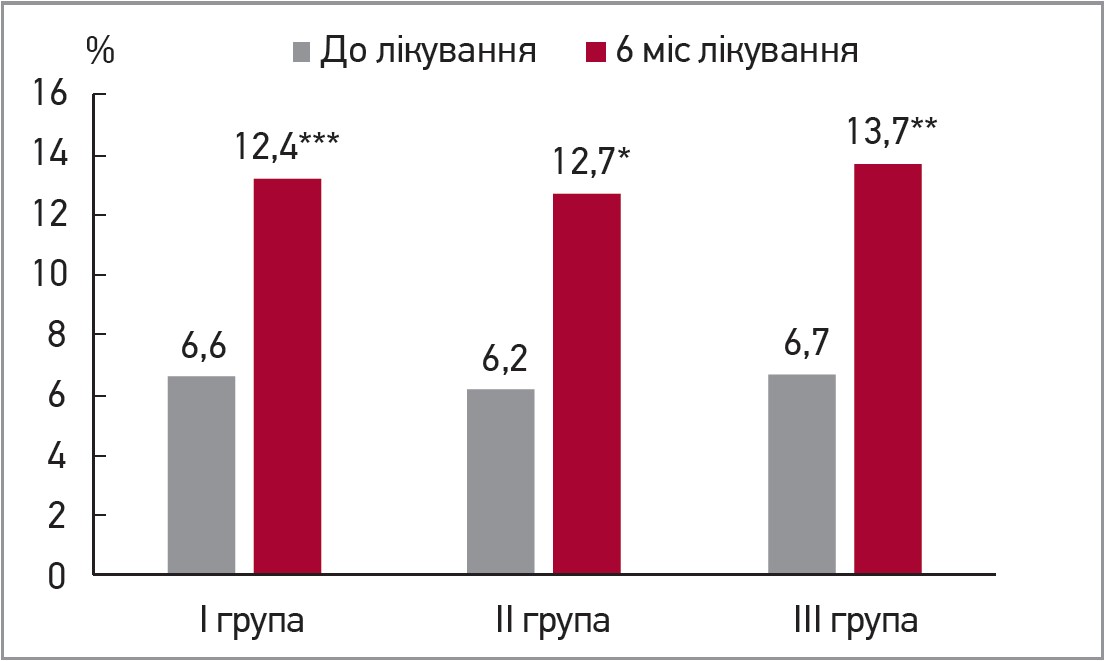
За результатами аналізу на тлі лікування препаратом Магнікор спостерігали суттєве зниження активності запалення низької градації, про що свідчить зменшення рівня СРП на 12,2 (р<0,04), 23,1 (р<0,03), 18,8% (р<0,04) в першій, другій та третій групах відповідно, а також значне зменшення рівня прозапального цитокіну TNF (р<0,001), відчутну тенденцію до зростання в усіх групах протизапального цитокіну ІЛ‑10. У пацієнтів із вищим початковим рівнем ЕАС (яку розглядали як маркер системної ендотеліальної дисфункції) спостерігали достовірне зменшення добової альбумінурії на 19,9% (р<0,03) у першій групі та 30,9% (р<0,04) у третій групі. На користь поліпшення функціональних властивостей ендотелію свідчать зменшення концентрації АДМА в плазмі крові пацієнтів усіх трьох груп, а також позитивна динаміка показника ендотелійзалежної вазодилатації. В усіх групах дослідження спостерігали суттєве збільшення індексу ЕЗВД, що відображає позитивний вплив лікування на ендотеліальну функцію в пацієнтів із ССЗ: у першій групі – з 6,6±3,7 до 13,2±4,1% (р=0,002), у другій – з 6,2±3,9 до 12,7±3,5% (р=0,01), у третій – з 6,7±4,1 до 13,7±2,5% (р=0,001) (рис. 1). Збільшення значення індексу ЕЗВД у групах було односпрямованим і зіставним.
Рис. 1. Індекс ЕЗВД після 6 міс лікування препаратом Магнікор
Примітки: * р=0,01; ** р=0,001; *** р=0,002.
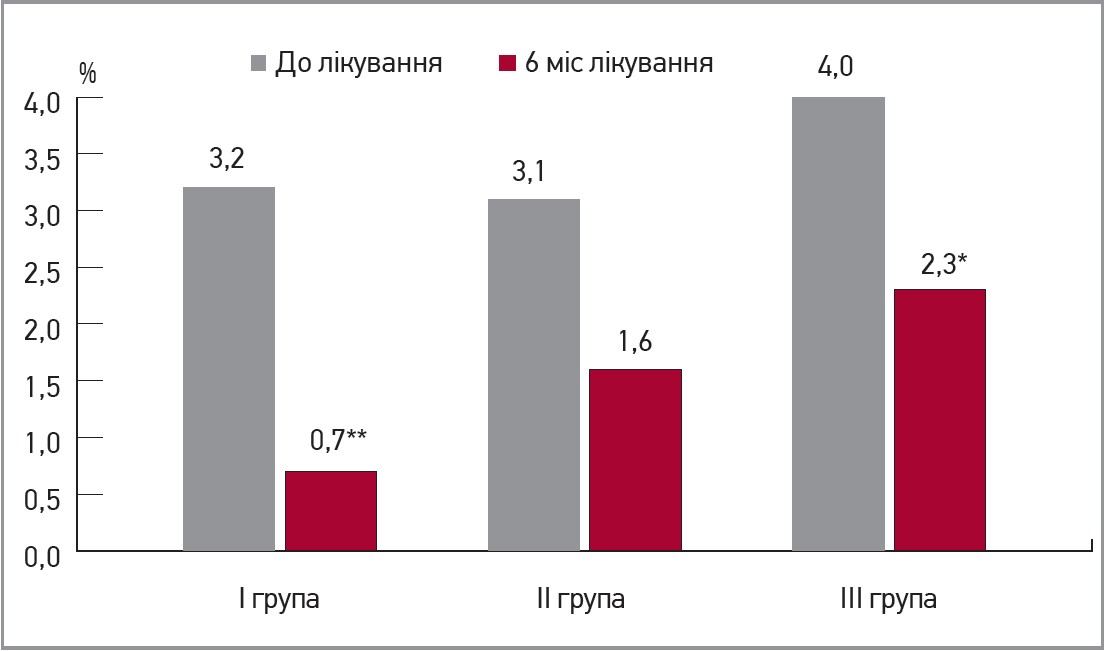
Антитромбоцитарну активність препарату Магнікор засвідчило суттєве зменшення рівня експресії на тромбоцитах GpІІb/IIIa та P-селектину (CD62Р), а також достовірне зниження відсотка тромбоцитів, які мають на поверхні P-селектин, на 78, 48 та 42% відповідно в пацієнтів першої, другої, третьої груп (рис. 2).
Рис. 2. Відсоток тромбоцитів, які експресують на поверхні CD62Р під впливом 6 міс лікування препаратом Магнікор
Примітки: * р=0,05; ** р=0,01.
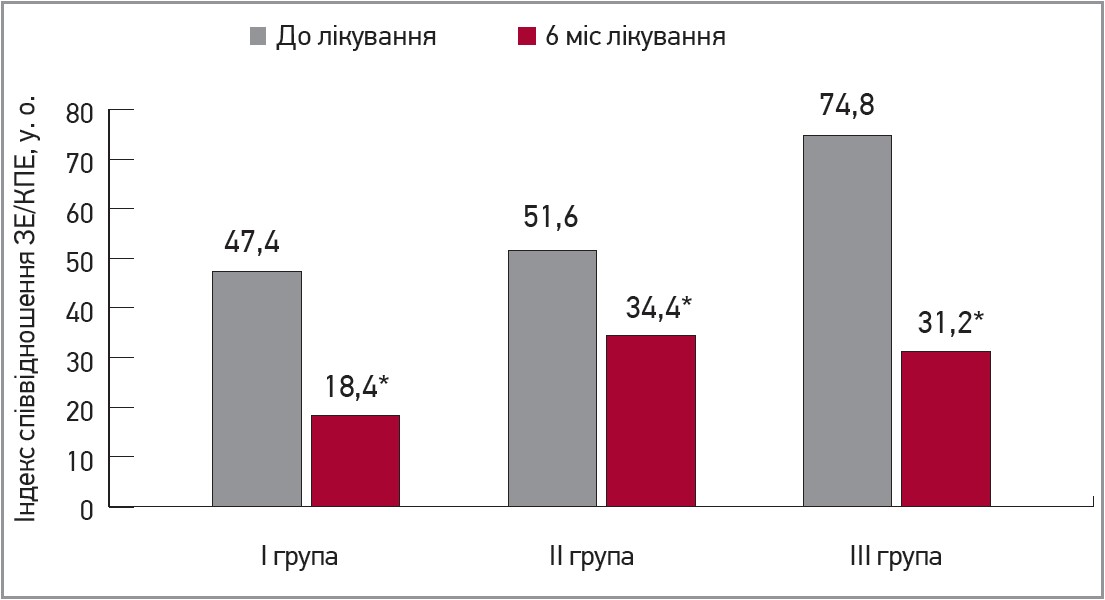
Результати аналізу динаміки КПЕ та ЗЕ дозволили продемонструвати покращення функції ендотелію під впливом Магнікору: кількість КПЕ збільшилася вдвічі в другій та третій групах, а в першій групі – втричі. Хоча в першій та другій групах кількість злущених ендотеліоцитів зросла порівняно з початковими значеннями, індекс співвідношення ЗЕ/КПЕ зменшився в 2,5 раза в першій групі, в 1,6 раза – в другій групі та в >2 рази в третій групі, що свідчить про відновлення функції кісткового мозку продукувати КПЕ та зменшення вираженості дисфункції ендотелію (рис. 3).
Рис. 3. Індекс співвідношення ЗЕ/КПЕ після 6 міс лікування препаратом Магнікор
Примітка: * р=0,001.
Отже, тривале використання препарату Магнікор супроводжувалося достовірним зменшенням активації тромбоцитів у всіх групах пацієнтів, що сприяє зниженню здатності тромбоцитів до агрегації та взаємодії з клітинами крові й ендотеліоцитами. Суттєві зміни показників спостерігалися навіть у пацієнтів, котрі до початку дослідження вже приймали АСК. Імовірно, це є свідченням низької прихильності хворих до лікування препаратами АСК.
Важливим є той факт, що тривале лікування препаратом Магнікор не спричиняло негативних змін із боку об’єктивного статусу пацієнтів і лабораторних показників. Переносимість препарату була розцінена як хороша. Протягом дослідження в 2 пацієнтів третьої групи через 1 міс після початку прийому досліджуваного препарату спостерігали побічну реакцію у вигляді дискомфорту натще в епігастрії, іноді – відчуття печії. Скарги були непостійними, низького ступеня тяжкості, після рекомендацій щодо режиму харчування зазначені симптоми зникли. Інші 58 пацієнтів заявляли про відсутність будь-яких неприємних відчутів на тлі прийому препарату Магнікор. Підтвердження хорошої переносимості терапії препаратом Магнікор – покращення показника стану здоров’я за шкалою EQ‑5D‑5L в усіх групах пацієнтів, а саме збільшення значення на 21,4 (перша група), 21,8 (друга група), 18,8% (третя група).
Висновки
-
Препарат Магнікор – ефективний засіб для лікування пацієнтів із ССЗ. Незалежно від попереднього прийому препаратів АСК, у т. ч. у кишковорозчинній формі, чи призначення його вперше лікування Магнікором супроводжувалося пригніченням активності тромбоцитів крові – їхньої здатності до агрегації та взаємодії з клітинами крові й ендотеліоцитами. Найвираженіші зміни спостерігалися в першій групі пацієнтів, які до залучення до випробування приймали Магнікор.
-
На тлі лікування препаратом Магнікор установлено статистично значуще зменшення маркерів системного запалення, а саме рівня СРП у крові, прозапального цитокіну TNF, а також тенденцію до зростання вмісту протизапального цитокіну ІЛ‑10.
-
Зменшення активації тромбоцитів крові та інтенсивності системного запалення асоціювалося з відновленням функції ендотелію і підвищенням здатності кісткового мозку продукувати КПЕ.
-
Лікування препаратом Магнікор сприяло покращенню функції ендотелію в пацієнтів із ССЗ: спостерігали збільшення значення індексу ЕЗВД, а також зниження показників добової альбумінурії у хворих з його вищим початковим значенням.
-
Використання препарату Магнікор є ефективним і безпечним; він значно покращує стан здоров’я за шкалою EQ‑5D‑5L у пацієнтів усіх досліджуваних груп.
Література
- Antithrombotic Trialists’ (ATT) Collaboration, Baigent C., Blackwell L., Collins R., Emberson J., Godwin J., Peto R., Buring J., Hennekens C., Kearney P., Meade T., Patrono C., Roncaglioni M.C., Zanchetti A. Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials. Lancet 2009; 373: 1849-1860.
- Yoo S.G.K., Chung G.S., Bahendeka S.K. et al. Aspirin for Secondary Prevention of Cardiovascular Disease in 51 Low-, Middle-, and High-Income Countries. JAMA. 2023; 330 (8): 715-724. doi: 10.1001/jama.2023.12905.
- JAMA. 2022; 327 (16): 1577-1584. doi: 10.1001/jama.2022.4983.
- J Am Coll Cardiol. 2022 Oct, 80 (14) 1287-1298.
- Naylor J. Study shows that low-dose aspirin associated with a 15% lower risk of developing diabetes in people aged over 65 years. EurekAlert! August 31, 2023. Accessed August 31, 2023. https://www.eurekalert.org/news-releases/1000081.
Медична газета «Здоров’я України 21 сторіччя» № 19/1 (556), 2023 р