11 серпня, 2022
Реваскуляризація коронарних артерій: основні положення американських рекомендацій
Ішемічна хвороба серця (ІХС) залишається основною причиною захворюваності й смертності у всьому світі. Реваскуляризація міокарда – важлива терапевтична опція у веденні пацієнтів з ІХС зі значним ураженням коронарних судин. Американська асоціація серця (AHA) та Американська колегія кардіологів (ACC) за участю Товариства із серцево-судинної ангіографії та втручань (SCAI) 2021 р. розробили настанову щодо реваскуляризації коронарних артерій на заміну відповідним рекомендаціям 2011 р. із коронарного шунтування (КШ) та 2011 і 2015 рр. із черезшкірних коронарних втручань (ЧКВ). У документі запропоновано основані на доказах підходи до ведення хворих на ІХС, для яких розглядається можливість проведення коронарної реваскуляризації, з метою поліпшення якості надання допомоги та врахування інтересів пацієнтів.
Методологія
Було проведено ретельний пошук літератури (клінічних досліджень, оглядів тощо) серед англомовних публікацій у базах PubMed, EMBASE, Cochrane Collaboration, CINHL Complete та ін. у травні – вересні 2019 р., але у процесі розробки настанови також було взято до уваги релевантні дослідження, опубліковані до травня 2021 р. До авторського колективу увійшли клініцисти, кардіологи, інтервенційні хірурги, кардіохірурги, кардіоанестезіологи, середній медичний персонал, представники допоміжного персоналу медзакладу і пацієнтської спільноти.
Клас рекомендацій відображає їх силу, оцінюючи співвідношення користі й ризику для пацієнта тих чи інших клінічних стратегій втручання, лікування або діагностичного тестування. Рівень доказовості вказує на якість наукових даних, що підтримують втручання, на основі типу, якості й узгодженості результатів клінічних випробувань та інших джерел (таблиця).
Прийняття рішень при наданні допомоги: важливі моменти
Рішення щодо лікування хворих, які потребують реваскуляризації міокарда, повинні ґрунтуватися на клінічних показаннях та не залежати від статі, раси, етнічної належності (І, B-NR). Рішення стосовно реваскуляризації має бути пацієнт-орієнтованим, тобто клініцистові слід брати до уваги преференції, цілі, культурні переконання, медичну обізнаність, соціальні детермінанти здоров’я хворого та ухвалюватися разом із ним (І, C‑LD). Пацієнтам, які підлягають коронарографії або реваскуляризації, необхідно надати адекватну інформацію про користь, ризики, терапевтичні наслідки та потенційні альтернативи виконанню хірургічної або черезшкірної реваскуляризації міокарда із наданням, за можливості, достатнього часу для прийняття інформованого рішення з метою поліпшення клінічного результату (І, C‑LD).
Передпроцедурний огляд: роль кардіологічної команди
Пацієнтам, для яких оптимальна лікувальна стратегія є невизначеною, рекомендоване залучення кардіологічної команди, що включає спеціалістів з інтервенційної кардіології, кардіохірургії та клінічної кардіології для поліпшення клінічного результату (І, B-NR). Моделі роботи кардіологічної команди включають зустрічі – як регулярні (щоденні, щотижневі), так і ситуативні (зокрема в екстрених ситуаціях); водночас є аргументи на користь дистанційних консультацій.
Кардіологічна команда розглядає такі чинники, як:
- Анатомія коронарної системи: ураження лівої коронарної артерії (ЛКА), багатосудинне пошкодження, висока анатомічна складність.
- Коморбідності: цукровий діабет, систолічна дисфункція, коагулопатія, клапанна хвороба серця, крихкість пацієнта, злоякісні новоутворення, термінальна ниркова недостатність, хронічне обструктивне захворювання легень, імуносупресія, тяжкі неврологічні розлади, хвороби печінки / цироз, попередня серцево-судинна (СС) подія, кальциноз/аневризма аорти.
- Процедурні фактори: локальні та регіональні клінічні результати, доступ до ЧКВ, ризики, пов’язані з хірургічним втручанням або ЧКВ.
- Особливості пацієнта: нестабільний стан або шок, преференції хворого, нездатність або небажання отримувати подвійну антитромботичну терапію (ПАТТ), релігійні переконання, освіта тощо.
У пацієнтів, для яких розглядається КШ, рекомендовано оцінити ризики за шкалою Американського товариства торакальних хірургів (STS) (І, B-NR). Цей інструмент створено на основі даних пацієнтів, які перенесли КШ, і призначено для прогнозування небажаних подій у кандидатів для КШ, як-от ризик смерті, ниркова недостатність, інсульт, інфекція глибокої рани стегна, повторна операція, тривале перебування у стаціонарі. З тією ж метою розроблено Європейську систему оцінки ризику кардіологічних операцій (EuroSCORE ІІ).
Визначення тяжкості уражень
Коронарографія залишається стандартним методом визначення анатомії коронарного русла та ступеня тяжкості коронарного артеріального стенозу. Коронарний (окрім ЛКА) стеноз ≥70% та стеноз ЛКА ≥50%, за даними візуальної оцінки, є критеріями значного стенозу та допомагають обрати стратегію реваскуляризації. Проміжним, за даними ангіографії, вважають коронарний стеноз 40‑69%, і в цих випадках зазвичай проводять додаткові обстеження для оцінки його фізіологічного значення.
У пацієнтів із багатосудинною ІХС для прийняття рішень щодо реваскуляризації може бути корисною оцінка складності змін коронарного русла за анатомічною шкалою SYNTAX (ІІb, B-NR). Для визначення типу реваскуляризації необхідна кількісна характеристика тяжкості судинних уражень, очікуваної повноти реваскуляризації та прогнозованого ризику смерті.
В осіб зі стенокардією або її еквівалентом, недокументованою ішемією та проміжним, за даними ангіографії, стенозом для прийняття рішень щодо проведення ЧКВ рекомендовано провести оцінку гемодинамічної значущості стенозу шляхом вимірювання фракційного резерву кровоплину (FFR) або миттєвого безхвильового співвідношення (iFR) (І, A). У стабільних хворих із помірним, за даними ангіографії, стенозом та FFR >0,80 або iFR >0,89 ЧКВ не проводять (ІІІ: користь відсутня, B-R).
У пацієнтів із проміжним стенозом ЛКА для оцінки тяжкості ураження доцільним є виконання внутрішньосудинного ультразвукового дослідження (ВСУЗД) (ІІa, B-NR). ВСУЗД може надати важливу анатомічну інформацію крім тої, яку можна отримати шляхом коронарографії, зокрема дозволяє точно визначити:
- розмір просвіту судини;
- довжину ураження;
- морфологію;
- локалізацію бляшок;
- наявність тромбів;
- розшарування стінки судин;
- розправлення стента.
ВСУЗД особливо корисне у випадках ураження ЛКА, ангіографічна візуалізація якої може бути ускладнена через невдалий ракурс або перекриття іншими судинами. Просторова роздільна здатність ВСУЗД значно перевищує таку ангіографії (100‑150 і 300 мкм відповідно).
Реваскуляризація у пацієнтів з інфарктом міокарда з елевацією сегмента ST
Реваскуляризація інфаркт-залежної артерії
Пацієнтам з інфарктом міокарда з елевацією сегмента ST (STEMI) та симптомами ішемії, що тривають <12 год, слід проводити ЧКВ для поліпшення виживаності (І, A). Особам зі STEMI та кардіогенним шоком або гемодинамічно нестабільним показане ЧКВ або КШ (якщо ЧКВ неможливе) для поліпшення виживаності, незалежно від часу, що минув після маніфестації ІМ (І, B-R). Хворим на STEMI, які мають механічні ускладнення (розрив міжшлуночкової перегородки, недостатність мітрального клапана через інфаркт папілярного м’яза, розрив вільної стінки), рекомендоване КШ під час проведення хірургічного втручання для поліпшення виживаності (І, B-NR). Пацієнтам зі STEMI, у котрих тромболітична терапія виявилася неуспішною, має бути виконане рятівне ЧКВ інфаркт-залежної артерії (ІЗА) для поліпшення клінічних результатів (І, C‑LD).
У пацієнтів зі STEMI, які отримують тромболітичну терапію, для поліпшення клінічних результатів доцільним є раннє проведення ангіографії в межах 3‑24 год після фібринолізу для визначення того, чи потрібне ЧКВ (ІІa, B-R). У хворих на STEMI, що є стабільними та поступили до медзакладу в період 2‑24 год після появи симптомів, слід виконати ЧКВ для поліпшення клінічних результатів (ІІa, B-NR). В осіб зі STEMI, для яких ЧКВ неможливе або є неуспішним, із великою площею міокарда в зоні ризику, екстрене або невідкладне КШ може бути ефективним як метод реперфузії для поліпшення результатів (ІІa, B-NR). У пацієнтів зі STEMI, ускладненим збереженням ішемії, гострою тяжкою серцевою недостатністю або життєзагрозливою аритмією, ЧКВ має переваги для поліпшення клінічних наслідків, незалежно від того, скільки часу минуло від маніфестації ІМ (ІІa, C-EO).
Безсимптомним стабільним пацієнтам зі STEMI, які мають цілком оклюдовану ІЗА протягом >24 год після появи симптомів та без ознак тяжкої ішемії, не слід виконувати ЧКВ (ІІІ: користь відсутня, B-R). Особам зі STEMI не варто проводити екстрене КШ після неуспішного первинного ЧКВ (ІІІ: негативний вплив, C-EO):
- за відсутності ішемії або великої площі міокарда в зоні ризику, або
- якщо хірургічна реваскуляризація неможлива через невідновлення кровотоку або незадовільні дистальні мішені.
Пацієнтам зі STEMI тромболітична терапія рекомендована тільки у випадках, коли ЧКВ не є негайно доступною, та очікувана затримка від поступлення у медзаклад до ЧКВ становить >120 хв. У зв’язку із тим, що в ~35% хворих, які отримали тромболітичну терапію, не вдається досягти реперфузії, а ще у 10% реперфузія виявилася незадовільною (коронарний кровотік за шкалою TIMI <3), раннє транспортування пацієнта до медичної установи, де виконується ЧКВ, сприятиме ранній катетеризації та/або ЧКВ.
Реваскуляризація ураженої артерії, що не пов’язано з інфарктом
У деяких гемодинамічно стабільних хворих на STEMI із багатосудинним ураженням коронарних артерій після успішного первинного ЧКВ рекомендоване поетапне проведення ЧКВ на інших артеріях зі значним стенозом, що не пов’язано з інфарктом, для зниження ризику смерті (І, A). У певної категорії пацієнтів зі STEMI та складним багатосудинним ураженням, що не асоційоване з інфарктом коронарних артерій після успішного первинного ЧКВ, доцільним є планове КШ для зниження ризику серцевих подій (ІІa, C-EO).
У деяких гемодинамічно стабільних пацієнтів зі STEMI та багатосудинним ураженням коронарних артерій низької складності рутинне ЧКВ на стенозованих артеріях, що не пов’язані з інфарктом, під час первинного ЧКВ може бути розглянуте для зниження частоти кардіальних подій (ІІb, B-R).
Особам зі STEMI, ускладненим кардіогенним шоком, не слід проводити рутинне ЧКВ не асоційованих з інфарктом уражених артерій під час первинного ЧКВ через підвищений ризик смерті або розвитку ниркової недостатності (ІІІ: негативний ефект, B-R).
Реваскуляризація в осіб із гострим коронарним синдромом без стійкої елевації сегмента ST
Пацієнтам із гострим коронарним синдромом без стійкої елевації сегмента ST (NSTE-ACS), які мають підвищений ризик повторних ішемічних подій та є кандидатами на реваскуляризацію, показано інвазивну стратегію для визначення, чи проводити реваскуляризацію з метою зниження ризику СС-подій (І, A). Особам із NSTE-ACS і кардіогенним шоком, яких розглядають для виконання реваскуляризації, рекомендовано екстрену реваскуляризацію для зменшення ймовірності летальних випадків (І, B-R). Хворим на NSTE-ACS, які мають рефрактерну стенокардію чи електричну нестабільність міокарда або є гемодинамічно нестабільними, показано екстрену інвазивну стратегію для визначення, чи проводити реваскуляризацію з метою поліпшення клінічних результатів (І, C‑LD).
Для пацієнтів із NSTE-ACS, що були початково стабілізовані та мають високий ризик клінічних подій, доцільно вибрати ранню інвазивну стратегію (в межах 24 год) замість відтермінованої для поліпшення клінічних наслідків (ІІa, B-R). Для осіб із NSTE-ACS, які були початково стабілізовані, з середнім або низьким ризиком клінічних ускладнень, інвазивна стратегія для визначення, чи проводити реваскуляризацію, є доцільною перед випискою з лікарні для поліпшення клінічних результатів (ІІa, B-R). У хворих на NSTE-ACS, в яких ЧКВ було неуспішним, та збереглася ішемія, наявні порушення гемодинаміки або загрозлива оклюзія артерії зі значною площею міокарда в зоні ризику, і котрим можна виконати КШ, необхідним є екстрене КШ (ІІa, B-NR).
Пацієнтам із NSTE-ACS, які були доставлені до медзакладу із кардіогенним шоком, рутинне багатосудинне ЧКВ уражень, які не пов’язані з інфарктом, у тій самій установі виконувати не слід (ІІІ: негативний вплив, B-R).
Високий ризик клінічних ускладнень у хворих необхідно визначати за глобальним реєстром гострих коронарних подій (GRACE; >140), а також з урахуванням таких факторів, як вік (≥75 років), підвищений показник за шкалою TIMI (тромболізис при інфаркті міокарда) та збільшений вміст кардіомаркерів.
Реваскуляризація у хворих на стабільну ІХС
Реваскуляризація або фармакотерапія для поліпшення виживаності
Згідно з результатами клінічних випробувань, КШ має переваги порівняно з медикаментозним лікуванням для деяких груп пацієнтів, зокрема з ураженням стовбура ЛКА, багатосудинним пошкодженням та ішемічною кардіоміопатією. Однак слід зауважити, що багато досліджень проводили до широкого впровадження антитромботичної та статинотерапії, а також визнання переваг β-блокаторів й інгібіторів ангіотензинперетворювального ферменту (іАПФ) / блокаторів рецепторів ангіотензину ІІ (БРА). Рандомізовані контрольовані випробування, де були б показані переваги ЧКВ над фармакологічним лікуванням в осіб зі стабільною ІХС, відсутні. Отже, користь та ризики ЧКВ у кожному випадку має зважувати кардіологічна команда.
Пацієнтам зі стабільною ІХС та багатосудинним ураженням, придатним для КШ, із тяжкою систолічною дисфункцією лівого шлуночка (ЛШ), коли фракція викиду (ФВ) ЛШ <35%, рекомендоване проведення КШ для поліпшення виживаності (І, B-R). У деяких хворих на стабільну ІХС із багатосудинним ураженням, яким може бути виконано КШ, та із систолічною дисфункцією ЛШ від легкої до помірної (ФВ ЛШ 35‑50%) доцільно провести КШ (шунт внутрішньої грудної артерії [ВГА] до лівої передньої низхідної артерії [ПНА]) для поліпшення виживаності (ІІa, B-NR).
Особам зі стабільною ІХС та значним стенозом стовбура ЛКА рекомендоване КШ для поліпшення виживаності (І, B-R). Втім, у деяких пацієнтів, у котрих ЧКВ здатне забезпечити реваскуляризацію, еквівалентну такій, що можлива за КШ, для поліпшення виживаності слід провести ЧКВ (ІІa, B-NR).
У пацієнтів зі стабільною ІХС, нормальною ФВ, значним стенозом трьох основних коронарних артерій (включно із проксимальною частиною лівої ПНА або ні) та анатомічною можливістю виконання КШ ймовірно доцільним є КШ для поліпшення виживаності (ІІb, B-R). Навіть якщо у таких хворих наявна анатомічна можливість проведення ЧКВ, доцільність проведення цієї процедури для поліпшення виживаності є невизначеною (ІІb, B-R). Також досі не підтверджено, чи варто виконувати коронарну реваскуляризацію особам зі стабільною ІХС, нормальною ФВ ЛШ та значним стенозом проксимальної частини лівої ПНА для поліпшення виживаності (ІІb, B-R).
Коронарна реваскуляризація для поліпшення виживаності не рекомендована пацієнтам зі стабільною ІХС, нормальною ФВ ЛШ та ураженням однієї або двох коронарних артерій без залучення проксимальної частини лівої ПНА (ІІІ: користь відсутня, B-R). Також не слід проводити коронарну реваскуляризацію особам зі стабільною ІХС, у яких ураження ≥1 коронарної артерії не має анатомічного або функціонального значення (стеноз артерії, крім стовбура ЛКА, <70%; FFR >0,80), якщо первинною або єдиною метою є поліпшення виживаності (ІІІ: негативний вплив, B-NR).
Реваскуляризація або медикаментозне лікування щодо зниження ризику СС-подій
Для пацієнтів зі стабільною ІХС та багатосудинним ураженням, яким може бути проведено КШ або ЧКВ, реваскуляризація є доцільною для зниження ризику СС-подій, таких як спонтанний ІМ, непланова невідкладна реваскуляризація або серцева смерть (ІІa, B-R).
Реваскуляризація з метою полегшення симптомів
Реваскуляризацію для полегшення симптомів рекомендовано пацієнтам із рефрактерною стенокардією, що триває незважаючи на медикаментозну терапію, та зі значним стенозом коронарних артерій, які придатні для реваскуляризації (І, A). Якщо в осіб зі стенокардією відсутні анатомічні або фізіологічні критерії реваскуляризації, не слід проводити ані КШ, ані ЧКВ (ІІІ: негативний вплив, C‑LD).
Прийнятні клінічні ситуації для проведення КШ або ЧКВ
Ураження високої складності
Механізми, за якими КШ і ЧКВ поліпшують кровотік, варіюють, тому для різних груп пацієнтів та чи інша методика має переваги щодо виживаності та зниження ризику спонтанного ІМ в майбутньому. Так, хворим, які потребують реваскуляризації стовбура ЛКА зі значним ураженням високої складності, рекомендовано проводити КШ, а не ЧКВ, для поліпшення виживаності (І, B-R). Також вибір КШ є доцільним для осіб, яким необхідно виконати реваскуляризацію через ІХС із багатосудинним складним або дифузним ураженням (за шкалою SYNTAX >33), адже має переваги над ЧКВ щодо виживаності (ІІa, B-R).
Цукровий діабет
Цукровий діабет (ЦД) пов’язаний із підвищенням смертності внаслідок хвороб серця у 2‑4 рази, агресивнішим атеросклерозом, більш дифузними ураженнями коронарного русла та меншими коронарними судинами. Після коронарної реваскуляризації особи із ЦД мають вищий ризик смерті та повторних процедур. Хворим на ЦД та ІХС, що мають багатосудинне ураження із залученням лівої ПНА, яким може бути проведено КШ для зменшення ймовірності летальних випадків та повторної реваскуляризації, рекомендовано саме КШ (ВГА до ПНА), а не ЧКВ (І, A).
Натомість пацієнтам із ЦД та ІХС із багатосудинним ураженням, що підлягає ЧКВ, котрі мають показання для реваскуляризації та є поганими кандидатами на хірургічне втручання, корисним може бути ЧКВ для зниження віддалених результатів ішемії (ІІa, B-NR). Для осіб із ЦД, в яких відзначено стеноз стовбура ЛКА та ІХС із пошкодженнями інших коронарних судин низької або помірної тяжкості, слід розглянути ЧКВ як альтернативу КШ для зниження ризику серйозних СС-подій (ІІb, B-R).
Пацієнти із раніше поведеним КШ
У хворих, яким раніше вже проводили КШ, ЧКВ або повторне КШ пов’язані з більшою імовірністю невдалої процедури та ускладнень, а також гіршими клінічними результатами порівняно з пацієнтами без попереднього КШ. Необхідність повторної реваскуляризації є незалежним предиктором вищого ризику смерті. Таким пацієнтам, що мають прохідний шунт ВГА до лівої ПНА та потребують повторної реваскуляризації, за можливості проведення ЧКВ доцільно виконувати саме його, а не КШ (ІІa, B-NR).
Особам із попереднім КШ та рефрактерною стенокардією, що зберігається незважаючи на належну медикаментозну терапію та може бути асоційована з ураженням лівої ПНА, ймовірно доцільним є проведення КШ, а не ЧКВ, із можливим використанням ВГА як шунта до лівої ПНА (ІІa, C‑LD). Якщо пацієнт із попереднім КШ має ІХС зі складним ураженням, доцільно надати перевагу КШ над ЧКВ, коли ВГА може бути використана як кондуїт для шунтування лівої ПНА (ІІb, B-NR).
Прихильність до ПАТТ
При прийнятті рішення щодо процедури реваскуляризації у хворого на ІХС із багатосудинним ураженням слід звернути увагу на його прихильність до ПАТТ. Передчасне припинення ПАТТ після ЧКВ пов’язане із тромбозом стента та несприятливими клінічними результатами, зокрема смертю. Якщо можливе проведення як КШ, так і ЧКВ, а пацієнт або не має доступу до ПАТТ, або погано переносить чи неприхильний до такої терапії впродовж необхідного періоду, доцільним є вибір КШ (ІІa, B-NR).
Особливі групи пацієнтів та клінічні обставини
Вагітність
Рішення щодо вагітних є складними. Клініцисти мають враховувати ризик для плода та ризик і користь для матері. Вагітним зі STEMI, що не був спричинений спонтанною дисекцією коронарної артерії, з метою реваскуляризації слід проводити первинне ЧКВ (ІІa, C‑LD). Для вагітних із NSTE-ACS інвазивна стратегія є доцільною у випадках, коли медикаментозна терапія виявилася неефективною у лікуванні загрозливих для життя ускладнень (ІІa, C‑LD).
Вагітних зазвичай виключають із клінічних досліджень, тому даних щодо безпеки застосування антитромботичних засобів під час вагітності, особливо у ІІІ триместрі, недостатньо. Зазвичай вважається, що приймання ацетилсаліцилової кислоти (АСК) у низькій дозі є безпечним під час вагітності. Якщо необхідне застосування клопідогрелю, курс терапії має бути якнайкоротшим і потребує нагляду лікаря. Дані щодо використання інших антитромботичних препаратів у вагітних обмежені.
Літні пацієнти
Із клінічних досліджень також зазвичай виключають осіб віком >75 років, тому оптимальні методи лікування таких хворих залишаються невизначеними. Літні пацієнти, що підлягають коронарній реваскуляризації, є особливо вразливими через складніші ураження та численні коморбідності. Після ЧКВ вони мають підвищений ризик кровотеч та інсультів. Згідно з настановою, в осіб похилого віку, як і у решти хворих, стратегія лікування ІХС повинна базуватися на їхніх індивідуальних преференціях, когнітивній функції та очікуваній тривалості життя (І, B-NR).
Особи із хронічною хворобою нирок
Оптимальні методи лікування пацієнтів із хронічною хворобою нирок також залишаються до кінця не визначеними. В осіб із ХХН, яким вводиться контрастна речовина для проведення коронарографії, слід вжити заходів для мінімізації ризику контраст-індукованого гострого пошкодження нирок (І, C‑LD). Пацієнтам зі STEMI і ХХН рекомендовані коронарографія та реваскуляризація з адекватними заходами для зменшення ймовірності гострого ураження нирок (І, C-EO). У хворих групи високого ризику зі NSTE-ACS і ХХН варто провести коронарографію та реваскуляризацію з адекватними заходами для зниження ризику гострого пошкодження нирок (ІІa, B-NR). Для пацієнтів категорії низького ризику із NSTE-ACS і ХХН доцільним є зважування ризиків і потенційної користі від проведення коронарографії та реваскуляризації (ІІa, C-EO). Безсимптомним хворим на стабільну ІХС і ХХН рутинна ангіографія і реваскуляризація не рекомендовані, якщо відсутні особливі показання (ІІІ: користь відсутня, B-R).
Некардіологічна операція
Пацієнтам з ІХС без пошкодження стовбура ЛКА або нескладними ураженнями, яким проводять некардіологічну операцію, не рекомендовано рутинну коронарну реваскуляризацію лише з метою зниження ризику періоперативних СС-подій (ІІІ: користь відсутня, B-R). В осіб із фібриляцією шлуночків, поліморфною шлуночковою тахікардією або зупинкою серця для поліпшення виживаності варто виконати реваскуляризацію коронарних артерій зі значними ураженнями (І, B-NR). Пацієнтам з ІХС та підозрою на стійку мономорфну шлуночкову тахікардію, пов’язану з рубцевими змінами, не рекомендовано реваскуляризацію лише з метою запобігання рецидивам шлуночкової аритмії (ІІІ: користь відсутня, C‑LD).
Спонтанна дисекція коронарних артерій
Реваскуляризація може бути розглянута для пацієнтів зі спонтанною дисекцією коронарних артерій, які є гемодинамічно нестабільними, або ж у них зберігається ішемія незважаючи на консервативну терапію (ІІb, C‑LD). Проте рутинну реваскуляризацію особам із спонтанною дисекцією коронарних артерій проводити не слід (ІІІ: негативний вплив, C‑LD).
Технічні аспекти ЧКВ
Судинний доступ
У пацієнтів із гострим коронарним синдромом (ГКС), яким проводять ЧКВ, променевий доступ має переваги перед стегновим щодо зниження ризику смерті, судинних ускладнень та кровотечі (І, A). За наявності стабільної ІХС також рекомендований променевий доступ для зменшення ймовірності кровотечі у місці артеріального доступу та судинних ускладнень (І, A). Під час вибору судинного доступу варто взяти до уваги, що променева артерія надалі може бути використана як графт для коронарного шунтування. Тож у випадках, коли КШ у майбутньому має високу ймовірність, ситуацію слід обговорити з пацієнтом та кардіохірургом.
Тип стента
За останні два десятиріччя технологія стентів із медикаментозним покриттям значно еволюціонувала. Зокрема, було оптимізовано склад покриття, полімер і дизайн стента, що підвищило його безпеку та ефективність. Тому в пацієнтів, що підлягають ЧКВ, рекомендовано застосовувати стенти з лікарським покриттям, – порівняно із металевими вони мають переваги щодо запобігання рестенозу, ІМ, гострому тромбозу стента тощо (І, A).
Внутрішньосудинна візуалізація
ВСУЗД може бути корисним для контролю ЧКВ, особливо у разі стентування стовбура ЛКА або складних коронарних уражень, для зниження ризику ішемічних подій (ІІa, B-R). Альтернативою ВСУЗД під час проведення стентування коронарних артерій (окрім устя стовбура ЛКА) є оптична когерентна томографія (ІІa, B-R). Застосування і ВСУЗД, і оптичної когерентної томографії може допомогти визначити, чому стентування виявилося невдалим (ІІa, C‑LD).
Тромбектомія
У пацієнтів зі STEMI, спричиненим тромбозом ІЗА, руйнування тромбу перед проведенням ЧКВ здається логічним. Однак результати досліджень показали, що рутинна аспіраційна тромбектомія перед ЧКВ не надає клінічних переваг (ІІІ: користь відсутня, А).
Терапія за наявності кальцифікатів
В осіб із фібротичними або тяжкими кальцифікованими ураженнями коронарних судин перед стентуванням може бути корисним проведення ротаційної атеректомії (ІІa, B-R). Також для цих хворих перед імплантацією стента, ймовірно, доцільно розглянути такі методи модифікації бляшок, як орбітальна або балонна атеректомія, лазерна ангіопластика, коронарна внутрішньосудинна літотрипсія (ІІb, B-NR).
Повторна реваскуляризація шунта
У пацієнтів, котрим раніше було проведено КШ та які потребують реваскуляризації шунта із підшкірної вени, ЧКВ значно частіше супроводжується тяжкими СС-подіями, зокрема перипроцедурним ІМ, ніж ЧКВ нативних коронарних артерій. У деяких хворих, що раніше перенесли КШ та підлягають ЧКВ венозного шунта, для зниження ризику дистальної емболізації доцільним є застосування пристрою протиемболічного захисту (ІІa, B-R). В осіб, які раніше перенесли КШ, за можливості, треба надати перевагу ЧКВ нативної коронарної артерії замість ЧКВ значно стенозованого шунта із підшкірної вени (ІІa, B-NR). Пацієнтам із хронічною оклюзією венозного шунта його черезшкірну реваскуляризацію проводити не слід (ІІІ: користь відсутня, C‑LD).
Рестеноз стента
У пацієнтів із симптомним рестенозом стента, у яких заплановано ЧКВ, слід використовувати стенти із лікарським покриттям. Це дозволяє поліпшити результати, якщо анатомія уражень відповідна, і хворий здатний дотримуватися ПАТТ (І, A). Що стосується осіб із симптомним рецидивним дифузним рестенозом стента та показаннями для реваскуляризації, з метою зниження ризику рецидивів доцільним є проведення КШ, а не ЧКВ (ІІa, C-EO).
Фармакотерапія у пацієнтів при проведенні ЧКВ
АСК і пероральні інгібітори P2Y12
АСК і пероральні інгібітори P2Y12-рецепторів залишаються наріжними каменями у профілактиці тромботичних ускладнень ЧКВ. Пацієнтам, яким проводять ЧКВ, для зниження ризику ішемічних подій рекомендоване приймання АСК у навантажувальній дозі з подальшим переходом на використання щоденно (І, B-R). Хворим на ГКС, котрим виконують ЧКВ, для зменшення ймовірності ішемічних подій варто призначити інгібітор рецепторів P2Y12 у навантажувальній дозі з подальшим переходом на щоденне приймання (І, B-R). При цьому для таких пацієнтів перевагу слід надавати тикагрелору або прасугрелу порівняно із клопідогрелем (ІІa, B-R).
Пацієнтам зі стабільною ІХС, яким проводять ЧКВ, для зниження ризику ішемічних подій рекомендовано приймати клопідогрель у навантажувальній дозі з подальшим переходом на щоденне застосування (І, C‑LD). Хворим, яким виконують ЧКВ, упродовж 24 год після тромболітичної терапії варто призначити клопідогрель у навантажувальній дозі 300 мг із подальшим переходом на щоденне приймання (І, C‑LD). Для таких пацієнтів віком <75 років прийнятною альтернативою клопідогрелю може бути тикагрелор (ІІb, B-R). Особам, котрим проводять ЧКВ та які в минулому перенесли інсульт або транзиторну ішемічну атаку (ТІА), не слід призначати прасугрел (ІІІ: негативний вплив, B-R). У пацієнтів, яким проводять ЧКВ, а також вони раніше не отримували інгібіторів рецепторів P2Y12, для зниження ризику перипроцедурних ішемічних подій доцільним є застосування кангрелору внутрішньовенно (ІІb, B-R). Кангрелор – потужний прямий інгібітор рецепторів тромбоцитів P2Y12 зі швидким початком дії та відновленням функції тромбоцитів у межах 1 год після припинення інфузії.
Інгібітори рецепторів глікопротеїну IIb/IIIa
Інгібітори рецепторів глікопротеїну IIb/IIIa – розумний вибір у пацієнтів із ГКС зі значним тромботичним ураженням та невідновленим кровотоком, яким проводять ЧКВ (ІІa, C‑LD). Водночас рутинне застосування цих ліків в осіб зі стабільною ІХС, яким виконують ЧКВ, не рекомендоване (ІІІ: користь відсутня, B-R). Інгібітори рецепторів глікопротеїну IIb/IIIa є антитромботичними засобами прямої дії, значення яких останнім часом, завдяки рутинному стентуванню і ПАТТ, зменшилося.
Нефракціонований гепарин і бівалірудин
Введення нефракціонованих гепаринів внутрішньовенно є доцільним для зниження ризику ішемічних подій у пацієнтів, котрим проводять ЧКВ (І, C-EO). В осіб із гепарин-індукованою тромбоцитопенією для запобігання тромботичних ускладнень під час ЧКВ замість нефракціонованих гепаринів слід використовувати бівалірудин або аргатробан (І, C‑LD). Загалом бівалірудин може бути прийнятною альтернативою нефракціонованим гепаринам для зменшення ймовірності кровотеч у хворих, яким проводять ЧКВ (ІІb, A). Якщо пацієнт отримує терапію еноксапарином підшкірно, й останню дозу препарату було введено за <12 год до ЧКВ, під час процедури не варто застосовувати нефракціоновані гепарини, які можуть підвищити ризик кровотеч (ІІІ: негативний вплив, B-R).
Технічні аспекти КШ
Кондуїти
У пацієнтів, яким виконують ізольоване КШ, при виборі трансплантата рекомендовано надавати перевагу променевій артерії на противагу підшкірній вені для шунтування другої за значенням стенозованої не-ПНА судини з метою поліпшення довгострокових кардіальних результатів (І, B-R). У хворих, котрим проводять КШ, слід використовувати ВГА (віддаючи перевагу лівій ВГА) для шунтування ПНА у випадках, коли шунтування ПНА показане для поліпшення виживаності та зниження ризику повторних ішемічних подій (І, B-NR).
Хірургічні втручання на клапанах/аорті або інші кардіологічні операції
КШ рекомендоване пацієнтам, яким проводять хірургічні операції на клапанах чи аорті або ж інші кардіологічні втручання, а також котрі мають значні ураження артерій, із метою зниження ризику ішемічних подій (І, C‑LD).
Епіаортальное ультразвукове сканування
Рутинне застосування епіаортального ультразвукового сканування може бути корисним у пацієнтів, яким виконують КШ, для оцінки наявності, локалізації та тяжкості атеросклеротичних змін у висхідній частині дуги аорти з метою зниження частоти атеротромботичних ускладнень (ІІa, B-NR).
Фармакотерапія у хворих при виконанні КШ
Лікування для зниження ризику інфікування рани грудини
Для зменшення ймовірності інфікування рани грудини у пацієнтів, яким виконують КШ, слід проводити безперервну інфузію інсуліну для підтримки рівня глюкози в сироватці <180 мг/дл як інтраоперативно (І, B-R), так і в ранньому післяопераційному періоді (І, B-R).
Антитромботична терапія
Пацієнтам, яким виконують КШ та котрі до операції вже отримували АСК щоденно, рекомендовано продовжувати приймання АСК до інтервенції для зниження ризику ішемічних подій (І, B-R). Якщо КШ заплановане для хворого, який не отримує АСК, початок терапії АСК (100‑300 мг/добу) безпосередньо у преоперативному періоді (<24 год до початку втручання) не рекомендований (ІІІ: користь відсутня, B-R). Пацієнти, спрямовані на невідкладне КШ, мають припинити застосування клопідогрелю і тикагрелору принаймні за 24 год до операції для зменшення ймовірності великих кровотеч (І, B-NR). Особам, яким виконують КШ, для зниження ризику кровотеч та потреби в переливанні крові варто припинити використовувати інгібітори рецепторів глікопротеїну IIb/IIIa швидкої дії (ептифібатид і тирофібан) за 4 год та абциксимабу за 12 год до початку втручання (І, B-NR).
Якщо у пацієнта заплановане проведення КШ, а він приймає інгібітор рецепторів P2Y12, доцільно припинити застосування клопідогрелю за п’ять днів, тикагрелору – за три дні, а прасугрелу – за сім днів до операції для зниження ризику великих кровотеч та переливання препаратів крові (ІІa, B-NR).
Бета-блокатори та аміодарон
У пацієнтів, яким проводять КШ і котрі не мають протипоказань для призначення β-блокаторів, застосування цих лікарських засобів перед втручанням може бути корисним для зниження частоти виникнення післяопераційної ФП (ІІa, B-R), ризику госпітальної смерті та летальності протягом 30 днів після інтервенції (ІІb, B-NR). Для зниження частоти виникнення післяопераційної ФП перед операцією ймовірно доцільним є застосування аміодарону (ІІa, B-R).
Фармакотерапія після коронарної реваскуляризації
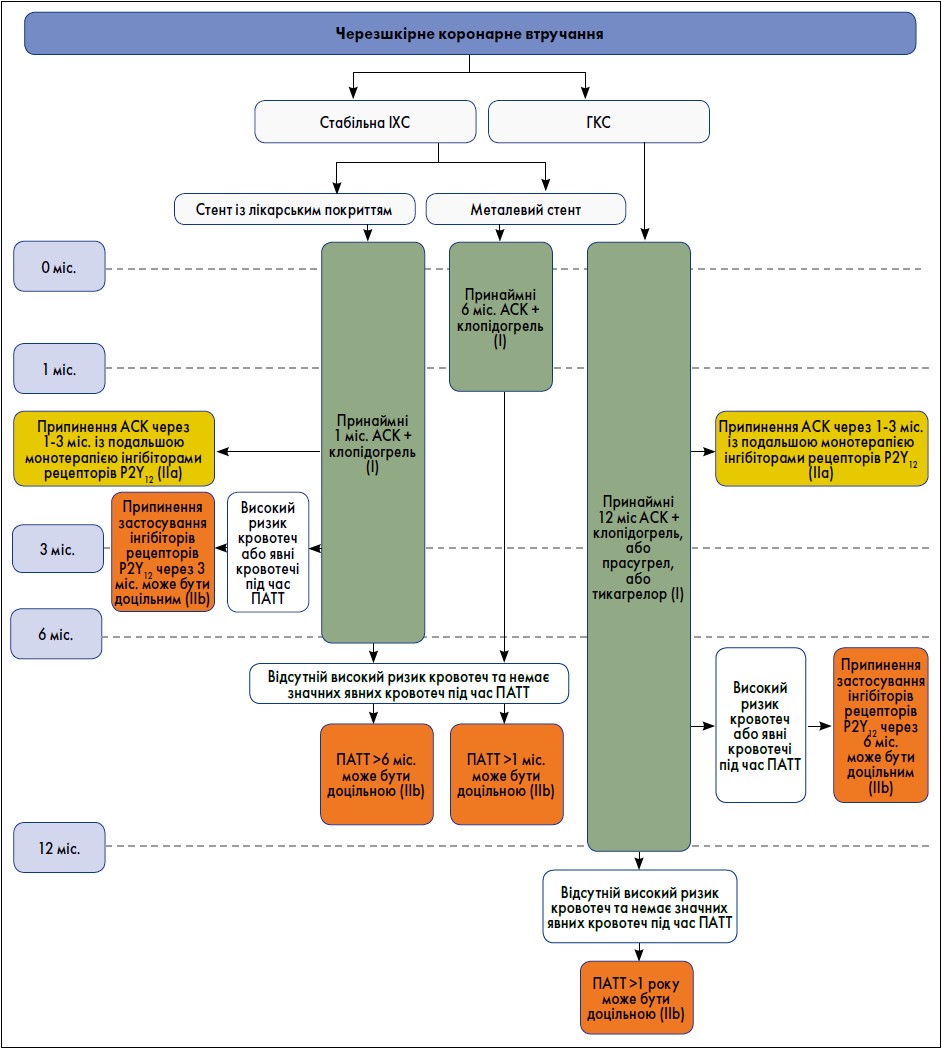
Пацієнти, яким проводять коронарну реваскуляризацію, потребують агресивних заходів вторинної профілактики. Це, зокрема, зміни способу життя та медикаментозний контроль рівня холестерину, цукру крові й артеріального тиску, а також застосування антитромботичної терапії (рисунок).
Рисунок. ПАТТ у пацієнтів, які перенесли ЧКВ
Антитромботична терапія після КШ
У пацієнтів після КШ застосування АСК (100‑325 мг/добу) слід розпочати протягом 6 год після операції та продовжувати без обмеження тривалості курсу з метою зниження ризику змикання судинного шунта та небажаних СС-подій (І, A). У деяких хворих із метою поліпшення прохідності венозного шунта доцільною може бути ПАТТ: АСК + тикагрелор або клопідогрель протягом одного року (ІІb, B-R).
Застосування бета-блокаторів після КШ
У 18% осіб, які перенесли КШ, виникає ФП та в чотири рази зростає ризик інсульту. Для зниження частоти постоперативної ФП або її наслідків у пацієнтів, які перенесли КШ, терапію β-блокаторами треба розпочинати якомога раніше (І, B-R).
Потрійна пероральна антикоагулянтна терапія після ЧКВ
Пацієнтам із ФП, які перенесли ЧКВ та отримують потрійну пероральну антикоагулянтну терапію, для зниження ризику кровотеч рекомендовано припинити приймання АСК через 1‑4 тижні після процедури та продовжити застосовувати інгібітор рецепторів P2Y12 разом із прямим оральним антикоагулянтом (ПОАК), як-от ривароксабан, дабігатран, апіксабан, едоксабан, або варфарином (І, B-R). Особам із ФП, котрі перенесли ЧКВ та використовують пероральний антикоагулянт, а також ПАТТ або монотерапію інгібітором рецепторів P2Y12, для зменшення ймовірності кровотеч доцільно надати перевагу ПОАК порівняно із варфарином (ІІa, B-R).
Підготувала Тетяна Ткаченко
Оригінальний текст документа читайте на сайті www.ahajournals.org