5 січня, 2021
Роль пробіотичної підтримки при лікуванні псоріазу й атопічного дерматиту
 Останнім часом зріс інтерес до вивчення мікробіому людини, котрий сформувався в результаті тривалої коеволюції з мікробною спільнотою. Цей унікальний мікробний орган має складну структуру, що функціонує у взаємній згоді з усіма іншими органами та системами організму, утворюючи єдину надорганізмову систему [3]. Більшість (3/4) мікробіому становлять Firmicutes і Bacteroides [11], вони виконують важливі метаболічні й фізіологічні функції людини та сприяють гомеостазу протягом життя.
Останнім часом зріс інтерес до вивчення мікробіому людини, котрий сформувався в результаті тривалої коеволюції з мікробною спільнотою. Цей унікальний мікробний орган має складну структуру, що функціонує у взаємній згоді з усіма іншими органами та системами організму, утворюючи єдину надорганізмову систему [3]. Більшість (3/4) мікробіому становлять Firmicutes і Bacteroides [11], вони виконують важливі метаболічні й фізіологічні функції людини та сприяють гомеостазу протягом життя.
Мікробіом і мікробіота
Усі біотопи тіла людини (ротова порожнина, волосся, ніс, вуха, сечостатеві шляхи, шкіра, очі, шлунково-кишковий тракт, бронхолегенева система) містять власний унікальний специфічний складний мікробний комплекс, який складається зі спеціалізованих мікробів із різними функціями. Групу коменсалів, симбіотичних і патогенних мікроорганізмів, які перебувають у фіксованому середовищі й підтримують біохімічний, метаболічний та імунний баланси макроорганізму, описує поняття «мікробіота» [2]. Зокрема, мікробіота кишечнику – це величезна колекція бактерій, вірусів, грибків і найпростіших, які колонізують шлунково-кишковий тракт [16]. Ця колекція мікробів перевищує кількість клітин людини в 10 разів і містить генетичний матеріал у 150 разів більший, аніж власна каріосома людини [39].
Механізм впливу мікробіоти на імунну систему людини
Вважають, що збільшення поширеності алергічних захворювань зумовлено зниженням стійкості імунного гомеостазу, а не надмірною реакцією на нешкідливі екологічні сигнали [18]. Згідно з цією теорією, внесок мікробіому кишечнику в імунний гомеостаз погіршується внаслідок типової західної дієти.
Імунний гомеостаз починає формуватися на ранніх етапах життя через вплив материнської мікробіоти, а кишкова флора немовляти отримує подальший розвиток завдяки впливу грудного молока, іншої їжі та мікробів довкілля [6].
Метаболіти, що виробляються кишковим мікробіомом, мають імуномодифікувальний потенціал, здатний змінити баланс між імунною толерантністю та запаленням через їхній вплив на диференціацію наївних Т‑клітин як у регуляторні, так і в лінії Th17.
Коменсальні бактерії забезпечують діяльність імунної системи кишечнику завдяки специфічним взаємодіям між бактеріальними антигенами та Toll-подібними рецепторами (Toll-like receptors – TLR) [19]. Наприклад, мікроби в кишечнику є джерелом пептидоглікану, здатного змінювати експресію TLR на поверхні багатьох клітин вродженої імунної системи. TLR розпізнають молекулярні структури, пов’язані з патогенами, та запускають каскади подій, які пов’язують вроджену імунну систему з адаптивною шляхом активації сигнального шляху ядерного фактора каппа B (NF‑κB). Внесок мікробіому кишечнику в адаптивну імунну систему включає індукцію імуноглобуліну А й підтримку гомеостазу між ефекторними хелперними (Th1, Th2 та Th17) і регуляторними Т‑клітинами [19].
Надмірне зростання кишкової мікрофлори призводить до утворення токсичних метаболітів, які можуть травмувати ентероцити, підвищити проникність кишечнику та зрештою спричинити системне запалення [7].
 Низький уміст клітковини та високий уміст жиру, характерні для західної дієти, принципово змінюють мікробіом кишечнику, що призводить до недостатнього вироблення імуномодулювальних метаболітів, особливо коротколанцюгових жирних кислот. Останні відомі своїми протизапальними ефектами, опосередкованими рецептором, зчепленим із G‑білками, та внеском у цілісність епітеліального бар’єра [21].
Низький уміст клітковини та високий уміст жиру, характерні для західної дієти, принципово змінюють мікробіом кишечнику, що призводить до недостатнього вироблення імуномодулювальних метаболітів, особливо коротколанцюгових жирних кислот. Останні відомі своїми протизапальними ефектами, опосередкованими рецептором, зчепленим із G‑білками, та внеском у цілісність епітеліального бар’єра [21].
Протизапальна активність додатково опосередковується регуляторними Т‑клітинами й зумовлюється трансформувальним фактором росту-β (TGF-β) та/або інтерлейкіном‑10 (IL‑10). Останній виконує інгібувальну функцію, індукуючи TGF-β й інші цитокіни, а також супресивні сигнальні молекули, включно з CTLA‑4 та PD‑1. Отже, внаслідок зміни мікробіому кишечнику відзначається зниження місцевої та системної імунної толерантності [33].
Вісь «кишечник – мозок»
Проведено багато досліджень із вивчення інтегративних зв’язків між кишечником і нервовою системою. Ці складні взаємозв’язки дістали назву осі «кишечник – мозок» [8, 26].
Механізми, що лежать в основі зазначеної осі, опосередковуються нейро-імуно-ендокринними медіаторами, й ця двонаправлена мережа зв’язку включає центральну нервову систему (ЦНС), спинний мозок, вегетативну та кишкову нервові системи, гіпоталамо-гіпофізарно-надниркову вісь (ГГНВ).
Вегетативна нервова система керує як аферентними сигналами, що виникають із просвіту кишечнику та передаються до ЦНС, так і еферентними сигналами від ЦНС до кишечнику.
ГГНВ вважається основною еферентною віссю, котра координує адаптаційні реакції організму у відповідь на стресові фактори будь-якого виду [36]. Це частина лімбічної системи, що переважно бере участь у забезпеченні реакцій, пов’язаних із пам’яттю й емоціями. Фактори зовнішнього середовища, а також зростання рівня прозапальних цитокінів, активують цю систему, й вона через секрецію в гіпоталамусі кортикотропін-рилізинг-фактора стимулює продукцію в гіпофізі адренокортикотропного гормона, що, своєю чергою, зумовлює вивільнення кортизолу з надниркових залоз. Кортизол є основним гормоном стресу, котрий впливає на органи та системи людини, включаючи мозок. Отож як нервові, так і гормональні ланки забезпечують регуляцію мозком діяльності функціональних ефекторних клітин кишечнику, таких як імунні, епітеліальні клітини, ентеральні нейрони, клітини непосмугованих м’язів, інтерстиційні клітини Кахаля й ентерохромафінні клітини. Ці самі клітини перебувають також під впливом мікробіоти кишечнику [22].
Встановлено, що відсутність мікробної колонізації призводить до зміни експресії й обміну нейромедіаторів в ентеральній і центральній нервових системах, а також до зміни сенсорно-моторних функцій кишечнику, затримці спорожнення шлунка та кишкового транзиту, збільшення розмірів сліпої кишки. Нервово-м’язові порушення асоціювалися зі зниженням експресії генів ферментів, які беруть участь у синтезі та транспорті нейромедіаторів, а також м’язових скорочувальних білків [14].
Виявлено взаємозв’язок між профілем кишкової мікрофлори та тривожно-депресивними розладами: бактерії роду Alistipes були надлишково представлені на тлі стресу, депресії, тривоги, а бактерії роду Oscillobacter, які продукують валеріанову кислоту, переважали в профілі кишкової мікробіоти лише в пацієнтів із депресією. Показово, що валеріанова кислота мікробного походження, конкурентно зв’язуючись із ГАМК‑рецепторами, підсилює дисбаланс у ГАМК‑ергічній системі головного мозку, що характерний для пацієнтів із депресією [1]. Експресія нейропептиду субстанції Р, що викликає запальні сигнали, спостерігається в разі як вульгарних вугрів, так і дисбактеріозу кишечнику [24].
Вважають, що коли пробіотик, потрапляючи в організм людини, викликає позитивні зміни в емоційній і когнітивній сферах, доцільно використовувати поняття «психобіотик». Це стосується й використання пробіотиків у здорових людей. Психологічні стресори змушують кишкову флору виробляти різні нейромедіатори (серотонін, норадреналін та ацетилхолін) або запускають ентероендокринні клітини, що вивільняють нейропептиди.
Передусім до психобіотиків відносять біфідобактерії та лактобацили, котрі завдяки метаболізму клітковини продукують ГАМК. Пропонується включати до психобіотиків і пребіотики [29].
Проте члени сімейства Bacillus здатні продукувати дофамін і норадреналін, сімейства Enterococcus і Streptococcus – серотонін. Указані нейромедіатори не лише підвищують проникність кишечнику, що призводить як до кишкового, так і до системного запалення, а й безпосередньо отримують доступ до кровообігу через порушений кишковий бар’єр, що зумовлює системні ефекти [17].
За результатами експериментальних досліджень встановлено, що блукальний нерв опосередковує взаємозв’язок між психобіотиками та їхніми психофізіологічними ефектами [29].
Вісь «кишечник – шкіра»
Активно вивчається останнім часом роль мікроорганізмів шкіри в підтримці здоров’я та розвитку захворювань [20, 30]. Доведено, що бактерії шкіри та кишечнику є життєво важливими для імунологічної, гормональної та метаболічної рівноваги організму людини [13, 31].
Є кілька механізмів, завдяки котрим порушений мікробіом кишечнику призводить до порушення функцій шкіри. Встановлено, що метаболіти, котрі продукуються мікробіотою кишечнику, регулюють клітинну проліферацію, ліпідний обмін та інші метаболічні функції, опосередковані шляхом mTOR. Своєю чергою, шлях mTOR може впливати на склад мікробіоти кишечнику через регуляцію кишкового бар’єра.
Доведено, що кишковий бар’єр відіграє важливу роль у підтримці здоров’я людини. Низка бактерій, включно з патогенними та коменсалами, різними шляхами впливають на його функції. При порушенні складу мікробіоти кишечнику та цілісності кишкового бар’єра цей двонаправлений взаємозв’язок може призвести до метаболічного запалення. Порушення роботи кишкового бар’єра спричиняє проникнення погано перетравленої їжі, мікробів і токсинів у кровообіг, які досягають тканин-мішеней, включаючи шкіру, де зумовлюють імунні відповіді Th2, що призводить до подальшого пошкодження тканин [35].
Роль порушень мікробіоти у виникненні атопічного дерматиту та псоріазу
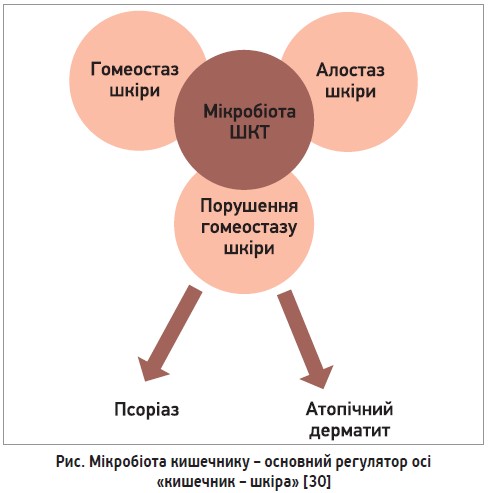 На рисунку показано роль порушень мікробіоти кишечнику в розвитку захворювань шкіри. Однією з причин виникнення атопічного дерматиту є порушення бар’єрних функцій шкіри [15, 28]. Це може бути зумовлено втратою функціональних мутацій у гені FLG, що кодує філагрин (структурний білок шкіри, від англ. filament aggregating protein), який відіграє важливу роль у підтримці епідермального гомеостазу, допомагаючи утримувати воду. Мутації в гені FLG надзвичайно поширені, трапляються приблизно в 9% осіб європейської популяції.
На рисунку показано роль порушень мікробіоти кишечнику в розвитку захворювань шкіри. Однією з причин виникнення атопічного дерматиту є порушення бар’єрних функцій шкіри [15, 28]. Це може бути зумовлено втратою функціональних мутацій у гені FLG, що кодує філагрин (структурний білок шкіри, від англ. filament aggregating protein), який відіграє важливу роль у підтримці епідермального гомеостазу, допомагаючи утримувати воду. Мутації в гені FLG надзвичайно поширені, трапляються приблизно в 9% осіб європейської популяції.
Як відомо, філагрин специфічно взаємодіє з кератином й іншими проміжними білками – філаментами кератинового цитоскелета, утворюючи тісні зв’язки між цими волокнами. Відбуваються колапс і сплощення клітин на поверхні рогового шару з утворенням лусочок. У верхній частині рогового шару філагрин розпадається на окремі амінокислоти, він містить велику кількість гістидину, що метаболізується в транс-уроканінову та піролідон‑5-карбонову кислоти; ці органічні кислоти допомагають підтримувати в епідермісі необхідний рівень рН. Філагрин перебуває на передній лінії захисту й захищає організм від потрапляння зовнішніх речовин навколишнього середовища, котрі в іншому випадку можуть спричиняти аномальні імунні реакції.
Втрата експресії філагрину призводить до посилення черезшкірної передачі алергенів. Було показано, що майже в 50% усіх тяжких випадків екземи може бути щонайменше один мутантний ген філагрину. У гострій стадії алергени, порушуючи дисфункціональний шкірний бар’єр, спричиняють вивільнення кератиноцитами цитокінів, таких як тимічний стромальний лімфопротеїн (TSLP), IL‑33 та IL‑25. Останні, своєю чергою, активують вроджені лімфоїдні клітини 2 типу шляхом їх взаємодії з IL‑17B та IL‑1RL1 відповідно, що призводить до продукування IL‑13 та IL‑5, які потім стимулюватимуть Th2-відповідь імунної системи. Активація клітин Th2 додатково посилюється за допомогою TSLP‑опосередкованого дозрівання клітин Лангерганса та дендритних клітин CD11с. На хронічній стадії IL‑22, що виділяється з клітин Th22, зумовлює епідермальне продукування протимікробних пептидів, включаючи дефензини, що можуть брати участь у перекосі імунної відповіді на бажанішу відповідь Th1.
У разі псоріазу відзначають зменшення кількості бактерій-симбіонтів, включно з Bifidobacteria, Lactobacilli та Faecalibacterium prausnitzii, а також колонізацію кишечнику певними патогенними мікроорганізмами, як-от Salmonella, Escherichia coli, Helicobacter, Campylobacter, Mycobacterium, Alcaligenes. Зменшення фізіологічної мікробіоти призводить до функціональних наслідків, включаючи порушення регуляції кишкової імунної відповіді, що може вплинути на віддалені системи органів [5, 32].
Доведено, що клітини Th17 та їхні цитокіни відіграють основну роль у розвитку псоріазу, але також беруть участь у патофізіології синдрому подразненого кишечнику [12, 37]. Також ця підмножина клітин має значення в розвитку анкілозивного спондиліту та ревматоїдного артриту, котрі часто відзначаються в пацієнтів із псоріазом і синдромом подразненого кишечнику [40]. Із крові хворих на активний псоріаз виділено ДНК кишкового мікробного походження [25].
На мікробіом кишечнику значний вплив має дієта. Різка її модуляція протягом короткого терміну може швидко змінити також кишкові бактерії. Це дає змогу штучно модифікувати мікробіом із терапевтичною метою. Тому додаткове введення живих корисних пробіотичних бактерій кишечнику має перспективну роль у профілактиці та лікуванні різних шкірних захворювань.
Відновлення цілісності та герметичності кишкового бар’єра пов’язують з особливими центральними ефектами пробіотичних видів. Зокрема, застосування пробіотичних штамів Lactobacillus helveticus R0052 та Bifidobacterium longum R0175 відновлювало щільне з’єднання й цілісність бар’єра, ослаблювало активність осі ГГНВ та вегетативної нервової системи. Пробіотики також запобігали змінам у нейрогенезі гіпокампа й експресії генів гіпоталамусу, що беруть участь у синаптичній пластичності [4].
Певні мікроби також можуть сприяти функції кишкового епітеліального бар’єра за допомогою «перехресних переговорів» з елементами імунітету слизової оболонки [34]. Наприклад, Lactobacillus LGG секретує p40 – білок, здатний пригнічувати опосередкований цитокінами апоптоз і порушення епітеліального бар’єра. Lactobacillus rhamnosus підвищує експресію муцину в клітинах кишечнику та посилює кишковий слизовий бар’єр [41].
За результатами подвійного сліпого плацебо-контрольованого рандомізованого дослідження в дорослих пацієнтів з атопічним дерматитом встановлено, що використання комбінації пробіотиків Lactobacillus paracasei Lpc‑37, Lactobacillus acidophilus 74-2 та Bifidobacterium animalis subsp. Lactis DGCC42 протягом 8 тиж асоціювалося зі зменшенням SCORAD. Збільшилася кількість L. paracasei та B. lactis, виділених із фекалій пацієнтів з атопічним дерматитом [27]. Схожі результати отримано при застосуванні Bifidobactrium breve.
Використання L. salivarius протягом 16 тиж у пацієнтів із середньою та тяжкою формами атопічного дерматиту поліпшувало SCORAD і значно знижувало вміст цитокінів Th1, зокрема IL‑12, інтерферону-γ та співвідношення Th1/Th2 (IL‑12, IFN-γ/IL‑4, IL‑5) [10]. Відзначено значне зменшення стафілококів у фекаліях пацієнтів, які приймали пробіотики.
Введення пробіотичного штаму Lactobacillus pentosus GMNL‑77 пригнічувало експресію фактора некрозу пухлини (TNF), IL‑6 і прозапальних цитокінів у осі цитокінів IL‑23/IL‑17 через інгібування дендритних клітин CD103+, кишкових антигенопрезентувальних клітин, які модулюють регуляторні Т‑клітини в шлунково-кишковому тракті. Також ця пробіотична бактерія суттєво зменшувала прояви еритеми, лущення та потовщення епідермісу в мишей з експериментальним псоріазом [9].
Згідно з результатами плацебо-контрольованого дослідження за участю пацієнтів із псоріазом, додаткове введення Bifidobacterium infantis 35624 сприяло значному зниженню рівня TNF у плазмі порівняно з групою плацебо [23]. У пацієнтів із пустульозним псоріазом, резистентним до терапії стероїдами та метотрексатом, після початку прийому Lactobacillus sporogenes 3 рази на день спостерігалося значне клінічне поліпшення протягом 2 тиж із майже повною ремісією через 4 тиж [38].
Компанія «Фармак» створила дієтичну добавку Лактіалє® Мульті, в одній капсулі котрої міститься сумарно 2,0×109 колонієутворювальних одиниць пробіотичних мікроорганізмів: 7 різних штамів лактобацил (L. casei, L. plantarum, L. rhamnosus, L. acidophilus, L. delbrueckii ssp. bulgaricus, L. helveticus, L. salivarius), 4 різні штами біфідобактерій (B. bifidum, B. breve, B. longum, B. infantis), а також Bacillus subtilis, Lactococcus lactis ssp. lactis, Streptococcus thermophilus. Штами цієї дієтичної добавки є важливими для підтримки кишкового бар’єра та забезпечення протизапальних ефектів імунної системи.
Отже, нові терапевтичні стратегії лікування та профілактики таких захворювань шкіри, як атопічний дерматит і псоріаз, мають ґрунтуватися на пробіотичній модуляції мікробіоти кишечнику для забезпечення протизапальної й імуномодулювальної дій. Із погляду фармакоекономіки для реалізації цієї мети можна рекомендувати дієтичну добавку – психобіотик Лактіалє® Мульті, що містить штами основних пробіотичних бактерій із доведеною ефективністю.
Список літератури знаходиться в редакції.
Медична газета «Здоров’я України 21 сторіччя» № 22 (491), 2020 р.



