27 грудня, 2020
Інсулінотерапія: практичні аспекти оновлених світових рекомендацій
Безперервне навчання фахівців зі сфери охорони здоров’я є однією з ключових передумов високої якості медичної допомоги. На тлі інформаційного перевантаження практикуючим лікарям інколи складно виокремити найбільш пріоритетні теми та авторитетні джерела, які б базувалися на принципах доказової медицини та були орієнтовані на реальну клінічну практику. 29 вересня 2020 року, за підтримки компанії «Санофі», пройшла конференція за участю ендокринологів, які працюють в амбулаторних і стаціонарних медичних закладах. Доповіді, що їх було заслухано на цьому заході, дали можливість його учасникам оновити свої знання щодо одного з найважливіших питань сучасної діабетології – інсулінотерапії (ІТ).
 Робота конференції розпочалася з виступу завідувачки кафедри ендокринології Вінницького національного медичного університету ім. М.І. Пирогова, доктора медичних наук, професора Марини Володимирівни Власенко, яка докладно розповіла про важливість правильної титрації дози інсуліну.
Робота конференції розпочалася з виступу завідувачки кафедри ендокринології Вінницького національного медичного університету ім. М.І. Пирогова, доктора медичних наук, професора Марини Володимирівни Власенко, яка докладно розповіла про важливість правильної титрації дози інсуліну.
Компенсація цукрового діабету (ЦД) сприяє покращенню якості життя пацієнтів завдяки не лише усуненню симптомів власне ЦД, але насамперед – запобіганню багатьох ускладнень, зокрема мікро- та макроваскулярних. Так, досягнення рівня глікозильованого гемоглобіну (HbA1c) <7% дає можливість знизити ризик серцево-судинних ускладнень на 84%, цереброваскулярних порушень – на 86%, нефропатії – на 83%, ретинопатії – на 87%, а частоту ампутацій – на 50% (Kayar Y. et al., 2017).
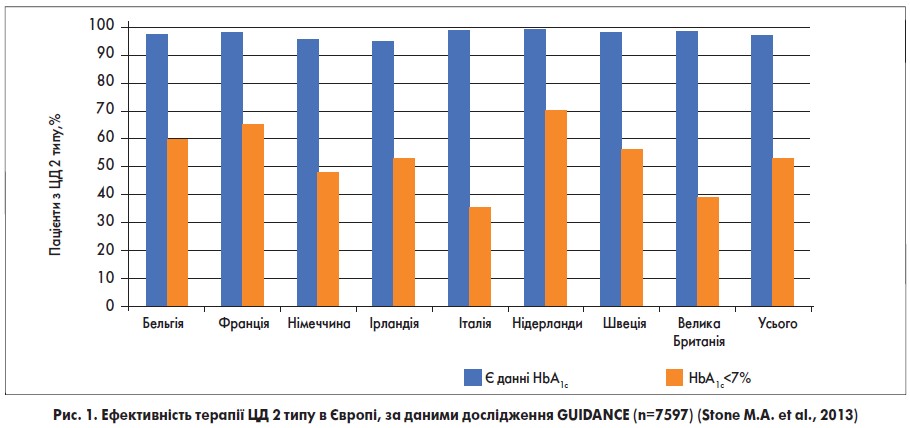
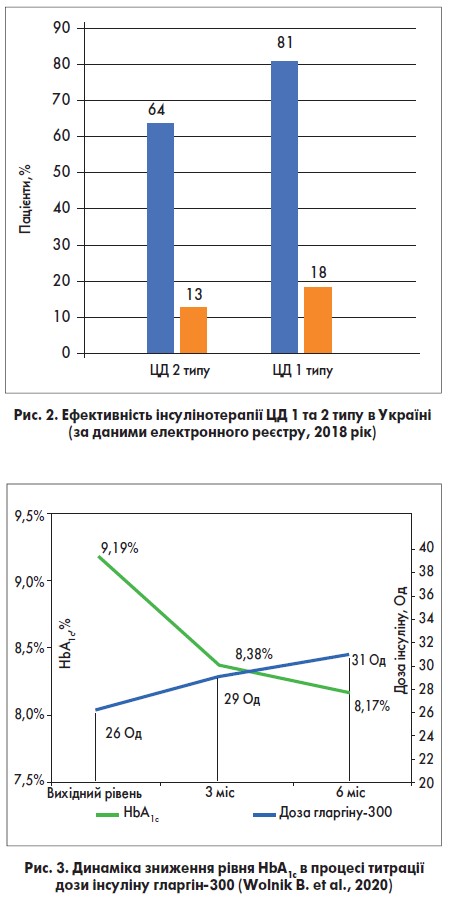
На жаль, в Україні частота компенсації ЦД залишається вкрай низькою; у той час як у країнах Європи рівня HbA1c <7% досягає 54% пацієнтів, в Україні – лише 13-18%. Ба більше, у нас значний відсоток хворих на ЦД просто не контролюють рівень HbA1c, навіть під час ІТ. Порівняльні дані, які відображають ситуацію з контролем діабету в країнах Європи та Україні, відображені на рисунках 1 та 2.
 Однією з причин назадовільного контролю ЦД є недостатня титрація дози інсуліну. Це може бути пов’язано як із низькою прихильністю пацієнта до лікування, так і з недостатнім розумінням лікарями важливості та практичних аспектів даного етапу ІТ.
Однією з причин назадовільного контролю ЦД є недостатня титрація дози інсуліну. Це може бути пов’язано як із низькою прихильністю пацієнта до лікування, так і з недостатнім розумінням лікарями важливості та практичних аспектів даного етапу ІТ.
А тим часом, підкреслила професор М.В. Власенко, навіть помірна титрація дози інсуліну значно знижує рівень HbA1с. У мультицентровому проспективному обсерваційному дослідженні з вивчення ефективності інсуліну гларгін‑300 у 469 пацієнтів із неконтрольованим ЦД 2 типу чи епізодами гіпоглікемії на інсулінах НПХ було показано, що навіть при незначній титрації дози гларгіну‑300 вже через 3 міс середнє значення HbA1c знижувалося на 0,77%, а через півроку – на 1,01%. Залежність між титрацією дози інсуліну та показником HbA1c показана на рисунку 3.
Безперечна важливість титрації зумовлює потребу в розумінні її алгоритму всіма лікарями, які ведуть пацієнтів із ЦД і в стаціонарі, і на амбулаторному етапі, адже саме там, в умовах скорочень об’ємів стаціонарної допомоги, в основному відбувається даний етап ведення пацієнтів із ЦД.
.jpg) ІТ є тим особливим видом лікування, що складається з послідовних взаємопов’язаних між собою етапів, розуміння кожного з яких забезпечує кінцевий результат лікування. Свою доповідь керівниця відділу вікової ендокринології і клінічної фармакології ДУ «Інститут ендокринології і обміну речовин ім. В.П. Комісаренка НАМН України» (м. Київ), доктор медичних наук Олеся Вадимівна Зінич присвятила основним практичним аспектам кожного зі згаданих етапів.
ІТ є тим особливим видом лікування, що складається з послідовних взаємопов’язаних між собою етапів, розуміння кожного з яких забезпечує кінцевий результат лікування. Свою доповідь керівниця відділу вікової ендокринології і клінічної фармакології ДУ «Інститут ендокринології і обміну речовин ім. В.П. Комісаренка НАМН України» (м. Київ), доктор медичних наук Олеся Вадимівна Зінич присвятила основним практичним аспектам кожного зі згаданих етапів.
Є 5 основних кроків ІТ: визначення цілі лікування, вибір інсуліну, ініціація, титрація та інтенсифікація.
І етап. Визначення глікемічних цілей
Метою лікування є встановлення цільового показника HbA1c, з огляду на індивідуальні особливості кожного пацієнта. Для більшості хворих на ЦД цей показник становитиме менше 7%. Варіації цільового рівня HbA1c залежно від віку, анамнезу та супутнього лікування відображені в таблиці 1.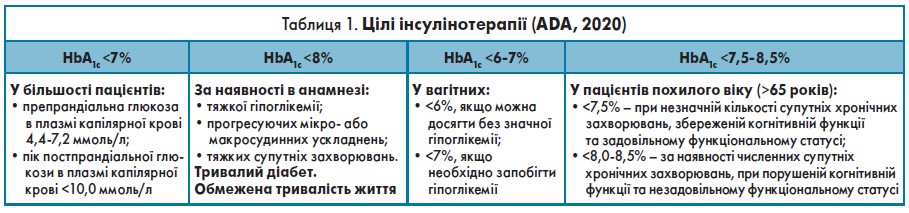
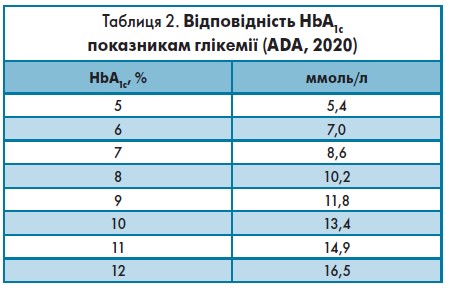 Часто пацієнти не розуміють, при яких рівнях цукру в крові показник HbA1c дорівнює цільовому, тобто <7%. Цього можна досягти тоді, коли препрандіальна глюкоза в плазмі капілярної крові коливається в межах 4,4-7,2 ммоль/л, а пік постпрандіальної глюкози в плазмі капілярної крові становить <10,0 ммоль/л. Оскільки пацієнт корегує дози інсуліну за показниками глюкози крові, лікарі мають інформувати пацієнта про цільові для нього рівні глюкози натще (ГН) та після їжі. Відповідність рівня HbA1c показникам глікемії відображено в таблиці 2.
Часто пацієнти не розуміють, при яких рівнях цукру в крові показник HbA1c дорівнює цільовому, тобто <7%. Цього можна досягти тоді, коли препрандіальна глюкоза в плазмі капілярної крові коливається в межах 4,4-7,2 ммоль/л, а пік постпрандіальної глюкози в плазмі капілярної крові становить <10,0 ммоль/л. Оскільки пацієнт корегує дози інсуліну за показниками глюкози крові, лікарі мають інформувати пацієнта про цільові для нього рівні глюкози натще (ГН) та після їжі. Відповідність рівня HbA1c показникам глікемії відображено в таблиці 2.
Після встановлення цілі лікування та пояснення її пацієнту переходять до наступного етапу ІТ.
ІІ етап. Вибір інсуліну
 Безумовно, будь-який інсулін має відповідати вимогам з якості, які включають чистоту, стабільність та дотримання умов зберігання. Крім того, кожен фахівець мусить обрати найефективніший та найбезпечніший препарат, що неможливо без розуміння його фармакокінетики та фармакодинаміки.
Безумовно, будь-який інсулін має відповідати вимогам з якості, які включають чистоту, стабільність та дотримання умов зберігання. Крім того, кожен фахівець мусить обрати найефективніший та найбезпечніший препарат, що неможливо без розуміння його фармакокінетики та фармакодинаміки.
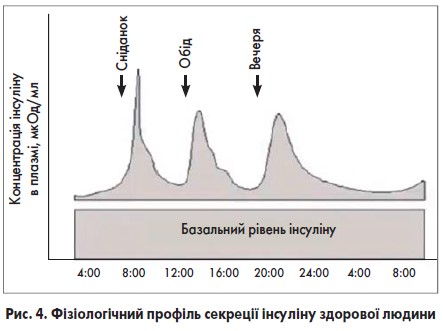
Для оцінки фармакодинаміки та розуміння дії різних препаратів інсуліну варто згадати фізіологічний профіль секреції інсуліну здорової людини (рис. 4).
Профілі дії препаратів інсуліну, доступних на фармацевтичному ринку, відображені на рисунку 5.
Як можна пересвідчитися, аналоги інсуліну діють більш фізіологічно, якщо порівняти з інсулінами людини.
Основним параметром, який забезпечує якість життя та прихильність пацієнтів до ІТ, є частота гіпоглікемій. Найбільш оптимальний профіль безпеки стосовно даного параметру мають базальні аналоги інсуліну ІІ покоління – гларгін‑300 та деглюдек‑100, їхні профілі та тривалість дії представлені на рисунку 6 (Garber A.J. et al., 2012; Zinman B. et al., 2012; Gough S.C. et al., 2013; Meneghini L. et al., 2013; Onishi Y. et al., 2013; Riddle M.C. et al., 2014; Yki-Järvinen H. et al., 2015; Bolli G.B. et al., 2015.)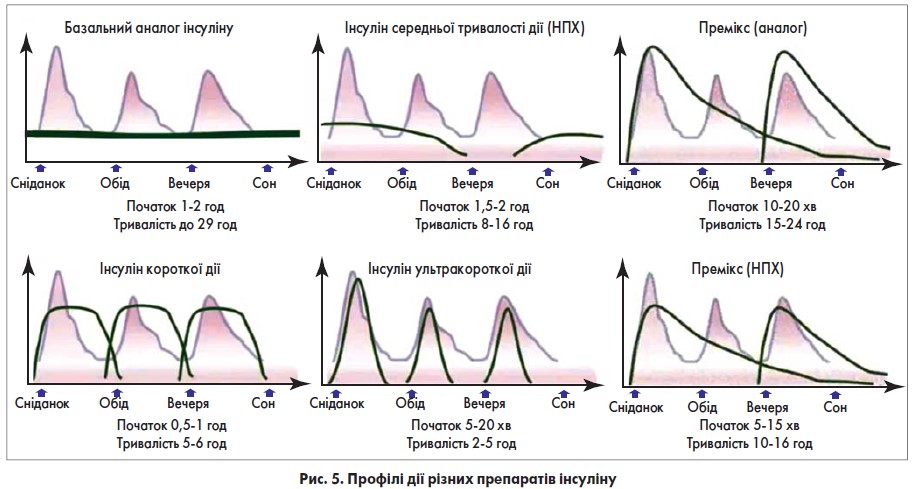
За результатами рандомізованого прямого порівняльного дослідження BRIGHT протягом перших 12 тиж лікування (період титрації) кількість підтверджених випадків гіпоглікемії в групі Gla‑300 була меншою, ніж у групі Ideg‑100. Протягом 13-24 тиж лікування частота гіпоглікемій була однакова в обох групах.
Саме тому використання базального аналогу інсуліну не лише дає можливість ефективно досягти цілей терапії, але й робить це безпечно, гарантуючи низький ризик гіпоглікемій, що, своєю чергою, покращує комплаєнс.
ІІІ етап. Ініціація базального інсуліну
Правильний вибір стартової дози інсуліну дозволяє прискорити досягнення глікемічних цілей.
Вибір початкової дози базального інсуліну залежить від виду інсуліну та клінічної ситауції та коливається від фіксованих 10 Од/добу до індивідуального призначення дози з розрахунку на масу тіла пацієнта, а саме 0,1-0,2-0,4 Од/кг/добу.
ІV етап. Титрація дози інсуліну
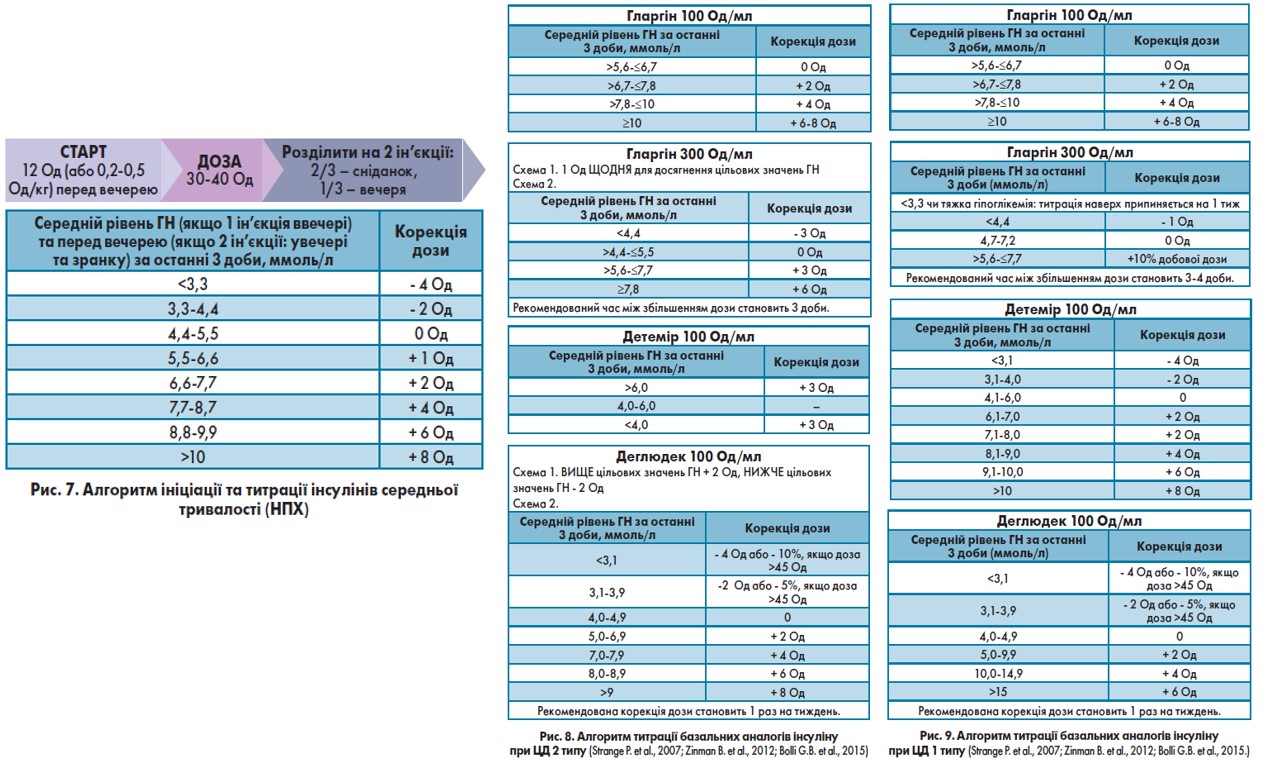
Алгоритм титрації при використанні базальних інсулінів відображений на рисунках 7-9.
 Переведення пацієнтів з інших інсулінів на гларгін 300 Од/мл проводять таким чином:
Переведення пацієнтів з інших інсулінів на гларгін 300 Од/мл проводять таким чином:
- Переведення з аналогу інсуліну: конверсія 1:1.
- Переведення з НПХ (2 р./день): 20% від добової дози базального інсуліну (при декомпенсації конверсія 1:1).
- При переведенні з інсуліну гларгін 300 Од/мл на інсулін гларгін 100 Од/мл знизити дозу на 20% для зменшення ризику виникнення гіпоглікемії.
Титрація двофазного аналогу інсуліну відбувається за алгоритмом, який представлено в таблиці 3.
Саме титрація дає можливість досягнути належного контролю ЦД та запобігти розвитку хронічних ускладнень і знизити рівень смертності.
V етап. Інтенсифікація
Перед початком даного етапу потрібно оцінити, чи насправді в пацієнта зросла потреба в підвищенні дози інсуліну, адже часто неналежний контроль глікемії може бути пов’язаний із супутніми захворюваннями, порушенням техніки ін’єкцій, недотриманням умов зберігання інсуліну та прийомом алкоголю.
Варто пам’ятати про те, що потреба в інсуліні зростає прямо пропорційно зі стажем захворювання. Якщо при дебюті хвороби контроль досягається на дозі 0,5-0,6 Од/кг, то при тривалому (довше 5 років) ЦД потреба зростає до 0,7-1 Од/кг, а при декомпенсації – до 1,0-2,0 Од/кг.
Потреба в інсуліні також підвищується за таких умов:
- багата на жири дієта;
- бідна на харчові волокна їжа;
- іммобілізація;
- стрес (психічний, операційний, травматичний та ін.);
- інфекція (гостра, хронічна);
- підвищення рівня контрінсулярних гормонів (наприклад, при гіперкортицизмі);
- прийом препаратів із контрінсулярною дією (при бронхіальній астмі, захворюваннях сполучної тканини);
- статеве дозрівання;
- вагітність;
- гіперліпопротеїнемія (ожиріння);
- поява антитіл до інсуліну.
 З іншого боку, потреба в інсуліні знижується при:
З іншого боку, потреба в інсуліні знижується при:
- бідній на жири дієті;
- багатій на харчові волокна їжі;
- поліпшенні показників стану м’язевої системи;
- зниженні рівня контрінсулярних гормонів (наприклад, у разі недостатності наднирників);
- прогресуючій діабетичній нефропатії;
- зниженні швидкості деградації інсуліну (зокрема, патологія печінки).
За необхідності інтенсифікації потрібно розглянути потребу в прандіальному інсуліні. Це показано в разі недосягнення цільового рівня HbA1c при застосуванні базального інсуліну в дозі 0,5 Од/кг/добу та/або підвищенні HbA1c та/або постпрандіальної глікемії, незважаючи на досягнуті цільові показники глікемії натще, або якщо гіпоглікемія виникла при збільшенні дози базального інсуліну. Стартувати можна з 4 Од/добу або з 10% дози базального інсуліну (ADA, 2020).
Алгоритм визначення стартової дози та титрація дози інсуліну короткої/ультракороткої дії представлений на рисунку 10.
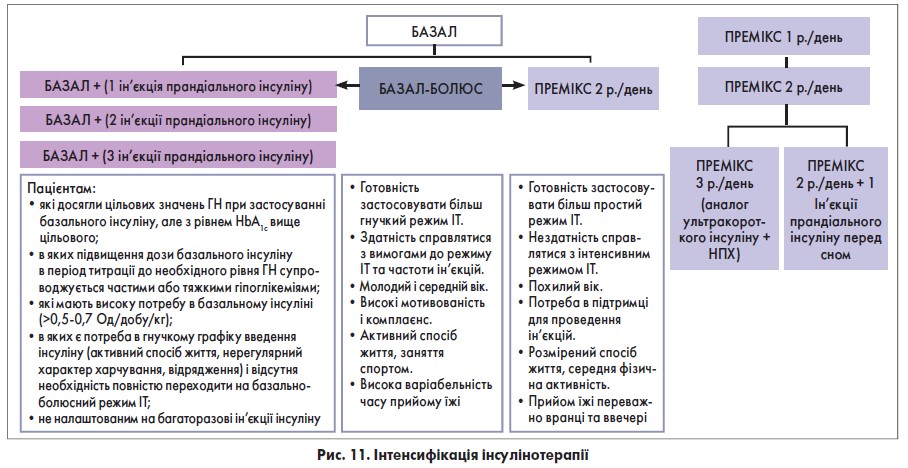
Загальний алгоритм етапу інтенсифікації представлено на рисунку 11.
 Практичну реалізацію основних етапів ІТ завідувачка відділу діагностики та лікування метаболічного синдрому ДНУ «Центр інноваційних медичних технологій НАН України», професор кафедри діабетології Національної медичної академії післядипломної освіти ім. П.Л. Шупика (м. Київ), доктор медичних наук Надія Миколаївна Жердьова продемонструвала учасникам конференції на прикладі реального клінічного випадку.
Практичну реалізацію основних етапів ІТ завідувачка відділу діагностики та лікування метаболічного синдрому ДНУ «Центр інноваційних медичних технологій НАН України», професор кафедри діабетології Національної медичної академії післядипломної освіти ім. П.Л. Шупика (м. Київ), доктор медичних наук Надія Миколаївна Жердьова продемонструвала учасникам конференції на прикладі реального клінічного випадку.
До клініки звернувся пацієнт, вік – 25 років, вага – 68 кг. Протягом останніх 15 років він хворіє на ЦД 1 типу. Періодично в нього розвиваються гіпоглікемії. Супутні захворювання включають діабетичну непроліферативну ретинопатію.
На момент звернення хворий дотримувався такого режиму ІТ:
- інсулін людини продовженої дії (НПХ) – 30 Од/добу (20 Од/ранок + 10 Од/вечір);
- інсулін людини короткої дії – 22 Од/добу (8 Од/сніданок, 6 Од/обід, 6 Од/вечеря).
Дані глікемічного профілю показали відсутність контролю ЦД:
- глюкоза плазми натще становила 15,4 ммоль/л;
- постпрандіальна глюкоза – 14,2 ммоль/л;
- HbA1c – 8,4%.
Крок 1-й. Поставити пацієнту глікемічні цілі
Оскільки наш пацієнт молодого віку і не має ані тяжких супутніх захворювань, ані ускладнень ЦД, ми ставимо йому глікемічні цілі такі самі, як для більшості пацієнтів: HbA1c <7%, глікемія плазми натще в межах 4,4-7,2 ммоль/л, а постпрандіальна глікемія <10,0 ммоль/л.
Крок 2-й. Обрати вид інсуліну
З огляду на те що пацієнт має неконтрольований перебіг діабету та схильний до гіпоглікемій, необхідно надавати перевагу базальним інсулінам, стабільним та з низьким ризиком гіпоглікемій. Встановлено, що аналоги інсуліну мають достовірно менший ризик виникнення гіпоглікемій проти інсулінів людини.
У дослідженні OneCare вперше порівнювали ефективність та безпеку двох базальних аналогів ІІ покоління – інсуліну гларгін‑300 та деглюдек‑100 при ЦД 1 типу на основі даних безперервного моніторингу концентрації глюкози в крові (СGM). Дослідження проводилося в умовах реальної практики за участю 199 дорослих пацієнтів із неконтрольованим перебігом діабету чи з гіпоглікемією на тлі ІТ базальними аналогами І покоління, яких переводили на гларгін‑300 чи деглюдек‑100 (Conget І. et al., 2020).
У результаті не було виявлено достовірної різниці в усіх параметрах глікемії за весь день (24 год) дослідження. Але при детальнішому аналізі було підтверджено, що застосування гларгіну‑300 при ЦД 1 типу збільшує час в цільовому діапазоні глікемії та зменшує час вище цільового діапазону вночі. Це призводить до достовірно нижчої частоти гіперглікемії (>13,8 ммоль/л) на гларгіні‑300 протягом нічного часу, якщо порівняти з деглюдеком‑100 (Conget І. et al., 2020).
Призначаючи пацієнтові інсулін короткої дії, ми маємо взяти до відома той факт, що 42% пацієнтів не дотримуються однакового режиму введення інсуліну короткої дії (Schaper N.S. et al., 2017):
- 58% приймають інсулін короткої дії тільки до їжі;
- 24% – під час чи після їжі;
- 18% – до, під час чи після їжі.
Саме тому необхідно обрати інсулін, який однаково ефективно знижував би глікемію незалежно від часу введення (до чи після їжі). Найбільш оптимальним із цього погляду є препарат ЕпайдраÒ®, який характеризується більш раннім початком дії та вираженішим піком концентрації, якщо порівняти з інсуліном аспарт, що відображено на рисунку 12 (Bolli G.B. et al., 2011).
Крім того, для оптимального цукрознижувального ефекту інсулін аспарт має застосовуватися до прийому їжі, що зменшує постпрандіальну глікемію на 22% краще, ніж у разі ін’єкції після їжі (Schaper N.S., 2017). Епайдра® ж однаково ефективно знижує рівень глікемії та HbA1c як до, так і після їжі (Bolli G.B. et al., 2011).
Саме з огляду на все вищезазначене, було вирішено перевести пацієнта на інсулін Тожео СолоСтар та інсулін Епайдра®.
Крок 3-й. Обрати стартову дозу інсулінів
Оскільки пацієнт отримував ін’єкції базального інсуліну двічі на добу, при переході на інсулін Тожео СолоСтар дозу необхідно знизити на 20%. Стартова доза Тожео СолоСтар:
30 Од/добу - 20% = 14 Од 1 раз на добу.
Стартова доза інсуліну Епайдра®:
Корекція ХО: 1-2 Од Епайдра® на кожну 1 ХО.
Корекція глікемії перед їжею: 1 Од Епайдра® на кожні «зайві» 2 ммоль/л глюкози.
Крок 4-й. Обрати схему титрації доз інсуліну
Титрація дози інсуліну має вирішальне значення для успішного досягнення цільового значення глікемії. Ранній початок зниження глікемії забезпечує кращі результати контролю в довгостроковій перспективі та знижує ускладнення з боку судин (Khunti K. et al., 2020).
Ключові вимоги до титрації дози інсуліну:
- Швидкий початок – одразу після ініціації базального інсуліну.
- Простота виконання.
- Мінімальний ризик гіпоглікемій.
- Обмежена тривалість (зазвичай 3 міс).
- Зниження HbA1c до цілього значення <7%.
Ми рекомендуємо пацієнту дуже просту схему титрації інсуліну Тожео СолоСтар: + 1 Од щодня до досягнення цільових рівнів ГН. Титрація вгору припиняється на 1 тиж при [глюкоза плазми натще] ГПН <3,3 ммоль/л чи тяжкій гіпоглікемії (Yale J.F., 2015).
Схема титрації інсуліну Епайдра® при ЦД 1 типу: підвищення дози на 1-2 Од або 10-15% двічі на тиждень до досягнення цільових значень постпрандіальної глікемії. У разі гіпоглікемії з’ясувати причину; якщо незрозуміло – знизити дозу на 10-20% (Корпачов В.В., 2001; ADA, 2018).
Крок 5-й. Контролювати терапію
Контроль терапії та вирішення питання про інтенсифікацію лікування має проводити лікар на основі даних самоконтролю глікемії пацієнтом, показника HbA1c та результатів об’єктивного дослідження. Пацієнт із ЦД 1 типу мусить самостійно проводити контроль глікемії протягом доби декілька разів (натще, через 2 год після сніданку, перед обідом, через 2 год після обіду, перед вечерею, через 2 год після вечері) та в разі появи симптомів гіпоглікемії. Кожні 3-6 міс необхідно контролювати рівень HbA1c. Відсутність досягнення індивідуальних цілей терапії на попередньому режимі ІТ протягом 3-6 міс є показанням до інтенсифікації/перегляду ІТ.
Зі змінами в медичній системі України виникла потреба і в модифікації підходу до ведення пацієнтів. Скорочення об’ємів стаціонарної допомоги підвищили відповідальність ендокринологів, які надають амбулаторну допомогу, за ефективність ІТ пацієнта з ЦД. Запорукою досягнення цілей лікування є вибір інсулінів, профіль дії яких максимально наближений до фізіологічної секреції інсуліну та супроводжується низькою добовою варіабельністю глікемії і, відповідно, меншим ризиком її виникнення.
Досягнення компенсації у хворих, з одного боку, мінімізує навантаження на лікаря, а з іншого – підвищує його професійний рівень, зміцнює авторитет серед пацієнтів і колег, а значить – сприяє емоційному задоволенню результатами своєї роботи (ADA, 2018).
Список літератури знаходиться в редакції.
Підготувала Ганна Кирпач
Тематичний номер «Діабетологія, Тиреоїдологія, Метаболічні розлади» № 3 (51) 2020 р.