27 грудня, 2020
Мітопротекторні клінічні стратегії в пацієнтів із цукровим діабетом 2 типу
Цукровий діабет (ЦД) 2 типу – системне захворювання, яке характеризується розвитком гіперглікемії, гіперліпідемії та резистентності організму до інсуліну. Такі патологічні зміни, як підвищення рівню глюкози в крові і використання енергетичного субстрату центральними й периферійними тканинами, зумовлює дисфункцію мітохондрій в різних органах.
Мітохондрія знаходиться на перетині критичних клітинних шляхів, таких як метаболізм енергетичного субстрату, генерація активних форм кисню (АФК) і апоптоз (рис. 1). Саме порушення цих процесів унаслідок ЦД 2 типу призводить до дефіциту життєво важливих функцій, які включають метаболізм гепатоцитів, серцевий викид, скорочення скелетних м’язів, вироблення інсуліну β-клітинами і здоров’я нейронів.
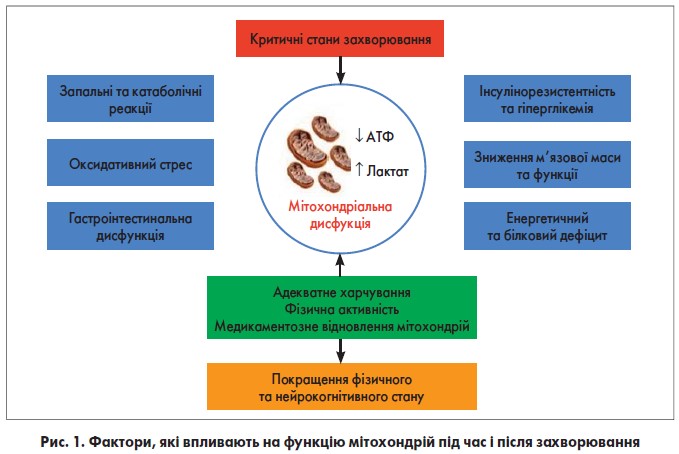 Мітохондріальна функція має важливе значення для покращення перебігу захворюваннь. Декілька факторів пов’язані з дисфункцією мітохондрій, яка, своєю чергою, асоційована зі зменшенням вироблення енергії, що відбивається в зниженні доступності аденозинтрифосфату (АТФ) і підвищенні рівня лактату. Адекватне харчування під час і після захворювання може поліпшити функцію мітохондрій і покращити довгострокові фізичні та нейрокогнітивні результати до, після та під час захворювання.
Мітохондріальна функція має важливе значення для покращення перебігу захворюваннь. Декілька факторів пов’язані з дисфункцією мітохондрій, яка, своєю чергою, асоційована зі зменшенням вироблення енергії, що відбивається в зниженні доступності аденозинтрифосфату (АТФ) і підвищенні рівня лактату. Адекватне харчування під час і після захворювання може поліпшити функцію мітохондрій і покращити довгострокові фізичні та нейрокогнітивні результати до, після та під час захворювання.
Відомо, що мітохондрії схильні до різних генетичних і екологічних порушень, накопичення мутацій мітохондріальної ДНК (мтДНК) і виснаження числа копій мтДНК, що допомагає пояснити поширеність пов’язаних із мітохондріями захворювань, зокрема ЦД 2 типу. Мітохондріальна дисфункція (МДФ) та процес пошкодження й загибелі клітин тіла людини в результаті окислення – так званий окислювальний стрес (OС) виникають як наслідок низки розладів; у декількох клінічних дослідженнях було зроблено спробу протидіяти OС і МДФ шляхом призначення допоміжних засобів проти прогресування захворювання. Наш огляд спрямований на те, щоб зосередитися на двох, мабуть, віддалених захворюваннях, а саме на ЦД 2 типу і такому рідкісному генетичному захворюванні, як анемія Фанконі (ФА). Патогенетичні зв’язки між ЦД 2 типу і ФА включають високу поширеність діабету 2 типу в пацієнтів із ФA і доведену наявність ОС і MДФ при обох розладах. Останню фенотипну/патогенетичну ознаку, а саме МДФ, можна розглядати і як механістичну основу для обліку клінічних результатів при обох захворюваннях, і як передумову для клінічних досліджень, спрямованих на протидію МДФ. У разі ЦД 2 типу є гіпотеза щодо оцінки in vivo будь-якого зменшення мітохондріальних кофакторів або мітохондріальних поживних речовин (МПР), таких як α-ліпоєва кислота (АЛК), коензим Q10 (коQ10) та l-карнітин (КАРН), з можливим комбінованим лікуванням на основі МПР. Що ж до ФА, поки що є дані стосовно МДФ, отримані в умовах in vitro або в ході молекулярних досліджень. Вони спонукають до необхідності підтвердити МДФ in vivo та розробити клінічні дослідження ефективності використання МПР для пом’якшення або затримки клінічного прогресу ФА.
Окислювально-відновні та мітохондріальні аномалії належать до серйозних розладів, які впливають на розвиток діабету, старіння, генетичних, неврологічних, психоневрологічних і серцево-судинних захворювань. Таким чином, у декількох клінічних дослідженнях із перемінним успіхом було зроблено спробу забезпечити ад’ювантне лікування, спрямоване на протидію розладів, пов’язаних з OС/MДФ, за допомогою основних мітохондріальних кофакторів. На думку Wesselink та співавт., мітохондріально-орієнтоване лікування може забезпечити основну підтримку в прогресуванні захворювання при деяких розладах, асоційованих з OС/MДФ. Ключовими молекулами в функціях мітохондрій визнали так звані МПР, АЛК, коQ10 і КАРН. Вони беруть участь у забезпеченні трьох основних функцій мітохондрій, а саме в циклі Кребса (AЛК), ланцюгах перенесення електронів (кoQ10) і перенесенні ацилкарнітину (КАРН).
Основні завдання мітохондрії закріплені на окислювальному метаболізмі поживних речовин при синтезі високоенергетичних молекул, таких як АТФ, тому активні форми кисню (АФК) є необхідним побічним продуктом цих біотрансформацій і викликають внутрішньомітохондріальний прооксидантний стан. Саме тому мітохондрії зазвичай розглядають як «силову установку» клітини і першу жертву цього прооксидантного стану. Використання МПР є еволюційним рішенням для мітохондріальної та клітинної виживаності. Вони виконують свою роль кофактора в енергетичному, прооксидантному метаболізмі і мають властивості сильних антиоксидантів.
ЦД 2 типу
Участь OС в патогенезі ЦД 2 типу було продемонстровано в останні 30 років. Механістична роль OС і MДФ в патогенезі ЦД 2 типу включає примітивне пошкодження β-клітин підшлункової залози (ПЗ) й такі основні клінічні наслідки прогресування цього типу діабету, як мікро- і макроангіопатії і пошкодження сітківки.
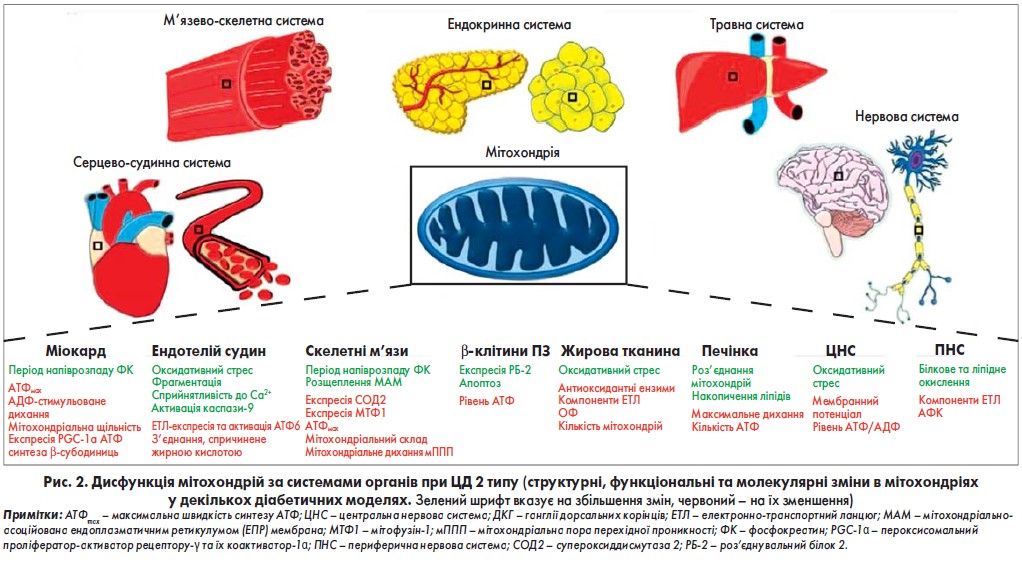
Міжнародна федерація діабету (International Diabetes Federation – IDF) повідомляє, що число дорослих пацієнтів у віці 18-99 років із ЦД 2 типу в усьому світі становить 451 млн і що до 2045 року, при збереженні наявної тенденції, цей показник зросте до 693 млн. Підвищений ризик розвитку діабету 2 типу в осіб похилого й старечого віку і в людей з ожирінням, у поєднанні з епідеміологічними даними щодо збільшення у світовій популяції частки літнього населення, потребує глибокого розуміння молекулярних змін, що лежать в основі цих зв’язків. Багато вчених незалежно дійшли висновку, що МДФ стає причиною таких порушень, як швидке старіння організму, ожиріння і ЦД 2 типу. Ожиріння характеризується підвищеною концентрацією вільних жирних кислот (ЖК) у циркулюючій крові та накопиченням тріацилгліцерину в периферичних тканинах, що призводить до мітохондріальних наслідків – підвищеної ліпотоксичності, підвищення ризику ОС і порушення енергетичного метаболізму субстрату та окисного фосфорилювання (OФ). МДФ грає особливу роль при ЦД 2 типу через її встановлений зв’язок з інсулінорезистентністю (ІР). Розглянемо більш детально структурні, функціональні та молекулярні зміни, які супроводжують дисфункцію мітохондрій при ЦД 2 типу в різних органах (рис. 2).
МДФ у травній системі
У хворих на ЦД 2 типу часто спостерігається печінкова дисфункція у вигляді неалкогольної жирової хвороби печінки (НАЖХП). Чи є НАЖХП причиною або наслідком діабетичної патології, залишається предметом дискусій; проте зміни в метаболізмі субстрату енергії печінки і мітохондріальної функції в пацієнтів із ЦД 2 типу з НАЖХП добре охарактеризовані. Найчастіше в цих пацієнтів виявляються дві серйозні метаболічні зміни – зниження чутливості печінки до інсуліну, що супроводжується підвищеним накопиченням жирової тканини в печінці. У пацієнтів з ожирінням, ІР та неалкогольним стеатогепатитом зазначають такі мітохондріальні порушення, як зниження максимального дихання, посилення мітохондріальної роз’єднаності та збільшення протонного витоку. Ці зміни підтверджуються зниженням умісту АТФ і обміну в печінці у хворих на ЦД 2 типу.
Кальцієвий гомеостаз робить свій внесок у функцію мітохондрій і чутливість до інсуліну в печінці. Ендоплазматичний ретикулум (ЕПР) має функціональний зв’язок із мітохондріями за допомогою приєднання мітофузіну‑2. Ученими було виявлено, що ці взаємодії на пов’язаних із мітохондріями EПР мембранах (MAMs) відіграють основну роль у передачі сигналів інсуліну, хоча обговорюється питання про те, чи збільшується, чи зменшується зв’язування цих органел при ІР печінки. Нещодавно отримані результати продемонстрували, що спостерігається руйнування MAM у скелетних м’язах пацієнтів із ЦД 2 типу.
МДФ у м’язево-скелетній системі
Резистентність до інсуліну скелетних м’язів є центральним фактором патогенезу ЦД 2 типу. Учені ретельно дослідили системний метаболізм мітохондрій скелетних м’язів у цієї групи хворих. Ця дисфункція характеризується різними методами як in vivo, так і ex vivo. У дослідженні в пацієнтів із ЦД 2 типу, відібраних за індексом маси тіла, період напіврозпаду відновлення ФК musculus vastus lateralis був на 45% більше, ніж у контрольної групи. Ці результати підтверджуються виявленням в окремій групі зниження АТФмах, що оцінюється по відновленню ФК у musculus vastus lateralis у пацієнтів із ЦД 2 типу.
Вплив фізичних вправ на зворотні зміни МДФ
Було показано, що фізичні вправи не тільки покращують чутливість до інсуліну в пацієнтів із ЦД 2 типу, але й допомагають відновити функцію мітохондрій. Фактично, мітохондріальна функція in vivo, знижена у хворих на ЦД 2 типу, нормалізувалася завдяки тренуванням до контрольних рівнів. В окремому дослідженні за програмою зниження ваги в пацієнтів із ЦД 2 типу, яка включала ≥4 дні фізичних вправ із максимальною частотою серцевих скорочень 60-70%, виявили збільшення щільності мітохондрій скелетних м’язів, розмір, зміст кардіоліпіну, мтДНК, активність цитрат-синтази. Ван Тієн та співавт. зазначили, що після року тренувань двічі на тиждень у пацієнтів із тривалим перебігом діабету 2 типу спостерігалася підвищена константа швидкості відновлення ФК, щільність мітохондрій та активність комплексу I musculus vastus lateralis. Фізичні вправи не лише надають позитивний ефект у згаданої групи пацієнтів (зниження вмісту жиру в печінці, поліпшення функції β-клітин, посилення функції ендотелію, поліпшення структури і функції серця та сповільнення розвитку діабетичної периферичної невропатії), а й покращують чутливість до інсуліну і функцію мітохондрій скелетних м’язів як у здорових осіб, так і в учасників із недіабетичним ожирінням.
МДФ в ендокринологічній системі
Бета-клітини ПЗ реагують на потреби організму в інсуліні відповідно до рівня глюкози. Коли будь-яка з регуляторних функцій порушується, виникають порушення системного метаболізму. У стані метаболічного гомеостазу тимчасові коливання рівня глюкози в крові легко коригуються невеликими змінами секреції інсуліну. Але на тлі ЦД 2 типу хронічний вплив гіперглікемії та гіперліпідемії погіршує функцію β-клітин. З огляду на результати численних досліджень, учені визначили ключові чинники цього процесу – мітохондріальні структурні або функціональні порушення. Було показано, що β-клітини ПЗ у пацієнтів із діабетом мають підвищену експресію комплексів електронного транспортного ланцюга (ETC) I і V, хоча рівні АТФ і співвідношення АТФ/АДФ знижуються. Науковці пояснили цей парадокс підвищеною експресією РБ‑2 в діабетичних острівцевих клітинах, в яких стимульована глюкозою продукція інсуліну була знижена. Важлива роль мітохондрій в забезпеченні нормальної функції β-клітин підтверджується також віковою втратою мтДНК, що відповідає зниженню секреції інсуліну. У цілому мітохондрії β-клітин ПЗ відіграють динамічну роль у процесі секреції інсуліну.
Жирова тканина, яку часто ігнорують як пасивний орган, чутлива до інсуліну і має високу динаміку і гостру чутливість до різних факторів довкілля. Зв’язок між ожирінням і ЦД 2 типу забезпечує достатню мотивацію для вивчення того, як популяції адипоцитів змінюються в умовах діабету. Однією з таких змін, характерних для жирової тканини хворих на ЦД 2 типу, є порушення мітохондріальної функції, а саме – підвищення мітохондріальної АФК та пригнічення мітохондріальних антиоксидантних ферментів. Також було показано, що багато компонентів ETC знижують експресію в вісцеральних жирових мітохондріях жінок із ЦД 2 типу
МДФ у серцево-судинній системі
Під час обстеження серцевого м’яза спостерігалося посилення ОС, підвищення АФК і фрагментація мітохондріального ланцюга в тканині правого передсердя в пацієнтів із діабетом, що, імовірно, призвело до розвитку дисфункції. При збільшенні метаболічного стресу міокард стає більш сприйнятливим до Ca2+, що індуковане мітохондріальною проникністю і подальшою активацією шляху власного апоптозу.
В ендотелії судин, через поділ мітохондрій, виявлено підвищене накопичення мітохондріальних АДФ, і можливо, наслідками цих порушень є структурні аномалії та зниження антиоксидантного захисту.
Для протидії ОС, асоційованому з ЦД 2 типу, було запропоновано використання декількох антиоксидантів. У нещодавніх дослідженнях додатково вивчалася МДФ як характерна ознака ЦД 2 типу, у той час як механістична роль метформіну й рослинного антидіабетичного препарату була пов’язана з поліпшенням функції мітохондрій.
Як передбачив Люфт у 1994 р., у «мітохондріальної медицини» – великий потенціал, за останні роки зросла кількість базових і клінічних досліджень, в яких вивчали внутрішньоклітинні порушення при різних розладах організму, зокрема ЦД 2 типу. Аналіз наявної інформації показує перспективи використання ад’ювантної терапії, націленої на відновлення мітохондрій.
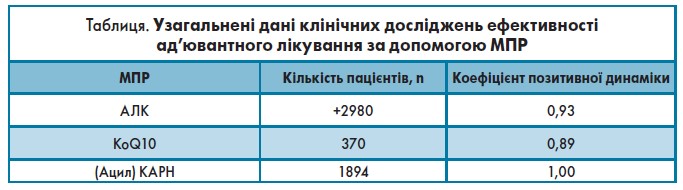
З огляду на визнання важливої ролі MПР у регуляції функцій мітохондрій, велика кількість літератури присвячена позитивним результатам лікування пацієнтів із діабетом за допомогою таких МПР, як АЛК, або кoQ10, або КАРН. Ці дані узагальнені в таблиці.
Безпека і токсичність МПР
АЛК
α-Ліпоєва кислота синтезується de novo в мітохондріях з 8-вуглецевої жирної (октанової) кислоти і функціонує в якості кофактора для декількох мітохондріальних комплексів, залучених у цикл трикарбонових кислот. Однак через деякі відмінності лише R-ліпоєва кислота синтезується ендогенно і ковалентно пов’язана з ацил-білком-носієм в кожному мультиферментному комплексі. АЛК – природний коензим мітохондрій мультиензимного комплексу, який каталізує окисне декарбоксилювання α-кетокислот, таких як піруват і α-кетоглютарат. АЛК є потужним антиоксидантом, що визначає можливість її терапевтичного використання при різних розладах організму, пов’язаних з ОС та МДФ. АЛК може пригнічувати активність клітин, що визначають імунну відповідь шляхом інгібування в них інтерлейкінів і стимуляції цАМФ. Нейропротекторні можливості АЛК реалізуються за рахунок поліпшення функції мітохондрій.
Таким чином, аналіз експериментальних і клінічних досліджень свідчить про універсальність антиоксидантної дії АЛК у судинному руслі й цитоплазмі клітинних структур різних органів і можливість за допомогою АЛК впливати на запалення, апоптоз, кровотік, ендотеліальну дисфункцію, активацію нейротрансмітерів та метаболічні процеси.
КoQ10
Коензим Q10 – природне та незамінне з’єднання, присутнє в мітохондріях. Синтез кoQ10 починається з тирозину або фенілаланіну для синтезу 4-гідроксибензоату і бензохінону з подальшим синтезом бічного ланцюга поліізопреноїду з ацетил-коензиму A (КoA). Бензохінонова група кoQ10 є ключовою для її функції в активації системи ОФ у мітохондріях і ATФ. Отримання електронів із відновлювальних еквівалентів допомагає генерувати ЖК і метаболізм глюкози, тоді як перенесення протонів із мітохондріального матриксу в міжмембранний простір створює градієнт протонів через внутрішню мембрану мітохондрій. Ця особливість також допомагає кoQ10 транспортувати протони через лізосомальні мембрани для підтримки оптимального pH.
Використання кoQ10 в якості харчової добавки має дуже низьку токсичність і не викликає серйозних побічних ефектів. Прийнятна добова доза становить 12 мг/кг/день. Вона розрахована за рівнем неспостережуваного несприятливого ефекту (NOAEL) 1200 мг/кг/день, отриманого за результатами 52-тижневого дослідження хронічної токсичності на щурах, що рівноцінно 720 мг/день для людини вагою 60 кг (Hidaka et al.). Крім того, введення екзогенного кoQ10 не пригнічує його фізіологічну продукцію. У нещодавньому дослідженні Galeshkalami та співавт. повідомили про переваги комбінації AЛК і кoQ10 при експериментальній діабетичній невропатії шляхом модулювання OС і апоптозу.
КАРН
Карнітин – природна речовина, яка в основному синтезується в печінці в його L-формі з лізину і метіоніну і транспортується через кровоток до серцевих і скелетних м’язів. КАРН необхідний для β-окислення мітохондріальних ЖК і транспорту довголанцюгових жирних кислот через внутрішню мембрану мітохондрій у формі ацилкарнітину, де вони можуть метаболізуватися для отримання енергії.
З часу відкриття КАРН і його активного стереоізомеру ацетил-L-карнітину (ALК) використовувалися в багатьох дослідженнях за участю пацієнтів – окремо або в складі комбінованої терапії. Використання КАРН у клінічних дослідженнях, які включали хворобу Альцгеймера, депресію, старіння, діабет, ішемію та інші неврологічні захворювання, не супроводжувалося повідомленнями про серйозні токсичні ефекти. КАРН/ALК та різні хімічні аналоги широко використовувалися як допоміжні засоби при неврологічних розладах або для запобігання несприятливим явищам на тлі різних хіміотерапевтичних методів лікування, таких як зменшення пошкодження головного мозку після гіпоксичної ішемії в новонароджених щурів. Song та співавт. проаналізували результати рандомізованих контрольованих досліджень і повідомили, що КАРН добре переноситься пацієнтами з хронічною серцевою недостатністю, покращує перебіг захворювання та функцію серця.
Антиоксидантну терапію (АОТ) за правом можна вважати патогенетичною, оскільки роль вільних радикалів у патогенезі ЦД 2 типу та його ускладнень сьогодні не викликає сумнівів, і розглядати як один з обов’язкових компонентів комплексного лікування.
Сучасна АОТ представлена різними препаратами (препарати тіоктової кислоти (ТК), α-токоферолу, вітаміну С, селену та ін.), які широко застосовуют для лікування захворювань, асоційованих з ОС та МДФ.
Антиоксиданти необхідні на різних «лініях захисту»: у позаклітинній рідині, на мембрані і в цитоплазмі клітини. Захист внутрішньоклітинних структур здійснюють сполуки, які розчиняються як у воді, так і в жирах, оскільки вони спочатку мають проникнути крізь мембрану клітини, а потім розчинитися в цитоплазмі. До таких речовин належить і ТК, представлена в усіх середовищах: позаклітинній рідині, мембрані й цитоплазмі.
Недостатність ендогенного антиоксидантного захисту при високій активності процесів вільнорадикального окислення зумовлює доцільність включення в схему терапії антиоксидантних препаратів, зокрема ТК. З позицій доказової медицини ТК зарекомендувала себе як ефективний препарат для лікування полінейропатії (наймасштабніші клінічні дослідження з цього питання – ALADIN, 1995; DEKAN, 1997).
ТК представлена в якості кофактора в багатоферментних комплексах і мітохондріальних ферментах, які каталізують окислювальне декарбоксилювання пірувату та інших Α-кетокислот. Відновлена форма ТК є сильним відновником регенерації окислених антиоксидантів, таких як аскорбат, глутатіон, коензим Q10 і вітамін Е.
Основною формою ТК, яка взаємодіє з вільними радикалами, є дигідроліпоєва кислота. Наявність антиоксидантного ефекту зумовлено присутністю в молекулі двох тіолових груп і здатністю пов’язувати молекули радикалів та іонів металів, що входять до складу ферментів – каталізаторів окислення. Застосування ТК супроводжується підвищенням синтезу глютатіону – важливого ендогенного антиоксиданту.
Усі наведені в цьому огляді докази щодо вирішальної ролі ОС та МДФ у визначенні відновлення після чи під час перебігу захворювання є переконливими. Оскільки базові механізми включають різні шляхи й процеси, стратегії з кількома цілями найкраще підходять для усунення дисбалансів.
За матеріалами Giovanni Pagano et аl.
Mitoprotective Clinical Strategies in Type 2 Diabetes
and Fanconi Anemia Patients: Suggestions
for Clinical Management of Mitochondrial Dysfunction Antioxidants. – 2020, 9, 82.
Реферативний огляд підготувала Юлія Золотухіна.
Повну версію дивіться на сайті:
http://www.mdpi.com/journal/antioxidants
Тематичний номер «Діабетологія, Тиреоїдологія, Метаболічні розлади» № 3 (51) 2020 р.