11 березня, 2021
Досвід застосування аналогів інсуліну ІІ покоління в умовах клінічних досліджень і реальної клінічної практики: чи є відмінності?
Ті реалії, з якими людство стикнулося в 2020-му, диктують нові підходи до лікування, особливо пацієнтів із хронічними захворюваннями.
Усім практикуючим лікарям варто бути в курсі останніх досягнень в області як своєї, так і суміжних спеціальностей. Одним із шляхів отримання найактуальнішої інформації є участь лікарів у різного роду конференціях, форумах, зустрічах, на яких фахівці діляться своїм досвідом із колегами. Зустріч експертів, організована за підтримки компанії «Санофі», стала саме таким корисним заходом. Вітчизняні фахівці та їх колеги з-за кордону розглянули наукові й суто клінічні питання ведення пацієнтів із цукровим діабетом (ЦД) і обмінялися власним досвідом.
Захід почався з виступу керівниці відділу клінічної діабетології ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України» (м. Київ), доктора медичних наук Л.К. Соколової.  Вона ознайомила присутніх із результатами проміжного аналізу дослідження ATOS, який включив дані 77% пацієнтів. Уперше про результати згаданого дослідження доповідалося на конгресі Американської діабетичної асоціації 2020 (ADA, 2020).
Вона ознайомила присутніх із результатами проміжного аналізу дослідження ATOS, який включив дані 77% пацієнтів. Уперше про результати згаданого дослідження доповідалося на конгресі Американської діабетичної асоціації 2020 (ADA, 2020).
Метою ATOS стала оцінка ефективності й безпеки інсуліну гларгін‑300 (Gla‑300) в інсулін-наївних пацієнтів із ЦД 2 типу. Це 12-місячне проспективне обсерваційне міжнародне багатоцентрове дослідження реальної клінічної практики проводилося за межами США та Західної Європи, у країнах із невисоким рівнем доходів, зокрема в Україні (200 учасників у 20 центрах). Дані збирали на початку дослідження, а також через 3; 6 та 12 міс після початку лікування Gla‑300 (Gagik R. et al., 2020).
У дослідження було включено 4527 учасників віком ≥18 років із 18 країн світу. Критерієм включення став недостатньо компенсований прийомом ≥1 перорального цукрознижувального препарату (ПЦЗП) ЦД 2 типу (7% Первинною кінцевою точкою був відсоток пацієнтів, які досягнули заздалегідь визначеної індивідуальної мети HbA1c на 6-му міс дослідження. Вторинні кінцеві точки включали: HbA1c на 3-му та 12-му міс дослідження, зміну рівня HbA1c, глюкози в плазмі натще (ГПН), глюкози плазми, що вимірювалася пацієнтами самостійно глюкометром (ГПСГ), на 3-му, 6-му, 12-му міс та безпека препарату. Для аналізу даних використовували описову статистику кількісних параметрів ефективності й безпеки.
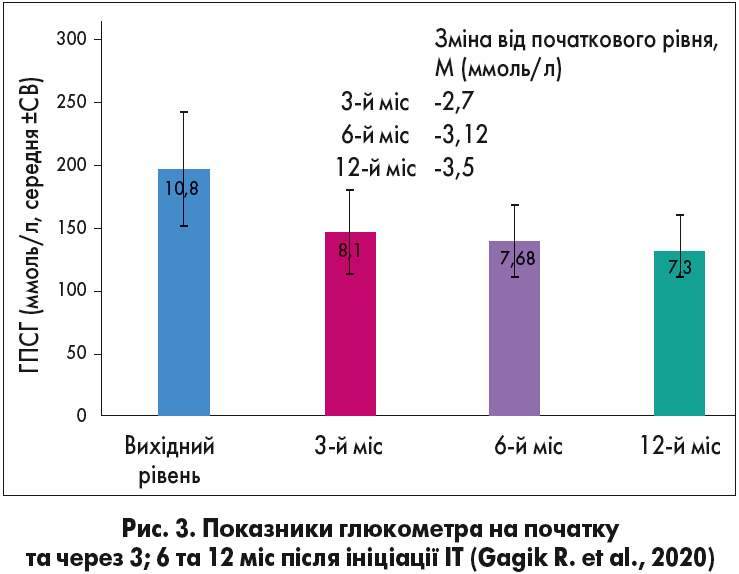
Демографічні показники та характеристики учасників перед початком лікування гларгіном‑300 відображені в таблиці 1.
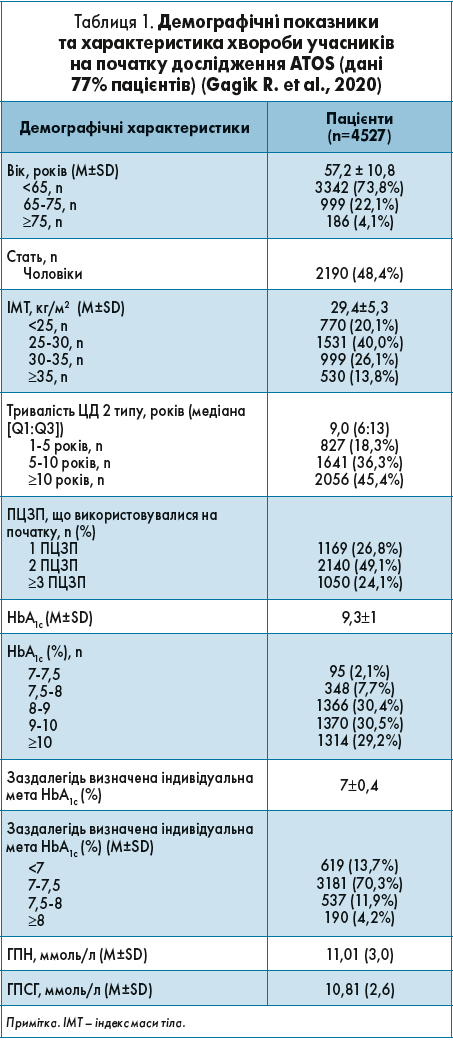
Середній вік в основній досліджуваній популяції становив 57,2±10,8 року, більшість пацієнтів мали надмірну масу тіла або ожиріння І ступеня, захворювання не контролювалося прийомом 2 ПЦЗП, а середній рівень HbA1c становив 9,3% при індивідуальній меті HbA1c 7,0±0,4%. Динаміка рівня HbA1c відображена на рисунку 1.
З графіку видно, що початковий рівень (9,28%) знизився до 8,19%, 7,77% та 7,34% (різниця з початковим рівнем становить -1,09, -1,51 та -1,89%) на 3-му, 6-му та 12-му міс дослідження відповідно. Частка пацієнтів, які досягли своєї заздалегідь визначеної індивідуальної мети HbA1c на 6-му міс дослідження, склала 25,1% (n=845/3337; 95% ДІ 23,6-26,6).
Середня добова доза Gla‑300 при ініціації інсулінотерапії (ІТ) склала 14,4 Од. Через 3; 6 та 12 міс вона була підвищена до 19,6, 22,0 та 23,7 Од відповідно.
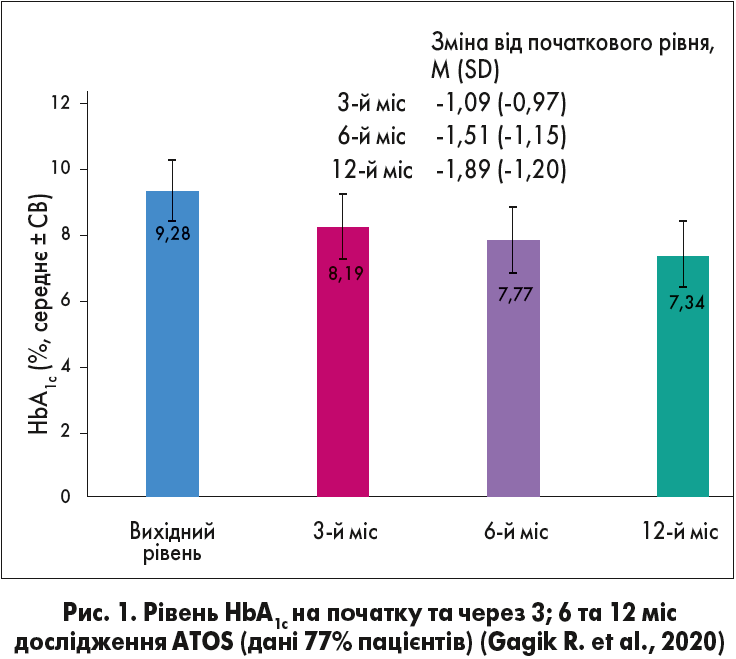
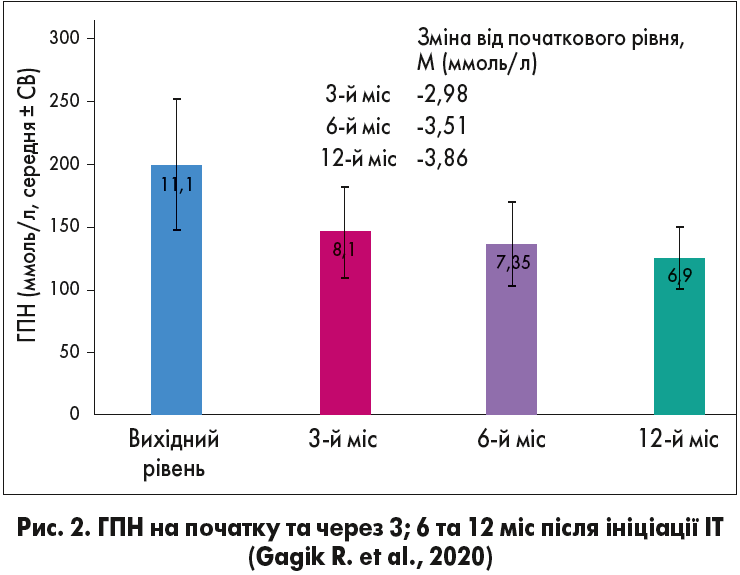
Динаміка ГПН та ГПСГ відображена на рисунках 2 та 3.
Частота задокументованих симптомних і тяжких гіпоглікемій (глюкоза в крові ≤3,9 та <3 ммоль/л) була низькою на 6-му міс (0,75% [частота події: 0,026] та 0,13% [частота події: 0,003]) та 12-му міс (0,88% [частота події: 0,027] та 0,20% [частота події: 0,004]). Загалом 0,04% учасників повідомили про тяжку гіпоглікемію через 6 та 12 місяців. Частота задокументованих симптомних, тяжких і нічних гіпоглікемій була низькою і порівняною на 6-му та 12-му міс дослідження (0,2%, 0,07% та 0,02% відповідно).
Загалом у ході проміжного аналізу ATOS було встановлено:
- Учасники мали високий вихідний рівень HbA1c (9,28%), що свідчить про затримку призначення інсуліну.
- Усього 25,1% пацієнтів досягли своєї попередньо визначеної індивідуальної цілі HbA1c на 6-му місяці. Ця цифра є достатньо високою, адже більшість пацієнтів вступили в дослідження з первинно високим рівнем HbA1c.
- Середня зміна дози інсуліну від початку дослідження до 6-го міс була нижчою, ніж спостерігалася в клінічних випробуваннях. Це вказує на те, що в реальних клінічних умовах більше пацієнтів можуть досягти свого цільового HbA1c завдяки титруванню дози інсуліну.
- Середня значення HbA1c було нижче від вихідного рівня в усіх пацієнтів. Також спостерігалося зниження рівнів ГПН та ГПСГ, що відображає поліпшення контролю глікемії, незважаючи на неоптимальне титрування інсуліну.
- Частота зафіксованих симптомних та тяжких гіпоглікемічних подій, які трапляються протягом ночі та в будь-який час доби, була низькою.
Таким чином, в умовах реальної клінічної практики в країнах із невисоким рівнем доходів призначення гларгіну‑300 хворим на неконтрольований ЦД 2 типу, які лікуються ПЦЗП, сприяло поліпшенню глікемічного контролю з низьким ризиком гіпоглікемії.
В учасників зустрічі щодо представлених даних виникла низка методологічних і практично орієнтованих запитань.
? Більшість пацієнтів у дослідженні ATOS отримували ≥2 ПЦЗП. Чи відмінялись якісь із них, і якщо так, то які саме?
Оскільки значна частина пацієнтів була значуще декомпенсована, жоден ПЦЗП їм не відміняли, однак більшості була знижена доза препаратів сульфанілсечовини.
? Чи проводився пацієнтам, які брали участь у дослідженні ATOS, добовий моніторинг глікемії для оцінки добової варіабельності?
У 70% пацієнтів зробити це було неможливо через карантин. В учасників, залучених у дослідження на більш пізніх етапах, добовий моніторинг проводився. Застосування гларгіну‑300 (Тожео СолоСтар) в інсулін-наївних пацієнтів із ЦД 2 типу асоціювалося з малою добовою варіабельністю глікемії, що вкотре підкреслює переваги препарату стосовно безпеки.
? Які середні добові дози інсуліну Тожео СолоСтар використовувалися в пацієнтів в Україні в рамках дослідження ATOS?
Інсулінотерапію зазвичай ініціювали з дози 10-12 Од/добу, поступово титруючи до досягнення індивідуальних цілей лікування. У більшості пацієнтів в Україні вона склала 30 Од/добу. Однак у Тернополі середня добова доза була вищою і складала 40, а інколи й 50 Од/добу. Це насамперед пов’язано з демографічними характеристиками досліджуваної популяції, зокрема з ожирінням, на яке страждала більшість пацієнтів у тернопільському центрі.
? Згідно з останніми даними ВООЗ, середня добова доза інсуліну, яка використовується пацієнтами з ЦД 2 типу у світі, становить 40 Од/добу. З українського реєстру відомо, що в нашій країні в середньому використовують 30 Од/добу інсуліну. При цьому компенсації досягає незначна частка пацієнтів – лише 10-13%. Результати дослідження ATOS показують досягнення цільового рівня HbA1c на значно меншій дозі інсуліну Тожео СолоСтар (24 Од/добу). Як це можна пояснити?
Імовірніше, це є наслідком комбінації великої кількості факторів, зокрема таких:
- правильна титрація дози інсуліну;
- наявність постійного двостороннього зв’язку лікар-пацієнт;
- дотримання правил здорового харчування та підвищення фізичної активності;
- достатньо залишкова активність підшлункової залози, яка забезпечувала чутливість до інсуліну.
У другій частині зустрічі експертів виступив професор Роберт Рітцель (Німеччина), який присвятив свою доповідь новим даним, отриманим у ході клінічних досліджень та з практичного досвіду застосування інсуліну гларгін‑300 (Тожео СолоСтар).
який присвятив свою доповідь новим даним, отриманим у ході клінічних досліджень та з практичного досвіду застосування інсуліну гларгін‑300 (Тожео СолоСтар).
Згідно з останніми версіями світових рекомендацій з ведення пацієнтів із ЦД, більшість із них потребують ІТ базальним інсуліном для достатнього контролю рівня глікемії (Консенсус ADA/EASD).
Базальний інсулін – це єдиний цукрознижувальний засіб, який можна титрувати, тобто підлаштовувати під індивідуальні цілі лікування. Головними недоліками першого базального НПХ інсуліну, синтезованого ще в 1946 році, була наявність піку дії та значна добова варіабельність глікемії. Згодом були створені аналоги інсуліну І покоління гларгін‑100 та детемір, абсорбція яких була менш варіабельною, а тривалість дії довшою. Все ж їхні фармакокінетичні характеристики та профіль безпеки не задовольняли вчених. У результаті з’явилися аналоги інсуліну ІІ покоління – гларгін‑300 та деглюдек (IDeg), які на сьогодні вважаються найоптимальнішим рішенням у разі потреби в базальному інсуліні (Eliaschewitz F.G. et al., 2016; Pettus J. et al., 2016).
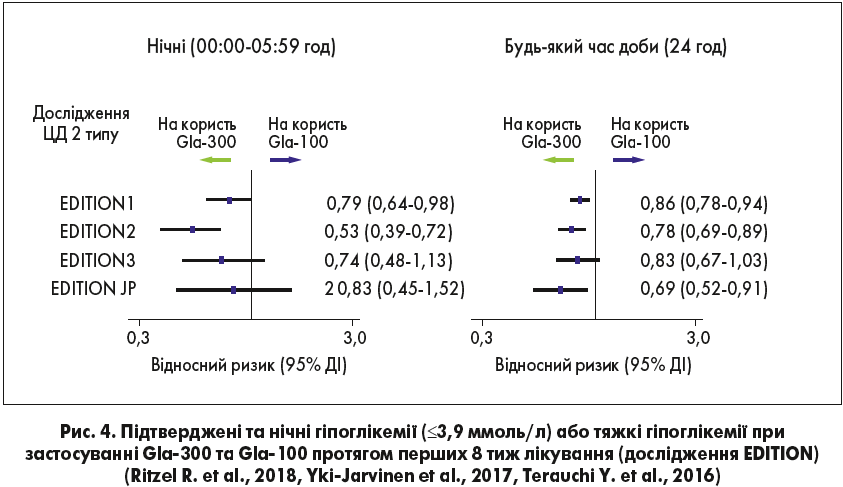
Метааналіз рандомізованих 6-місячних мультицентрових відкритих досліджень фази ІІІ EDITION1; 2 і 3 проводився з метою порівняння ефективності й безпеки інсуліну Gla‑300 та Gla‑100. Було показано, що ці два інсуліни забезпечували порівняний рівень контролю глікемії, однак дані щодо безпеки різнилися. Було виявлено, що загальна кількість гіпоглікемій і частота нічних гіпоглікемій була достовірно нижчою в групі Gla‑300 (рис. 4).
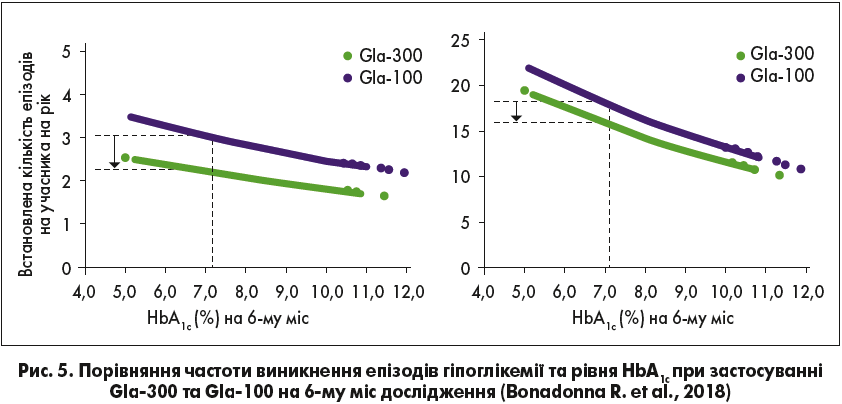
Для підтвердження релевантності цих даних треба ознайомитися з результатами інших досліджень. На рисунку 5 представлені дані аналізу R. Bonadonna та співавт., які відображають взаємозв’язок між рівнем HbA1c та частотою виникнення гіпоглікемій на тлі прийому Gla‑300 та Gla‑100.
Як можна побачити з графіків, досягнення однакового рівня HbA1c супроводжується меншим ризиком виникнення гіпоглікемій при використанні Gla‑300, якщо порівняти з Gla‑100 (Bonadonna R. et al., 2018).
Це пов’язано насамперед із фармакокінетичним профілем аналогів базального інсуліну ІІ покоління. І деглюдек, і гларгін‑300 мають подовжений період напіввиведення, однак механізми його різні.
При підшкірному введенні деглюдек утворює довгі макромолекули інсуліну, які сповільнюють його вивільнення в системний кровотік. Крім того, при потраплянні в кров препарат змінює частину жирних кислот і зв’язується з альбуміном. Своєю чергою, гларгін‑300 формує преципітат у підшкірно-жировій клітковині, що й забезпечує подовження періоду напіввиведення.
Кілька масштабних контрольованих клінічних досліджень порівнювали ефективність і безпеку аналогів ІІ покоління деглюдеку та гларгіну.
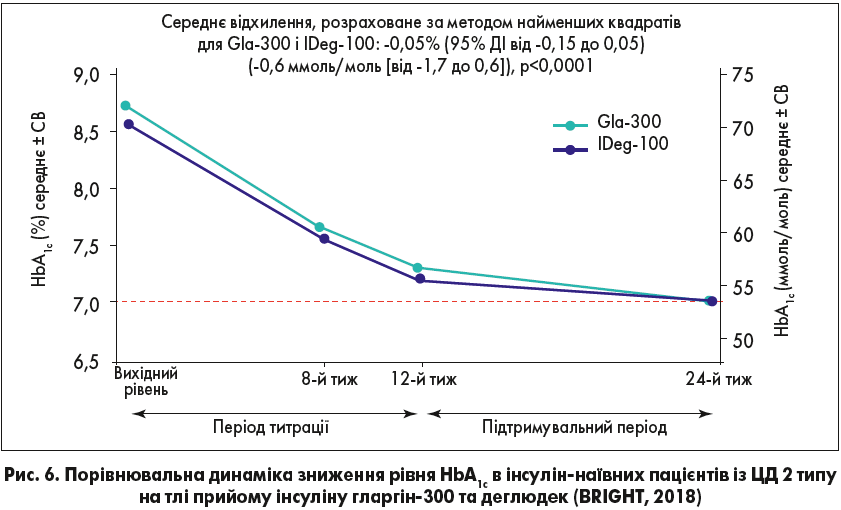
Так, у мультицентрове відкрите рандомізоване активно контрольоване дослідження BRIGHT було включено 929 дорослих пацієнтів із неконтрольованим перебігом ЦД 2 типу. Критеріями включення виступали вік ≥18 років, тривалість ЦД 2 типу >1 року, 7,5%≥HbA1c≤10,5%, 25 кг/м2≥ІМТ≤40 кг/м2, прийом ПЦЗП ± [агоністи рецепторів глюканоподібного пептиду 1] арГПП‑1 протягом ≥3 міс та інсулін-наївність (Rosenstock J. et al., 2018).
Лікування тривало 24 тиж, перші 12 припадали на період титрації, а 13-24-й тиж – на підтримку титрації. Пацієнти були випадковим чином розподілені на 2 групи. Перша група ініціювала терапію Gla‑300 в дозі 0,2 Од/кг, друга – IDeg‑100 в дозі 10 Од/добу.
Було показано, що інсулін Gla‑300 знижував рівень HbA1c в інсулін-наївних пацієнтів із ЦД 2 типу так само ефективно, як IDeg‑100, що відображено на рисунку 6.
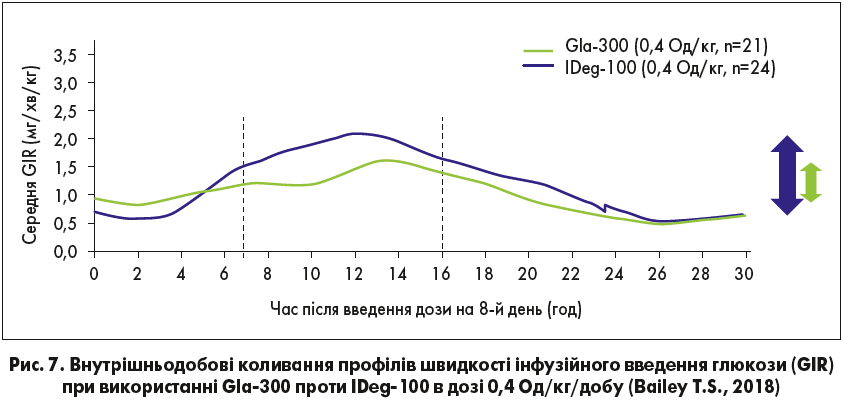
При цьому використання гларгіну‑300 в період титрування супроводжувалося меншою частотою підтверджених гіпоглікемій (≤3,9 ммоль/л). Найчастіше гіпоглікемії в обох групах лікування виникали в проміжку між 06:00-10:00 (Ritzel R. et al., 2019). Це пов’язано з більш низькою добовою варіабельністю гларгіну‑300, на 20% нижчою за інсулін деглюдек (рис. 7).
Певні відмінності в ефективності гларгіну‑300 та деглюдеку‑100 спостерігаються в особливих популяціях пацієнтів, зокрема у хворих із порушенням функції нирок (рис. 8).
Таким чином, застосування інсуліну гларгін‑300 в пацієнтів із ШКФ <60 мл/хв/1,73 м2 достовірно ефективніше, ніж інсулін деглюдек‑100, знижувало рівень HbA1c.
На нещодавньому конгресі EASD були представлені результати ще одного порівняльного дослідження ефективності й безпеки Gla‑300 і IDeg‑100 OneCare (Conget І. et al., 2020), яке проводилося в умовах реальної клінічної практики за участю дорослих пацієнтів із ЦД 1 типу. Для оцінки первинних кінцевих точок виконувався безперервний моніторинг концентрації глюкози в крові (CGM).
Дослідження OneCare стало першим, яке проводилося в умовах реальної клінічної практики і в ході якого було підтверджено достовірну ефективність аналогів інсуліну ІІ покоління в пацієнтів із ЦД 1 типу. Було встановлено, що деглюдек і гларгін‑300 однаково ефективно контролювали глікемію протягом доби, що корелює з даними, отриманими в пацієнтів із ЦД 2 типу. Водночас прийом Gla‑300 супроводжувався кращим контролем глікемії в нічний період та нижчою частотою нічних гіпоглікемій.
Для екстраполяції даних цих досліджень в умовах рутинної практики професор Рітцель представив увазі присутніх клінічний випадок.
У червні 2020 року до нього звернувся 21-річний пацієнт зі стажем ЦД 1 типу 9 років. Хворий був направлений до ендокринолога у зв’язку з переходом від педіатричного ендокринолога до дорослого.
На момент огляду пацієнт отримував базальний інсулін НПХ двічі на день і прандіальний аналоговий інсулін. На тлі цього лікування рівень HbA1c становив 7,8%, виникали часті епізоди гіпоглікемії, у тому числі й нічної (5-10 подій на добу).
Хворому замінили інсулін НПХ на гларгін‑300, при цьому добова доза була знижена на 20%, а пацієну рекомендували самостійно проводити титрування дози 1 р./добу на основі середнього рівня ГПН, виміряного протягом тижня.
У вересні 2020 року (через 3 міс після первинного звернення) рівень HbA1c на тлі лікування гларгіном‑300 становив уже 6,6%, а частота гіпоглікемій зменшилася до 1 випадку на добу. Пацієнт почувався значно краще, що напряму відобразилося на комплаєнсі та ефективності лікування.
Після закінчення доповіді професор Рітцель охоче відповів на запитання експертів та поділився досвідом застосування аналогів інсуліну ІІ покоління в Німеччині.
? З якого рівня HbA1c починають призначати інсулін хворим на ЦД 2 типу в Німеччині і з яких саме інсулінів стартують?
Зазвичай ІТ при ЦД 2 типу ініціюють при рівні HbA1c 8-10%. Старт ІТ відбувається на амбулаторному етапі, так само як і самоконтроль та самотитрування дози. Оскільки вартість інсуліну повністю покривають страхові компенсації, при виборі препарату враховується лише його ефективність і безпека. Тобто вибір не залежить від відсотку реімбурсації, як у країнах із низьким рівнем доходу. Тому лікарі обирають найбільш безпечні та ефективні препарати – аналоги інсуліну ІІ покоління.
? Який параметр ви вважаєте більш клінічно значущим: добову варіабельність глікемії чи варіабельність глікемії між днями?
Ці параметри більш значущі для клінічних досліджень, а не рутинної лікарської практики. Якщо клінічні дослідження показали низьку варіабельність глікемії, повторно оцінювати її в кожного пацієнта недоцільно. На практиці ми класично орієнтуємося на ГПН та HbA1c, а добовий моніторинг може мати значення хіба що при ініціації ІТ.
? Чи переводять німецькі лікарі своїх пацієнтів із Gla‑100 на Gla‑300 і в яких випадках? Чи може це робити сімейний лікар?
Зазвичай лікарі намагаються перевести більшість пацієнтів на аналоги інсуліну ІІ типу. Застосування однієї інєкції на добу забезпечує вищу прихильність до лікування. У реаліях Німеччини це легко, адже ціна інсуліну НПХ та аналогів однакова.
Пацієнтів із ЦД 1 типу завжди переводять ендокринологи. При ЦД 2 типу ситуація різна в кожному індивідуальному випадку. Чим більше в пацієнта супутніх захворювань і ускладнень, тим більше він потребує консультації ендокринолога та інших вузьких спеціалістів.
? Чи потрібно сімейному лікарю в Німеччині мати спеціальний сертифікат, для того щоб переводити пацієнта з одного інсуліну на інший?
Ні, однак за відсутності сертифікату лікар не отримуватиме надбавку до зарплатні за виконання цієї опції. Саме тому більшість сімейних лікарів у Німеччині, яким доводиться мати справу з ІТ, мають сертифікат.
? Чи є сенс при переході на базальний інсулін одного виробника змінювати прандіальний інсулін на препарат тієї ж фірми?
В основному потреби в цьому немає, оскільки більшість цих інсулінів не відрізняються і безпечно комбінуються.
Останні міжнародні гайдлайни підкреслюють, що сьогодні основною метою лікування ЦД не може вважатися лише досягнення глікемічних цілей. Кожен практикуючий лікар має звертати увагу як на органспецифічні ускладнення, зокрема на серцево-судинні захворювання, серцеву недостатність, хронічну хворобу нирок, так і на параметри безпеки. Зустріч експертів стала прикладом застосування цього підходу на практиці, а участь фахівців з іншої країни дала можливість вітчизняним лікарям-ендокринологам ознайомитися з новим поглядом на традиційні проблеми, з якими щодня стикається наша ендокринологічна медична допомога в рамках реформування медицини, та можливими шляхами їх вирішення.
Gagik R. Galstyan, Anil Bhansali, Hernando Vargas-Uricoechea, Amir Tirosh, Guannan Sun et al. Real-World Effectiveness and Safety of Insulin Glargine 300 U/mL (gla‑300) in Insulin-Naіve Patients with Type 2 Diabetes (T2DM): Interim Analysis of the ATOS Study. Diabetes Jun 2020, 69 (Supplement 1) 1028-P; DOI: 10.2337/db20-1028-P
Режим доступу: https://diabetes.diabetesjournals.org/content/69/Supplement_1/1028-P
Підготувала Ганна Кирпач
Тематичний номер «Діабетологія, Тиреоїдологія, Метаболічні розлади» № 4 (52) 2020 р.