12 вересня, 2022
Профілактика раннього розвитку та прогресування діабетичної нефропатії: роль альфа-ліпоєвої кислоти у протидіабетичній терапії
Діабетична нефропатія (ДН) – серйозне хронічне ускладнення цукрового діабету (ЦД), яке залишається провідною причиною розвитку термінальної стадії хронічної хвороби нирок (ХХН) і смерті хворих на діабет в усьому світі [1, 2]. ДН розвивається у приблизно 20-30% пацієнтів із ЦД 1 типу і 35-40% – із ЦД 2 типу [3] і характеризується такими клінічними ознаками, як стійка альбумінурія, зниження швидкості клубочкової фільтрації, гіперкреатинінемія, уремія та підвищення артеріального тиску (АТ) [4, 5]. Нещодавні дослідження показали, що основний молекулярний механізм патогенезу і прогресування ДН полягає в надлишковій продукції активних форм кисню (АФК) [6-12]. АФК – це вільні радикали, що їх переважно виробляють мітохондрії під час метаболічних процесів. Надмірна продукція АФК призводить до окислювального стресу, що, своєю чергою, опосередковує пошкодження тканин, яке спостерігають у разі розвитку таких патологічних станів, як ЦД [13, 14].
Сучасні підходи до лікування ДН поділяють на немедикаментозні і медикаментозні. Перші полягають у модифікації способу життя, а це передбачає дієту (зменшення споживання цукру і натрію), фізичні вправи, психологічні та соціальні втручання і навчання самоконтролю діабету [15]. Фармакологічна терапія спрямована на корекцію гіперглікемії за допомогою протидіабетичних препаратів і блокаду ренін-ангіотензин-альдостеронової системи за допомогою інгібіторів ангіотензинперетворювального ферменту (іАПФ) і блокаторів рецепторів ангіотензину II (БРАІІ), а також недигідропіридинових блокаторів кальцієвих каналів. Використання цих препаратів дає можливість досягнути стійкого контролю глікемії й АТ для зменшення протеїнурії, уповільнення прогресування ДН до термінальної стадії ХХН і запобігання серцево-судинним ускладненням [9, 16]. Наявні фармакологічні підходи до лікування, безумовно, сповільнюють прогресування ДН, однак не нівелюють патологічні зміни і не є профілактикою ДН у пацієнтів із ЦД. Таким чином, є нагальна потреба у визначенні нових фармакологічних агентів і стратегій для впливу на сигнальні шляхи, зокрема окислювальний стрес, індукований АФК.
Альфа-ліпоєва, або тіоктова, кислота (AЛК), є сірковмісним природним антиоксидантом і кофактором кількох важливих мітохондріальних мультиферментних комплексів, які беруть участь у біоенергетичних процесах у мітохондріях і метаболізмі амінокислот [17]. АЛК синтезується ендогенно синтазою ліпоєвої кислоти в мітохондріях тканин, у тому числі й нирок, а також потрапляє в організм із рослинних і тваринних джерел або у вигляді дієтичних добавок [18, 19]. У низці експериментальних і клінічних досліджень виявлено, що рівні циркулюючої АЛК у пацієнтів із ЦД знижуються, а додатковий прийом АЛК позитивно впливає як на перебіг ЦД 1 і 2 типів, так і на діабетичні ускладнення, зокрема діабетичну периферичну нейропатію [20, 21]. Було також показано, що AЛК позитивно впливає на рівень глюкози в крові, ліпідний профіль і вміст гамма-глутамілтрансферази у вагітних із гестаційним ЦД [22, 23]. Генетичне інгібування синтази ліпоєвої кислоти [24] під час моделювання ДН у гризунів супроводжувалося прискоренням розвитку патологічного процесу, а додавання АЛК, навпаки, сповільнювало розвиток і прогресування ДН [25-28], а також супроводжувалося низкою переваг у пацієнтів із термінальною стадією ХХН на гемодіалізі [29]. Однак досі не було описано ефектів у разі доповнення АЛК до традиційної протидіабетичної терапії, спрямованої на корекцію ДН, у пацієнтів із ЦД 2 типу, що і стало метою цього дослідження.
Матеріали і методи
Заява етичного комітету. Експериментальний протокол був затверджений Інституційним комітетом із догляду і використання тварин Університету Гани (ID протоколу: UG-IACUC002/19-20). Експеримент проводився в Корпусі для лабораторних тварин Меморіального інституту медичних досліджень ім. Ногучі, з дотриманням протоколу і гарантії якості відповідно до правил належної лабораторної практики. Усі процедури і методи, використані в цьому дослідженні, відповідали рекомендаціям Національного інституту охорони здоров’я щодо догляду і використання лабораторних тварин.
Поводження з тваринами. П’ятдесят вісім самців щурів лінії Sprague-Dawley з масою тіла 150-200 г і віком від 6 до 8 тиж отримали з Департаменту експериментів на тваринах Меморіального інституту медичних досліджень ім. Ногучі Університету Гани, Легон, Аккра.
Протокол експерименту
Як описано в попередніх дослідженнях [30, 31], у 51 з 58 щурів індукували ЦД 2 типу шляхом внутрішньоочеревинного введення 110 мг/кг нікотинаміду. Через 15 хв внутрішньоочеревинно вводили стрептозотоцин у дозі 55 мг/кг одноразово. Рівень глюкози в крові натще після індукції ЦД 2 типу вимірювали на 3-й день за допомогою портативного ручного глюкометра. Щури, в яких рівень глюкози в крові натще перевищував 13,9 ммоль/л (250 мг/дл), вважалися хворими на діабет і були включені в дослідження [31]. Решта 7 щурів стали здоровою контрольною групою.
Групи лікування
Після підтвердження діагнозу ЦД 2 типу на 3-й день експерименту кожна з шести груп щурів із діабетом щодня протягом 6 тиж отримували 15 мг/кг гліклазиду (n=7), 10 мг/кг раміприлу (n=7), 60 мг/кг АЛК перорально або комбінації цих препаратів, тоді як ще одна група щурів із діабетом (група контролю з діабетом; n=9) отримувала дистильовану воду. Масу тіла і рівень глюкози в крові вимірювали на 7-й, 14-й, 21-й, 28-й, 35-й та 42-й дні.
Через 6 тиж лікування у щурів проводили забір крові і сечі для аналізу, а також вилучали нирки та підшлункову залозу (ПЗ) для подальшого дослідження.
Підготовка і біохімічний аналіз плазми/сироватки, гістологічний аналіз, імуногістохімія
Зразки крові в пробірках ЕДТА і Еппендорф центрифугували зі швидкістю 3000 об./хв протягом 15 хв за температури 4 °C. Зразки плазми й сироватки, отримані в результаті центрифугування, зберігали в пробірках ЕДТА і Еппендорф відповідно за температури -20 °C. Рівні інсуліну в плазмі визначали за допомогою набору для радіоімунологічного аналізу (РІА). Також визначали рівні креатиніну плазми, загального білка, азоту сечовини крові, сечової кислоти, тригліцеридів (ТГ) і холестерину ліпопротеїнів високої щільності (ЛПВЩ) [32].
Рівні інтерлейкіну (IЛ) -1β і ІЛ‑6 (маркери запалення) також вимірювали за допомогою ELISA [33]. Рівні альбуміну в сечі визначали за допомогою автоматичного хімічного аналізатора і розраховували співвідношення альбумін/креатинін у сечі кожної групи. Функцію β-клітин оцінювали шляхом обчислення індексу HOMA-β за формулою:
20 × інсулін (мМО/мл) / (глюкоза (ммоль/л) – 3,5) [72].
Гістологічний аналіз проводили за методикою, описаною в попередніх роботах [35, 36].
Імуногістохімія
Дотримуючись стандартного протоколу перед фарбуванням PAS (за допомогою реактиву Шиффа), здійснювали імуногістохімічне фарбування зрізів нирок [35, 36]. Зрізи переглядали два досвідчених ниркових патологи і проводили кількісну оцінку під світловим мікроскопом, використовуючи подвійний сліпий підхід.
Визначення рівня малонового діальдегіду та вмісту глутатіону в нирках
Рівень малонового діальдегіду у сироватці крові і нирковій тканині визначали за описаною раніше методикою [37, 38] з деякими модифікаціями.
Уміст глутатіону в нирках визначали в гомогенатах нирок кожної групи за допомогою набору GSH-Glo™ від Promega (Медісон, Вісконсин, США), за раніше описаною методикою [34]. Приблизно 100 мг замороженої ниркової тканини з кожної групи гомогенізували в 1 мл крижаного 0,5% хлориду калію та обробляли ультразвуком протягом хвилини. Гомогенати центрифугували зі швидкістю 3000 об./хв за температури 4 °C протягом 10 хв, а надосадову рідину використовували разом зі стандартом глутатіону в тестовому наборі. Уміст ниркового глутатіону кількісно визначали за допомогою хемілюмінесценції в планшет-рідері SpectraMax 2.
Статистичний аналіз
Дані виражали як середнє значення ± стандартне квадратичне відхилення від середнього значення (SEM). Статистичний аналіз проводили за допомогою одностороннього дисперсійного аналізу (ANOVA) з наступним проведенням тесту Бонферроні за допомогою програмного забезпечення Prism (Prism 6, GraphPad Software, Inc., Сан-Дієго, Каліфорнія, США). Значення р між групами <0,05 вважали статистично значущим.
Результати
Протидіабетична терапія АЛК супроводжувалася підтриманням стабільної маси тіла, нормоінсулінемії та нормоглікемії
Індукція ЦД 2 типу призвела до значної втрати маси тіла, гіпоінсулінемії та гіперглікемії, що відображено на рисунку (A-C). Відсоткова зміна маси тіла в усіх групах лікування, за винятком щурів, що отримували тільки раміприл (група RAM) і раміприл з АЛК (група RAM+ALА), була достовірно позитивною проти групи контролю з діабетом (рис., A; p<0,001). Примітно, що потрійна комбінована терапія АЛК, гліклазином і раміприлом (ALA+GLC+RAM) супроводжувалася відновленням маси тіла щурів до значень, порівнянних із показниками здорової контрольної групи (рис., A). Крім того, середній рівень глюкози в крові був помітно вищим у нелікованих щурів із діабетом проти групи здорового контролю, що зумовлено зниженням функції β-клітин та рівня інсуліну (рис., B-D; p<0,001). Однак моно- і подвійна терапія супроводжувалася покращенням функції β-клітин, підвищенням рівня інсуліну та зниженням середньої глікемії, якщо порівняти з групою контролю з діабетом, хоча вони і не досягли відповідних рівнів групи здорового контролю (рис., B-D; p<0,05). Цікаво, що потрійна комбінована терапія запобігала цим суттєвим змінам і підтримувала функцію β-клітин, концентрації інсуліну і глюкози на рівнях, порівнянних із відповідними значеннями в групі здорового контролю (рис., B-D; p>0,05). Виражене зниження рівня інсуліну і підвищення середнього рівня глюкози в крові в групі контролю з діабетом відображає руйнування панкреатичних острівців Лангерганса, що впливає на β-клітини, які виробляють інсулін, порівняно з інтактними острівцями у здоровій контрольній групі. Моно- і подвійна терапія певним чином захищає острівці Лангерганса, проте найкращий захисний ефект спостерігався у щурів, які отримували потрійну комбіновану терапію: показники в цій групі були порівнянними з такими в групі здорового контролю. Таким чином, потрійна комбінована терапія з ALA, GLC і RAM забезпечувала підтримання маси тіла і збереження острівців Лангерганса та функції β-клітин при ЦД 2 типу, що супроводжувалося нормоінсулінемією та нормоглікемією.
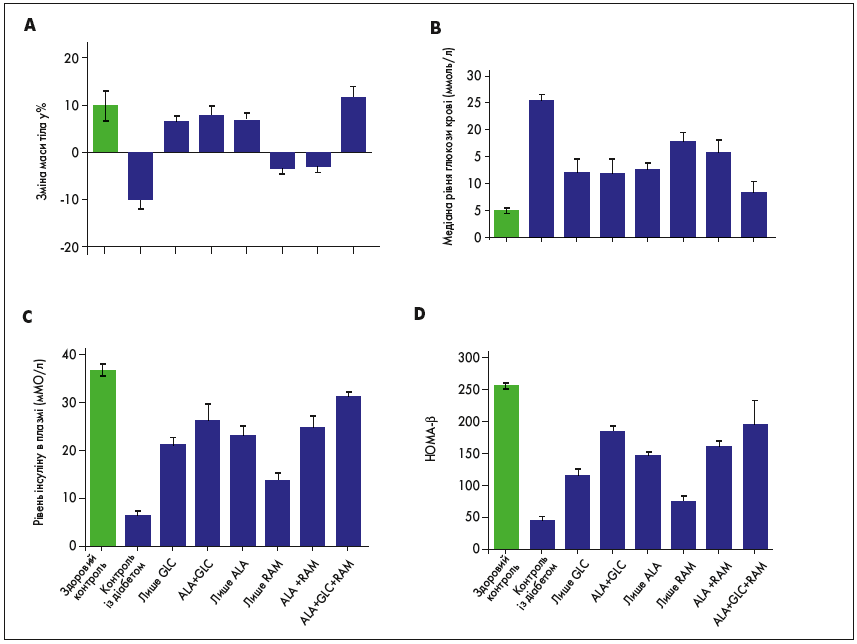 Рис. Зміни маси тіла і медіани рівня глюкози: (A) Відсоткова зміна маси тіла; (B) Медіана рівня глюкози в крові; (C) Рівень інсуліну в плазмі; (D) Функція β-клітин
Рис. Зміни маси тіла і медіани рівня глюкози: (A) Відсоткова зміна маси тіла; (B) Медіана рівня глюкози в крові; (C) Рівень інсуліну в плазмі; (D) Функція β-клітин
Доповнення протидіабетичної терапії АЛК запобігало прогресуванню ранньої ДН
Були досліджені гістопатологічні зміни в нирках після 6 тиж індукції та лікування ЦД 2 типу. Індукція ЦД 2 типу призвела до суттєвого пошкодження клубочкових і тубулярних відділів нирок проти нирок щурів групи здорового контролю (p<0,001). За винятком групи RAM, моно- і подвійна терапія за допомогою GLC, ALА та RAM достовірно запобігала гістопатологічним змінам у порівнянні з групою контролю з діабетом (p<0,01), але не в порівнянні з групою здорового контролю. Однак потрійна комбінація ALA, GLC і RAM достовірно запобігла цим морфологічним змінам, зводячи їх до рівня, порівнянного з групою здорового контролю (p>0,05). Крім того, моно- і подвійна терапія помітно зменшила відкладення колагену та експресію α-АГМ і захистила клітини ниркових канальців від апоптозу проти групи контролю з діабетом (p<0,05), причому найбільший ефект спостерігався у щурів, які отримували потрійну комбіновану медикаментозну терапію і чиї нирки мали характеристики, схожі з такими в щурів групи здорового контролю (p>0,05). Після цього вимірювали такі маркери функції нирок, як плазмові рівні креатиніну, сечової кислоти, загального білка, азоту сечовини крові, розраховували співвідношення альбумін/креатинін і встановлювали відносну вагу нирок. Відповідно до гістопатологічної оцінки ЦД 2 типу супроводжувався вираженим підвищенням плазмових рівнів креатиніну, азоту сечовини крові, сечової кислоти та співвідношення альбумін/креатинін у сечі і значним зниженням концентрації загального білка у плазмі проти таких рівнів у щурів здорової контрольної групи (p<0,05). Цікаво, що, тоді як моно- і подвійна терапія знижувала рівні цих маркерів функції нирок порівняно з нелікованими щурами групи контролю з діабетом, монотерапія раміприлом не супроводжувалася достовірним зниженням рівня креатиніну в плазмі порівняно з групою контролю з діабетом (p>0,05). Зазначимо, що потрійна комбінована терапія (ALA+GLC+RAM) знижувала рівні цих маркерів функції нирок до таких у групі здорового контролю, за винятком азоту сечовини крові, рівень якого був достовірно вищим, ніж у групі здорового контролю (p<0,05). Також оцінювали відносну вагу нирок шляхом обчислення співвідношення маси нирок до маси тіла у відсотках. Відносна маса нирок була значно вищою у щурів групи контролю з діабетом проти такої в щурів групи здорового контролю і щурів, які отримували різні види лікування (p<0,05). У сукупності ці результати демонструють, що лікування ЦД 2 типу комбінацією АЛК, гліклазину і раміприлу ефективніше захищає від прогресування ранньої ДН, ніж моно- і подвійна терапія.
Обговорення
Це дослідження показує, що доповнення традиційної антидіабетичної терапії AЛК нормалізує масу тіла, захищає острівці ПЗ та підтримує нормоглікемію, водночас зменшуючи пошкодження нирок, запалення та нирковий фіброз і покращуючи ліпідний профіль і нирковий антиоксидантний статус у разі ЦД 2 типу. Усі ці ефекти запобігали прогресуванню ДН і зрештою сприяли збереженню функції та цілісності нирок. Порівняно з групою здорового контролю, у щурів з індукованим ЦД 2 типу спостерігали підвищення рівня глюкози в 5 разів, а також виражену втрату маси тіла, що є поширеними ознаками неконтрольованого або нелікованого ЦД. Оскільки фармакологічне лікування ЦД потребує постійного моніторингу для оптимального глікемічного контролю, застосування гліклазиду, відомого похідного сульфонілсечовини ІІ покоління, який застосовують разом з іншими гіпоглікемічними засобами для лікування ЦД 2 типу, знизило рівень глюкози вдвічі, хоча й не допомогло досягнути нормоглікемічного рівня. Подібне спостерігалося і після використання АЛК. Терапія раміприлом також знижувала рівень глюкози у щурів із ЦД, однак рівень глікемії при цьому був значно вищим, ніж при монотерапії гліклазидом чи АЛК. І лише потрійна комбінована терапія АЛК, гліклазидом і раміприлом виражено знижувала глікемію до рівня, порівнянного з нормоглікемією. Хоча в цьому експерименті не досліджували складну взаємодію метаболічних і електрогенних механізмів, які регулюють виробництво і секрецію інсуліну β-клітинами панкреатичних острівців Лангерганса, отримані результати свідчать про синергічний ефект потрійної комбінованої терапії і/або активацію різних механізмів кожним із цих препаратів, що може частково сприяти стимулюванню вивільнення інсуліну з функціонуючих β-клітин ПЗ шляхом зниження проникності для іонів калію і підвищення чутливості периферичних тканин до інсуліну і, таким чином, знижувати інсулінорезистентність [39]. Крім того, спостерігався належний захисний вплив потрійної комбінованої терапії на острівці ПЗ. Це напряму корелювало з підвищеною функцією β-клітин і рівнями інсуліну в плазмі в межах здорових контрольних значень, що свідчить про збереження β-клітин, що виробляють інсулін. Це спостереження узгоджується з даними Yi та співавт. [40], які повідомили про захист β-клітин і покращення функції острівців після додавання АЛК на мишачій моделі ДН. Важливо зазначити, що АЛК має інсуліноміметичну активність, посилюючи активність рецепторів інсуліну, і таким чином забезпечує цитопротекцію через інгібування апоптотичного шляху [41]. Крім того, вона підвищує чутливість до інсуліну скелетних м’язів шляхом посилення плазмової транслокації білка – переносника глюкози підтипу 4 (GLUT 4) і стимуляції сигнальних шляхів AMP-активованої протеїнкінази (AMPK) [42, 43], а також фосфоінозитид‑3-кінази (PI3K), сприяючи фосфорилюванню тирозину в рецепторах інсуліну й покращуючи PI3K-залежне поглинання глюкози [41, 44, 45], усі з яких є важливими механізмами регулювання рівня глюкози. Описані механізми дії АЛК разом із добре відомим закриттям АТФ-чутливих калієвих каналів (у плазматичній мембрані β-клітин), що призводить до інфлюксу Ca2+ і Ca2+-залежного екзоцитозу гранул інсуліну під впливом сульфонілсечовини, наприклад гліклазиду [46-48], і помірним цукрознижувальним ефектом раміприлу, можуть пояснити відновлення нормоглікемії, яке спостерігали при застосуванні потрійної комбінованої терапії в нашому дослідженні. Незважаючи на те що цей синергічний ефект або активація різних механізмів при використанні потрійної комбінованої терапії може підвищити ризик гіпоглікемії, необхідні подальші дослідження, щоб оцінити згаданий ефект і визначити, чи буде необхідна корекція дози для довгострокового контролю глікемії.
Окрім вираженої ниркової експресії МПН‑1, яка спостерігалася в цьому дослідженні, в інтерстиції нирок щурів групи контролю з діабетом, які не отримували лікування, також визначали надмірне відкладення колагену і помітно підвищену експресію альфа-актину гладеньких м’язів (α-АГМ); обидві ознаки вказують на нирковий інтерстиційний фіброз [50]. Важливо зауважити, що після використання потрійної комбінованої терапії спостерігали значуще зниження відкладення колагену й експресії α-АГМ в нирковому інтерстиції, порівнянне з таким у нирках щурів групи здорового контролю, тоді як моно- і подвійна терапія не супроводжувалася подібним ефектом. Результати дослідження також свідчать про те, що активація фіброзного шляху відіграє важливу роль у ранньому розвитку та прогресуванні ДН, тому необхідні подальші дослідження для вивчення механізмів зниження експресії колагену, α-АГМ та, можливо, інших білків фіброзного шляху при застосуванні потрійної комбінованої терапії ЦД.
Фарбування TUNEL (метод, що виявляє апоптотичні клітини, які зазнають фрагментації ДНК на останній фазі апоптозу) виявило значний ступінь апоптозу клітин ниркових канальців щурів групи контролю з діабетом, які не отримували лікування, проте потрійна комбінована терапія надійно захищала клітини ниркових канальців від апоптозу порівняно з моно- і подвійною терапією. Потрійна комбінована терапія також суттєвіше, ніж моно- і подвійна терапія, зменшувала вираженість альбумінурії, яка є загальновизнаним маркером пошкодження клубочків і вважається найбільш раннім предиктором ДН та інших захворювань нирок, нормалізувала співвідношення альбумін/креатинін у сечі, а також рівні загального білка в плазмі.
Окрім впливу потрійної комбінованої терапії на вираженість протеїнурії також досліджували додаткові механізми запобігання ранньому прогресуванню ДН. Відомо, що гіперліпідемія, окислювальний стрес і запалення є основними патологічними факторами розвитку та прогресування ДН [10-14, 24, 40]. Хоча ці патологічні шляхи активувалися при індукції ЦД 2 типу, 6-тижнева моно- і комбінована терапія АЛК, гліклазидом і раміприлом пригнічувала їх, що супроводжувалося зниженням рівнів тригліцеридів у плазмі, IЛ-β, IЛ‑6 і сироваткового і ниркового малонового діальдегіду, підвищенням вмісту холестерину ЛПВЩ в плазмі крові та рівня глутатіону в нирках.
Таким чином, результати проведеного дослідження підтверджують, що раннє призначення фармакотерапії при ДН разом із доповненням традиційної протидіабетичної терапії АЛК запобігає ранньому розвитку і прогресуванню ДН при ЦД 2 типу. Додавання АЛК при ДН є ефективнішим фармакотерапевтичним підходом, ніж традиційна протидіабетична терапія, і забезпечує виражену нефпропротекторну дію.
Dugbartey et al. G.J. Supplementation of conventional anti-diabetic therapy with alpha-lipoic acid prevents early development and progression of diabetic nephropathy. Biomedicine & Pharmacotherapy. V. 149 (2022). 112818.
Список літератури – у редакції.
Підготувала Ганна Кирпач
Тематичний номер «Діабетологія, Тиреоїдологія, Метаболічні розлади» № 3 (59) 2022 р.



