24 вересня, 2022
Езетиміб в оптимальній гіполіпідемічній терапії у хворих на цукровий діабет: узгоджені позиції та дискусійні питання
Пацієнти із цукровим діабетом (ЦД) і діабетичною (атерогенною) дисліпопротеїнемією (ДЛП) мають високу схильність до розвитку серцево-судинних захворювань (ССЗ). Низкою настанов і рекомендацій щодо атеросклеротичних ССЗ (АССЗ) підтверджено внесення хворих на ЦД до категорії високого та дуже високого кардіоваскулярного ризику, а також переваги холестеринознижувальної терапії, а саме досягнення відповідного цільового значення холестерину (ХС) ліпопротеїнів низької щільності (ЛПНЩ) з метою профілактики АССЗ у цих пацієнтів. Однак пацієнти з дуже високим ризиком розвитку ССЗ частіше не досягають своєї терапевтичної мети, особливо це стосується хворих на ЦД.
Результати дослідження JUPITER (Justification for Use of Statins in Prevention: An Intervention Trial Evaluating Rosuvastatin) свідчать, що небезпека вперше виявленого ЦД 2 типу зростає у разі використання статинів (розувастатину) тільки в осіб, що мали значні чинники ризику ЦД 2 типу, зокрема порушення глікемії натще (ПГН). Окрім того, залишаються певні ризики, не повністю враховані зниженням рівня ХС ЛПНЩ. Потенційними чинниками є інсулінова резистентність (ІР), метаболічний синдром (МС) і патофізіологічні зміни ліпідного профілю (зокрема, невідповідний рівень малих щільних часточок ХС ЛПНЩ (мщ ХС ЛПНЩ) (найбільш атерогенної субфракції) та ремнантних ліпопротеїнів, що є значимим фактором ризику хронічного коронарного синдрому (ХКС). У пацієнтів із ЦД 2 типу, МС та/або верифікованими ССЗ переважає атерогенна ДЛП, що характеризується підвищеною концентрацією в крові триацилгліцеринів (ТГ), ліпопротеїнів, збагачених ТГ, часто з підвищеним умістом аполіпопротеїну (апо) B, «атерогенного» ХС і низьким умістом ХС ліпопротеїнів високої щільності (ЛПВЩ) та апоА-І.
Отже, затвердження стратегії ліпідного контролю, здатної контролювати ризики серцево-судинних (СС) подій з мінімізацією небезпеки виникнення ЦД 2 типу серед пацієнтів із ПГН при лікуванні статинами, є важливим питанням у сфері громадського здоров’я.
Інгібітори 3-гідроксил‑3-метилглутарил-коферменту А-редуктази (ГМГ-КоА-редуктази) завдяки широкому спектру позитивних ефектів широко використовуються для запобігання виникненню ССЗ. Однак застосування високоінтенсивної терапії статинами для досягнення цільового значення ХС ЛПНЩ, окрім небезпеки виникнення ЦД 2 типу, зумовлює появу ще частіших побічних ефектів і виразнішого СС-ризику. Ці обставини спричиняють потребу в дослідженнях щодо можливостей та опрацювання альтернативних методів зниження рівня ХС ЛПНЩ, окрім збільшення доз статинів як препаратів першого вибору.
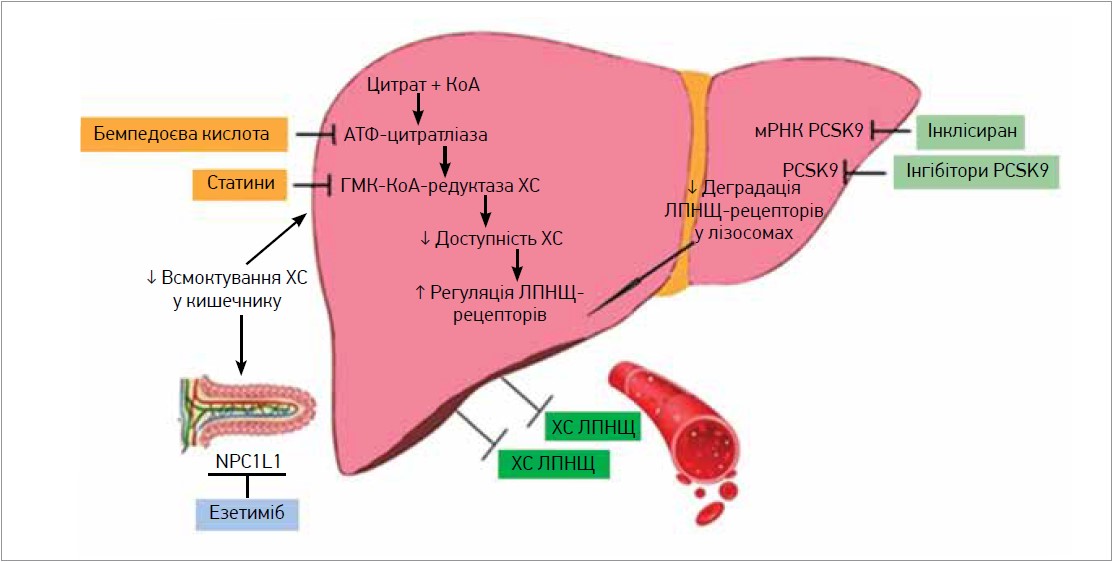
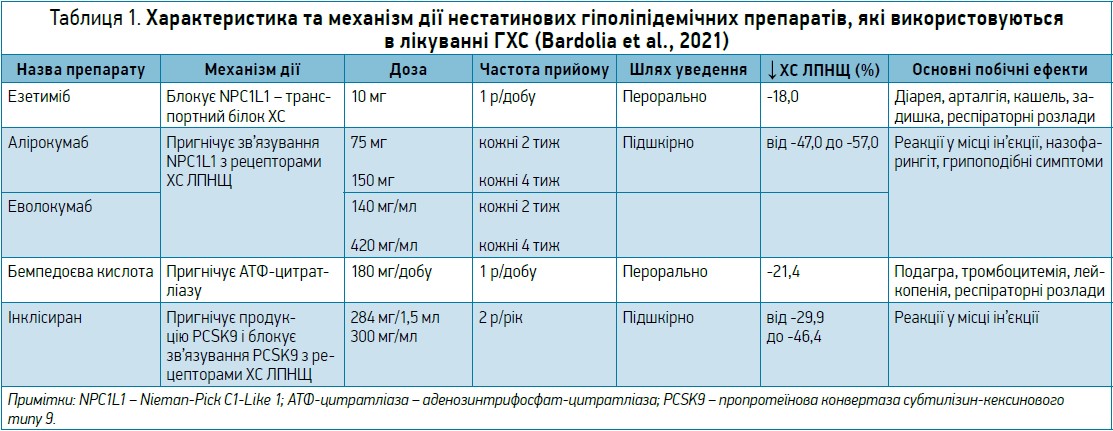
В таблиці 1 і на рисунку наведено характеристику та механізм дії нестатинових гіполіпідемічних препаратів, які використовуються в лікуванні гіперхолестеринемії (ГХС) (Bardolia et al., 2021).
Рис. Механізм дії основних нестатинових гіполіпідемічних препаратів (Bardolia et al., 2021)
Примітки: КоА – кофермент A; мРНК PCSK9 – матрична рибонуклеїнова кислота PCSK9.
Останніми десятиліттями з’явилася нова стратегія зниження рівня ХС шляхом пригнічення абсорбції ХС за допомогою езетимібу, який блокує транспортний білок ХС – NPC1L1. Оскільки статини підвищують усмоктування фракційного ХС, комбінована терапія з інгібіторами абсорбції ХС вважається перспективною та здійсненною стратегією, особливо для хворих на ЦД із високим рівнем NPC1L1. На сьогодні результати низки досліджень чітко продемонстрували, що порівняно з монотерапією інгібіторами ГМГ-КоА-редуктази комбінована терапія статином у поєднанні з езетимібом має більші клінічні переваги задля покращення параметрів ліпідів та кардіопротекції у пацієнтів із ЦД 2 типу із широким діапазоном чинників СС-ризику.
Езетиміб – це представник нового класу ліпідознижувальних препаратів, які селективно пригнічують інтестинальну абсорбцію ХС і відповідних рослинних стеролів. Лікарський препарат є перорально активним та має механізм дії, відмінний від інших класів гіполіпідемічних засобів (зокрема, статинів, секвестрантів жовчних кислот, фібратів і рослинних станолів). Езетиміб гальмує усмоктування (14C)-ХС без впливу на абсорбцію ТГ, жирних кислот, жовчних кислот, прогестерону, етинілестрадіолу чи жиророзчинних вітамінів А і D. Інгібуючи всмоктування ХС на рівні ворсинок слизової оболонки тонкого кишечнику (шляхом взаємодії з білком NPC1L1), езетиміб знижує кількість ХС, що надходить до печінки. У відповідь на зменшення надходження ХС печінка активує на поверхні рецептори ЛПНЩ (ЛПНЩ-рецептори), що супроводжується збільшенням кліренсу ХС ЛПНЩ з крові. Ліпідознижувальний препарат бере участь у регуляції рівня ХС ЛПНЩ-рецепторів; зменшує рівень ХС ЛПНЩ на 18-20%, ТГ (≈10%), незначно впливає на концентрацію ХС ЛПВЩ у крові (1-3%).
Лікарський препарат після перорального прийому швидко всмоктується та інтенсивно метаболізується в тонкому кишечнику й печінці шляхом кон’югації у фармакологічно активний фенольний глюкуронід (езетиміб-глюкуронід). Максимальна концентрація в плазмі крові езетиміб-глюкуроніду спостерігається через 1-2 год, езетимібу – через 4-12 год. Період напіввиведення для езетимібу й езетиміб-глюкуроніду становить ≈22 год, що дозволяє призначати його 1 р/добу (вранці чи ввечері). Екскреція препарату та його метаболітів відбувається здебільшого із жовчю. За даними фармакокінетичних досліджень, не спостерігалося суттєвих відмінностей концентрацій езетимібу в плазмі крові в людей літнього віку, осіб чоловічої та жіночої статі чи залежності концентрації препарату від прийому їжі.
За даними Cosentino і співавт. (2020), езетиміб має такі ефекти:
- ХС ЛПНЩ на 10-18% за рахунок пригнічення абсорбції ХС із кишечнику та зменшення транспортування до печінки, що спричиняє підвищення експресії печінкових ЛПНЩ-рецепторів (здебільшого);
- апоВ на 11-16%;
- ХС ЛПНЩ на 25%, загальний рівень ХС ЛПНЩ на 34-61% (у поєднанні зі статинами);
- ХС ЛПНЩ на 20-22% і апоB на 25-26% без зниження рівня ХС ЛПВЩ (у поєднанні з фенофібратом).
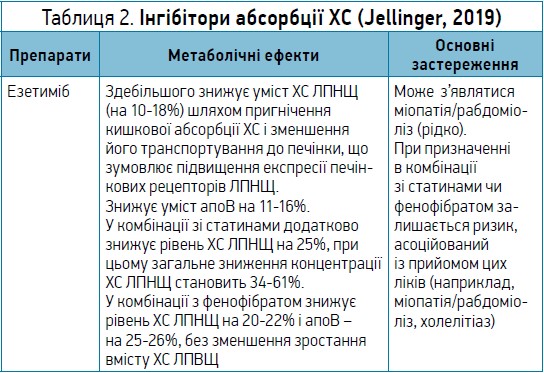
У таблиці 2 наведено особливості й основні характеристики інгібіторів абсорбції ХС (Jellinger, 2019).
Важливо зазначити, що монотерапія (як препаратами класу інгібіторів ГМГ-КоА-редуктази, так і інгібіторами абсорбції ХС) активує фізіологічні компенсаторні механізми, спрямовані на підтримання рівня ХС у плазмі крові. На тлі зниження рівня ХС, опосередкованого дією статинів, компенсаторно збільшується абсорбція ХС у кишечнику. І навпаки, гальмування абсорбції ХС у кишечнику за допомогою езетимібу може зумовлювати компенсаторне збільшення синтезу ХС у гепатоцитах і периферичних тканинах. Отже, езетиміб пригнічує абсорбцію ХС, зменшуючи транспортування інтестинального ХС до печінки; статини знижують синтез ХС у печінці, а разом ці механізми забезпечують додаткове зниження рівня ХС.
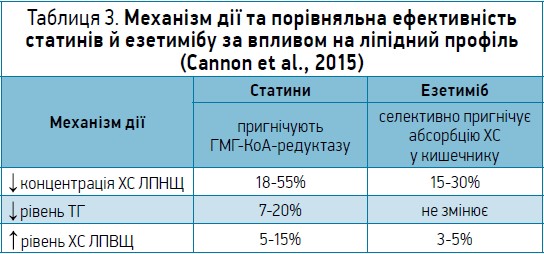
У таблиці 3 наведено відомості про особливості гіполіпідемічної ефективності статинів та езетимібу (Cannon et al., 2015).
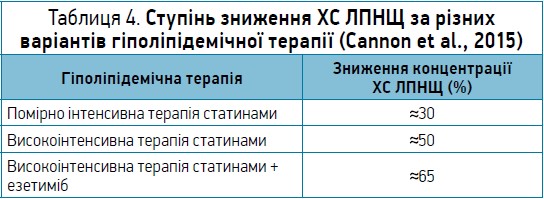
У таблиці 4 наведено розрахунок ступеня зниження ХС ЛПНЩ за різних варіантів гіполіпідемічної терапії (Cannon et al., 2015).
У дослідженнях, під час проведення котрих вивчали ефективність езетимібу, здебільшого порівнювали ефективність з плацебо чи статином або додавали езетиміб до схеми лікування препаратами інгібіторів ГМК-КоА-редуктази.
В перших двох варіантах отримані клінічні дані навряд чи можна вважати інформативними, оскільки вплив езетимібу на зниження рівня ХС є відносно слабким порівняно з ефектами статинів, а кардіопротекторні властивості інгібіторів ГМК-КоА-редуктази продемонстровано за різних захворювань, тому монотерапія езетимібом зазвичай не використовується. Додавання езетимібу до статину може бути вдалим варіантом для подальшого зниження рівня ХС ЛПНЩ. Зокрема, повідомляється про додаткові кардіопротекторні ефекти комбінованої терапії статином у поєднанні з езетимібом порівняно з монотерапією інгібіторами ГМК-КоА-редуктази.
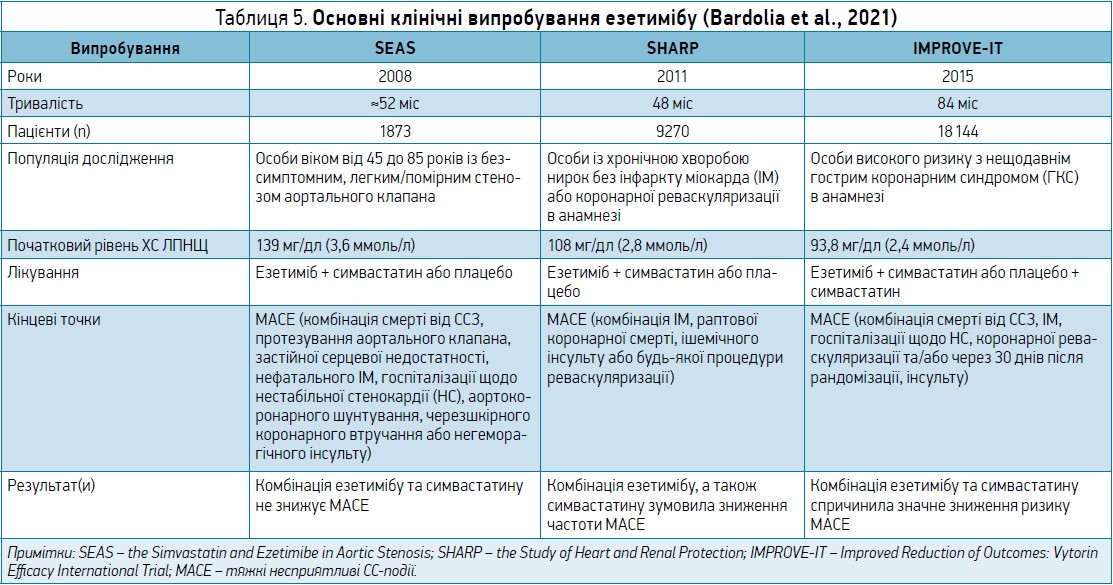
Міжнародні програми клінічних досліджень езетимібу в поєднанні зі статинами містили низку великих випробувань з інструментальними та твердими клінічними кінцевими точками, до основних з яких слід віднести SEAS (2008), SHARP (2011) і IMPROVE-IT (2015).
У таблиці 5 наведено інформацію про основні клінічні випробування езетимібу (Bardolia et al., 2021).
У випробуванні IMPROVE-IT, результати котрого опубліковано у 2015 р., 18 144 хворих, госпіталізованих щодо ГКС, котрі мали відносно невисокий рівень ХС ЛПНЩ (1,3-3,2 ммоль/л, або 50-125 мг/дл), отримували монотерапію симвастатином або ж його поєднанням з езетимібом протягом 7 років. Через 1 рік спостереження середній рівень ХС ЛПНЩ у групі комбінованої терапії становив 1,4 ммоль/л, що було на 0,4 ммоль/л менше, ніж у пацієнтів, які отримували симвастатин. У хворих, котрі знаходилися на комбінованій терапії інгібітором ГМГ-КоА-редуктази й езетимібом, спостерігалися значне зменшення показників смертності від ССЗ, ГКС, госпіталізації щодо НС, коронарної реваскуляризації та інсульту на 6,4%, а також зниження частоти абсолютного ризику (R) розвитку СС-ускладнення або смерті внаслідок ССЗ на 2,0%.
За допомогою проведення низки досліджень продемонстровано, що езетиміб чинить сприятливий та/або нейтральний вплив на метаболізм глюкози в пацієнтів із ЦД 2 типу. Повідомляється про позитивні ефекти езетимібу на стан ІР і рівень глікемії. Зокрема, езетиміб у мишей KK/H1J із діабетом 2 типу, які знаходилися на дієті з високим умістом жиру, сприяв позитивній динаміці вмісту глюкози та параметрів ІР. Спостерігалися збільшення концентрації глюкагоноподібного пептиду‑1 (GLP‑1) у сироватці крові, активних форм GLP‑1 у кишечнику; відсутність змін екскреції генів мРНК, залучених до синтезу GLP‑1. Продемонстровано, що езетиміб значно стимулював секрецію активного GLP‑1, що супроводжувалося активацією мітоген-активованого білка/кінази, яка регулюється позаклітинним сигналом (MEK)/позаклітинної сигнал-регульованої кінази (ERK). Езетиміб-стимульована секреція GLP‑1 скасовувалася в результаті пригнічення шляху MEK/ERK за допомогою PD98059 (високоселективного інгібітора активації MEK1 in vitro). Отже, ймовірно, що езетиміб задіяний у контролі глікемії шляхом стимуляції секреції GLP‑1 ендокринними клітинами L-типу епітелію кишечнику через сигнальний шлях MEK/ERK.
Повідомляється про позитивну динаміку індексу ІР – HOMA-IR (Homeostasis Model Assessment of Insulin Resistance) після призначення езетимібу 10 мг/добу хворим із ГХС, у 30% з яких було діагностовано ЦД 2 типу чи ПГН. Отримані результати становлять особливу зацікавленість у контексті доказів асоціації статинотерапії з невеликим збільшенням ризику нових випадків ЦД 2 типу. Отже, додавання езетимібу до статину було б найдоцільнішим для нейтралізації діабетогенного ефекту інгібіторів ГМК-КоА-редуктази та підвищення чутливості тканин до інсуліну.
Nakamura та співавт. (2019) повідомляють, що езетиміб знижує рівні постпрандіального інсуліну та ТГ у пацієнтів із МС, а також припускають, що фармакологічний препарат має потенційні позитивні ефекти на стан ІР. Результати метааналізу 16 рандомізованих контрольованих досліджень (РКД), проведеного H. Wu та співавт. (2018), продемонстрували, що комбіноване використання езетимібу з низькоінтенсивною (порівняно з високоінтенсивною) терапією статинами не супроводжувалося суттєвою різницею в змінах рівня препрандіальної глюкози та глікованого гемоглобіну A1c (HbA1c). Автори акцентують увагу на тому, що порівняно з високоінтенсивною терапією статинами застосування схеми лікування езетиміб із низькоінтенсивною терапією інгібіторами ГМК-КоА-редуктази протягом >3 міс може сприятливо впливати на стан контролю глікемії, зокрема на рівень препрандіальної глюкози. Однак у 2021 р. опубліковано результати Propensity-Matched Nationwide Cohort Study щодо дослідження ефективності комбінації статинів і езетимібу порівняно з монотерапією препаратами інгібіторів ГМГ-КоА-редуктази та небезпеки розвитку ССЗ, а також ЦД 2 типу в дорослих із порушеною толерантністю до глюкози. Повідомляється про таке: незважаючи на те що тривалість терапії як статинами, так і комбінацією статину з езетимібом становила не менше 6 міс, додавання езетимібу до препарату із групи інгібіторів ГМГ-КоА-редуктази (порівняно з монотерапією статинами) не підвищує ризику ЦД 2 типу та характеризується нейтральним ефектом. За аналогією в ретроспективному дослідженні, до якого було залучено 877 пацієнтів із ДЛП, високоінтенсивна терапія статинами асоціювалася з вищим ризиком уперше діагностованого ЦД 2 типу, особливо в осіб із переддіабетом, проте додавання езетимібу до інгібітора ГМГ-КоА-редуктази продемонструвало нейтральний ефект щодо стану метаболізму глюкози.
Wu та співавт. (2018) провели в PubMed, EMBASE та Кокранівській бібліотеці метааналіз публікацій, які стосувалися РКД щодо порівняння ефективності впливу езетимібу із плацебо, додавання езетимібу до статинів, або низькоінтенсивної терапії інгібітором ГМГ-КоА-редуктази в поєднанні з езетимібом, або комбінованого використання езетимібу з високоінтенсивною терапією статинами на вміст препрандіальної глікемії та HbA1c До огляду було внесено результати 16 РКД. Показано, що призначення езетимібу не сприяло розвитку побічних ефектів щодо вмісту глюкози натще (зважена середня різниця середніх (WMD) -0,62; 95% довірчий інтервал (ДІ) від -3,13 до 1,90) і HbA1c (WMD 0,07; 95% ДІ від -0,07 до 0,20%). Лікування езетимібом і використання низькоінтенсивної (порівняно з високоінтенсивною) терапії інгібіторами ГМГ-КоА-редуктази не супроводжувалося суттєвими змінами концентрації препрандіальної глікемії (WMD -1,78; 95% ДІ від -6,33 до 2,77%) і HbA1c (WMD -0,05; 95% ДІ -0,14 до 0,05%). Продемонстровано, що порівняно із хворими, які знаходилися на високоінтенсивній терапії статинами, виразніше зниження рівня глюкози натще спостерігалося в пацієнтів, котрі отримували езетиміб у поєднанні з низькоінтенсивною терапією інгібіторами ГМГ-КоА-редуктази >3 міс (WMD -7,12; 95% ДІ від -13,86 до -0,38%). Отже, результати метааналізу дозволяють стверджувати, що комбінування езетимібу з низькоінтенсивною терапією статинами тривалістю >3 міс (порівняно з високоінтенсивною) має позитивну тенденцію на стан контролю глікемії.
Результати клінічного відкритого багатоцентрового дослідження EUCLID (The Effect of Switching from Statin-Monotherapy to Statin / Ezetimibe Combination Therapy on Lipid Profiles in Patients with Type 2 Diabetes and Dyslipidemia), завершеного у 2020 р., свідчать, що додаткове призначення пацієнтам із ЦД 2 типу езетимібу до статинів протягом 12 міс не вплинуло на параметри глікемії, що демонструє клінічну користь комбінованої терапії інгібітором ГМГ-КоА-редуктази та селективного інгібітора абсорбції ХС і фітостеролів у тонкому кишечнику. Крім того, показники вмісту залишкового ХС, маркера атерогенних ліпідів мали тенденцію до зниження протягом інтервалу спостереження в хворих, які досягли цільового рівня ХС ЛПНЩ через 12 міс. Отже, в зазначеному дослідженні не спостерігалося очевидного ефекту комбінованого використання езетимібу зі статинами на вміст маркерів запалення, зокрема окисненого ХС ЛПНЩ і високочутливого С-реактивного білка (hs-CRP). Отримані результати частково узгоджуються з висновками дослідження RESEARCH Study Group (2015), у якому показано, що використання низькоінтенсивної терапії інгібіторами ГМГ-КоА-редуктази в поєднанні з езетимібом, а також включення езетимібу до високоінтенсивного режиму статинотерапії покращувало атерогенні ліпідні профілі, в т. ч. уміст залишкового ХС. Імовірно, завдяки модуляції ліпідного обміну й атерогенних шляхів триваліше лікування з комбінованим використанням езетимібу зі статинами також може сприяти покращенню цих показників.
Результати Propensity-Matched Nationwide Cohort Study (2021) довели, що призначення езетимібу на додаток до терапії статинами в дорослих пацієнтів із ПГН (порівняно з монотерапією інгібіторами ГМГ-КоА-редуктази) не було пов’язане зі значними відмінностями щодо ризику виникнення ЦД 2 типу та ССЗ. Автори повідомляють, що комбіноване використання езетимібу зі статинами є таким самим ефективним щодо попередження ГКС та інсульту в пацієнтів із ПГН, як і монотерапія інгібіторами ГМГ-КоА-редуктази. Водночас продемонстровано, що додавання езетимібу до певної дози статинів сприяє покращенню СС-наслідків у дорослих пацієнтів, які нещодавно перенесли ГКС. Підтвердженням цьому є висновки клінічного випробування Y. B. Lee та співавт., проведеного у 2021 р. Автори вважають, що езетиміб можна безпечно комбінувати зі статинами в пацієнтів із ПГН, особливо в хворих із незадовільною толерантністю до підвищення дози інгібіторів ГМГ-КоА-редуктази.
Shin і Choi (2022) провели метааналіз 17 публікацій, присвячених порівняльному аналізу впливу комбінованої терапії інгібіторами ГМГ-КоА-редуктази з езетимібом і монотерапії статинами на показники вмісту ліпідів та глюкози в крові, а також аналізу відмінностей у побічних ефектах, пов’язаних із лікуванням у хворих на ЦД. Автори повідомили, що загалом додавання езетимібу до статину забезпечувало значно виразніше зниження вмісту ХС ЛПНЩ, ніж монотерапія статинами (WMD 0,691; 95% ДІ 0,534-0,847). Комбіноване використання езетимібу зі статинами сприяло позитивнішим ефектам у змінах рівнів ХС ЛПВЩ, загального ХС (ЗХС), ТГ і апоВ, однак не апоA1. Окрім того, комбіноване лікування супроводжувалося зменшенням рівня препрандіальної глікемії значніше за монотерапію статинами. Що стосується безпеки, то між двома методами лікування не було суттєвих відмінностей у побічних ефектах, пов’язаних з лікуванням. Автори дійшли висновку, що додавання езетимібу до статину (порівняно з монотерапією інгібіторами ГМГ-КоА-редуктази) сприяє виразнішому позитивному впливу на провідні параметри вмісту ліпідів у крові без збільшення ризику розвитку побічних ефектів.
Метою багатоцентрового проспективного відкритого пілотного дослідження EUCLID (2020 р.) (The Ezetimibe add-on to statin for Usability Clinical trial on Lipid profile and Inflammation in hypercholesterolemia with Diabetes mellitus), проведеного в 6 лікарнях Японії, було дослідити терапевтичний ефект переходу від монотерапії статинами до комбінованої терапії інгібіторами ГМГ-КоА-редуктази з езетимібом на ліпідний та метаболічний профілі в пацієнтів із ЦД 2 типу й ДЛП, а також рівень HbA1c ≤9,0%. Пацієнти із ЦД 2 типу та ДЛП отримували протягом 12 міс (як доповнення до основного лікування статинами) езетиміб 10 мг/добу.
Основні висновки EUCLID:
1) перехід від монотерапії інгібіторами ГМГ-КоА-редуктази до комбінованого використання езетимібу зі статинами в пацієнтів із ЦД 2 типу та ДЛП супроводжувався ефективним зниженням концентрації ХС ЛПНЩ без негативного впливу на показники препрандіальної глікемії;
2) комбінована терапія є ефективнішою в хворих із вищим вихідним рівнем ХС ЛПНЩ порівняно з результатами, отриманими в пацієнтів із нижчою концентрацією ХС ЛПНЩ;
3) пацієнти з вищим початковим рівнем ЗХС і ХС ЛПНЩ можуть потребувати подальшого інтенсивного лікування для досягнення цільового рівня ХС ЛПНЩ, особливо це стосується хворих із високим ризиком СС-подій.
Torimoto та співавт. (2013) провели порівняльне 12-тижневе дослідження в хворих на ЦД 2 типу з рівнем ХС ЛПНЩ ≥2,07 ммоль/л (80,5 мг/дл), які отримували лікування розувастатином (2,5 мг/добу). Пацієнтів розподіляли до таких груп: перша (додаткової терапії езетимібом у дозі 10 мг/добу) чи друга (збільшення дози розувастатину до 5 мг/добу). Встановлено, що комбінована терапія розувастатином з езетимібом сприяла виразнішому зниженню рівня ХС ЛПНЩ (-31% у 1-й групі та -12% – у 2-й); мщ ХС ЛПНЩ і окиснених ЛПНЩ у сироватці крові. Лише в хворих на ЦД 2 типу, які знаходилися на комбінованій терапії інгібітором ГМГ-КоА-редуктази з езетимібом спостерігалося значне зниження рівня ТГ. Багатофакторний аналіз виявив, що додаткова терапія езетимібом сприяла виразнішому покращенню рівня ХС ЛПНЩ. Отже, комбіноване використання езетимібу зі статинами досягає не лише кількісного, а і якісного покращення рівня ліпідів у сироватці крові в пацієнтів із ЦД 2 типу; а це означає, що таке використання може сприяти гальмуванню прогресування атеросклерозу.
Hwang та співавт. (2019) повідомили результати одноцентрового рандомізованого відкритого активно-контрольованого випробування серед 36 пацієнтів із ЦД 2 типу, рандомізованих з метою монотерапії розувастатином (20 мг/добу) або комбінованого використання розувастатину з езетимібом (5 мг/10 мг/добу). Після 6-тижневого лікування зниження рівня ХС ЛПНЩ і апоВ було зіставним між двома групами (р=0,54 і р=0,86 відповідно). Відомо, що зміни показників співвідношення aпoB/апоA1 є сильнішим провісником ССЗ, ніж параметри рутинної ліпідограми. Авторами повідомляється, що зміни aпoB/апоA1 (-0,44±0,16 у хворих, які знаходилися на монотерапії препаратом із групи інгібіторів ГМГ-КoА-редуктази, та -0,47±0,25 у групі розувастатину з езетимібом) не відрізнялися між собою. З іншого боку, зниження вмісту ТГ, а також вільних жирних кислот (ВЖК) було більшим у групі комбінованого використання розувастатину в комбінації з езетимібом, ніж у пацієнтів, які знаходилися на монотерапії інгібітором ГМГ-КoА-редуктази (-10,5 мг/дл (міжквартильний діапазон (IQR) від -37,5 до 29,5) і 0,0 мкЕкв/л (IQR від -136,8 до 146,0) у групі монотерапії інгібітором ГМГ-КoА-редуктази -49,5 мг/дл (IQR від -108,5 до -27,5) та -170,5 мкЕкв/л (IQR від -353,0 до 0,8) у групі езетимібу в поєднанні з розувастатином (р=0,010 і р=0,049 відповідно). 6-тижнева комбінована низькоінтенсивна терапія розувастатином та езетимібом у пацієнтів із ЦД 2 типу продемонструвала виразніше зниження рівня ТГ і ВЖК порівняно з помірно інтенсивною монотерапією інгібітором ГМГ-КoА-редуктази. Крім того, продемонстровано, що призначення хворим на ЦД 2 типу 10 мг езетимібу на добу протягом 6 міс було ефективнішим за 5 мг аторвастатину на добу щодо зменшення концентрації ВЖК у плазмі крові, незважаючи на статистично значуще зниження рівня ЗХС і ХС ЛПНЩ у пацієнтів, які знаходилися на монотерапії інгібітором ГМГ-КoА-редуктази.
До рандомізованих багатоцентрових відкритих проспективних досліджень RESEARCH Study Group (Recognized Effect of Statin and Ezetimibe therapy for Achieving the LDL-C goal) (2013 р.) і Effect of ezetimibe add-on therapy over 52 weeks extension analysis of prospective randomized trial (RESEARCH study) in type 2 diabetes subjects (2017 р.) залучали пацієнтів із ЦД 2 типу, в котрих, незважаючи на терапію 10 мг аторвастатином або 1 мг пітавастатином, не досягнуто цільового рівня ХС ЛПНЩ. Між такими групами пацієнтів здійснено проведення аналізу ефективності зниження концентрації ХС ЛПНЩ: призначення 10 мг езетимібу в комплексі з 1 мг пітавастатину чи комбіноване використання 10 мг езетимібу з 10 мг аторвастатину (EAT-групи); 20 мг аторвастатину або 2 мг пітавастатину (DST-групи з подвійною дозою інгібітора ГМГ-КоА-редуктази). Первинний аналіз – 12 тиж, остаточний – 52 тиж. Продемонстровано, що в EAT- та DST-групах хворих протягом 52-тижневого періоду лікування досягнуто статистично значуще зменшення концентрації ХС ЛПНЩ і hs-CRP. Важливо, що додаткова терапія езетимібом (EAT-групи) порівняно з пацієнтами, залученими до DST-групи, продемонструвала значну перевагу щодо зниження рівня ХС ЛПНЩ, ліпопротеїнів проміжної щільності (ЛППЩ), ТГ, апоВ та досягнення цільових значень ХС ЛПНЩ. Окрім того, комбіноване використання езетимібу зі статинами посприяло значному зниженню концентрації мщ ЛПНЩ. Отже, режим включення езетимібу до базового рівня статину показав кращі результати щодо покращення ліпідного профілю в пацієнтів із ЦД 2 типу. Зокрема, спостерігалося виразніше відсоткове й абсолютне зниження вмісту ХС ЛПНЩ, ніж стратегія, застосована у DST-групах.
Мета Multicenter Randomized Controlled PRECISE-IVUS Trial (2015 р.) – провести порівняльне дослідження ефективності застосування езетимібу й аторвастатину (одночасного) з монотерапією аторвастатином у пацієнтів із ХКС, близько у 30% з яких діагностовано ЦД. Установлено, що використання терапії езетимібом у поєднанні з аторвастатином протягом 9-12 міс супроводжувалося значнішим зменшенням рівня ХС ЛПНЩ, незважаючи на те що титрування аторвастатину було спрямоване на досягнення цільового рівня ХС ЛПНЩ <70 мг/дл. За результатами дослідження не виявлено жодних відмінностей між групами пацієнтів у динаміці концентрації мщ ЛПНЩ або hs-CRP, однак установлено, що додаткова терапія езетимібом сприяла значному зниженню вмісту ліпопротеїнів дуже низької щільності (ЛПДНЩ).
Razzack і співавт. (2021) провели пошук у базах даних (Medline, Scopus, Embase, Cochrane) з метою порівняння й узагальнення ефектів змін умісту ліпідів у результаті комбінованого лікування езетимібом і статинами та монотерапії інгібіторами ГМГ-КоА-редуктази в хворих на ЦД 2 типу. Розрахунок середньої різниці проводився з використанням дихотомічних змінних та безперервних числових даних для вибраних значень із застосуванням моделі випадкових ефектів за методом Мантеля Хензеля. Установлено, що комбінована терапія езетимібом і статином корелювала з більшою середньою відсотковою зміною показників умісту ХС ЛПНЩ (WMD -17,9; 95% ДІ -19,85 до -14,54; p=0,78). Статистично значуща різниця (WMD -20,36; 95% ДІ -25,67 до -15,06; p=0,92) спостерігалася в підгрупі симвастатину. Повідомляється про значне зменшення рівнів апоВ у пацієнтів, які знаходилися на комбінованій терапії (WMD -6,6; 95% ДІ від -8,40 до -3,91; p=0,20). Крім того, не спостерігалося суттєвих відмінностей між двома методами лікування в частоті побічних ефектів, пов’язаних із прийомом препаратів. Автори дійшли висновку, що езетиміб як доповнення до монотерапії інгібіторами ГМГ-КоА-редуктази сприяє значному зниженню рівнів апоВ (провісника майбутніх ССЗ), а також показників умісту ХС ЛПНЩ.
Hong і співавт. у 2018 р. опублікували результати метааналізу та метарегресійного аналізу РКД за участю 50 хворих (24 тиж спостереження), під час яких порівнювали ефекти комбінованого використання езетимібу й статинів із монотерапією препаратами із групи інгібіторів ГМГ-КоА-редуктази або плацебо-контрольованої групи. Один із критеріїв включення – повідомлення про тяжкі несприятливі СС-події (MACE). Проаналізовано загалом 7 випробувань із 28 191 зареєстрованим пацієнтом (7298 із ЦД 2 типу, 25,9%); середній період спостереження – 5 років. Установлено, що комбінована терапія езетимібом і статином у хворих на ЦД 2 типу сприяла виразнішому зниженню ризику MACE, ніж у пацієнтів за відсутності ЦД. Автори з огляду на отримані результати вважають, що комбінована терапія езетимібом і статином у пацієнтів із ЦД асоціюється з більшою користю для стану СС-системи.
Miao та співавт. (2019) на основі метааналізу публікацій в електронних базах даних провели оцінку ефективності терапії статином і езетимібом порівняно з монотерапією препаратом із групи інгібіторів ГМГ-КoА-редуктази щодо зниження поширеності ССЗ та/або цереброваскулярних захворювань у пацієнтів із ЦД чи без нього. До метааналізу було внесено 8 досліджень: 136 893 особи; 80 790 хворих на ЦД, 85 555 без ЦД; вік – 63,5 року (95% ДІ 61,2; 65,8); 61,5% (95% ДІ 55,2; 67,8) – чоловіки. Тривалість спостереження становила 45 міс (95% ДІ 27,5; 62,5). Установлено, що ризик ССЗ був значно меншим при поєднанні езетимібу зі статином, ніж при монотерапії інгібіторами ГМГ-КoА-редуктази як при ЦД (відносний ризик (ВР) 0,69; 95% ДІ 0,67; 0,73; p<0,00001), так і в пацієнтів без порушень вуглеводного обміну (ВР 0,68; 95% ДІ 0,52; 0,90; p=0,006). Ризик поширеності інсульту був значно меншим при додаванні езетимібу до статину, ніж за монотерапії статинами в разі ЦД (ВР 0,74; 95% ДІ 0,56; 0,98; р=0,03), однак незначно меншим у пацієнтів без ЦД (ВР 0,74; 95% ДІ 0,39; 1,41; p=0,39). Автори дійшли висновку, що комбіноване використання езетимібу зі статинами є ефективнішим у зниженні частоти ССЗ без істотної різниці між хворими на ЦД і пацієнтами без порушень вуглеводного обміну, ніж монотерапія інгібіторами ГМГ-КoА-редуктази.
The IMPROVE-IT Investigators. Benefit of Adding Ezetimibe to Statin Therapy on Cardiovascular Outcomes and Safety in Patients With Versus Without Diabetes Mellitus (2018 р.): до дослідження було залучено 18 144 пацієнтів, з яких 4933 (27%) становили хворі на ЦД 2 типу після перенесеного протягом останніх 10 днів ГКС із рівнем ХС ЛПНЩ 50-125 мг/дл (1,3-3,2 ммоль/л). Хворі були рандомізовані з метою призначення комбінованого використання езетимібу із 40 мг симвастатину чи плацебо / 40 мг симвастатину. Первинна кінцева точка – це смерть унаслідок СС-причин/інсульту. Встановлено, що поєднання езетимібу з інгібітором ГМГ-КоА-редуктази (незалежно від верифікованого діагнозу ЦД / відсутності ЦД) сприяло досягненню значно нижчого середньозваженого значення середньої арифметичної медіани рівня ХС ЛПНЩ порівняно із плацебо / 40 мг симвастатину. Комбіноване використання езетимібу зі статинами в пацієнтів із ЦД 2 типу сприяло зниженню 7-річної частоти первинних кінцевих подій, визначених за допомогою кривих Каплана-Мейєра, на 5,5% в абсолютному значенні (коефіцієнт ризику (КР) 0,85; 95% ДІ 0,78-0,94); у пацієнтів без ЦД абсолютна різниця становила 0,7% (КР 0,98; 95% ДІ 0,91-1,04). Стратифікація за шкалою ризику TIMI (Thrombolysis in Myocardial Infarction) Risk Score for Secondary Prevention (шкала Morrow і Antman для ГКС із підйомом сегмента ST) виявила, що в усіх хворих на ЦД 2 типу, які знаходилися на комбінованому використанні езетимібу зі статинами, незалежно від ступеня ризику спостерігався позитивний ефект. Дані IMPROVE-IT свідчать, що результати комбінованої терапії езетимібу із препаратом із групи інгібіторів ГМГ-КoА-редуктази є значимішими в хворих на ЦД, а також у пацієнтів групи високого ризику без діагностованих порушень вуглеводного обміну. Отже, в хворих на ЦД спостерігалася значно більша відносна й абсолютна користь у покращенні наслідків ССЗ, ніж у пацієнтів без ЦД, яка була зумовлена зменшенням частоти гострих ішемічних подій, у т. ч. ГКС, ішемічний інсульт. Важливо, що переваги езетимібу досягнуті без збільшення випадків безпеки порівняно із плацебо.
Мета дослідження Yu та співавт. (2020) полягала в тому, щоб на ґрунті пошуку в PubMed і EMBASE порівняти й узагальнити ефекти зміни вмісту ліпідів у результаті комбінованого лікування езетимібом та статинами (E/S), а також монотерапії подвійною дозою препарату із групи інгібіторів ГМГ-КoА-редуктази (D/S) у пацієнтів із ГХС. Проведено аналіз результатів лише рандомізованих плацебо-контрольованих, подвійно сліпих клінічних досліджень, під час яких досліджували зміни концентрації ХС ЛПНЩ, ЗХС і ХС ЛПВЩ. Первинною кінцевою точкою РКД були рівні ХС ЛПНЩ, ЗХС і ХС ЛПВЩ, у кінцевій точці виражені як середнє значення та стандартне відхилення. Загалом проведено метааналіз результатів 11 РКД із 1926 дорослими пацієнтами із ГХС, рандомізованими для призначення езетимібу 10 мг у поєднанні зі статинами чи подвійної дози інгібіторів ГМГ-КoА-редуктази. Отримані результати свідчать, що в пацієнтів групи E/S (порівняно із групою D/S) зафіксовано значно нижчий рівень ХС ЛПНЩ (зважена різниця середніх (MD) -13,14 мг/дл; 95% ДІ -16,83; -9,44; p=0,00001) і концентрацію ЗХС (MD -23,79 мг/дл; 95% ДІ -38,65; -8,93; p=0,002) від вихідного рівня. Не спостерігалося суттєвих відмінностей між показниками вмісту ХС ЛПВЩ. Комбіноване використання езетимібу з 10 мг аторвастатину (MD -16,98 мг/дл; p<0,0001) чи застосування 20 симвастатину (MD -17,35 мг/дл; p<0,0001) довело сильнішу здатність знижувати рівень ХС ЛПНЩ, ніж поєднання езетимібу з 10 мг розувастатину (MD -9,29 мг/дл; p=0,05). Ефективність короткострокового (6-16 тиж) і тривалого (52 тиж) лікування не виявила істотних відмінностей у вмісті ХС ЛПНЩ між двома групами. Отже, комбіноване використання езетимібу зі статинами є ефективнішим у зниженні концентрації ХС ЛПНЩ і ЗХС у крові в пацієнтів із ГХС, ніж використання подвійної дози препарату із групи інгібіторів ГМГ-КoА-редуктази.
Вивченню особливостей гіполіпідемічних ефектів, безпеці комбінованої терапії езетимібом та статином, а також високоінтенсивної терапії інгібітором ГМГ-КoА-редуктази в хворих на ЦД 2 типу з високим СС-ризиком присвячено численні дослідження, однак їхні результати є суперечливими та непереконливими. До знакового випробування належить Effect of ezetimibe add-on therapy over 52 weeks extension analysis of prospective randomized trial (RESEARCH study) in type 2 diabetes subjects, проведене Sakamoto і співавт. у 2017 р. Автори повідомляють, що реєструвалося підвищення активності печінкових трансаміназ, але в пацієнтів не спостерігався значний клінічний ризик розвитку гепатиту. Терапія езетимібом загалом добре переноситься, а профіль безпеки лікарського засобу (співвідношення користь/ризик) відповідає аналогічному за високоінтенсивної терапії статинами.
Zhu і співавт. (2020) провели метааналіз результатів 14 РКД серед 3105 пацієнтів із високим ризиком ССЗ. Мета: оцінка ефективності комбінованої терапії езетимібом і статином у дозі 10 мг порівняно з високоінтенсивною терапією 40 мг аторвастатину в пацієнтів із ГХС. Продемонстровано, що ефективність комбінованої терапії езетимібом і аторвастатином у дозі 10 мг у зниженні рівнів ХС ЛПНЩ, ХС не-ЛПВЩ-параметра, що комплексно оцінює усі потенційно атерогенні фракції ліпопротеїнів (ЛПНЩ, ТГ, ЛПДНЩ, ЛППЩ, а також ЗХС і ТГ), була значно кращою, ніж монотерапії подвійною дозою аторвастатину. Отримані результати свідчать, що гіполіпідемічна активність комбінованого використання езетимібу зі статинами є ефективнішою. Крім того, не виявлено суттєвої та статистично значущої різниці в змінах активності аланінамінотрансферази, аспартатамінотрансферази і креатинфосфокінази – чутливих біомаркерів ушкодження гепатоцитів або м’язових клітин.
У березні 2022 р. Joseph і співавт. оприлюднили позицію Американської асоціації серця (American Heart Association) щодо провідних принципів менеджменту чинників ризику ССЗ у дорослих із ЦД 2 типу. Зокрема, повідомляється, що хворим на ЦД 2 типу із факторами дуже високого ризику AССЗ (множинні чинники ризику АССЗ або одна велика подія АССЗ та щонайменше один інший чинник високого ризику АССЗ: вік >65 років, сімейна ГХС, артеріальна гіпертензія, куріння, застійна серцева недостатність в анамнезі), які отримують максимально переносимі дози статинів, інгібітори ГМГ-КoА-редуктази доцільно комбінувати з езетимібом. Езетиміб вважається оптимальним початковим фармакологічним агентом з огляду на результати IMPROVE-IT щодо позитивного впливу комбінованої терапії на зменшення частоти кардіоваскулярних подій. Додавання езетимібу до помірно інтенсивної терапії статинами може сприяти зниженню рівня ХС ЛПНЩ, аналогічному за використання високоінтенсивної терапії інгібіторами ГМГ-КoА-редуктази. В дорослих із ЦД 2 типу та 10-річним ризиком АССЗ ≥20% раціональним може бути додавання езетимібу до максимально переносимої терапії статинами, мета – зниження рівня ХС ЛПНЩ на ≥50%.
Комбіноване використання низькоінтенсивної або помірно інтенсивної терапії статинами й езетимібом задіює два комплементарні механізми: зниження внутрішньоклітинної концентрації ХС із посиленням захоплення ХС ЛПНЩ гепатоцитами (за рахунок дії інгібіторів ГМГ-КoА-редуктази) та зниження абсорбції ХС у кишечнику (дія езетимібу). Ці механізми діють синергічно (подвійне пригнічення ХС) і можуть забезпечити такий самий сумарний ефект, як за використання високоінтенсивної терапії статинами – зниження рівня ХС ЛПНЩ на 45-65% від вихідних значень. Безпека комбінованої терапії є еквівалентною безпеці монотерапії інгібіторами ГМГ-КoА-редуктази в аналогічних дозах. Ця комбінація зазвичай переноситься краще, ніж високі дози інгібіторів ГМГ-КоА-редуктази; вона має переваги в хворих із ризиком розвитку міопатії та статин-індукованого ЦД 2 типу.
Отже, незважаючи на деякі застереження, езетиміб залишається препаратом вибору в арсеналі фармакологічних агентів за відсутності досягнення цільового рівня ХС ЛПНЩ при монотерапії інгібіторами ГМГ-КoА-редуктази. Комбіноване використання езетимібу зі статинами є ефективним для зниження ризику виникнення СС-ускладнень у хворих на ЦД 2 типу із ХКС та ГКС в анамнезі. Подальші дослідження, в т. ч. РКД, необхідні для підтвердження переваги езетимібу в поєднанні з інгібіторами ГМГ-КоА-редуктази порівняно з монотерапією статинами.
Медична газета «Здоров’я України 21 сторіччя» № 9 (526), 2022 р.