20 червня, 2023
Сучасні похідні сульфонілсечовини в лікуванні цукрового діабету 2 типу
Загальна захворюваність і поширеність цукрового діабету (ЦД) 2 типу продовжують швидко зростати в усьому світі. Так, за прогностичними даними Міжнародної діабетичної федерації (IDF), до 2030 року кількість пацієнтів із діабетом становитиме 643 млн, що спричинить відповідне збільшення видатків [1]. Лише в 2019 році світові витрати на лікування діабету перевищили 760 млрд дол. США та, за прогнозами фахівців, до 2045 року сягнуть 845 млрд дол. Незважаючи на значний арсенал цукрознижувальних препаратів, контролю захворювання вдається досягати досить незначній частці пацієнтів, що не може не викликати занепокоєння [2, 3]. Можливими причинами цього є недотримання положень рекомендацій, труднощі, пов’язані з практичним застосуванням настанов, розробка непослідовних рекомендацій, обмеженість доступу до лікарських засобів тощо [4]. В цій статті розглянемо нові можливості в лікуванні ЦД 2 типу, які відкривають сучасні препарати сульфонілсечовини (ПСС).
У більшості міжнародних настанов у разі вперше діагностованого ЦД 2 типу як терапію першої лінії рекомендують призначати метформін, а також змінити спосіб життя [5, 6]. У виборі пероральних гіпоглікемічних засобів другої та третьої ліній можуть бути певні варіації. Одними з найстаріших пероральних цукрознижувальних засобів, які мають високу ефективність, прихильність, переносимість та продовжують широко призначатися в багатьох країнах світу, є ПСС. Так, за даними епідеміологічних досліджень, близько третини хворих на ЦД 2 типу із США та Європи отримують препарати цієї групи [7, 8].
Причини неефективності пероральних протидіабетичних засобів
За первинної неефективності цукрознижувального засобу відсутній ранній контроль глікемії після початку лікування. Найчастіше це спостерігається в худих пацієнтів із низьким резервом β-клітин, які могли бути віднесені до категорії латентного автоімунного діабету в дорослих (LADA). Вторинна неефективність спостерігається в пацієнтів, які перестали реагувати на пероральний цукрознижувальний препарат (ПЦП) після багатьох років належного лікування. Її розвиток пов’язують з виснаженням β-клітин підшлункової залози, резерв яких постійно зменшується в міру прогресування ЦД 2 типу [9]. Відомо, що зі зниженням функції β-клітин пов’язані високий рівень HbA1с і більша тривалість ЦД 2 типу. Саме зниження функції β-клітин є однією з основних причин неефективності багатьох класів цукрознижувальних засобів [10].
Зазвичай у пацієнта з нещодавно діагностованим ЦД 2 типу приблизно половина β-клітин уже втрачена. Щороку кількість β-клітин продовжує зменшуватися на 4-7%, причому цей показник може зростати в разі збільшення маси тіла, наявності таких супутніх станів, як синдром обструктивного апное уві сні, інфекції, стрес тощо.
Найпоширенішою є недостатня ефективність монотерапії або подвійної терапії. У такому випадку рекомендують додати або третій ПЦП, або інсулін [11].
Метформін і ПСС мають найбільший вплив на зниження рівня HbA1c порівняно з іншими ПЦП. Наразі сучасні ПСС розглядаються як безпечні та розумні варіанти лікування ЦД 2 типу, оскільки здатні стимулювати секрецію інсуліну β-клітинами підшлункової залози, що допомагає контролювати глікемію [12].
Механізм дії ПСС
Усі похідні сульфонілсечовини стимулюють ендогенну секрецію інсуліну шляхом блокади чутливих до аденозинтрифосфату калієвих іонних каналів (KATP) на β-клітинах підшлункової залози. Особливість сучасних похідних сульфонілсечовини, як-от глімепірид, – зв’язування зі специфічним сайтом на каналі КАТР, завдяки чому відбувається алостеричне та менш виражене інгібування КАТР, що пояснює знижений ризик розвитку гіпоглікемії порівняно із традиційними похідними сульфонілсечовини [13].
Клінічні докази
Феномен метаболічної пам’яті
За даними проспективного дослідження UKPDS (UK Prospective Diabetes Study), а також дослідження ADVANCE (Action in Diabetes and Vascular Disease: Preterax and Diamicron Modified Release Controlled Evaluation), тривале лікування ПСС асоціювалося зі зниженням ризику розвитку мікросудинних ускладнень [14, 15].
Також дослідження UKPDS дозволило встановити, що стійкі ускладнення ЦД 2 типу розвиваються навіть після досягнення глікемічного контролю, що отримало назву феномена метаболічної пам’яті. В її основі лежить зв’язок між поганим метаболічним контролем і погіршенням функціональної спроможності ендогенних вазорепаративних систем, що може спричинити розвиток судинних ускладнень у майбутньому, тобто довгострокові переваги інтенсивного контролю глікемії можуть зберігатися навіть протягом багатьох років після припинення лікування [16].
Лікування сучасними ПСС доцільно розпочинати на ранніх стадіях ЦД 2 типу, що дозволить досягти максимального глікемічного контролю, а також отримати додаткові переваги за рахунок впливу на механізми метаболічної пам’яті [17]. ПСС блокуванням каналів NC (Ca-ATP) зменшують міграцію ендотеліальних клітин, послаблюючи в такий спосіб метаболічну пам’ять.
Також відомо, що ДНК клітини може зберігати інформацію про поганий метаболічний контроль, зокрема несприятливі наслідки гіперглікемії. Це може зменшити користь від майбутнього покращення контролю глікемії та сприятиме розвитку судинних ускладнень в органах-мішенях. Отже, раннє досягнення хорошого контролю діабету має вирішальне значення для запобігання віддаленим ускладненням. Ефект метаболічної пам’яті може бути більш значущим у пацієнтів із помірним або високим серцево-судинним ризиком, але без серцево-судинних захворювань (ССЗ), особливо в осіб із нещодавно виявленим діабетом [18].
Дослідження глімепіриду
Сучасний ПСС глімепірид вважається не лише потужним, а й безпечним цукрознижувальним препаратом. Це підтверджують результати масштабного подвійного сліпого рандомізованого дослідження CAROLINA (Cardiovascular Outcome Study of Linagliptin Versus Glimepiride in Patients With Type 2 Diabetes) за участю пацієнтів із ЦД 2 типу та високим серцево-судинним ризиком, під час проведення якого порівнювали кардіоваскулярну безпеку глімепіриду з інгібітором дипептидилпептидази‑4 (ДПП‑4) лінагліптином.
Аналіз первинної кінцевої точки (час до настання серцево-судинної смерті, розвитку нефатального інфаркту міокарда чи нефатального інсульту) виявив відсутність різниці між групами впродовж середнього періоду спостереження (6,3 року). Артеріальний тиск, рівні ліпідів, глюкози в плазмі натще та загальне зниження HbA1c істотно не відрізнялися між групами [19].
У відкритому рандомізованому дослідженні GRADE (Glycemia Reduction Approaches in Diabetes: A Comparative Effectiveness Study) вивчали тривалість утримання цільових показників HbA1c не вище 7% у пацієнтів із ЦД 2 типу при додаванні до попередньої терапії метформіном таких препаратів, як глімепірид, ситагліптин, ліраглутид або інсулін гларгін. Середня тривалість спостереження становила 5 років. Первинною кінцевою точкою дослідження було досягнення рівня HbA1c ≥7.
Серед хворих, розподілених на прийом глімепіриду, менша частка досягла первинної кінцевої точки порівняно із ситагліптином (72 vs 77% відповідно) [20]. Отже, глімепірид продемонстрував здатність забезпечити кращу стійкість глікемічного контролю порівняно із ситагліптином.
Комбінації з метформіном
ПСС + метфомін vs монотерапія метформіном. Поєднання ПСС із метформіном має вищу глікемічну ефективність порівняно з монотерапією метформіном (сукупна різниця між групами за рівнем HbA1с становила 0,9%). Комбінація ПСС з іншим пероральним цукрознижувальним засобом надає можливість досягти середнього зниження HbA1с на 1,62% [21].
ПСС + метформін vs тіазолідиндіон + метформін. Пацієнти, які отримували комбінацію ПСС + метформін, продемонстрували вираженіше зниження HbA1с порівняно з додаванням тіазолідиндіону до метформіну [22]. Зокрема, додавання глімепіриду до метформіну зумовило швидше зниження рівня HbA1с порівняно з додаванням піоглітазону (р=0,024) [23].
ПСС + метформін vs інгібітор ДПП‑4 + метформін. Згідно з результатами метааналізу, глімепірид мав на 12% вищу глікемічну ефективність порівняно з інгібіторами ДПП‑4 в комбінації з метформіном [24].
ПСС + метформін vs інгібітор натрійзалежного котранспортера глюкози-2 (НЗКТГ-2) + метформін. Глімепірид та емпагліфлозин продемонстрували схоже зниження HbA1c через 104 тижні лікування [25].
ПСС + метформін vs аналог глюкагоноподібного пептиду‑1 (ГПП‑1) + метформін. Одне дослідження довело не меншу ефективність ліраглутиду порівняно із глімепіридом, доданим до метформіну [26].
ПСС як препарат третьої лінії
Потрійна терапія ЦД 2 типу передбачає призначення ПЦП трьох різних класів або два ПЦП у комбінації з інсуліном [27]. Результати низки досліджень та метааналізів показують, що додавання третього препарату до комбінованої терапії метформіном + ПСС є клінічно ефективнішим щодо зниження HbA1c порівняно з лише подвійною терапією [27].
В одному з досліджень 74% пацієнтів досягали хорошого контролю діабету (середній рівень HbA1c складав 6,9±0,3%) протягом середнього періоду спостереження 37 міс після переходу на потрійну терапію ПСС + метформін + тіазолідиндіон [28]. Наразі є докази, що в пацієнтів із уперше діагностованим ЦД 2 типу потрійна терапія із застосуванням ПЦП, які підвищують чутливість до інсуліну та стимулюють функцію β-клітин, спричиняє значне і триваліше зниження HbA1c порівняно з терапією, спрямованою лише на зниження рівня глікемії без впливу на основні патогенетичні ланки захворювання [29].
Глімепірид значно знижував рівень HbA1с при додаванні до комбінації метформін + тіазолідиндіон порівняно з початковим рівнем (р<0,001). Також було показано, що на такій потрійній терапії значно більша частка хворих досягала цільового рівня HbA1с (≤7%) порівняно з подвійною терапією метформіном + тіазолідиндіоном (62,2 vs 26,0% відповідно; p<0,001) [30].
В іншому дослідженні продемонстровано покращення контролю ЦД 2 типу в разі додавання глімепіриду як препарату третьої лінії до комбінації ситагліптин + метформін [31].
Роль ПСС за різних клінічних сценаріїв
Важливими факторами досягнення клінічного успіху при застосуванні ПСС є характеристики пацієнта та прихильність до лікування. ПСС може бути кращим вибором для хворих із нещодавно діагностованим ЦД 2 типу, особливо для тих, хто не переносить метформін.
Водночас стартова комбінована терапія має низку переваг порівняно з поетапною / послідовною щодо зниження ризику віддалених ускладнень за рахунок впливу на механізми метаболічної пам’яті. Сучасні ПСС у поєднанні зі зміною способу життя та метформіном є безпечним і ефективним початковим лікуванням для пацієнтів, котрі мають рівень HbA1c ≥7,5% [32]. Раннє застосування метформіну та ПСС у пацієнтів із ЦД 2 типу з високим початковим рівнем HbA1c і низьким ризиком гіпоглікемії може бути кориснішим за поетапне використання метформіну з подальшим додаванням ПСС.
Практичне застосування концепції метаболічної підтримки
Раціональний вибір ПЦП, що ґрунтується на застосуванні рекомендацій з урахуванням показників лабораторних досліджень, може виявитися досить складним завданням. Окрім того, в країнах із низьким і середнім рівнем економічного розвитку слід ураховувати доступність для пацієнта обраних лікарських засобів. Такі виклики погіршують контроль глікемії та досягнення інших терапевтичних цілей.
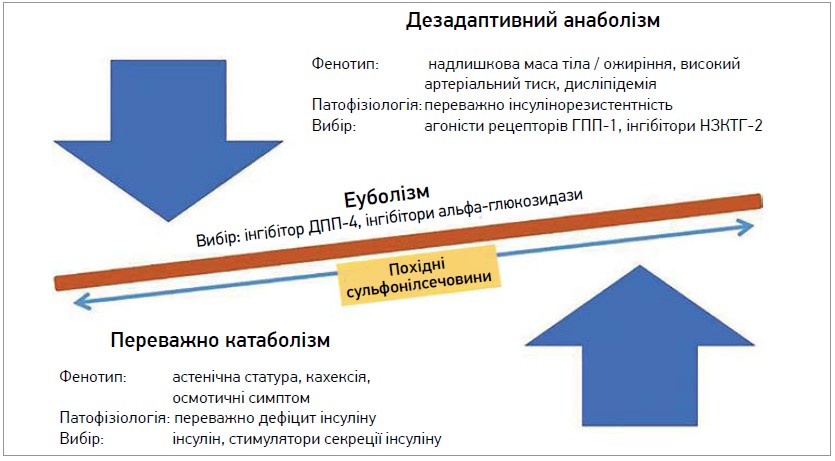
У такому разі доцільно використовувати підхід, заснований на концепції метаболічної підтримки. Відповідно до нього вибір лікування має проводитися з урахуванням метаболічного профілю пацієнта (еуболічний, переважно катаболічний або дезадаптивний анаболізм) (рис. 1) [33].
Рис. 1. Підхід до лікування пацієнтів із ЦД 2 типу, що ґрунтується на концепції метаболічної підтримки
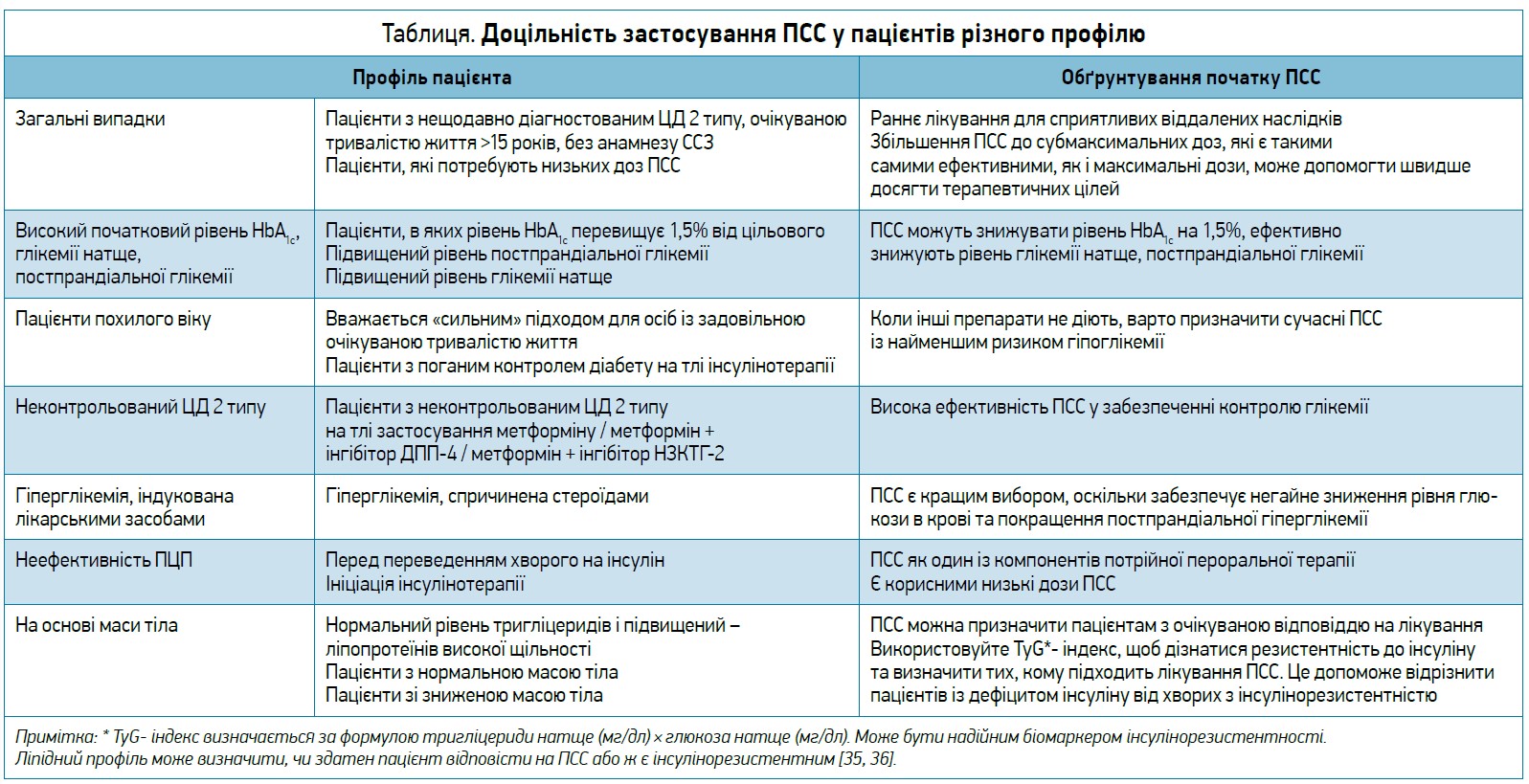
Розподіл пацієнтів на відповідні групи можна виконати, використовуючи лише фенотипові ознаки. Завдяки простоті підходу лікарі та інші медичні працівники можуть легко раціоналізувати цукрознижувальну терапію. Отже, концепція метаболічної підтримки може допомогти підібрати ефективну терапію, сприяючи швидшому досягненню оптимальних глікемічних цілей [34]. Крім того, можна виокремити певні профілі пацієнтів із ЦД 2 типу, які з високою імовірністю зможуть отримати користь від призначення ПСС (табл.).
Місце ПСС у сучасних настановах із ведення ЦД 2 типу
ПСС мають потенціал для використання на всіх стадіях ЦД 2 типу: на ранній – як терапія першої лінії разом із коригуванням способу життя; на пізніших стадіях – для подвійної пероральної (доповнення до метформіну) чи потрійної терапії (доповнення до метформіну + гліптину або метформіну + гліфлозину) як додаткова терапія до призначення базального інсуліну. Однак на кожному з етапів лікування інші фармакологічні засоби можуть мати певні переваги. Так, вибір певних ПСС замість нових антидіабетичних препаратів, як-от інгібітори НЗКТГ‑2, агоністи ГПП‑1, інгібітори ДПП‑4, потенційно може підвищити ризик кардіоваскулярних ускладнень. У такому випадку перевагу слід надавати сучасним ПСС. Наприклад, глімепірид є нейтральним щодо серцево-судинної системи порівняно з іншими похідними сульфонілсечовини. Ступінь інгібування КАТР‑каналів у глімепіриду є нижчим, тому цей препарат менше втручається в гомеостаз калію; його можна безпечно застосовувати в пацієнтів із ЦД 2 типу із супутньою ішемічною хворобою серця [37]. На відміну від інших представників класу, глімепірид не порушує ішемічного прекондиціонування кардіоміоцитів [38].
Отже, режим лікування має бути індивідуалізованим для кожного пацієнта та адаптованим до клінічного профілю і характеристик хворого, а також ураховувати вартість і доступність препаратів, що особливо актуально для країн, що розвиваються [39].
Рекомендації щодо застосування ПСС в окремих клінічних ситуаціях
MODY‑діабет
ЦД дорослого типу в молодих осіб (Maturity Onset Diabetes of the Young, MODY) – це генетичний тип діабету, зумовлений первинною дисфункцією β-клітин підшлункової залози. Загалом на MODY припадає <2% випадків діабету, але зазвичай його неправильно діагностують як ЦД 1 або ЦД 2 типу. ПСС рекомендовані як перша лінія терапії MODY, оскільки пацієнти з типом HNF1A-MODY є чутливими до терапії цими препаратами. Відповідно до рекомендацій SAFES, монотерапія ПСС – рекомендований варіант лікування першої лінії у пацієнтів із MODY [40].
Порушення функції нирок
Відповідно до Ініціативи щодо поліпшення якості результатів лікування захворювань нирок (Kidney Disease Outcomes Quality Initiative, KDOQI) глімепірид можна розпочинати призначати консервативно з 1 мг/день пацієнтам із хронічною хворобою нирок 3-5 стадій. Низькі дози гліклазиду та глімепіриду можна застосовувати за легкого і помірного порушення функції нирок [41]. Для хворих із помірною та тяжкою нирковою недостатністю перевагу слід віддавати ПСС короткочасної дії, що метаболізується в печінці (наприклад, гліпізид) [42].
Люди літнього віку
Геріатричні пацієнти мають підвищений ризик гіпоглікемії через вікове зниження функції нирок і печінки, супутні захворювання, погане харчування та поліпрагмазію. У настанові IDF рекомендовано для людей похилого віку ПСС як препарат першого ряду, коли метформін протипоказаний, а також як доповнення до метформіну, якщо цільових показників глікемії не досягнуто [44].
Стероїд-індукований діабет
Установлено, що терапія глюкокортикоїдами може спричинити дебют ЦД 2 типу, а також погіршити контроль глікемії у пацієнтів із ЦД 2 типу. Вважається, що побічні ефекти глюкокортикоїдів спричинені підвищеною інсулінорезистентністю та дисфункцією β-клітин [46].
Підхід до лікування гіперглікемії, зумовленої стероїдами, зазвичай індивідуальний. Препаратом вибору в більшості клінічних ситуацій стійкої гіперглікемії є інсулін. Відповідно до настанови Об’єднаних британських діабетичних товариств (JBDS) для групи стаціонарного лікування, ранковий прийом ПСС 1 р/добу може найкраще контролювати зміну рівня глюкози, пов’язаного з пероральним прийомом стероїдів 1 р/добу [47]. Щоб уникнути гіпоглікемії, дози інсуліну чи ПСС слід титрувати відповідно до показників рівня глюкози в капілярній крові. ПСС, як-от глімепірид, гліклазид, гліпізид, – препарати першого вибору для лікування стероїд-індукованої гіперглікемії, оскільки їхня цукрознижувальна дія є негайною, а застосування супроводжується покращенням постпрандіальної гіперглікемії [48, 49].
Титрування дози ПСС
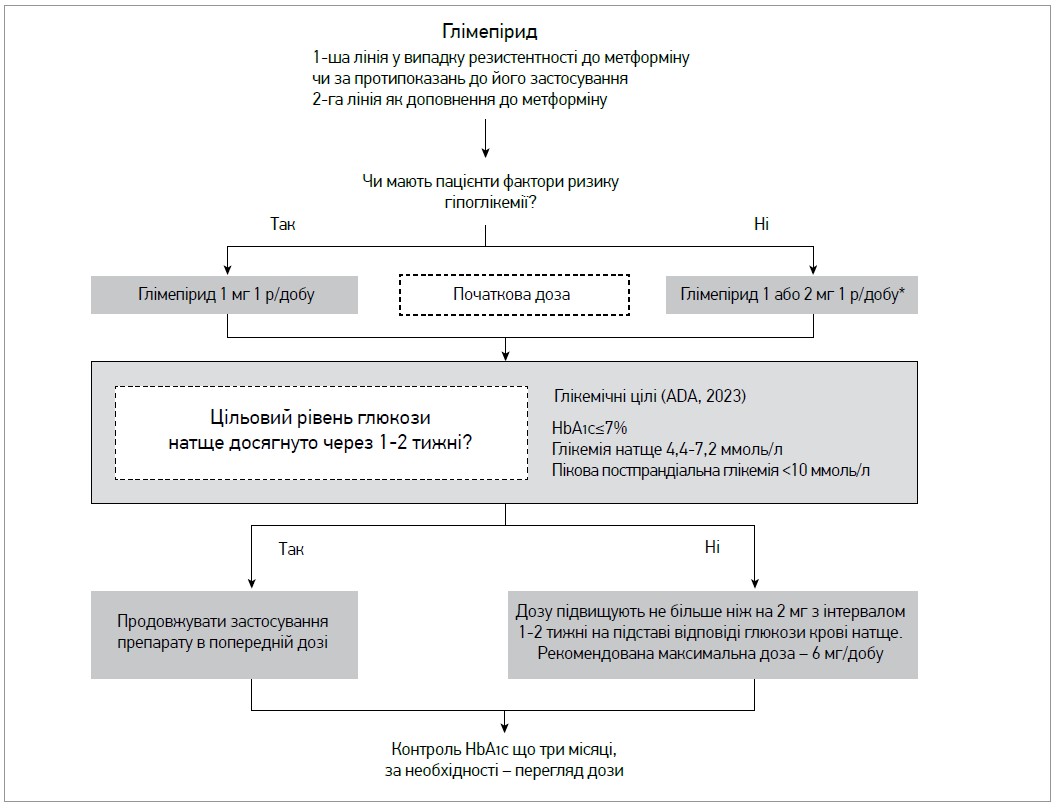
Довгострокову терапію ПСС слід продовжувати доти, доки препарат дозволяє контролювати захворювання, не спричиняючи гіпоглікемії. Приклад титрування дози глімепіриду наведено на рисунку 2.
Рис. 2. Алгоритм початку терапії та титрування дози глімепіриду
Примітка: * за рекомендацією FDA. В Україні, відповідно до інструкції із застосування лікарського засобу,
початкова доза глімепіриду становить 1 мг 1 р/добу.
Висновки
ПСС є одними з найчастіше призначуваних цукрознижувальних препаратів. Їхні добре вивчені ефективність та безпека роблять їх невід’ємною частиною фармакотерапії ЦД 2 типу. З огляду на наявні докази перевагу слід надавати сучасним ПСС, які мають вищу ефективність, серцево-судинну безпеку, менший ризик гіпоглікемії та не спричиняють збільшення маси тіла. Завдяки зазначеним перевагам сучасні ПСС усе частіше позиціонують як препарат першої лінії для раннього лікування ЦД 2 типу. На особливу увагу заслуговує глімепірид, який має нейтральний вплив на масу тіла (за деякими даними, навіть сприяє її зниженню), характеризується високою кардіоваскулярною безпекою, а також здатен забезпечувати тривале утримання глікемічного контролю.
Довідка «ЗУ»
В Україні глімепірид європейського виробництва представлено компанією «Берлін-Хемі» під назвою Олтар®. Олтар® показаний для лікування ЦД 2 типу в дорослих, коли лише дієта, фізичне навантаження та зниження маси тіла виявляються недостатніми для підтримання рівня глюкози в крові. Лінійка дозувань 2, 3, 4 або 6 мг глімепіриду в 1 таблетці дозволяє індивідуально підбирати цукрознижувальну терапію, а також плавно титрувати добову дозу з інтервалом 1 мг.
Підготував В’ячеслав Килимчук

Медична газета «Здоров’я України 21 сторіччя» № 9 (545), 2023 р.