15 серпня, 2021
Фуга назначению пробиотиков при СОVID‑19: использовать или пренебречь?
Мне всегда лучше работается после того, как я послушаю музыку.
Иоганн Вольфганг Гёте
 Новый вирус SARS-CoV‑2, виновник коронавирусной болезни‑19 (COVID‑19), внезапно ворвался в жизнь всего человечества, изменив устоявшиеся жизненные привычки и практически толкнув мир на грань гибели, спровоцировав развитие пандемии. Несмотря на появление первых стандартов лечения и активное проведение вакцинации, количество инфицированных и умерших от COVID‑19 пока продолжает измеряться миллионами, появляются новые (более агрессивные) мутации вируса, растет количество случаев с тяжелым течением заболевания и фатальными последствиями; все это делает проблему единоборства и противостояния SARS-CoV‑2 глобальной и животрепещущей.
Новый вирус SARS-CoV‑2, виновник коронавирусной болезни‑19 (COVID‑19), внезапно ворвался в жизнь всего человечества, изменив устоявшиеся жизненные привычки и практически толкнув мир на грань гибели, спровоцировав развитие пандемии. Несмотря на появление первых стандартов лечения и активное проведение вакцинации, количество инфицированных и умерших от COVID‑19 пока продолжает измеряться миллионами, появляются новые (более агрессивные) мутации вируса, растет количество случаев с тяжелым течением заболевания и фатальными последствиями; все это делает проблему единоборства и противостояния SARS-CoV‑2 глобальной и животрепещущей.
Среди множества адъювантных способов борьбы с этим заболеванием широко обсуждается возможность применения пробиотиков. Мы постарались разобраться в этом вопросе, прислушавшись к искусному целителю здоровья – Музыке и сделав наше повествование подобным фуге – многоголосым и полифоническим.
Экспозиция. Первые успехи и достижения
За время пандемии удалось достичь ряда успехов в изучении структурного строения и основных патогенных свойств SARS-CoV‑2, которые обусловливают способность вируса проникать в организм человека, взаимодействуя с рецепторами ангиотензинпревращающего фермента, расположенными в дыхательной и пищеварительной системах, и провоцировать развитие типичного клинического симптома (интерстициальной пневмонии), «цитокинового шторма» с последующим вероятным поражением других органов и систем, развитием полиорганной недостаточности и/или постковидного синдрома. Доказано, что течение COVID‑19 ассоциировано с увеличением концентрации провоспалительных цитокинов, в том числе гранулоцитарного колониестимулирующего фактора (G-CSF), человеческого интерферон-индуцированного протеина‑10 (IP10/ CXCL10), моноцитарного хемоаттрактантного белка‑1 (MCP‑1), фактора некроза опухоли-альфа (TNF-α), интерлейкина (ИЛ)-4 и ИЛ‑10 [2, 30], ИЛ‑17 и ИЛ‑6 [6].
Понимание патофизиологических механизмов инфицирования SARS-CoV‑2 и прогрессирования COVID‑19 позволило выявить потенциальные цели лечения и профилактики заболевания путем ингибирования проникновения и/или репликации вируса, блокирования чрезмерного иммунного ответа. Ценой жизни многих больных сделаны первые успехи в лечении и профилактике COVID‑19: обнаружены препараты и нутриенты, обладающие прямым и опосредованным противовирусным действием, появились первые стандарты терапии, разработаны новейшие мРНК вакцины, проводится активная вакцинация. Невзирая на достигнутые глобальные успехи в борьбе с COVID‑19, остается еще ряд проблем, среди которых наиболее актуальными являются профилактика инфицирования SARS-CoV‑2, предупреждение тяжелого течения заболевания, ускорение восстановления после перенесенного COVID‑19. Ученые всего мира возлагают большие надежды на пробиотические бактерии, полагая, что они способны усилить иммуномодулирующие свойства кишечного микробиома и улучшить функционирование оси «кишечник – легкие» [13].
Интермедия. Составляющие и особенности функционирования оси «кишечник – легкие»
Кишечный микробиом
Результаты многолетнего изучения микробиома, в том числе данные таких всемирно известных проектов, как Human Microbiome Project и Metagenomics of the human intestinal tract, свидетельствуют, что кишечная микрофлора представлена двумя доминирующими типами бактерий: Bacteroidetes (типичные представители – B. vulgatus, B. dorei, B. uniformis, B. ovatus) и Firmicutes (именно в него входят класс Bacilli, включающий в себя такие известные роды, как Lactobacillus, Enterococcus и Streptococcus) c относительно небольшим содержанием актиномицетов (род Bifidobacterium) [4]. В настоящее время ни у кого не вызывает сомнений участие кишечной микробиоты в процессах пищеварения (расщеплении пищевых волокон, синтезе короткоцепочечных жирных кислот (КЦЖК) и пищеварительных ферментов, обмене желчных кислот), синтезе витаминов группы В, К, аминокислот (аргинина, глутамина), дезинтоксикации некоторых видов лекарств и ксенобиотиков, регуляции активности иммунной, эндокринной и нервной систем (ось кишечник-головной мозг). Описаны мягкие гипохолестеринемические, антиканцерогенные, антимутагенные, гипоаллергические свойства ряда пробиотических бактерий (рис. 1).
Рис. 1. Механизмы действия и свойства кишечного микробиома (по Stavropoulou Е. et al., 2020 [41])
Наиболее значимыми в эпоху пандемии COVID‑19 оказались защитная и иммуномодулирующая функции микробиоты. Усиление синтеза бокаловидными клетками слизи и муцина, отмечающееся под воздействием лакто-, бифидобактерий, стрептококков, приводит к улучшению защитных свойств слизистой оболочки кишечника и позволяет избежать адгезии/ инвазии патогенных микроорганизмов [34]. Стимуляция выработки антибиотикоподобных веществ, бактериоцинов позволяет предотвратить проникновение таких недружественных бактерий, как золотистый стафилококк, кишечная палочка, листерия, сальмонелла, а также некоторых вирусов (ротавирус) [14]. Предполагается, что стимуляция выработки слизи, муцина, бактериоцинов, сохранение целостности эпителия и плотных межклеточных контактов является одним из основных механизмов, позволяющих микробиоте противодействовать проникновению, репликации SARS-CoV‑2 в кишечнике и предупреждать дальнейшее прогрессирование вирусной инфекции [14, 34].
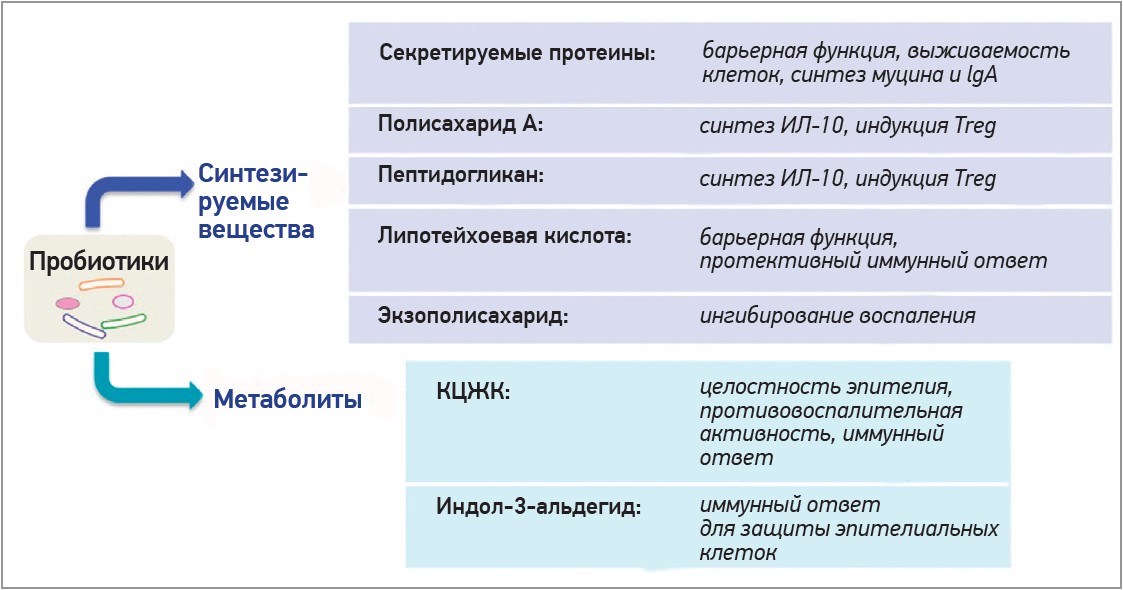
Не менее значимой является иммуномодулирующая способность микробиоты: при ее участии происходит усиление синтеза и секреции IgA плазматическими клетками, активация CD4+ и CD8+ Т-лимфоцитов для борьбы с патогенными микроорганизмами, снижение интенсивности воспалительной реакции за счет торможения выработки провоспалительных цитокинов ИЛ‑2, TNF-α [41, 46]. На протяжении последнего десятилетия уделяется большое внимание способности микробиоты взаимодействовать с сигнальными рецепторами врожденного иммунитета посредством микроорганизм-ассоциированных (microorganism-associated molecular patterns, MAMP) или патоген-ассоциированных молекулярных структур (pathogen-associated molecular patterns, PAMP), являющимися специфической патогенной «молекулярной сигнатурой» [11, 13]. Они считаются высокоуникальными (не имеющими аналогов в макроорганизме) консервативными молекулярными структурами, способными связываться образ-распознающими рецепторами (pattern recognition receptors, PRR), основными компонентами врожденной системы неспецифической защиты [11, 13, 34]. В обширной группе PRR непосредственно ответственными за распознавание MAMP и PAMP среди других молекул являются Toll-подобные рецепторы (TLR). Именно TLR вызывают различные иммунологические реакции в зависимости от типа клетки, лиганда или рецептора. После обнаружения микробных PAMP TLR инициируют воспалительные реакции и в конечном итоге устраняют патогенных захватчиков [11, 13]. Предполагается, что пробиотики могут модулировать иммунную систему за счет связывания своих MAMP (липотейхоевых кислот, пептидогликана, белков S-слоя и нуклеиновых кислот) с PPR (Toll- и NOD-подобными рецепторами), которые экспрессируются в слизистой оболочке кишечника, позволяя тем самым противостоять воздействию бактериальных и вирусных патогенов [34] (рис. 2).
Рис. 2. Вклад пробиотиков в регуляцию иммунного ответа (по Yan F. et al., 2020) [46]
Большое значение придают также метаболитам кишечной микрофлоры, КЦЖК (уксусной, пропионовой, масляным кислотам), обладающим иммунорегуляторными свойствами. Они способны соединиться с поверхностными рецепторами, связанными с G-белком, и косвенно модулировать функцию иммунной системы [34]. Триптрофан, другой метаболит пробиотических бактерий, не только усиливает кишечный барьер за счет укрепления плотных межклеточных контактов, но также обладает иммуномодулирующей активностью, ослабляя TNF-α-индуцированную активацию NF-κB и снижая экспрессию провоспалительных хемокинов [34]. Синтезируя витамины группы В, кишечная микробиота вносит дополнительный вклад в нормализацию работы иммунной системы.
Микробиом легких
В отличие от ранее господствовавшего утверждения, относительно недавно стало известно, что легкие не являются стерильными, а населены различной микрофлорой. Доказано, что верхние и нижние дыхательные пути колонизированы Firmicutes, Bacteroidetes, Proteobacteria и Actinobacteria, но количество бактерий в легких значительно меньше такового в кишечнике [1]. Доминирующими представителями нормальной легочной микрофлоры считаются Рrevotella, Veillonella, Streptococcus и Pseudomonas [1]. Подтвержден значительный вклад микробиоты легких в толерантность дыхательных путей, иммунный ответ на инфекционные респираторные патогены [1, 15, 47, 48], а также патофизиологию развития и прогрессирования различных заболеваний дыхательных путей [49].
Состав микробиома легких изменяется под влиянием различных факторов внешней среды; например, курение ассоциируется с уменьшением количества бактерий, обладающих противовоспалительными свойствами (Oceanospirillales, Desulfuromonadales, Nesterenkonia и Lactobacillaceae), и увеличением численности микроорганизмов с провоспалительной активностью (Proteobacteria и Firmicutes) [1, 40].
Ось «кишечник – легкие»
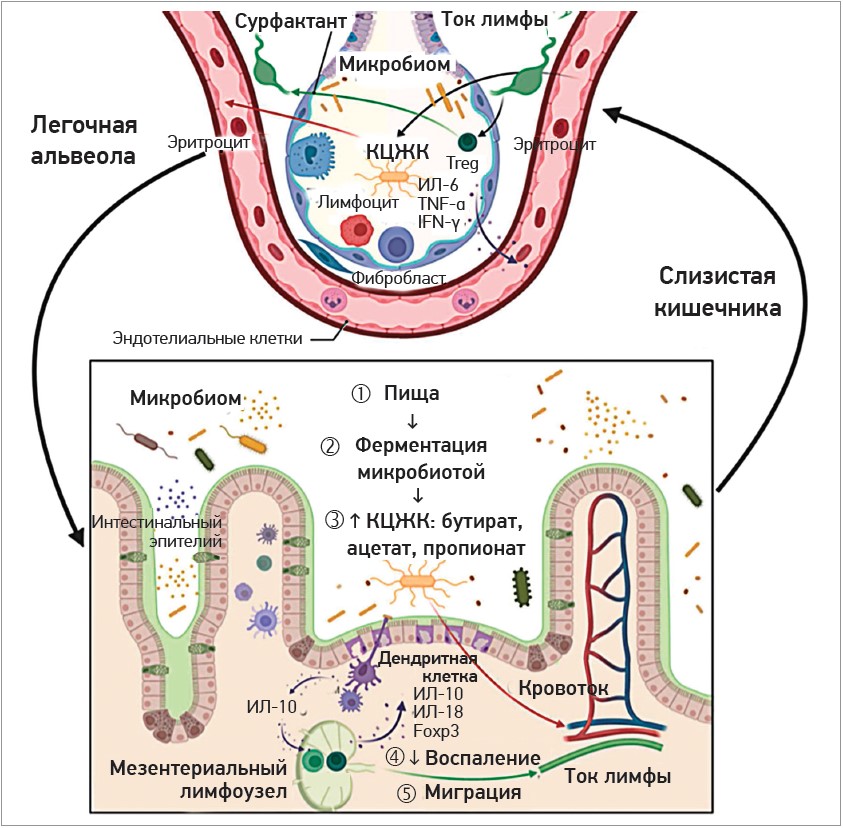
Понятие об оси, связывающей в единое целое кишечник и легкие, появилось относительно недавно [23]. Согласно сформулированной теории ось «кишечник – легкие», состояние микробиома кишечника оказывает значимое влияние на микробиоту дыхательного тракта, функциональное состояние легких [1, 40, 47]. Считается, что данная ось является двунаправленной, т. е. не только метаболиты пробиотиков и эндотоксины бактерий способны воздействовать на респираторный тракт посредством кровяного русла, но и воспалительный процесс в легких приводит к изменению состава, количества и функции кишечного микробиома [1, 15, 40, 47, 48] (рис. 3).
Рис. 3. Функционирование оси «кишечник – легкие» (по Cyprian F. et al., 2021 [9])
Сформулировано несколько теорий, объясняющих влияние кишечной микробиоты на иммунитет слизистой оболочки дыхательных путей; впервые все эти механизмы были подробно проанализированы de Oliveira [11]:
- согласно первой гипотезе, все слизистые оболочки организма взаимосвязаны, следовательно, активация иммунных клеток в слизистой одного органа может повлиять на состояние слизистой в других и активировать их. Миграция иммунных клеток из желудочно-кишечного тракта (ЖКТ) в слизистую оболочку дыхательных путей способствует улучшению локального иммунного ответа при респираторных вирусных инфекциях;
- другая теория базируется на способности цитокинов и факторов роста, секретируемых слизистой оболочкой ЖКТ в ответ на воздействие комменсальной микробиоты, достигать системного кровотока и воздействовать на слизистые оболочки иных органов;
- третья гипотеза посвящена MAMP. Предполагается, что они могут абсорбироваться и передаваться в другие органы и ткани (внекишечные), где активируют RRP, расположенные в иммунных клетках, влияя на врожденный иммунный ответ;
- четвертая теория построена на иммуномодулирующем действии адсорбируемых метаболитов кишечной микробиоты, известном как «метаболическое перепрограммирование». Эти метаболиты, в частности КЦЖК, связываются с рецепторами иммунных клеток дыхательных путей и усиливают противовирусный ответ в легких [11].
Согласно концепции ось «кишечник-легкие», возникновение COVID‑19-индуцированной интерстициальной пневмонии, острого респираторного дистресс-синдрома по механизму двухсторонней связи приведет к глобальному нарушению функции кишечного микробиома, развитию дисбиоза, сопровождающего или провоцирующего возникновение других заболеваний [1, 15, 40, 47, 48]. На основании этой гипотезы высказано немало предположений о способности нормально функционирующей кишечной микробиоты предупреждать инфицирование SARS-CoV‑2, облегчать течение или ускорять выздоровление COVID‑19, повышать результативность вакцинации [1, 15, 40, 47, 48]. Несмотря на отсутствие прямых доказательств эффективности этого подхода, в настоящее время проводится активное изучение результативности применения пробиотиков у больных COVID‑19.
Кульминация. Пробиотики и респираторные вирусные инфекции
Учитывая вышеизложенные результаты экспериментальных исследований и обзорных статей, мы решили проанализировать современную доказательную базу эффективности пробиотиков при острых респираторных вирусных инфекциях (ОРВИ), в том числе COVID‑19.
Метаанализы: пробиотики при ОРВИ
Одной из основополагающих работ, подтверждающей эффективность пробиотиков при ОРВИ, является метаанализ 12 рандомизированных контролированных исследований (РКИ; n=3720), который подготовили эксперты Кокрановского сотрудничества; в нем оценивались эффективность и безопасность пробиотиков в профилактике ОРВИ по сравнению с плацебо [18]. Пробиотики превосходили плацебо в уменьшении количества пациентов, перенесших ОРВИ (как минимум один эпизод: отношение шансов (ОШ) 0,53; 95% доверительный интервал (ДИ) 0,37-0,76; р<0,001; как минимум три эпизода: ОШ 0,53; 95% ДИ 0,36-0,80; р=0,002), сокращении длительности одного эпизода ОРВИ (средние различия, СР -1,89; 95% ДИ от -2,03 до -0,175; р<0,001), уменьшении частоты назначения антибиотиков для лечения осложнений ОРВИ (ОШ 0,65; 95% ДИ 0,45-0,94) и снижении количества пропусков занятий в связи с простудой (OШ 0,10; 95% ДИ 0,02-0,47) [18]. Эксперты отметили низкое качество полученных доказательств и подчеркнули безопасность пероральных пробиотиков: частота возникновения побочных эффектов при их приеме была меньше, чем при применении плацебо [18].
Согласно метаанализу, основанному на данных 31 клинического исследования, прием пробиотиков/синбиотиков ассоциирован со снижением окислительного стресса в виде достоверного роста общей антиоксидантной способности сыворотки (взвешенная разность средних, ВРС 54,14 ммоль/л; 95% ДИ 27,87-80,40; р<0,001), сывороточной концентрации глутатиона (ВРС 40,38 мкмоль/л; 95% ДИ 20,72-60,03; р<0,001) и оксида азота (ВРС 3,54 мкмоль/л; 95% ДИ 1,73-5,34; р<0,001), уменьшением уровня малонового диальдегида (ВРС -0,45 мкмоль/л; 95% ДИ от -0,58 до -0,32; р<0,001) [38].
В 2020 г. представлены результаты метаанализа 6 РКИ (n=1551), подтвердившие способность пробиотиков достоверно уменьшать распространенность (относительный риск (ОР) 0,77; 95% ДИ 0,68-0,87; р<0,0001), частоту возникновения (ОШ 0,72; 95% ДИ 0,6-0,86; р=0,0002), среднюю продолжительность одного эпизода ОРВИ (СР -2,66; 95% ДИ от -4,79 до -0,54; р=0,01). Частота возникновения побочных эффектов в группе пробиотиков оказалась сопоставимой с таковой в группе плацебо [29].
В недавно опубликованном метаанализе 16 клинических исследований (n>10 000) исследовалось влияние кишечной микробиоты на вероятность развития респираторных инфекционных заболеваний (РИЗ) посредством оси «кишечник-легкие» [7]. Первичную конечную точку определили как долю участников, перенесших как минимум один эпизод РИЗ на протяжении периода наблюдения. Оказалось, что прием синбиотика уменьшал вероятность развития респираторной патологии на 16% (95% ДИ 4-27%), количество пациентов, заболевших РИЗ на 16% (95% ДИ 5-26%). Синбиотики оказались более эффективными в профилактике РИЗ у взрослых, чем у детей. Исследователи считают, что синбиотики могут служить альтернативной стратегией в поддержании здоровья, профилактике РИЗ [7].
Целесообразность обогащения пищевого рациона пробиотическими штаммами лактобацилл показана в рамках систематического обзора 39 РКИ в связи с потенциальным положительным влиянием на профилактику и лечение ОРВИ [39].
По мнению В. Mullish и соавт., назначение пробиотиков пациентам с избыточной массой тела или ожирением сопровождается не только снижением веса и улучшением некоторых метаболических параметров, а также уменьшением частоты развития ОРВИ на 27%, при этом эффективность пробиотиков оказалась выше у лиц старше 45 лет или участников с индексом массы тела ≥30 кг/м2. Основываясь на полученных данных, исследователи считают целесообразным назначение пробиотиков для профилактики ОРВИ, а также, возможно, и COVID‑19 [35].
Пробиотики и заболевания дыхательных путей
Пробиотики используются не только с целью лечения или профилактики ОРВИ; активно изучается их эффективность в лечении разнообразной респираторной патологии, в том числе и бронхиальной астмы (БА). Одно из последних таких исследований проведено китайскими учеными [21]. Несмотря на то, что прием пробиотиков не позволял снизить риск развития БА (ОР 0,95; 95% ДИ 0,82-1,11) или нивелировать одышку (ОР 0,99; 95% ДИ 0,88-1,11), пробиотикотерапия ассоциировалась с улучшением функции легких и ускорением достижения контроля над течением заболевания [21].
В условиях пандемии COVID‑19 и роста количества больных, нуждающихся в проведении искусственной вентиляции легких (ИВЛ), большое значение уделяют профилактике и лечению ИВЛ-ассоциированной пневмонии. Этой проблеме посвящены несколько недавно опубликованных метаанализов. В одном из них изучалась распространенность ИВЛ-ассоциированной пневмонии у тяжелобольных пациентов, получающих пробиотики [5]. Установлено, что пробиотики позволяют снизить распространенность ИВЛ-ассоциированной пневмонии (СР -3,75; 95% ДИ 0,56, -0,88; р=0,002), длительность пребывания в реанимационном отделении (СР -4,2; 95% ДИ от -6,93 до -0,58; р=0,02) и внутрибольничную летальность (ОШ 0,73; 95% ДИ 0,54-0,98; р=0,04) по сравнению с контролем [5]. В то же время пробиотики не оказывали достоверного влияния на продолжительность стационарного лечения (СР -1,94; 95% ДИ от -7,17 до 3,28; р=0,47) и частоту возникновения диареи (OШ 0,59; 95% ДИ 0,34-1,03; р=0,06). Авторы этого исследования называют пробиотикотерапию многообещающей и настаивают на продолжении ее применения у пациентов, находящихся на ИВЛ [5].
Результаты другого сетевого метаанализа подтверждают эффективность пробиотиков в профилактике ИВЛ-ассоциированной пневмонии: комбинация В. longum, L. bulgaricus и Streptococcus thermophilus, а также монокомпонентный пробиотик L. rhamnosus превосходили плацебо [16]. Назначение пробиотиков позволяло снизить показатели внутрибольничной летальности и смертности в отделениях реанимации [16].
Авторы информационного обзора и метаанализа клинических исследований считают, что пробиотики могут быть полезными в лечении различных заболеваний дыхательных путей (без учета этиологии заболевания – не только БА, ИВЛ-ассоциированной пневмонии) и рекомендуют применять эти препараты для лечения разнообразной респираторной патологии (рис. 4) [27].
Рис. 4. Суммарные данные об эффекторных механизмах пробиотиков и доказательства их эффективности при респираторных вирусных инфекциях (по Lehtoranta L. et al., 2020 [27])
Примечания: РФИ – регуляторный фактор интерферонов, ГИРК‑1 – ген‑1, индуцируемый ретиноевой кислотой,
НK – натуральные киллеры.
Данные доказательной медицины: выбор пробиотического штамма при ОРВИ
Проблема выбора эффективного и безопасного пробиотика является еще одним актуальным вопросом, требующим четкого ответа. Среди результатов экспериментальных и клинических исследований, опубликованных на протяжении 2019-2021 гг. и посвященных целесообразности применения пробиотиков при ОРВИ, следует отметить, что наибольшее количество проведено с применением лакто- и бифидобактерий.
В одном экспериментальном исследовании пробиотическая смесь, содержащая L. rhamnosus GG, Escherichia coli Nissle 1917, VSL # 3 и ежедневно вводимая новорожденным мышам перорально до инфицирования респираторно-синцитиальным вирусом (РСВ), предупреждала возникновение РСВ-индуцированного поражения легких, способствовала развитию противовирусного иммунитета за счет стимуляции синтеза интерферона (IFN)-β, увеличению количества КЦЖК, восстановлению микробиоты легких [20].
Способность L. rhamnosus GG усиливать иммунитет человека в противостоянии с респираторными вирусами подтверждена в метаанализе 12 РКИ (n=4527), установившем, что прием этой пробиотической бактерии позволяет достоверно сократить длительность ОРВИ (3 РКИ, n=1295, СР -0,78 дней; 95% ДИ) от -1,46 до -0,09 [25].
Иммуномодулирующие свойства в отношении ОРВИ отмечены у L. plantarum DR7: введение этого штамма уменьшало длительность назальных проявлений (СР 5,09 дней; 95% ДИ 0,42-9,75), частоту ОРВИ (СР 0,32; 95% ДИ 0,01-0,63) у взрослых в возрасте 30-60 лет по сравнению с плацебо. Терапия L. plantarum сопровождалась снижением уровня провоспалительных цитокинов в плазме (IFN-γ, TNF-α), выраженности оксидативного стресса и ростом противовоспалительных цитокинов (ИЛ‑4, ИЛ‑10), модуляцией активности Т-клеток в виде снижения экспрессии CD4 и CD8 в плазме в 11,26 и 1,80 раз соответственно (по сравнению с плацебо) [8].
Испанские ученые утверждают, что 12-недельная терапия L. plantarum ассоциирована с уменьшением частоты возникновения и степени выраженности симптомов респираторных вирусных инфекций, числа дней с высокой температурой, а также сокращением количества медикаментов, использующихся для лечения ОРВИ, в 3,4 раза по сравнению с плацебо (р=0,016) [3].
Ежедневный прием комбинированного пробиотика, состоявшего из L. plantarum HEAL9 и L. paracasei 8700:2, на протяжении 3 месяцев эффективно защищал детей в возрасте 1-6 лет (n=320) от развития ОРВИ, а в случае его возникновения достоверно уменьшал выраженность назальных симптомов в два раза по сравнению с плацебо [26].
В рамках небольшого клинического исследования доказано, что прием мультикомпонентного пробиотика, содержащего L. acidophilus LB-G80, L. paracasei LPc-G110, L. lactis LLL-G25, Bifidobacterium animalis BL-G101, B. bifidum BB-G90, на протяжении 30 дней до начала марафона позволяет уменьшить распространенность инфекционных заболеваний верхних дыхательных путей после спортивного соревнования, что сопровождается снижением уровня провоспалительного ИЛ‑6 сразу после марафона и ростом противовоспалительного ИЛ‑10 через 1 час после завершения гонки [45].
В систематическом обзоре и метаанализе 9 РКИ доказано, что употребление ферментированного молочного продукта, содержащего L. рaracasei, значительно снижает вероятность развития ≥1 эпизода РИЗ (ОШ 0,81; 95% ДИ 0,66-0,98; р=0,029), достоверно уменьшает среднее количество эпизодов РИЗ на 1 пациента (ОШ -0,09; 95% ДИ от -0,15 до -0,04; р=0,001); отмечена тенденция к снижению суммарного числа РИЗ (ОР 0,91; 95% ДИ 0,82-1,01; р=0,082) [37].
Группа ученых, выполнивших экспериментальное исследование на лабораторных мышах, отметила сильный потенциал B. bifidum в модуляции гуморальных и клеточных иммунных ответов, индукции сбалансированного иммунного ответа Th1/Th2 против вируса гриппа [31].
Следует отметить, что в настоящее время проводится исследование E-PROSPECT, посвященное уже не просто определению эффективности пробиотика при респираторной патологии, а экономическому анализу применения L. rhamnosus GG в профилактике тяжелой пневмонии и эндотрахеальной колонизации: оцениваются прямые и индивидуальные затраты, расходы на проведение радиологических / лабораторных исследований, оперативных / неоперативных вмешательств [24]. Данное исследование можно считать следующим шагом по использованию пероральных пробиотиков в лечении заболеваний органов дыхания.
Пробиотики и вирусная диарея
Еще одним толчком к использованию пробиотиков при COVID‑19 стали особенности инфицирования и выведения SARS-CoV‑2, предполагающие поражение ЖКТ, развитие диареи и выделение вируса с фекалиями. В то же время применение массивной антибиотикотерапии для лечения вторичной бактериальной терапии у больных COVID‑19 является фактором риска развития антибиотик-ассоциированной диареи (ААД), для лечения и профилактики которой широко используются пробиотические препараты.
Обоснованием сформулированной теории стали данные доказательной медицины, подтверждающие способность некоторых пробиотических штаммов нивелировать проявления вирусной диареи. Например, в одном метаанализе, изучавшем эффективность L. acidophilus в профилактике РИЗ у детей (n=1740), доказана способность этого пробиотика сокращать продолжительность диареи (4 РКИ, n=224, СР -20,31 ч; 95% ДИ от -27,06 до -13,57), тогда как прием L. paracasei CBA L74 не только уменьшал вероятность возникновения диареи (ОР 0,51; 95% ДИ 0,37-0,71), но и снижал риск развития фарингита (ОР 0,31; 95% ДИ 0,12-0,83) и ларингита (ОР 0,44; 95% ДИ 0,29-0,67) по сравнению с плацебо [32].
В другом систематическом обзоре и метаанализе подчеркивается антидиарейная активность штаммов B. clausii, которые значимо сокращают продолжительность диареи (СР -9,12 ч; 95% ДИ от -16,49 до -1,75; p=0,015), длительность госпитализации (СР -0,85 дня; 95% ДИ от -1,56 до -0,15; р=0,017), несколько уменьшают частоту опорожнения кишечника (СР -0,19; 95% ДИ от -0,43 до -0,06; p=0,14) по сравнению с контролем, а также имеют хороший профиль безопасности [19].
Консенсус азиатских экспертов, сформулировавший специальные рекомендации по адъювантному применению B. clausii (2020), рекомендовал использование этого пробиотика в качестве вспомогательной терапии для пероральной регидратации при острой вирусной диарее, а также для профилактики ААД, лечения Clostridium difficile-индуцированной диареи [10]. Свежий метаанализ, подготовленный М. Storr и соавт., поддерживает эффективность Saccharomyces boulardii и L. rhamnosus GG в профилактике ААД (как у детей, так и у взрослых) [42]. Согласно рекомендациям Всемирной гастроэнтерологической организации (WGO), представленным в руководстве «Пробиотики и пребиотики» (2017), для лечения и профилактики ААД следует использовать L. acidophilus, L. rhamnosus, L. reuteri, S. boulardii [17].
Поддерживают целесообразность применения S. boulardii при диарее авторы метаанализа, доказавшие, что их прием по сравнению с плацебо / отсутствием лечения позволяет сократить продолжительность диареи (23 РКИ, n=3450, средние различия -1,06 дня; 95% ДИ от -1,32 до -0,79), уменьшить продолжительность стационарного лечения по поводу острого гастроэнтерита (8 РКИ, n=999, СР -0,85 дня; 95% ДИ от -1,35 до -0,34) и снизить вероятность возникновения диареи на 2-7-й день болезни [43].
COVID‑19: роль и место пробиотиков
Международные медицинские базы данных пока не могут похвастаться большим количеством клинических исследований, метаанализов, в которых изучалась эффективность пробиотиков у больных СOVID‑19; ниже мы приводим обзор имеющихся публикаций.
Высокую эффективность пробиотиков и оси «кишечник-легкие» в лечении COVID‑19 подчеркивают G. d’Ettorre и соавт., которые назначали ПЦР-положительным стационарным больным COVID‑19 с поражением 50% легких, фебрильной температурой, нуждавшимся в неинвазивной кислородотерапии, поликомпонентные пробиотики [12]. Использование пробиотиков итальянские ученые назвали пероральной бактериотерапией. Бактериотерапия с использованием пробиотических штаммов Streptococcus thermophilus DSM 32345, L. acidophilus DSM 32241, L. helveticus DSM 32242, L. paracasei DSM 32243, L. plantarum DSM 32244, L. brevis DSM 27961, B. lactis DSM 32246, B. lactis DSM 32247 способствовала купированию диареи, ремиссии других симптомов практически у всех пациентов, принимавших пробиотики, по сравнению с больными, не получавшими эти препараты. Кроме того, риск развития дыхательной недостаточности оказался в восемь раз ниже у пациентов, находившихся на пероральной бактериотерапии. Распространенность дыхательной недостаточности и уровень смертности пациентов, переведенных в отделение интенсивной терапии и не получавших пероральные пробиотики, достоверно превышали таковые у больных, принимавших полезные бактерии [12]. Основываясь на полученных данных, исследователи считают, что пробиотики способны значительно улучшить клиническое состояние пациентов, инфицированных SARS-CoV‑2 [12].
Целесообразность использования штаммов Lactobacillus при COVID‑19 поддерживают авторы подробного литературного обзора, представившие данные доказательной медицины, накопленные на протяжении нескольких десятилетий и раскрывающие эффективность указанных пробиотических штаммов в лечении ОРВИ [49]. Основываясь на этих данных, S. Zrelli и соавт. (2021) предполагают способность лактобактерий укреплять клеточный барьер, препятствовать пенетрации SARS-CoV‑2 и модулировать иммунный ответ [49].
Один из первых метаанализов, анализировавших способность пробиотиков влиять на профилактику и лечение СOVID‑19, представили Z. Paknahad и соавт. (2020) [36]. Разделив 24 исследования на три подгруппы (в зависимости от области применения пробиотиков – сокращение длительности и тяжести СOVID‑19 (n=9), распространенность заболевания (n=6), вероятность развития осложнений, часто сопровождающих вирусные инфекции (n=9)), исследователи получили многообещающие результаты. Z. Paknahad и соавт. заключили, что прием пробиотиков может быть целесообразен при инфекции SARS-CoV‑2 и рекомендовали проведение широкомасштабных РКИ для принятия обоснованного решения [36].
В настоящее время проводится несколько РКИ, изучающих результативность пробиотиков при COVID‑19. В одном из них лицам, недавно контактировавшим с ПЦР-положительными родственниками (запланированное количество участников – 1132 человек), рекомендуют перорально принимать L. rhamnosus GG на протяжении 28 дней [44]. Исследователи ожидают подтвердить гипотезу, что пробиотик способен предотвратить развитие COVID‑19, уменьшить тяжесть заболевания у уже инфицированных лиц, а также восстановить состав и функцию кишечного микробиома [44].
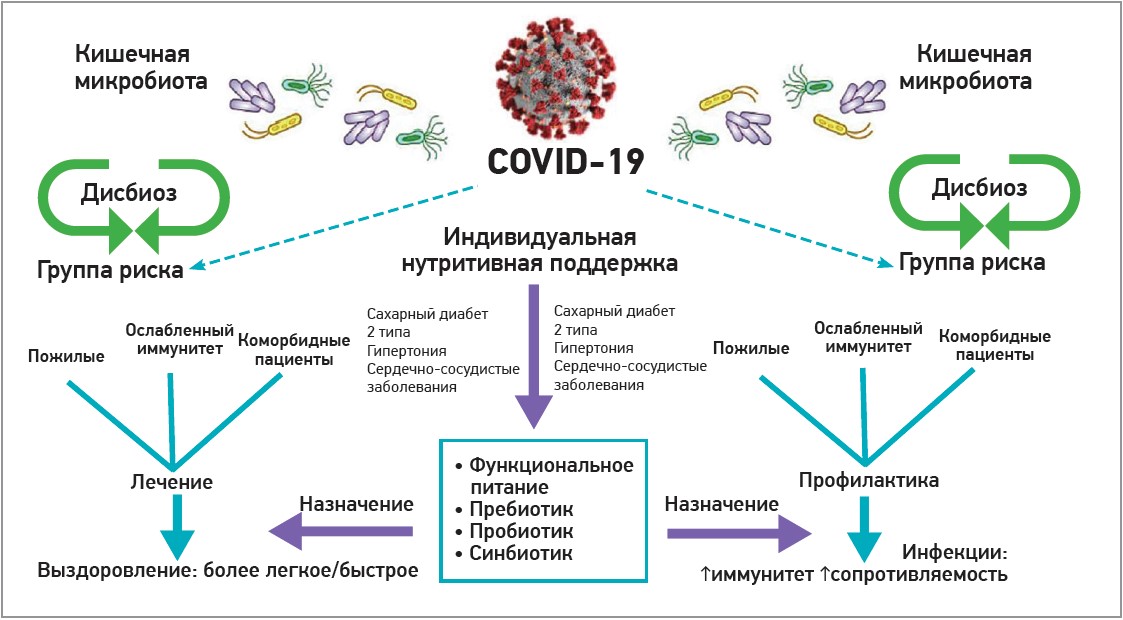
Последователи теории ось «кишечник-легкие» полагают, что в условиях пандемии COVID‑19 пожилые люди, пациенты с ослабленным иммунитетом и коморбидной патологией (сахарный диабет 2 типа, артериальная гипертония, сердечно-сосудистые заболевания) нуждаются в индивидуальной нутритивной поддержке, в том числе и в назначении пробиотиков как с профилактической, так и с лечебной целью, т. к. данная мера позволяет усилить иммунную защиту, повысить сопротивляемость к вирусным инфекциям, а также ускорить и облегчить процесс выздоровления (рис. 5).
Рис. 5. Индивидуальная нутритивная поддержка при COVID‑19 (по Dhar D. et al., 2020) [13]
Вакцинация от COVID‑19: нужны ли пробиотики?
Кампания по вакцинации против SARS-CoV‑2 стартовала относительно недавно, поэтому пока еще нет убедительных данных доказательной медицины, описывающих влияние пробиотиков на эффективность вакцин. Однако, принимая во внимание результаты систематического обзора и метаанализа 9 РКИ (n=623), подтвердившего способность пробиотиков и пребиотиков усиливать иммунный ответ при использовании противогрипозных вакцин [28], многие ученые ожидают формирования подобного эффекта в отношении COVID‑19, ведь прием пробиотиков/ пребиотиков позволяет улучшить серопротекцию в отношении H1N1 (ОШ 1,83; 95% ДИ 1,19-2,82, p=0,006), H3N2 (OШ 2,85; 95% ДИ 1,59-5,10; p<0,001) и уровень сероконверсии штамма B (OШ 2,11; 95% ДИ 1,38-3,21; p<0,001) [28].
Косвенным подтверждением целесообразности использования пробиотиков при вакцинации может быть экспериментальная работа, выполненная под руководством Y. Jung [22]. Исследователи использовали штаммы лактобактерий в качестве адъюванта при синтезе противогриппозных вакцин. Введение мышам одной дозы противогриппозной вакцины, содержащей термически инактивированные штаммы L. casei DK128, сопровождалось более значимым повышением уровня антител IgG1, IgG2 по сравнению с применением обычной вакцины. Использование указанного адъюванта позволяло добиться увеличения эффективности противогриппозной вакцины, сохранения функции легких, повышения клиренса вируса из легких, снижения уровня провоспалительных цитокинов [22].
Таким образом, данные доказательной медицины убедительно свидетельствуют о наличии противовоспалительного и иммуномодулирующего потенциала у ряда пробиотических штаммов. Эти штамм-специфические свойства зафиксированы и подтверждены в лабораторных, экспериментальных и клинических исследованиях в отношении различных респираторных вирусов, гриппа, РСВ, а также отмечены у больных COVID‑19 (правда, с менее значимой доказательной базой) [12, 36, 44, 49].
Кода. Возможное практическое решение
Одно из замечательных свойств человеческого разума – способность применения полученных знаний на практике. Пандемия COVID‑19 внесла ряд изменений в деятельность врачей всего мира, заставляя зачастую действовать решительно и назначать препараты ex juvantibus, иногда не дожидаясь публикации результатов широкомасштабных РКИ, практических руководств. Подобная ситуация складывается в отношении пробиотиков. Многие ученые, врачи практического здравоохранения считают целесообразным назначать больным COVID‑19 пробиотические препараты. Принимая такое решение, они оказываются перед выбором относительно того, какое средство назначить: моно- или поликомпонентное? Авторы систематического обзора 65 РКИ, анализировавшие эффективность пробиотиков при различных заболеваниях, пришли к выводу, что результативность монокомпонентных пробиотиков во многих случаях эквивалентна таковой поликомпонентных смесей, поэтому ученые рекомендуют выбор пробиотического продукта основывать не на количестве пробиотических штаммов, содержащихся в препарате, а на доказательной базе их эффективности [33]. Такого же мнения придерживаются М. Storr и соавт., опубликовавшие систематический обзор результативности пробиотиков при ААД: ученые настаивают на практическом применении пробиотиков, эффективность и безопасность которых подтверждена данными доказательных исследований, систематических обзоров, метаанализов [42].
Следуя рекомендациям L. McFarland [33] и М. Storr [42], мы еще раз проанализировали вышеприведенные сведения; оказалось, что наибольшей доказательной базой в отношении купирования симптомов ОРВИ обладают такие пробиотические штаммы, как L. rhamnosus, L. plantarum, L. acidophilus, L. paracasei, B. bifidum, в нивелировании вирусной диареи – L. acidophilus, L. rhamnosus, L. reuteri, S. boulardii, B. clausii.
Среди множества пробиотических препаратов, представленных на отечественном фармацевтическом рынке, необходимый состав пробиотических штаммов содержится в поликомпонентном синбиотике Опефера (компания World Medicine). Каждая капсула Опефера содержит достаточное количество различных пробиотиков: лактобактерии (L. rhamnosus, L. plantarum, L. acidophilus), бифидобактерии (B. bifidum, B. longum, B. infantis), Streptococcus thermophilus, S. boulardii, пребиотик инулин и сухой экстракт цветков ромашки аптечной (Компендиум, 2021). Учитывая состав Опефера, его назначение больным COVID‑19 может быть ассоциировано с более легким течением заболевания, быстрым купированием респираторных симптомов и нормализацией температуры, снижением потребности в кислородотерапии и предотвращением развития ИВЛ-ассоциированной пневмонии, нивелированием гастроэнтерологических проявлений инфекции SARS-CoV‑2 и ААД. Опефера может использоваться, вероятно, в случаях манифестации COVID‑19 выраженной диареей, за счет наличия в ее составе штаммов S. boulardii, обладающих выраженной антидиарейной активностью. Профилактический прием синбиотика Опефера может быть рекомендован пациентам, входящим в группу риска тяжелого течения COVID‑19: пожилым, пациентам с ослабленным иммунитетом, коморбидной патологией (сахарным диабетом, сердечно-сосудистыми заболеваниями, патологией печени и почек). Возможно, применение Опеферы целесообразно перед прививкой от SARS-CoV‑2 с целью повышения эффективности вакцинации. Оптимальная длительность, кратность и схемы приема пробиотиков пока еще точно не известны; ответы на эти вопросы скрыты в ближайшем будущем.
Противовоспалительные и иммуномодулирующие свойства некоторых пробиотических штаммов способны улучшить функционирование оси «кишечник-легкие» и, вероятно, предотвратить развитие, смягчить течение COVID‑19, повысить эффективность вакцинации от SARS-CoV‑2. Прием пробиотических штаммов, результативность и безопасность которых подтверждена данными доказательной медицины в лечении и профилактике ОРВИ/диареи (L. rhamnosus, L. plantarum, L. acidophilus, B. bifidum, S. boulardii, Streptococcus thermophilus), может быть рекомендован пациентам из группы риска, а также больным COVID‑19, соответственно, в качестве профилактического и/или адъювантного средства (Опефера). Потенциальные преимущества пробиотиков при COVID‑19 еще предстоит изучить, но есть весомые основания использовать их в качестве действенного оружия против нового и коварного врага. Подобно Ромену Роллану, сказавшему, что музыка, словно дождь, капля за каплей просачивается в сердце и оживляет его, мы надеемся на животворящее действие пробиотических бактерий и их действенную противовирусную активность в отношении SARS-CoV‑2.
Список литературы находится в редакции.
Медична газета «Здоров’я України 21 сторіччя» № 13-14 (506-507), 2021 р.