1 лютого, 2022
Сучасні можливості замісної терапії за допомогою травних ферментів мікробного походження
 Належне травлення є важливим фактором здоров’я та добробуту людини. Оскільки великі частинки їжі не можуть потрапити до клітин, процес травлення готує їжу для використання клітинами, розщеплюючи її на поживні речовини, які можуть усмоктуватися в кров і потрапляти до клітин. Ефективне травлення – це складний та багатоетапний процес, що включає механічне і ферментативне розщеплення їжі. Механічне травлення – фізичне розщеплення харчових речовин на дрібніші частинки для ефективнішого хімічного. Роль хімічного травлення полягає у подальшому спрощенні травними ферментами молекулярної структури харчових субстратів, основними з котрих є жири, складні вуглеводи та протеїни.
Належне травлення є важливим фактором здоров’я та добробуту людини. Оскільки великі частинки їжі не можуть потрапити до клітин, процес травлення готує їжу для використання клітинами, розщеплюючи її на поживні речовини, які можуть усмоктуватися в кров і потрапляти до клітин. Ефективне травлення – це складний та багатоетапний процес, що включає механічне і ферментативне розщеплення їжі. Механічне травлення – фізичне розщеплення харчових речовин на дрібніші частинки для ефективнішого хімічного. Роль хімічного травлення полягає у подальшому спрощенні травними ферментами молекулярної структури харчових субстратів, основними з котрих є жири, складні вуглеводи та протеїни.
Травлення розпочинається безпосередньо в ротовій порожнині з застосуванням як механічного, так і хімічного компонента. Хімічне травлення в роті незначне – в слині містяться альфа-амілаза та ліпаза, які перетравлюють крохмаль у мальтозу й мальтотріозу, а також гідролізують складноефірні зв’язки в тригліцеридах з утворенням діацил- і моноацилгліцеринів відповідно [53]. Під час потрапляння до шлунка харчова грудка (хімус) так само піддається механічному та хімічному впливу – за рахунок соляної кислоти й ферментів, які перетравлюють білки. Окремо слід звернути увагу, що в нормі антральний відділ шлунка виконує функцію подрібнення і тільки частинки діаметром <2 мм можуть проходити через воротар у дванадцятипалу кишку. Решта харчової грудки виштовхується назад у тіло шлунка для подальшого механічного та хімічного травлення; цей процес повторюватиметься доти, доки частинки їжі не стануть достатньо маленькими для проходження через воротар у дванадцятипалу кишку. Однак найбільша частина процесів хімічного травлення відбувається в тонкому кишечнику. В дванадцятипалій кишці хімус поєднується із секретом підшлункової залози та дванадцятипалої кишки. Підшлункова залоза – основний продуцент травних ферментів, включаючи амілазу, ліпазу, трипсиноген, хімотрипсиноген, прокарбоксипептидазу та проеластазу [69], які оптимально функціонують саме в середовищі тонкої кишки, де рН коливається від 6 до 7 через бікарбонат, що також виділяється підшлунковою залозою. Бікарбонат необхідний для розрідження секрету ферментів, підлуговування середовища та нейтралізації шлункової кислоти, коли «закислений» шлунковою кислотою хімус досягає просвіту дванадцятипалої кишки. Амілаза підшлункової залози сприяє перетворенню крохмалю на мальтозу та мальтотріозу, панкреатична ліпаза (спільно з коліпазою) спричиняє гідроліз складноефірних зв’язків у тригліцеридах з утворенням діацилгліцеролів та моноацилгліцеролів. Трипсиноген, хімотрипсиноген, прокарбоксипептидаза та проеластаза – попередники активних пептидаз; підшлункова залоза не секретує активну форму пептидаз – вони перетворюються на активні трипсин, хімотрипсин, карбоксипептидазу й еластазу тільки в просвіті дванадцятипалої кишки для запобігання автолізу залози. Якщо йдеться про травлення в тонкому кишечнику, не можна залишити без уваги жовч, що є його важливим компонентом, адже вона емульгує гідрофобні ліпіди в тонкому кишечнику, а це необхідно для доступу та дії панкреатичної ліпази [69].
Дефекти як у механічному, так і в хімічному травленні сприятимуть нездатності засвоювати певні поживні речовини, що зумовить їхній дефіцит з подальшим розвитком клінічної симптоматики; в цьому аспекті особливої уваги потребує саме підшлункова залоза як центральний орган, екзокринна секреція якого необхідна для ефективного травлення і засвоєння їжі (насамперед ліпідів), адже її недостатній вплив на протеїни та вуглеводи може бути частково компенсований за рахунок ферментів на попередніх етапах травлення.
Недостатнє надходження ферментів підшлункової залози до дванадцятипалої кишки зумовлює розвиток т. зв. екзокринної недостатності підшлункової залози (ЕНПЗ), яка на сьогодні є достатньо недооціненою проблемою сучасної гастроентерології. Під ЕНПЗ розуміють недостатню секрецію ферментів підшлункової залози та/або бікарбонату натрію (коли є порушення ацинарної та/або протокової функції підшлункової залози). Легка ЕНПЗ визначається як знижена секреція одного чи декількох ферментів при збереженні нормальних концентрацій бікарбонату в дванадцятипалій кишці й екскреції жиру з фекаліями. За помірної ЕНПЗ спостерігається зниження продукції як ферментів, так і бікарбонату, але нормальна екскреція жиру з фекаліями зберігається. В разі тяжкої ЕНПЗ (при скороченні функціонального резерву підшлункової залози на ≥90%) знижується продукція ферментів і бікарбонату, а також з’являється стеаторея – патологічне підвищення вмісту жирів у калі [55]. Внаслідок значної резервної ємності підшлункової залози легка та помірна екзокринна недостатність може бути компенсованою і явна стеаторея не розвивається, але ці пацієнти також мають підвищений ризик дефіциту поживних речовин (наприклад, жиророзчинних вітамінів із відповідними клінічними наслідками).
На жаль, клінічні симптоми ЕНПЗ не є специфічними та можуть бути схожими на прояви інших поширених захворювань шлунково-кишкового тракту (ШКТ). Зазвичай вони спостерігаються за стеатореї, недостатнього харчування, дефіциту мікроелементів і вітамінів (насамперед жиророзчинних), дискомфорту в животі, здуття живота, метаболічних захворювань кісток; це спричиняє значне зниження якості життя [73, 102].
Порушення травлення і всмоктування жиру, ймовірно, є найбільш клінічно значимим у пацієнтів з ЕНПЗ унаслідок низки причин, включаючи сприйнятливість ліпази до інактивації через зміну рН, а також наявність альтернативних механізмів перетравлення білків та вуглеводів. Основні механізми, що зумовлюють ЕНПЗ [37]: зниження продукції / секреції панкреатичної ліпази чи її підвищена деструкція (наприклад, за кислого рН), непрохідність протоків підшлункової залози, зниження стимуляції продукції ліпази (наприклад, при целіакії, хворобі Крона, синдромі Швахмана – Даймонда), порушення моторики верхніх відділів ШКТ (наприклад, спорожнення шлунка або швидкий транзит тонкою кишкою), стриктури внаслідок хірургічних втручань.
Мальабсорбція жиру, що триває, спричиняє дефіцит жиророзчинних вітамінів (A, D, E, K) поряд з можливим дефіцитом кальцію, фолієвої кислоти, магнію, тіаміну та цинку. Так, у результаті зниження всмоктування вітаміну D пацієнти з ЕНПЗ мають високий ризик розвитку остеопенії або остеопорозу через зниження мінеральної щільності кісткової тканини, що може ускладнюватися нетравматичними переломами [75, 92]. Дефіцит вітаміну К сприятиме порушенню в системі згортання крові; вітаміну Е – атаксії, а також периферійній невропатії; вітаміну А – порушенню нічного зору та ксерофтальмії. Пацієнти скаржитимуться на втрату маси тіла, збільшення об’єму калу, який буде «жирним» навіть візуально, але слід пам’ятати, що хворі з ЕНПЗ часто змінюють свій раціон, щоб зменшити споживання продуктів, котрі складно засвоюються, унаслідок чого симптоми мальабсорбції можуть не виявлятися постійно [12].
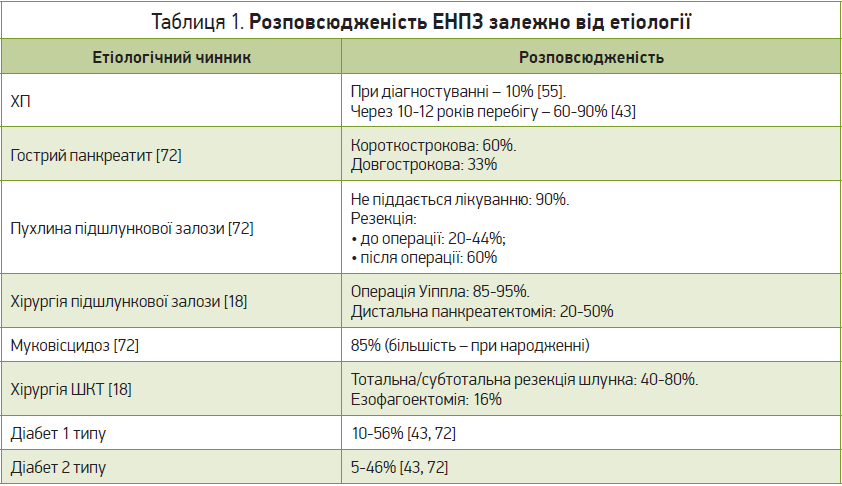
Найчастішою причиною ЕНПЗ є хронічний панкреатит (ХП) [35, 54], який характеризується хронічним патологічним запаленням підшлункової залози, що спричиняє її фіброз із втратою ацинарно-острівцевої структури, отже, додатково втрачається як екзокринна, так і ендокринна функція. ЕНПЗ найчастіше розвивається після 5-10 років перебігу ХП, для чого потрібне значне зниження (на ≈90%) ендогенної секреції ферментів підшлункової залози [38]. Ризик розвитку ЕНПЗ значно збільшується в осіб із хронічним вживанням алкоголю [5], що дуже негативно впливає на підшлункову залозу (алкоголь є дуже токсичним для ацинарних клітин) [37]. Куріння також негативно впливає на розвиток ХП; імовірність ЕНПЗ зростає, коли вплив тютюну поєднується з алкоголем [57, 81]. Так, у багатоцентровому дослідженні виявлено, що зловживання алкоголем у дозі ≥5 стандартних напоїв на день було пов’язано з понад 3-кратним збільшенням ризику розвитку ХП. Окрім того, серед осіб, які зловживали алкоголем і курили, ризик був вищим у 13 разів порівняно з тими, хто лише зловживав алкоголем та не курив (р<0,01) [103]. Нещодавнє перехресне дослідження довело, що в курців (навіть без захворювань підшлункової залози) спостерігається вища частота виявлення помірного (18%) та тяжкого (10%) зниження еластази калу (асоційованої з ЕНПЗ) порівняно з контролем [81]. Утримання від тютюну та алкоголю сповільнює розвиток ХП і пов’язаних з ним ускладнень, отже, й ЕНПЗ. Деякі генетичні причини ХП (мутації PRSS1, що зумовлюють спадковий панкреатит) також пов’язані з ЕНПЗ. Поширеність загальної остеопатії (остеопенія та остеопороз) становить >60% у пацієнтів із ХП [34].
ЕНПЗ можуть зумовлювати й інші етіологічні причини (як панкреатичні, так і позапанкреатичні): гострий панкреатит, муковісцидоз, рак підшлункової залози, цукровий діабет, целіакія, запальні захворювання кишечнику, операції на ШКТ та підшлунковій залозі, ВІЛ, генетичні, а також вроджені фактори тощо [4, 19, 40, 43, 46, 47, 50, 55, 71, 74, 79, 99].
Після тяжкого гострого панкреатиту ЕНПЗ може з’явитися внаслідок втрати паренхіми підшлункової залози та/або її функціональної здатності через значний панкреонекроз, зниження вивільнення ферментів з ацинарних клітин, обструкцію проток [88]. Метааналіз, що протягом 36 міс оцінював ЕНПЗ після гострого панкреатиту, продемонстрував, що вона розвинулася в 27% пацієнтів [46].
Муковісцидоз (англ. cystic fibrosis, CF) – автосомно-рецесивне захворювання, що характеризується мутацією в гені CF‑регулятора трансмембранної провідності, який в нормі експресується в протокових клітинах підшлункової залози, відповідальних за перенесення рідини й аніонів у просвіт протоків для розрідження секрету підшлункової залози, а також забезпечення його проходження до дванадцятипалої кишки. Ця зміна експресії генів спричиняє осадження білкових виділень, які перешкоджають відтоку (секрет підшлункової залози стає надзвичайно в’язким і закупорює її протоки), та руйнують ацинарні клітини [67], що у 85% пацієнтів зумовлює розвиток ЕНПЖ [16, 100]. Отже, в просвіті тонкої кишки порушується травлення білків, жирів і вуглеводів та з’являється передчасна активація травних ферментів підшлункової залози, спричиняючи автоліз, а також запалення.
Механізм ЕНПЗ при новоутвореннях підшлункової залози пов’язаний з обструкцією проток і втратою функціональної паренхіми через атрофію залози вище місця обструкції. Найтяжча ЕНПЗ спостерігається в пацієнтів із неоперабельною злоякісною пухлиною підшлункової залози – поширеність коливається від 50 до 90% [9]. Однак оперативне лікування (резекції) підшлункової залози при злоякісних та доброякісних новоутвореннях через втрату паренхіми підшлункової залози також дуже часто спричиняє зниження її функціональних можливостей, що зумовлює ЕНПЗ. Частота розвитку ЕНПЗ після дистальної панкреатектомії – в діапазоні 15-42%, а після центральної панкреатектомії – ≈10% [49, 64, 85]. Однак за наявності раніше існуючого ХП поширеність ЕНПЗ буде значно вищою і становитиме в середньому >60% як після панкреатодуоденектомії, так і після дистальної панкреатектомії [62, 85]. Крім того, резекція шлунка та/або тонкої кишки під час резекції підшлункової залози може спричинити порушення координації відповідних травних процесів з подальшим порушенням виробництва та вивільнення ферментів підшлункової залози [93].
Оперативне втручання на верхніх відділах ШКТ також впливає на екзокринну функцію підшлункової залози – після загальної / субтотальної резекції шлунка (як при пухлинах шлунка, так і при виразковій хворобі) в 40-80% випадків виявляється її недостатність. Езофагектомія також асоційована з виникненням ЕНПЗ у 16% випадків [6, 48, 96].
Порушення відтоку жовчі (наприклад, у хворих із жовчнокам’яною хворобою) зумовить порушення емульгації жирів; панкреатична ліпаза не має змоги отримати доступ до тригліцеридів, через що жири залишаться неперетравленими [33].
В разі цукрового діабету дуже часто спостерігаються ураження мікросудинного русла, що надає негативного ефекту багатьом органам і системам та може сприяти розвитку фіброзу підшлункової залози [61, 86], тому не дивно, що ЕНПЗ не є рідкістю як за діабету 1, так і 2 типу. Довготривалий анамнез діабету 1 та 2 типів пов’язаний з помірними екзокринними порушеннями в 30-50% і 15-35% хворих відповідно, а також з тяжкими – в 5-30% та 5-15% відповідно [76].
Помірна (20-30%) або тяжка ЕНПЗ (3-40%) також спостерігалася в хронічних хворих із серцевою недостатністю або тяжкохворих [59], можливо, через судинні чинники або чинники, пов’язані з ліками.
Процеси старіння організму негативно впливають на підшлункову залозу, сприяючи розвитку її фіброзу й атрофії, що, своєю чергою, спричиняє помірну ЕНПЗ у 10% і тяжку ЕНПЗ у 5% хворих віком >70 років [56].
ЕНПЗ часто зустрічається у ВІЛ‑позитивних пацієнтів, що нещодавно підтверджено за допомогою проспективного дослідження, в якому було виявлено помірне (в 32%) та тяжке (20%) зниження еластази калу в пацієнтів, котрі отримували антиретровірусну терапію [104].
Інші чинники ЕНПЗ – стани, які зустрічаються доволі нечасто (синдроми Швахмана – Даймонда та Йохансона – Бліззарда, вроджений дефіцит ферментів (трипсиногену, ентеропептидази), а також ізольований дефіцит амілази, ліпази тощо) [55].
В таблиці 1 наведено підсумок розповсюдженості ЕНПЗ залежно від етіологічного чинника її розвитку.
З огляду на вищезазначене перед лікарями постає питання своєчасної діагностики ЕНПЗ для призначення відповідного лікування.
За підозри ЕНПЗ вивчення рівнів еластази та трипсину може підтвердити діагноз. Сьогодні найпопулярнішим тестом для оцінки ЕНПЗ є вимірювання еластази калу; цей тест широко доступний і потребує лише незначного зразка калу, але він має істотний недолік – нездатність виключити ЕНПЗ за легкого чи помірного ступеня. Низькі рівні (<200 мкг/г) калу фекальної еластази, найімовірніше, пов’язані з ЕНПЗ, хоча ще більш низькі рівні є специфічнішими; водночас високі його значення (>500 мкг/г) дозволяють клініцисту виключити це ускладнення. Слід ураховувати ймовірність хибнопозитивних результатів (із їхнім заниженням) унаслідок «розбавлення» випорожнень у пацієнтів із діареєю [55], тому важливо не вимірювати рівні еластази в рідких випорожненнях. Допускається вимірювання трипсину в сироватці крові – рівні <20 нг/мл зазвичай спостерігаються в пацієнтів з ЕНПЗ [11, 51].
В арсеналі лікаря для підтвердження стеатореї та діагностики ЕНПЗ існує т. зв. золотий стандарт – 72-годинний аналіз умісту жиру в калі під час дієти з високим умістом жиру, що дає можливість вирахувати коефіцієнт поглинання жиру, але він є складним у проведенні, тому застосовується переважно під час клінічних випробувань. Крім того, він має певні обмеження з погляду специфічності – за мальабсорбції жиру, не пов’язаної з підшлунковою залозою.
У клінічних умовах можливо провести неінвазивний функціональний дихальний C13-тест (13C-MTG-BT) для оцінки ЕНПЗ і відповіді на лікування ферментними препаратами підшлункової залози, що є альтернативою 72-годинному тесту, за допомогою якого можна визначити ЕНПЗ легкого та помірного ступенів. На жаль, він також має обмеження з погляду специфічності – можливі хибнопозитивні результати за мальабсорбції жиру, не пов’язаної з підшлунковою залозою; крім того, такий тест не є широко доступним.
Варто враховувати, що лише прямі тести зі збиранням соку дванадцятипалої кишки після гормонального стимулу (аналогами секретину чи холецистокініну або прийом їжі) дозволяють кількісно оцінити екзокринну секрецію підшлункової залози та надійно виявити екзокринну недостатність легкого і середнього ступенів. Саме тому вони прийняті за еталонний стандарт. Однак це обстеження є інвазійним, складним, дороговартісним і проводиться лише у високоспеціалізованих центрах.
Кореляція між ЕНПЗ і хронічним недоїданням, що з’являється внаслідок дефіциту поживних речовин та мальабсорбції жиру, має бути в центрі уваги лікарів через ризик довгострокових ускладнень. Недостатнє харчування знижує імунокомпетентність пацієнтів і збільшує ризик негативних серцево-судинних подій [37]. ЕНПЗ – фактор серцево-судинного ризику, незалежний від інших відомих факторів (артеріальна гіпертензія, діабет, тютюн, ожиріння) [23]. Подальші наслідки ЕНПЗ можуть включати гіпероксалурію, ниркову недостатність, порушення когнітивних функцій, отже, й зниження працездатності та якості життя [55]. Наявність супутніх захворювань збільшує захворюваність та смертність пацієнтів з ЕНПЗ [30]. Окрім того, в хворих, котрі мають рак підшлункової залози, розвиток ЕНПЗ є фактором поганого прогнозу; його лікування незалежно покращує результати виживання [8, 70]. З огляду на це дуже важливо своєчасно діагностувати ЕНПЗ; її слід запідозрити, діагностувати та лікувати на ранній стадії у пацієнтів зі станами, пов’язаними з її наявністю та симптомами, як-от здуття живота, дискомфорт у животі, інші незрозумілі дефекти харчування [93]. З урахуванням зазначених ризиків, пов’язаних з недоїданням [95], пацієнтам з діагнозом ЕНПЗ необхідно застосовувати терапію, спрямовану на зменшення основного дефіциту екзокринних ферментів або його заміну за допомогою призначення замісної терапії ферментами підшлункової залози (ЗТФПЗ).
Показанням до ЗТФПЗ є стеаторея з екскрецією жиру з калом >15 г/добу. З огляду на те, що кількісні вимірювання фекального жиру не є широко доступними показанням можуть бути результати вищезазначених тестів у поєднанні з клінічними ознаками мальабсорбції або антропометричними та/або біохімічними ознаками недостатнього харчування. Аномально низькі харчові маркери, пов’язані з ЕНПЗ і ЗТФПЗ, також включають жиророзчинні вітаміни, преальбумін, протеїн-зв’язувальний ретинол, магній. ЗТФПЗ може бути корисною як пробна терапія протягом 4-6 тиж, якщо симптоми є незрозумілими. Саме тому вихідні вимірювання та втручання, які необхідно враховувати до початку ЗТФПЗ, передбачають антропометрію (індекс маси тіла, м’язова маса / сила, комп’ютерна томографія поперекового м’яза на рівні L3, сила захоплення), рівні альбуміну, преальбуміну, ретинол-зв’язувального протеїну, вітамінів D, A, E, В і фолієвої кислоти, глікозильованого гемоглобіну, а також визначення показника міжнародного нормалізованого співвідношення. Водночас слід оцінити параметри способу життя, які можуть збільшити ризик остеопорозу (фізична активність тощо).
Пацієнтам з ЕНПЗ рекомендується вживати більше страв меншими порціями, щоб полегшити травлення та відмовитися від куріння й алкоголю [55, 85]. Раціон таких хворих має бути збалансованим (без необхідності дотримуватися дієти з обмеженим умістом жирів або вживати продукти, збагачені клітковиною).
Принципи ЗТФПЗ полягають у забезпеченні рівня ферментів, достатнього для сприяння адекватному перетравленню та засвоєнню жирів і жиророзчинних вітамінів, що зумовлює покращення ознак, а також симптомів, пов’язаних з панкреатичною недостатністю [39].
Дозу ЗТФПЗ слід підбирати індивідуально відповідно до тяжкості стану пацієнтів та їхніх потреб [31]. З огляду на складність, пов’язану з оптимальним дозуванням ЗТФПЗ, і через варіабельність як умісту жиру в їжі людини, так і залишкової функції підшлункової залози серед медичних працівників все ще зберігається непослідовність щодо оптимального введення і потенційної користі. На жаль, доволі часто тих, кому навіть установлено правильний діагноз, не лікують відповідними дозуваннями ЗТФПЗ. При лікуванні ЕНПЗ необхідно забезпечити наявність в адекватній кількості в просвіті дванадцятипалої кишки активованих панкреатичних ферментів у прандіальний та постпрандіальний періоди. З огляду на першочергову важливість ліполізу розрахунок дозування ферментних препаратів для ЗТФПЗ заснований на активності ліпази, хоча ферментні препарати включають й інші ферменти підшлункової залози. Активність ферментів у різних ферментних препаратах розраховується відповідно до процедур Міжнародної фармацевтичної федерації (FIP), Європейської фармакопеї (PhEur) або Фармакопеї США (USP). Еквівалентність між різними одиницями є такою: для ліпази – 1 од. FIP/PhEur = 1 од. USP; для амілази – 1 од. FIP/PhEur = 4,15 од. USP, для протеази – 1 од. FIP/PhEur = 62,5 од. USP [55], тобто еквіваленти для ліпази є рівнозначними за всіма зазначеними системами оцінки (їх можна порівнювати).
За оцінками, підшлункова залоза в здорових осіб секретує не менше 300 000 МО ліпази з кожним прийомом їжі [55]; ця кількість значно більша за необхідну для нормального перетравлення жирів; за оцінками, лише ≈10% цієї кількості потрібно для адекватного перетравлення поживних речовин, тобто 30 000 МО. Однак при призначенні «зовнішньої» ліпази така кількість може не знадобитися, адже в багатьох хворих зберігається деяка залишкова секреція власної ліпази підшлункової залози. Крім того, може спостерігатися компенсаторне збільшення секреції шлункової ліпази різного ступеня, що може забезпечити деяке поліпшення травлення.
Незважаючи на ці міркування, рекомендується мінімальна початкова доза не менше 40 000-50 000 од. ліпази PhU з кожним основним прийомом їжі, а також половиною дози під час перекусів [55]. Останні рандомізовані клінічні дослідження (РКД) довели ефективність ЗТФПЗ із мікросферами з кишковорозчинним покриттям у дозі від 40 000 до 80 000 PhU ліпази для основного прийому їжі та половини цієї дози для легкої закуски [55]. Якщо існують побоювання щодо неадекватної відповіді, дозування можна скоригувати до 90 000 PhU з кожним прийомом їжі (за потреби) [55]. Ферментні добавки слід вводити під час їжі, адже їхня ефективність передбачає змішування з хімусом. Типовий режим полягає у тому, щоб розділити капсули/таблетки так, аби хворий їх приймав як на початку, так і наприкінці прийому їжі (наприклад, половина таблеток вживається після декількох укусів, інші – за мірою ковтання останніх кількох укусів).
Клінічна ефективність ЗТФПЗ може визначатися демонстрацією поліпшення стану за стеатореї – зникає видима стеаторея, покращуються рівень жиророзчинних вітамінів, харчові показники (наприклад, ретинолзв’язувальний протеїн), м’язова сила та якість життя, але вони є сурогатними показниками успіху. В метааналізі, проведеному D. de La Iglesia-García та співавт. [22], лікування ЗТФПЗ у пацієнтів із ХП покращило засвоєння як жиру, так і білка. Крім того, помічено, що ЗТФПЗ покращує симптоми болю в животі, метеоризму та консистенції випорожнень. У великому проспективному когортному дослідженні в хворих із ХП було доведено, що ЕНПЗ є незалежним фактором ризику смертності [24] – аналіз пацієнтів із ХП, які отримували ЗТФПЗ після операції на підшлунковій залозі, продемонстрував поліпшення виживання. Водночас так само покращені результати виживання були продемонстровані під час численних великих когортних досліджень у пацієнтів, котрі використовують ЗТФПЗ після операції з видалення раку підшлункової залози [32, 82, 87]; час виживання збільшився >2 рази [83]. Завдяки перевагам лікування ЕНПЗ отримано практичні рекомендації щодо застосування ЗТФПЗ у пацієнтів з раком підшлункової залози та хірургією підшлункової залози [85]. На жаль, аналіз ситуації з цією категорією хворих доводить, що більшість пацієнтів або не проходять лікування, або отримують неадекватні дози. В європейському дослідженні, проведеному серед осіб з ЕНПЗ через ХП або рак підшлункової залози, ¼ пацієнтів приймали ≤3 капсул/день; >⅔ хворих повідомили про симптоми стеатореї, що тривають [91].
Якість життя було оцінено у відкритому 51-тижневому дослідженні на продовження попереднього подвійного сліпого РКД ЗТФПЗ при лікуванні ЕНПЖ – вона значно покращилася порівняно з вихідним рівнем [80]. Належне впровадження ЗТФПЗ покращує якість життя цих пацієнтів, контролюючи їхні симптоми, а також знижує ризик захворюваності та смертності за рахунок покращення їхнього харчового статусу [26, 55].
Хоча зникнення клінічних ознак мальабсорбції вважається важливим критерієм успіху ЗТФПЗ, для оцінки ефективності такої терапії не завжди достатньо підтвердити нормалізацію параметрів харчування та покращення симптоматики, адже відсутність симптомів не виключає залишкової ЕНПЗ. Для якіснішої оцінки ефективності лікування рекомендуються функціональні тести (дихальний С13-тест (C-MTG-BT) і кількісне вимірювання фекального жиру) [55], особливо якщо симптоми не реагують або лише частково реагують. Це може бути пов’язано з іншими механізмами та потребує диференційної діагностики з іншими механізмами появи мальабсорбції. Визначення ще одного маркера (фекального хімотрипсину) хоча й не надає достовірної інформації щодо впливу ЗТФПЗ на травлення та всмоктування поживних речовин, але його можна використовувати для перевірки відповідності прийому призначеної терапії – низькі значення відповідатимуть непослідовному прийому ЗТФПЗ, при цьому необхідно пам’ятати, що успіх замісної терапії не може бути оцінений шляхом визначення концентрації еластази в калі, адже цим методом можливо визначити лише людський фермент, а не введений зовнішній аналог.
У випадку незадовільної клінічної відповіді [55] дозу ферменту необхідно збільшити (вдвічі чи втричі) або додати кислотосупресивну терапію (інгібітор протонної помпи або Н2-блокатор). Невідомо, який з цих варіантів є ефективнішим, але обидві стратегії варто розглядати як відповідні. Якщо вони виявляться неефективними, слід шукати інший чинник порушення травлення.
В разі призначення ЗТФПЗ необхідно враховувати, що її ефективність залежить від низки факторів, а насамперед від кислотності хімусу, який потрапив до дванадцятипалої кишки. Отже, постає запитання щодо того, яким ферментним препаратам надати перевагу? Згідно з рекомендаціями [55], мікросфери з кишковорозчинним покриттям або мінімікросфери є найкориснішими. Ці рН‑чутливі мінімікросфери захищають ферменти від руйнувальної дії кислотності шлунка та дозволяють їм швидко вивільнятися при рН 5,5 в дванадцятипалій кишці: після прийому кишковорозчинна оболонка захищає ферменти при проходженні через шлунок, під час потрапляння до дванадцятипалої кишки рН‑чутлива оболонка руйнується, виділяючи панкреатичні ферменти [7]. Ефективність рН‑чутливих мінімікросфер із кишковорозчинним покриттям у пацієнтів із ХП продемонстрована в декількох дослідженнях; доведено, що препарати з кишковорозчинним покриттям є ефективнішими, ніж без нього [55]. Продемонстровано, що мінімікросфери діаметром 1,0-1,2 мм пов’язані з вищою терапевтичною ефективністю (порівняно із засобами діаметром 1,8-2,0 мм) [55]. Окрім того, мікро- чи мінітаблетки розміром 2,2-2,5 мм також можуть бути ефективними, хоча наукові дані щодо їхньої ефективності в контексті ХП є обмеженими [55]. Саме тому під час призначення ЗТФПЗ слід пам’ятати, що в деяких людей неадекватна реакція на ЗТФПЗ також може бути спричинена інактивацією ліпази шлунковою кислотою, а це особливо важливо за застосування перорального препарату ЗТФПЗ без кишкового покриття, що потребує одночасного прийому кислоторедукувальних агентів [55, 98].
Окрім того, в тих, хто не відповідає на ЗТФПЗ та/або втрачає масу тіла, слід розглянути альтернативні діагнози, включаючи надмірне зростання бактерій тонкого кишечнику [27, 55, 65], розвиток вторинної злоякісної пухлини підшлункової залози чи не пов’язаної з нею хвороби, як-от целіакія.
Традиційно при порушеннях з боку підшлункової залози використовують ферменти тваринного походження, але вони мають низку особливостей під час застосування – насамперед такі ферменти інактивуються кислим рН шлунка за використання без кишковорозчинної оболонки, яка, до речі, в пацієнтів з вираженим порушенням секреції бікарбонатів в кишечнику (в зв’язку з неможливістю достатнього залуження середовища дванадцятипалої кишки, отже, й з незабезпеченням оптимальних умов для вивільнення) може затримати вивільнення кишковорозчинних ферментів, тому воно відбудеться в іншому місці [98]. В цьому аспекті використання ферментів мікробного походження, які є кислотостійкими та стабільнішими, – ефективне рішення. Переваги мікробних ферментів полягають у тому, що їх можна застосовувати в нижчих дозах, вони мають ширший діапазон активності рН і вищу стабільність, ніж аналоги тваринного походження [84]. Їхня ефективність у поліпшенні травлення була оцінена в клінічних дослідженнях, результати яких свідчать про те, що вони є досить ефективними та безпечними [13, 52, 94]. Такі ферменти можна застосовувати в тих осіб, котрі мають непереносимість тваринних ферментів або гіперчутливість до них.
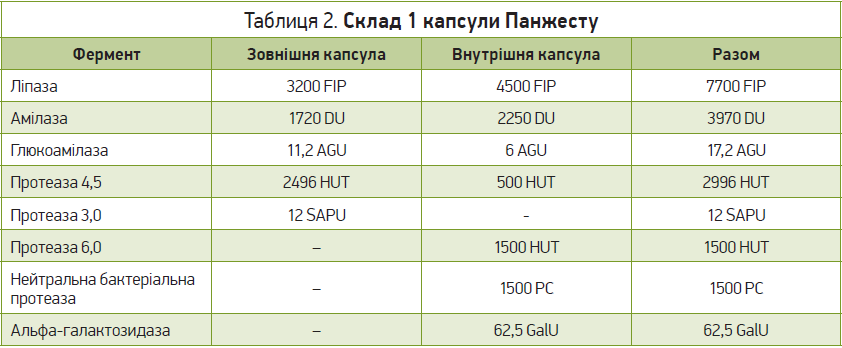
Одним із представників засобів, склад яких базується на ферментах мікробного походження, є Панжест, що має оригінальну структуру та містить різноманітні ферменти для травлення як у шлунку, так і в дванадцятипалій кишці (табл. 2).
Підтримка гомеостазу організму людини потребує достатнього споживання жирів, зокрема тригліцеридів, холестерину, фосфоліпідів, а також їхнього нормального засвоєння. Це відбувається завдяки балансу травних ліпаз, котрі секретуються в травному тракті людини, однак ліпази виробляються не лише в людей і тварин, а й різними рослинами та мікроорганізмами. Мікробні ліпази заслуговують на особливу увагу через свою здатність залишатися активними при екстремальних значеннях температури та рН. Серед мікроорганізмів гриби визнані одними з найкращих джерел ліпаз. Грибні ліпази сьогодні привернули значну увагу промисловості завдяки специфічності та стабільності субстрату в різних хімічних і фізичних умовах [41]. Ліпази Панжесту отримують із грибів, а біотехнологія виробництва стандартизована для забезпечення активності в широкому діапазоні значень рН, що дозволяє досягати піку специфічної активності в кислих і більш лужних умовах шлунка й тонкого кишечнику.
Для життєдіяльності організму людини задля правильного росту, розвитку, відновлення та інших функцій організму також необхідно перетравлювати протеїни. Розмаїття та складність дієтичних білків і вирішальна роль амінокислот у функціях організму відображені в тому факті, що майже 80% панкреатичних ферментів становлять протеази [68, 101]. Панжест містить 3 різні протеази, 2 з яких є грибними, які також стандартизовані на широкий діапазон активності рН з оптимальним значенням рН при більш кислих умовах (у шлунку). Нейтральні та лужні протеази є дуже стабільними в екстремальних умовах pH і температури [21, 63, 90].
Оскільки кишковий епітелій поглинає лише моносахариди, харчові вуглеводи мають гідролізуватися до глюкози під дією α-амілази [101]. Продукти перетравлювання α-амілази – декстрини, суміш мальтози, мальтотріози та розгалужених олігосахаридів. Ферменти щіткової облямівки кишечнику – глюкоамілаза-мальтаза, а також сахараза-ізомальтаза – завершують перетравлення декстринів [60, 101]. Переважними джерелами α-амілази є привушні залози та підшлункова залоза. Мікробні амілази – хороше та безпечне джерело амілаз.
Основне застосування глюкоамілаз полягає в оцукрюванні частково переробленого крохмалю до глюкози. Ниткоподібні гриби традиційно використовуються для продукування глюкоамілази [44], а її застосування допоможе засвоювати частково перероблений крохмаль, що надходить із клітковини харчових продуктів, для покращення якості травлення. Оскільки ці димери й олігосахариди погано перетравлюються, вони можуть ферментуватися кишковими бактеріями та спричиняти кишкові розлади внаслідок газоутворення [78].
Альфа-галактозидаза каталізує гідроліз кінцевих α-галактозильних фрагментів олігосахаридів, а також полісахаридів [3]. Людина, більшість тварин з однокамерним шлунком не можуть синтезувати достатню кількість α-галактозидази в ШКТ, аби цілком засвоїти ці галактосахариди. Це порушення травлення може спричинити різні негативні наслідки. Існують різноманітні стратегії, які сприяють зменшенню кишкових газів. Однак у більшості випадків результати є не надто задовільними. Харчовий фермент (альфа-галактозидаза в складі Панжесту) діє у ШКТ, розщеплюючи специфічні та незасвоювані олігосахариди перед тим, як вони метаболізуються бактеріями товстого кишечнику. Крім того, прийом травного ферменту альфа-галактозидази зменшує утворення кишкових газів після вживання їжі з високим умістом клітковини [29]. Отже, цей засіб може бути корисним для зменшення кількості ферментованих субстратів у товстому кишечнику та запобігання надмірному газоутворенню, пов’язаному з харчуванням [28].
Біотехнологія виробництва амілази, глюкоамілази й альфа-галактозидази у складі Панжесту стандартизована для забезпечення активності в широкому діапазоні значень рН, а це забезпечує стабільність при значеннях pH шлунка та тонкого кишечнику.
Мікробні ферменти, які входять до складу Панжесту, ретельно відібрані та чинять активність при різних значеннях рН ШКТ. Всі вони мають давню історію безпечного використання в людей та тварин у харчовій промисловості та визнані безпечними (мають статус GRAS) Управлінням з контролю за якістю продуктів харчування та лікарських засобів США (без негативного впливу на людину й інші форми життя) [10, 17, 25, 66].
Крім функціонально підібраного складу ферментів, засіб має нову оригінальну систему їхньої доставки – «капсула в капсулі»; із внутрішньої та зовнішньої капсул, в які розподілені компоненти, активні речовини потрапляють до певних ділянок ШКТ залежно від рН середовища.
Зовнішня капсула розпадається після потрапляння до шлунка, а травні ферменти (обрані для вивільнення в шлунку) розщеплюють їжу на менш складні поживні речовини, зберігаючи активність та стабільність в умовах кислого рН шлунка; попереднє перетравлювання їжі в шлунку запобігає розвитку його розладів і відчуття переповнення. Це може бути корисним за інших порушень з боку травного тракту, як-от диспепсія. Диспепсія охоплює сукупність симптомів з боку верхніх відділів ШКТ, у т. ч. дискомфорт у животі, відчуття швидкого насичення тощо; щорічна частота її виникнення становить ≈25% [2]. Тимчасовий дефіцит травних ферментів може бути одним із факторів, що сприяють проявам функціональної диспепсії, тому застосування травних ферментів з метою поліпшення травлення під час диспепсії зменшує такі симптоми, як переповнення шлунка та постпрандіальний дистрес, відрижка, а також метеоризм, здуття живота [52, 97].
Внутрішня капсула виготовлена з рослинного полімеру; його унікальні властивості чинять опір кислим умовам шлунка, захищаючи внутрішню капсулу від розпаду та вивільнення її умісту на цій ділянці; вона розчиняється лише в тонкому кишечнику, де ферменти сприяють перетравленню їжі замість панкреатичних ферментів.
Результати доклінічних і клінічних досліджень обґрунтовують застосування цих ферментів як дієтичної добавки для людей з розладами травлення та екзокринними порушеннями підшлункової залози.
На базі Політехнічного університету Валенсії (La Universidad Politècnica de València, Іспанія) в 2016 році проведено дослідження in vitro, де оцінювали гідролітичну активність Панжесту. Методологія базувалася на перетравленні in vitro стандартної порції їжі (55,6 г згідно з Minekeus et al., 2014), що містить жир, вуглеводи, білки та клітковину. З цією метою використовувалася стандартизована система відтворення травлення в шлунку та кишечнику. Такий підхід дозволив підтвердити повний розпад зовнішньої капсули в кислих умовах шлунка, а також внутрішньої капсули при більш лужному рН кишечнику. Крім того, в цьому дослідженні порівнювали ефективність травлення під впливом Панжесту і лікарського засобу на основі панкреатину тваринного походження, що мав галенову форму кишковорозчинних гранул (10 000 од. PhEur, 8000 од. PhEur амілази та 600 од. PhEur протеази).
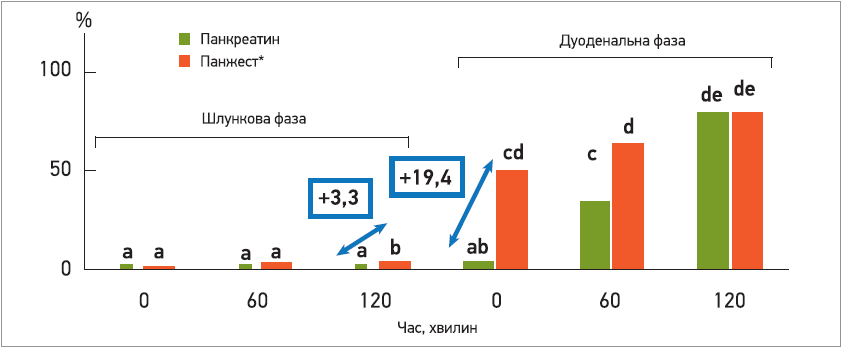
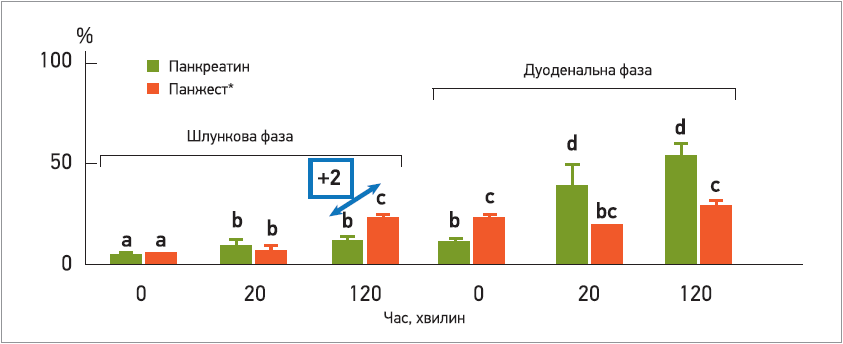
Суміш мікробних ферментів виявилася ефективнішою за панкреатин тваринного походження в індукції ліполізу (рис. 1) в умовах шлунка, а також протягом 1-ї год надходження до дванадцятипалої кишки. Тваринний панкреатин виявився неактивним за таких значень рН у шлунку, оскільки його доставка відбувається в кишковорозчинних гранулах задля уникнення інактивації кислотою. Крім того, посилення ліполізу на вході до дванадцятипалої кишки (у 19 разів) свідчить про те, що мікробні ліпази є високоефективними та стабільними в цих умовах травлення; імовірно, це допоможе запобігти розладу травлення після надходження їжі до кишечнику.
Рис. 1. Вплив на процеси ліполізу при застосуванні Панжесту і лікарського засобу на основі панкреатину тваринного походження
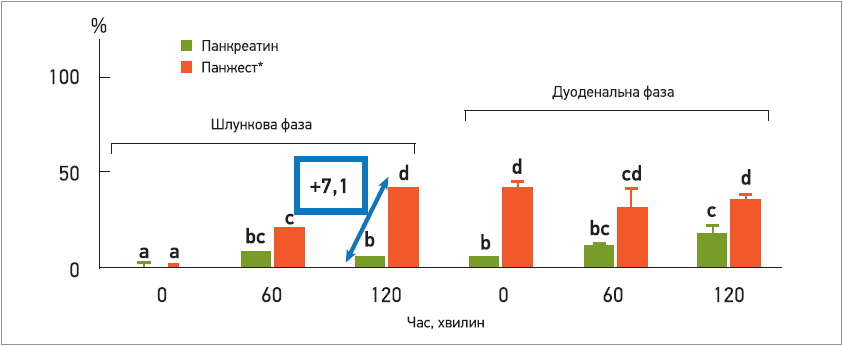
Що стосується перетравлювання вуглеводів, то амілази та глюкоамілази також продемонстрували активність у кислих умовах шлунка – тваринний панкреатин був малоактивним за цих значень рН (рис. 2). Гліколіз, індукований Панжестом, розпочався через 20 хв після початку процесу травлення, а через 2 год в шлунку він був ефективнішим у 7 разів, ніж при застосуванні панкреатину тваринного походження. Це підтверджує факт стабільності ферментів у кишечнику; швидкість травлення зберігалася протягом 2 год перебування в кишечнику і була ефективнішою, ніж у тваринного панкреатину.
Рис. 2. Вплив на процеси гліколізу при застосуванні Панжесту і лікарського засобу на основі панкреатину тваринного походження
Ефективність протеолізу під впливом Панжесту також була очевидно ефективнішою після 2 год травлення в шлунку (рис. 3); крім того, ферменти зберігали протеолітичну активність протягом 2 год у кишечнику.
Рис. 3. Вплив на процеси протеолізу при застосуванні Панжесту і лікарського засобу на основі панкреатину тваринного походження
Вищезазначені результати випробування свідчать про можливі ефекти Панжесту для перетравлення їжі в людей з порушеннями травлення та/або ЕНПЗ. Крім того, підсилення перетравлення їжі в шлунку забезпечить добре перетравлений хімус у дванадцятипалій кишці, що запобігатиме відчуттю розладу шлунка та його переповнення.
З огляду на такі дані було проведено низку досліджень щодо використання мікробних ферментів у тварин і в пацієнтів з диспепсичними проявами (табл. 3).
З метою оцінки ефективності та переносимості мультиферментного комплексу було проведено післяреєстраційне спостережне дослідження тривалістю 14 днів із залученням 2125 пацієнтів, які мали функціональну диспепсію або інші розлади травлення; в результаті виявлено полегшення частоти та ступеня тяжкості загальних симптомів функціональної диспепсії (відрижки, диспепсії, відчуття переповнення шлунка, дискомфорту в животі, втрати апетиту, а також метеоризму й здуття живота) [52]. Аналогічні результати отримали інші дослідники в рандомізованому подвійному сліпому плацебо-контрольованому дослідженні в паралельних групах за участю 40 пацієнтів із функціональною диспепсією, котрі отримували травний мультиферментний комплекс мікробного походження або плацебо протягом 60 днів [58]. Застосування мікробних ферментів було ефективним і безпечним у лікуванні клінічних симптомів у хворих із функціональною диспепсією.
Також цікавим виявився результат подвійного плацебо-контрольованого перехресного дослідження за участю 16 здорових волонтерів. Метою випробування стало вивчення впливу мікробної ліпази на відчуття переповнення шлунка при споживанні їжі з високим умістом жирів. Застосування мікробної ліпази достовірно зменшувало відчуття переповнення шлунка після вживання жирної їжі в здорової особи порівняно із плацебо [36].
Водночас було проведено подвійне плацебо-контрольоване дослідження, учасники якого отримували 300 або 1200 GalU альфа-галактозидази в провокаційному тесті з використанням 420 г варених бобів, білого хліба, оливкової олії, солі та води [29]. Застосування альфа-галактозидази зменшило газоутворення після провокаційного прийому їжі – фермент знизив респіраторну екскрецію водню та ступінь тяжкості метеоризму, а також усі супутні симптоми. В іншому рандомізованому плацебо-контрольованому випробуванні [42] було продемонстровано, що використання пероральної мікробної альфа-галактозидази при симптомах, зумовлених раціоном харчування з високим умістом клітковини, зумовлює достовірне зниження випадків (порівняно із плацебо) метеоризму.
Дослідження на тваринах та за участю людей також підтверджують ефективність використання мікробних травних ферментів задля коригування недостатності підшлункової залози.
Дослідження на тваринах і випробування за участю людей демонструють таке: мікробні ферменти потужніші й ефективніші за панкреатин тваринного походження, тому менша кількість одиниць мікробних ферментів дозволяє досягти еквівалентних результатів (порівняно з панкреатичним ферментом тваринного походження) [1, 84, 89, 94]. Згідно з результатами вищезазначених досліджень було встановлено, що застосування цих ферментів збільшує засвоєння жиру та білків, яке має значимий вплив на соматичний ріст і ліпідний профіль. Ці мікробні ферменти оцінювали в клінічних випробуваннях II та III фази в пацієнтів з ЕНПЗ і муковісцидозом [14, 15, 89]. Отже, з огляду на цю інформацію, а також результати вичерпного огляду літератури, виконаного Roxas і співавт. (2008) [84], можна дійти висновку про те, що застосування мікробних ферментних препаратів є безпечним варіантом сприяння травленню в людини.
Ферменти в складі Панжесту сприяють повноцінному травленню жирів, вуглеводів, білків, які містяться в щоденному раціоні людей, при функціональних порушеннях травлення через дефіцит або дисбаланс травних ферментів, як-от диспепсія, дискомфорт після прийому їжі, відчуття переповнення шлунка, а також зменшують газоутворення під час перетравлення їжі. Панжест може бути рекомендований при станах, що супроводжуються недостатністю панкреатичних ферментів, як-от муковісцидоз, хронічний панкреатит, хірургічні втручання у верхніх відділах ШКТ. Застосування Панжесту зазвичай добре переноситься і не спричиняє значних побічних ефектів.
Отже, Панжест – відмінне рішення для поліпшення травлення в пацієнтів із функціональною диспепсією (розладом травлення) та ЕНПЗ насамперед за рахунок двох важливих переваг. По-перше, вона містить мікробні ферменти, що мають більшу ефективність і стабільність та ширший діапазон активності рН, а це надає змогу обирати одні ферменти для рН шлунка, інші – для рН кишечнику (це неможливо для панкреатину свинячого походження). По-друге, нова технологія «капсула в капсулі» дозволяє доставляти мікробні ферменти за певних значень рН, зокрема в шлунку та кишечнику, щоб гарантувати травлення в ШКТ. Попереднє перетравлення їжі в шлунку запобігає розвитку його розладів і відчуттю переповнення, оскільки добре засвоюваний хімус доставлятиметься до тонкого кишечнику. Водночас застосування травних ферментів мікробного походження збільшує засвоєння жиру та запобігає порушенню засвоєння поживних речовин у пацієнтів з розладами екзокринної функції підшлункової залози [36, 52, 84]. Крім того, завдяки походженню від грибів Панжест являє собою безпечніший варіант для людей, які мають алергію на білки чи речовини тваринного походження.
* Торговельна назва у ЄС – Enzimax від компанії AORA Health.
Список літератури знаходиться в редакції.