8 березня, 2024
Унікальні властивості дріжджового пробіотика Saccharomyces boulardii CNCM I‑745: описовий огляд
Давно відомий сприятливий вплив на здоров’я та добробут людини як бактеріальних, так і дріжджових пробіотиків. Серед дріжджових грибів рід Saccharomyces є ефективним у поліпшенні здоров’я людини, при цьому Saccharomyces boulardii CNCM I‑745 класифікують як пробіотичний засіб. У цьому огляді висвітлюються унікальні властивості S. boulardii та його роль у профілактиці антибіотик-асоційованої діареї (ААД) та дитячого гострого гастроентериту (ДГГЕ) порівняно з бактеріальними пробіотиками. Унікальні властивості S. boulardii, як-от здатність до життєдіяльності в широкому діапазоні рН, нездатність набувати генів резистентності до антибіотиків і швидке досягнення рівноважного стану, надають йому перевагу над бактеріальними пробіотиками. Профілактичне застосування S. boulardii в пацієнтів з ААД дало змогу значно знизити ризик її виникнення (порівняно з контрольною групою) та відновити різноманітність мікробіоти кишечнику. Серед індійських дітей із ДГГЕ S. boulardii CNCM I‑745 виявився ефективнішим порівняно з Lactobacillus rhamnosus GG та 4 штамами Bacillus clausii в скороченні тривалості діареї та зменшенні часу госпіталізації. S. boulardii CNCM I‑745 визнано безпечним пробіотиком для дітей і дорослих, а також рекомендовано декількома міжнародними настановами з лікування гострої діареї. У цьому огляді обговорюються докази ефективності та безпеки S. boulardii CNCM I‑745 як пробіотика для профілактики шлунково-кишкових розладів.
Вступ і передумови для проведення дослідження
Вважається, що мікробіом кишечнику зумовлює розвиток захворювань шлунково-кишкового тракту (ШКТ) і широкий спектр хронічних захворювань людини, включаючи онкологічні й захворювання із запальними, метаболічними, серцево-судинними, автоімунними, неврологічними та психіатричними компонентами [1, 2]. Мікробний дисбіоз – це досить поширений у сучасному світі дисбаланс структури та функції кишкової мікробіоти. Зміни в раціоні харчування, бактеріальні інфекції та неконтрольоване застосування антибіотиків є частими причинами дисбіозу [3].
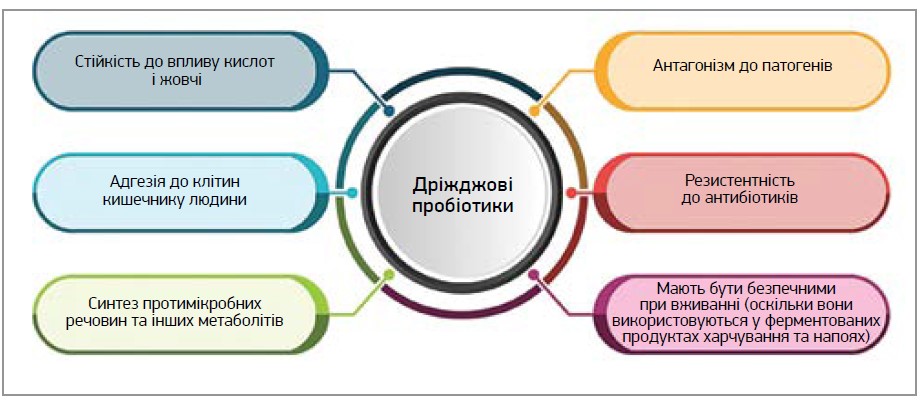
Одним із найефективніших способів відновлення мікробного балансу кишечнику є застосування пробіотиків [3]. Пробіотик – це термін грецького походження, що означає «для життя». Продовольча й сільськогосподарська організація ООН (FАО) та Всесвітня організація охорони здоров’я визначають пробіотики як «живі мікроорганізми, котрі при введенні в достатніх кількостях приносять користь здоров’ю господаря» [4, 5]. Було проведено численні дослідження пробіотиків бактеріального походження, але кількість робіт із вивчення пробіотиків дріжджового походження досить обмежена. Однією з щораз більших загроз, які викликають занепокоєння щодо пробіотиків бактеріального походження, є їхня здатність передавати гени резистентності патогенним бактеріям. Саме тут дріжджі, які за своєю природою є резистентними до антибактеріальних засобів, відіграють корисну та важливу роль як пробіотики [6]. Інші переваги пробіотиків дріжджового походження представлено на рисунку 1.
Рис. 1. Переваги дріжджів як пробіотиків (за матеріалами Shruthi та співавт., 2022)
Дріжджі S. boulardii CNCM I‑745 були першим дріжджовим пробіотиком, який досліджували з метою лікування клінічних розладів у людей. Штам S. boulardii стабільний за широкого діапазону температур і рН (включно з кислим середовищем). Він не призводить до розвитку антибіотикорезистентності та відтворює сприятливу дію проти інфекцій, спричинених патогенними бактеріями (наприклад, Clostridium difficile, Salmonella, Shigella, Escherichia coli), вірусами та дріжджами (переважно Candida albicans). Наявні дані свідчать на користь застосування S. boulardii CNCM I‑745 для лікування різних захворювань [7].
У цьому огляді узагальнено поточні дані щодо ролі S. boulardii як біотерапевтичного засобу для профілактики різних захворювань ШКТ, зокрема ААД та кишкового дисбіозу.
Огляд
Пошук статей здійснювали в базах даних PubMed і NCBI за такими ключовими словами: «пробіотики», «дріжджі як пробіотики» та «переваги пробіотиків». До огляду було включено статті відкритого доступу, в яких обговорювалися переваги різних штамів дріжджів як пробіотиків.
Історія відкриття пробіотиків
Ілля Мечников, лауреат Нобелівської премії, був першим, хто повідомив про позитивний вплив пробіотиків на здоров’я людини. Він припустив, що лактобактерії можна вважати пробіотиком, який має позитивний вплив на здоров’я та запобігає старінню [4].
Сприятливий вплив пробіотиків на здоров’я людини
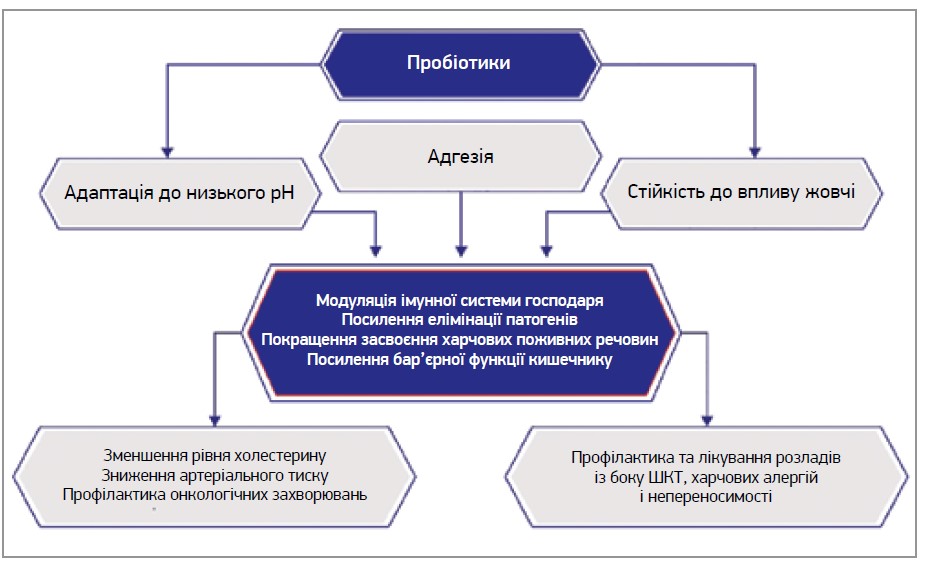
На рисунку 2 наведено деякі позитивні ефекти пробіотиків на здоров’я людини.
Рис. 2. Позитивні ефекти пробіотиків на здоров’я людини (за матеріалами Celebioglu та співавт., 2018)
Джерела пробіотиків
Пробіотичні бактерії були отримані з різних джерел, включаючи грудне молоко людини; раціони харчування, що містять продукти рослинного походження та м’ясо; фекалії людей і тварин; кишки тварин [9]. Іншим джерелом пробіотиків є ШКТ людини, з якого було виділено декілька пробіотичних штамів, наприклад Lactobacillus gasseri та Lactobacillus reuteri, які використовуються сьогодні. Крім того, в багатьох видів тварин, включаючи свиней, щурів і навіть свійських птахів, кишечник багатий на пробіотики [10]. У мікробіомі людини у великій кількості трапляються кілька видів бактерій, грибків і архей [11].
Властивості ідеального пробіотика
Пробіотичні штами діють диференційовано проти різних патогенів за допомогою різних механізмів. Вони впливають шляхом безпосереднього знищення або пригнічення певних патогенів, нейтралізації токсинів патогенів і зміцнення цілісності клітин господаря. Вони також запобігають прикріпленню патогенів до клітин господаря, відновлюють нормальну мікрофлору та врівноважують імунну відповідь (посилюють або знижують її).
Не всім пробіотикам властиві всі ці механізми, але деякі пробіотики, зокрема S. boulardii CNCM I‑745, мають численні антипатогенні властивості [12, 13]. S. boulardii має кілька механізмів дії (див. рис. 2), які можна поділити на три основні типи, а саме: дія в просвіті, трофічна дія та протизапальна сигнальна дія на слизових оболонках. S. boulardii в просвіті кишечнику може сприяти перешкоджанню впливу патогенних токсинів та їх прикріпленню, взаємодії з нормальною мікробіотою, зберігаючи клітинну фізіологію або відновлюючи рівень коротколанцюгових жирних кислот. Окрім того, S. boulardii здатний також регулювати імунну систему як у просвіті кишечнику, так і на системному рівні [14].
Дріжджі як пробіотик
Дріжджові пробіотики з деякими унікальними властивостями мають перевагу над бактеріальними пробіотиками; відмінності між ними наведено в таблиці 1.
|
Таблиця 1. Відмінності між бактеріями та дріжджами та їхній вплив на пробіотики |
||
|
|
Дріжджі |
Бактерії |
|
Розмір клітини [15] |
10 мкм |
1 мкм |
|
Структура клітинної стінки [15] |
Хітин, маноза (ФПМ, ФЛМ), глюкан |
Пептидоглікан, ЛПС (грамнегативні), ЛТК (грампозитивні) |
|
Оптимальні умови росту – pH [15] |
4,5-6,5 |
6,5-7,5 |
|
Температура (°C) [15] |
20-30 |
10-80 |
|
Антибіотикорезистентність [15] |
Так |
Ні |
|
Передача генетичного матеріалу [15] |
Ні |
Так |
|
Автоагрегація [16] |
Так |
Обмежена |
|
Примітки: ФПМ – фосфопептидоманан; ФЛМ – фосфоліпоманан; ЛПС – ліпополісахарид; ЛТК – ліпотейхоєва кислота. |
||
Можливі наслідки відмінностей між властивостями дріжджових і бактеріальних пробіотиків
Відмінності між властивостями дріжджових і бактеріальних пробіотиків та їхні можливі наслідки представлено в таблиці 2.
|
Таблиця 2. Можливі наслідки відмінностей між властивостями дріжджових і бактеріальних пробіотиків |
|
|
Властивості |
Коментар |
|
Стерична невідповідність [16] |
Клітини дріжджів через свій розмір, який у понад 10 разів більший за розмір бактерій, створюють стеричну невідповідність щодо патогенних бактерій. Це підвищує ймовірність того, що дріжджі стануть пробіотичним засобом |
|
Імунна відповідь [17] |
Клітини дріжджів містять численні імуномодулювальні компоненти. Зовнішній шар клітинної стінки складається з манопротеїнів, які зв’язують специфічну для дендритних клітин молекулу міжклітинної адгезії‑3, що захоплює неінтегрин (DC-SIGN), Toll-подібний рецептор‑4 (TLR4) та ін. Середній шар містить β-глюкани, які зв’язують дектин‑1 і TLR2 та 6. Внутрішній шар стінки містить хітин, який зв’язує рецептор манози |
|
Різні місця дії в ШКТ [15] |
Дріжджі трапляються як у шлунку, так і в товстій кишці, що свідчить про їхню здатність виживати в таких різних умовах (стійкість до зміни рН, переносимість стресу). Це доводить, що дріжджі є гарним кандидатом на роль пробіотика, оскільки пробіотики, які потрапляють до ШКТ, повинні бути стійкими до змін рН |
|
Антибіотикорезистентність [15] |
Бактерії можуть передавати гени резистентності патогенним бактеріям, що призводить до їхньої антибіотикорезистентності. Передача генетичного матеріалу між бактеріями та дріжджами неможлива, що робить дріжджі потенційним кандидатом на роль пробіотика для профілактики антибіотикорезистентності |
|
Автоагрегація [16] |
Здатність штамів дріжджів до самоагрегації й утворення пластівців є властивістю автоагрегації. Це реакція виживання за наявності несприятливих умов навколишнього середовища, як-от ШКТ людини. Це забезпечує конкурентну перевагу дріжджової клітини перед іншими мікроорганізмами, включаючи кишкові бактерії, оскільки порівняно з бактеріями дріжджові клітини більші та важчі, вони осідають швидше та в більшій кількості |
Властивості S. boulardii CNCM I‑745
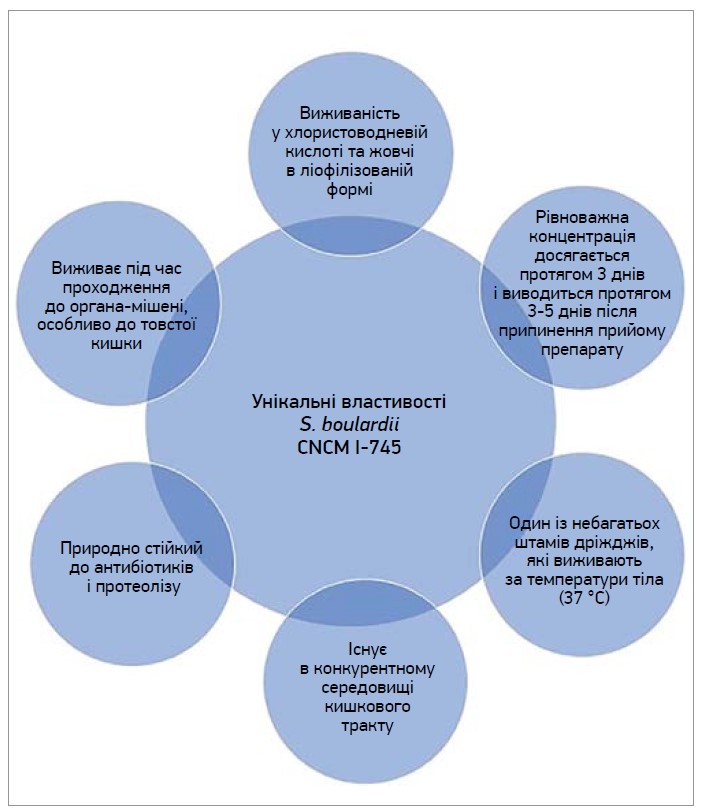
S. boulardii CNCM I‑745 – це дріжджовий пробіотик вибору для лікування ААД та ДГГЕ. Французький мікробіолог Анрі Булар відкрив S. boulardii CNCM I‑745, який належить до виду S. cerevisiae, в 1923 році [18]. Завдяки своїй здатності виробляти різні біологічно активні сполуки S. boulardii зайняв ключову позицію в науковій спільноті й останнім часом використовується для лікування захворювань кишечнику. Клінічні дані свідчать, що пероральне застосування S. boulardii є корисним у лікуванні численних захворювань ШКТ, включно з діареєю мандрівників, ААД, синдромом, пов’язаним із C. difficile, синдромом подразненого кишечнику та хворобою Крона [19]. Через надмірне використання протимікробних засобів спостерігається постійне зростання кількості мультирезистентних мікроорганізмів. Тому в разі антибіотикорезистентності пробіотики, особливо S. boulardii, можна застосовувати як доповнення до лікування інфекцій [19]. Унікальні властивості S. boulardii представлено на рисунку 3 [20, 21].
Рис. 3. Унікальні властивості S. boulardii CNCM I‑745
Механізм дії S. boulardii як пробіотика
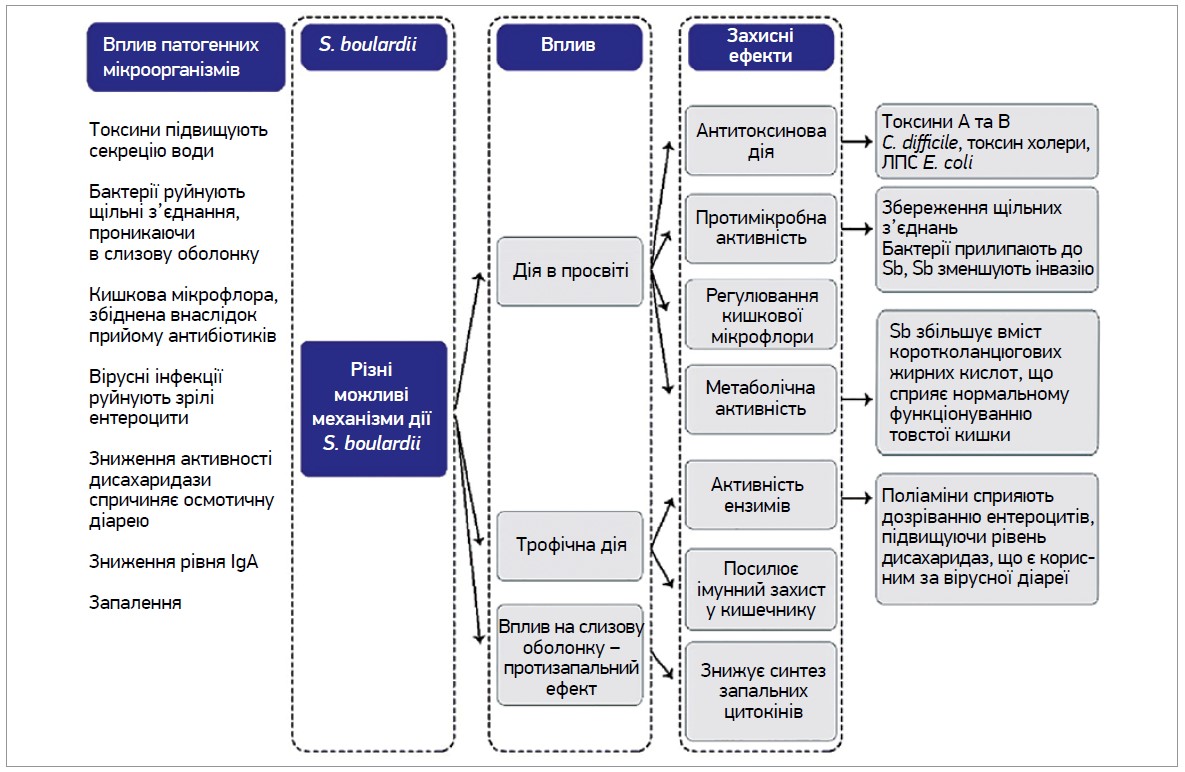
Мікробіом кишечнику виконує багато функцій, зокрема запобігає колонізації патогенами, підтримує епітеліальний бар’єр і контролює імунну відповідь [22]. S. boulardii аналогічно в межах свого пробіотичного ефекту відтворює різні механізми дії: наприклад, імунологічні й антитоксинові ефекти, модуляція кишкової флори та вплив на активність ферментів (рис. 4) [22].
Рис. 4. Різні потенційні механізми дії S. boulardii
Примітки: Sb – S. boulardii. Ліворуч відображено різноманітні ефекти різних патогенних мікроорганізмів. Праворуч наведено сім різних захисних ефектів S. boulardii. У просвіті кишечнику S. boulardii може розкладати токсини патогенних мікроорганізмів, перешкоджати прикріпленню патогенів, регулювати нормальну мікробіоту та підтримувати нормальну фізіологію кишечнику. S. boulardii також може опосередковано відновлювати нормальний баланс коротколанцюгових жирних кислот, підвищувати рівень секреторного IgA чи регулювати імунну систему, впливаючи на рівні цитокінів.
Клінічна користь S. boulardii як пробіотика при ААД та ДГГЕ
Клінічні докази, які демонструють роль S. boulardii в лікуванні ААД та ДГГЕ, наведено в таблиці 3.
Таблиця 3. S. boulardii в лікуванні ААД та ДГГЕ
|
Дослідження/дизайн |
Популяція |
Втручання |
Результати |
|
S. boulardii для профілактики ААД |
|||
|
McFarland і співавт.: метааналіз 10 РКД [14] |
Дорослі, які приймали антибіотики (n=1869) |
S. boulardii (200-1000 мг/добу) |
Повідомлялося про значущу терапевтичну ефективність S. boulardii в профілактиці ААД (ВР 0,47; 95% ДІ 0,35-0,63; р<0,001) |
|
McFarland і співавт.: метааналіз 22 досліджень (23 групи лікування) [23] |
Діти, які приймали антибіотики (n=4155) |
У 12 дослідженнях вивчали 1 штам пробіотика, а в 10 – комбінацію штамів пробіотиків |
За результатами аналізу даних 12 досліджень 1 штаму, S. boulardii значно знижує частоту ААД (об’єднане ВР 0,43; 95% ДІ 0,32-0,60). Усі пробіотики були безпечними |
|
Jindal і співавт.: рандомізоване відкрите дослідження в паралельних групах [24] |
Діти віком від 6 міс до 12 років (n=300) з інфекцією верхніх дихальних шляхів або сечовивідних шляхів, які приймали антибіотики |
Контрольна група: антибіотик. Група досліджуваного втручання: антибіотик + S. boulardii [BASE] 250 мг двічі на добу |
Спостерігалося значне зниження кількості випадків діареї в пацієнтів, які отримували S. boulardii (р<0,001) |
|
Szajewska та співавт.: систематичний огляд із метааналізом, 21 РКД [25] |
Діти та дорослі (n=4780), які отримували антибіотики за будь-яких показань, включно з ерадикаційною терапією Helicobacter pylori |
Контрольна група: антибіотик + плацебо / без лікування. Дослідна група: антибіотик + S. boulardii в будь-якій дозі / протягом будь-якого періоду |
Серед пацієнтів, які приймали антибіотики, спостерігалося зниження ризику ААД у групі S. boulardii порівняно з групою плацебо або відсутності лікування з 18,7 до 8,5%. S. boulardii знижував ризик діареї в дітей із 20,9 до 8,8% і в дорослих із 17,4 до 8,2%. У дітей S. boulardii також знижував ризик діареї, асоційованої з C. difficile |
|
Yang і співавт.: метааналіз 21 дослідження [26] |
Діти (n=3534), які приймали антибіотики |
S. boulardii |
Із погляду профілактики ААД було досягнуте значне зниження частоти діареї в пацієнтів групи S. boulardii порівняно з контрольною групою. За результатами метааналізу 7 досліджень (523 пацієнти), в групі S. boulardii спостерігалася значно вища ефективність у профілактиці ААД порівняно з контрольною групою |
|
S. boulardii в лікуванні ДГГЕ |
|||
|
Padayachee та співавт.: систематичний огляд 10 досліджень; метааналіз 5 РКД [27] |
Немовлята та діти віком менш як |
S. boulardii (250-500 мг/добу) порівняно з іншими методами лікування |
S. boulardii значно скоротив тривалість діареї порівняно з контрольною групою (РС -0,57; 95% ДІ від –0,83 до –0,30; n=548; 5 досліджень) і мав статистично значущий вплив на частоту випорожнень на 1-й, 2-й, 3-й і 4-й дні (р=0,001). Наприкінці 7-го дня всі діти мали тверді випорожнення |
|
Szajewska та співавт.: систематичний огляд і метааналіз 29 РКД [28] |
Діти віком від 1 міс до 15 років (n=4217) |
S. boulardii порівняно з плацебо або відсутністю призначень |
Повідомлялося, що S. boulardii ефективний за добової дози <300 мг (5 РКД; n=873; РС –0,84 дня; висока неоднорідність I2 = 91%), або 500 мг (15 РКД; n=2248; РС –0,86 дня; I2 = 58%), або >500 мг (1 РКД; n=41; РС –2,76 дня). У пацієнтів, які отримували S. boulardii, порівняно з контрольною групою зареєстровано зменшення тривалості госпіталізації (8 РКД; n=999; РС –0,85 дня; 95% ДІ від –1,35 до –0,34; I2 = 91%). На 2-7-й день лікування S. boulardii знижував ризик діареї. Небажані явища були порівнянними між групами |
|
Ragavan і співавт.: ретроспективний аналіз [29] |
Діти з Індії віком від 0 до 18 років (n=160) із гострою діареєю |
Розчин для пероральної регідратації та цинк у комбінації S. boulardii CNCM I‑745 (250 мг двічі на добу) або без останнього |
У групі S. boulardii медіана тривалості діареї після лікування була значно коротшою (3 дні) порівняно з групою, яка не приймала S. boulardii (4 дні). У групі S. boulardii спостерігалося значне зниження частоти випорожнень після лікування (1,7 порівняно з 2,5 у групі без S. boulardii) |
|
McFarland і співавт.: систематичний огляд (22 РКД) та метааналіз (17 РКД) [30] |
Лікування індійських пацієнтів із ДГГЕ (n=4059) |
П’ять одноштамових пробіотиків і три мультиштамові суміші (досліджувані штами включають S. boulardii CNCM) I‑745, L. rhamnosus GG, B. clausii O/C, SIN, N/R, T, Bifilac (4 штами), B. clausii UBBC‑07, L. casei DN114001, L. sporogenes і суміш 8 штамів |
S. boulardii CNCM I‑745 найбільше вплинув на скорочення тривалості діареї (стандартизована РС –1,86 дня; 95% ДІ від –2,8 до –0,9), S. boulardii та L. rhamnosus GG значно зменшили тривалість перебування в стаціонарі (–1,8 та –1,1 дня відповідно), тоді як B. clausii не вплинув. S. boulardii значно зменшив частоту випорожнень на добу на 4-й день, а L. rhamnosus GG – на 5-й день |
|
Fu та співавт.: систематичний огляд і метааналіз (10 досліджень) [31] |
Діти з ГГЕ віком понад 5 років (n=1282) |
Група S. boulardii порівняно з контрольною групою |
S. boulardii може ефективно скоротити тривалість діареї (РС 19,70; 95% ДІ від –24,87 до 14,52) та зменшити термін перебування в стаціонарі (РС -0,91; 95% ДІ від –1,28 до –0,54). Значно нижчий відносний ризик тривалості діареї спостерігався в дослідній групі після 1-го дня лікування (ВР -0,31; 95% ДІ 0,59; 0,03) та 3 днів лікування (ВР 0,52; 95% ДІ 0,41; 0,66) порівняно з контрольною групою. Після 3 днів лікування S. boulardii зменшив середню кількість випадків діареї приблизно на 1,03 (РС -1,03; 95% ДІ –1,53; –0,53). Небажаних побічних реакцій у жодній із груп не зареєстровано |
|
S. boulardii порівняно з іншими пробіотиками в лікуванні ААД та ДГГЕ |
|||
|
McFarland і співавт.: метааналіз [32] |
Діти, які приймали антибіотики |
Комбінація 16 різних типів пробіотиків |
Спостерігалася значна ефективність комбінації S. boulardii та L. rhamnosus у лікуванні ААД у дітей (об’єднане ВР 0,43; 95% ДІ 0,21-0,86) |
|
Vineeth і співавт. [33] |
Діти з Індії з ротавірусною діареєю (n=80) |
Середня доза S. boulardii |
У групі S. boulardii загальна середня тривалість діареї була значно коротшою порівняно з групою B. clausii |
|
Blaabjerg і співавт.: систематичний огляд і метааналіз 17 РКД [34] |
Амбулаторні пацієнти всіх вікових груп, які приймали антибіотики (n=3631) |
Види Lactobacilli, види Lactococcus, види Streptococcus, види Bifidobacterium, види Saccharomyces, Leuconostoc cremoris, види Bacillus, види Clostridium, окремо або в комбінації |
За результатами аналізу, в підгрупі S. boulardii (4 дослідження) спостерігався значно менший ризик ААД порівняно з контрольною групою (ВР 0,41; 95% ДІ 0,30-0,57), тоді як за комбінації L. acidophilus La‑5 і B. lactis Bb‑12 (2 дослідження) цього не спостерігалося (ВР 0,79; 95% ДІ 0,47-1,33) |
|
Vidjeadevan і співавт.: РКД [35] |
Діти віком 6-36 міс (n=105) із гострою діареєю |
Учасники групи А отримували розчин для пероральної регідратації та цинк; групи В – розчин для пероральної регідратації, цинк і S. boulardii; групи С – розчин для пероральної регідратації, цинк і B. clausii |
Середня тривалість діареї становила 108 год у групі А, тоді як у групах В та С вона становила 72 та 96 год відповідно. Середня тривалість діареї була найвищою в групі А (108 год) і найнижчою в групі В (72 год) |
|
Johnston і співавт.: кокранівський огляд, 33 дослідження [36] |
Діти віком від 0 до 18 років, які приймали антибіотики (n=6352) |
Оцінювані пробіотики включали штами Bacillus spp, види Bifidobacterium spp, Clostridium butyricum, види Lactobacilli spp, види Lactococcus spp, Leuconostoc cremoris, Saccharomyces spp або Streptococcus spp, окремо чи в комбінації, плацебо або відсутність лікування |
Серед різних пробіотиків, плацебо чи відсутності лікування L. rhamnosus або S. boulardii в дозах від 5 до 40 млрд колонієутворювальних одиниць (КУО) на добу були найдоцільнішими пробіотиками для профілактики ДПА |
|
Li та співавт.: баєсовський мережевий метааналіз (21 втручання) [37] |
Діти з гострою діареєю (n=13 443) |
Пробіотики можна поділити на одноштамові та мультиштамові. Одноштамові пробіотики включали S. boulardii, L. rhamnosus GG, L. reuteri, B. clausii, L. acidophilus, B. lactis, L. sporogenes, L. plantarum, E. coli Nissle 1917, L. paracasei та E. faecium. Мультиштамові пробіотики включали види L. (spp), L. spp + B. spp, L. spp + B. spp + S. spp, L. spp + S. spp, B. spp + S. spp, Bacillus spp + E. spp + Clostridium spp, L. spp + B. spp + E. spp, L. spp + B. spp + Pediococcus spp та L. spp + S. spp + C. spp + Bacillus spp. Контрольна група: плацебо / без лікування |
S. boulardii найефективніший серед усіх пробіотиків у зменшенні тривалості діареї (порівняно з плацебо) та ризику діареї, що триває ≥2 дні (порівняно з плацебо або відсутністю лікування). Він значно зменшує (відношення шансів 0,22; 95% ДІ 0,11-0,41) ризик діареї тривалістю ≥2 днів порівняно з плацебо або відсутністю лікування |
|
Altcheh і співавт.: рандомізоване дослідження у 2 паралельних групах [38] |
Діти віком від 6 міс до 5 років (n=317) із гострою діареєю легкого або середнього ступеня тяжкості |
Рандомізовані на 5 днів прийому S. boulardii CNCM I‑745 (n=159) або суміші 4 штамів B. clausii (n=158). Спостереження після лікування пробіотиками проводили впродовж 7 днів |
При застосуванні S. boulardii CNCM I‑745 спостерігалося значне зниження (р=0,04) середньої тривалості діареї (64,6 год, 95% ДІ 56,5-72,8) порівняно з B. clausii (78,0 год, 95% ДІ 69,9-86,1). Обидва пробіотики добре переносилися |
|
Примітки: РКД – рандомізоване контрольоване дослідження; ВР – відношення ризиків; ДІ – довірчий інтервал; РС – різниця середніх. |
|||
Безпека S. boulardii
Результати нещодавнього дослідження свідчать, що пробіотичний штам E. coli Nissle 1917 виробляє in vitro й in vivo колібактин і згодом індукує мутагенне пошкодження ДНК. Це серйозна проблема безпеки, яку не слід ігнорувати, пам’ятаючи про здоров’я пацієнтів і населення загалом [39]. Оскільки генотоксичну активність цього штаму неможливо відокремити від його пробіотичної активності, аспекти безпеки розповсюдженого призначення цього пробіотичного штаму потребують переоцінки. Це порушує важливе питання побічних ефектів, які можуть бути пов’язані з будь-яким ефективним пробіотиком [40].
S. boulardii CNCM I‑745 визнано безпечним пробіотиком. У клінічних дослідженнях не було зареєстровано побічних ефектів при застосуванні S. boulardii [19]. Дуже рідко в пацієнтів у критичному стані та (або) пацієнтів з ослабленим імунітетом спостерігалося збільшення кількості інфекцій, спричинених S. cerevisiae (фунгемія) [41]. У пацієнтів з ослабленим імунітетом навіть відкриття упаковки S. boulardii може призвести до забруднення повітря, збільшує ризик інфекції [42]. Однак результати метааналізу свідчать, що S. boulardii безпечний для дітей із гострою діареєю [43].
Глобальні рекомендації щодо застосування S. boulardii як пробіотика
Таблиця 4 містить глобальні рекомендації щодо застосування S. boulardii як пробіотика.
|
Таблиця 4. Глобальні рекомендації щодо застосування S. boulardii як пробіотика |
||||||
|
№ з/п |
Рекомендований штам |
Агентство, що рекомендує |
Рік рекомендації |
Рекомендоване показання (доза) |
Не рекомендується |
Якість доказів |
|
1 |
S. boulardii |
Індійська академія педіатрії [44] |
2022 |
Ад’ювантна терапія при гострій діареї (250-750 мг/добу) |
|
Від дуже низької до низької |
|
S. boulardii |
ESPGHAN [45] |
2022 |
ГГЕ в дітей (250-750 мг/добу) |
– |
Низька |
|
|
Профілактика ААД (≥5 млрд КУО/добу) |
– |
Середня |
||||
|
2 |
S. boulardii |
ESPGHAN [46] |
2020 |
ГГЕ в дітей як доповнення до пероральної регідратаційної терапії (250-750 мг/добу) |
1 |
Низька |
|
B. clausii |
– |
Не рекомендується для профілактики ААД |
Дуже низька |
|||
|
3 |
S. boulardii |
ESPGHAN [47] |
2016 |
Профілактика ААД у дітей |
|
Середня |
|
Профілактика діареї, пов’язаної з C. difficile, в дітей |
|
Низька |
||||
|
ААД у дорослих (5×109 КУО/капсула чи 250 мг двічі на добу) |
|
Рівень 1 |
||||
|
4 |
S. boulardii CNCM I‑745 |
Всесвітня гастроентерологічна організація [48] |
2017 |
Профілактика діареї, асоційованої з C. difficile (або профілактика рецидиву) в дорослих (5×109 КУО/капсула чи 250 мг двічі на добу) |
|
Рівень 3 |
|
Супутня терапія для ерадикації H. pylori (5×109 КУО/капсула чи 250 мг двічі на добу) |
|
Рівень 1 |
||||
|
Профілактика ААД (250-500 мг) |
|
Рівень 1 |
||||
|
5 |
S. boulardii CNCM I‑745 |
Латиноамериканські експерти [49] |
2015 |
Гостра інфекційна діарея |
|
Ступінь доказовості: 1а |
|
Профілактика ААД, діареї мандрівників |
|
Ступінь доказовості: 1b |
||||
|
6 |
S. boulardii |
Група експертів Європейської педіатричної асоціації [50] |
2018 |
Профілактика ААД, ГГЕ (як доповнення до пероральної регідратаційної терапії) (250-750 мг), профілактика діареї, асоційованої з C. difficile |
|
– |
|
7 |
S. boulardii |
Всесвітній журнал гастроентерології, Азійсько-Тихоокеанський регіон (АРАС) [51] |
2017 |
При ГГЕ як доповнення до пероральної регідратаційної терапії |
|
Висока |
|
ААД |
|
Висока |
||||
|
Діарея, асоційована з C. difficile |
|
Низька |
||||
|
8 |
S. boulardii |
ESPGHAN [45] |
2023 |
ААД |
|
Середня |
|
ГГЕ |
|
Низька |
||||
|
Примітка: ESPGHAN – Європейське товариство дитячої гастроентерології, гепатології та харчування. |
||||||
Висновки
Пробіотик S. boulardii CNCM I‑745 завдяки своїм унікальним властивостям відтворює різні ефекти, забезпечуючи патоген-зв’язувальну, імунологічну й антитоксичну дії. Крім того, він не може передавати генетичний матеріал, що робить його потенційним кандидатом на роль пробіотика для запобігання розвитку антибіотикорезистентності. S. boulardii вирізняється серед інших пробіотиків як один із найефективніших у профілактиці ААД у дітей. Порівняно з L. rhamnosus GG та деякими штамами B. clausii, S. boulardii CNCM I‑745 значно скорочує середню тривалість діареї в пацієнтів із ДГГЕ. Крім того, завдяки доведеній ефективності та безпеці ESPGHAN й інші міжнародні організації рекомендують його для профілактики та лікування гострої діареї. Отже, S. boulardii CNCM I‑745 є одним із найкращих пробіотиків вибору для лікування ААД та ДГГЕ завдяки його наявним перевагам перед бактеріальними пробіотиками, а також сприятливому профілю ефективності та безпеки.
Література
1. Quigley EM: Microbiota-brain-gut axis and neurodegenerative diseases. Curr Neurol Neurosci Rep. 2017, 17:94. 10.1007/s11910-017-0802-6
2. Compare D, Sgamato C, Nardone OM, Rocco A, Coccoli P, Laurenza C, Nardone G: Probiotics in gastrointestinal diseases: all that glitters Is not gold. Dig Dis. 2022, 40:123-32. 10.1159/000516023
3. Kim SK, Guevarra RB, Kim YT, et al.: Role of probiotics in human gut microbiome-associated diseases. J Microbiol Biotechnol. 2019, 29:1335-40. 10.4014/jmb.1906.06064
4. Gasbarrini G, Bonvicini F, Gramenzi A: Probiotics history. J Clin Gastroenterol. 2016, 50:S116-9. 10.1097/MCG.0000000000000697
5.Staniszewski A, Kordowska-Wiater M: Probiotic and potentially probiotic yeasts-characteristics and food application. Foods. 2021, 10:1036. 10.3390/foods10061306
6. Shruthi B, Deepa N, Somashekaraiah R, Adithi G, Divyashree S, Sreenivasa MY: Exploring biotechnological and functional characteristics of probiotic yeasts: a review. Biotechnol Rep (Amst). 2022, 34:e00716. 10.1016/j.btre.2022.e00716
7. Kazmierczak-Siedlecka K, Ruszkowski J, Fic M, Folwarski M, Makarewicz W: Saccharomyces boulardii CNCM I-745: a non-bacterial microorganism used as probiotic agent in supporting treatment of selected diseases. Curr Microbiol. 2020, 77:1987-96. 10.1007/s00284-020-02053-9
8. Celebioglu HU, Svensson B: Dietary nutrients, proteomes, and adhesion of probiotic lactobacilli to mucin and host epithelial cells. Microorganisms. 2018, 6:90. 10.3390/microorganisms6030090
9. Kesen MA, Aiyegoro OA: Beneficial characteristics and evaluation criteria of probiotics. Int J Food Biosci. 2018, 1:19-26.
10. Fontana L, Bermudez-Brito M, Plaza-Diaz J, Munoz-Quezada S, Gil A: Sources, isolation, characterisation and evaluation of probiotics. Br J Nutr. 2013, 109 Suppl 2:S35-50. 10.1017/S0007114512004011
11. Sen S, Mansell TJ: Yeasts as probiotics: mechanisms, outcomes, and future potential. Fungal Genet Biol. 2020, 137:103333. 10.1016/j.fgb.2020.103333
12. Ciorba MA: A gastroenterologist’s guide to probiotics. Clin Gastroenterol Hepatol. 2012, 10:960-8. 10.1016/j.cgh.2012.03.024
13. McFarland LV, Evans CT, Goldstein EJ: Strain-specificity and disease-specificity of probiotic efficacy: a systematic review and meta-analysis. Front Med (Lausanne). 2018, 5:124. 10.3389/fmed.2018.00124
14. McFarland LV: Systematic review and meta-analysis of Saccharomyces boulardii in adult patients. World J Gastroenterol. 2010, 16:2202-22. 10.3748/wjg.v16.i18.2202
15. Czerucka D, Piche T, Rampal P: Review article: yeast as probiotics -- Saccharomyces boulardii. Aliment Pharmacol Ther. 2007, 26:767-78. 10.1111/j.1365-2036.2007.03442.x
16. Alkalbani NS, Osaili TM, Al-Nabulsi AA, et al.: Assessment of yeasts as potential probiotics: a review of gastrointestinal tract conditions and investigation Methods. J Fungi (Basel). 2022, 8:365.10.3390/jof8040365
17. Hudson LE, McDermott CD, Stewart TP, et al.: Characterization of the probiotic yeast Saccharomyces boulardii in the healthy mucosal immune system. PLoS One. 2016, 11:e0153351. 10.1371/journal.pone.0153351
18. Hossain MN, Afrin S, Humayun S, Ahmed MM, Saha BK: Identification and growth characterization of a novel strain of Saccharomyces boulardii isolated from soya paste. Front Nutr. 2020, 7:27. 10.3389/fnut.2020.00027
19. Abid R, Waseem H, Ali J, Ghazanfar S, Muhammad Ali G, Elasbali AM, Alharethi SH: Probiotic yeast saccharomyces: back to nature to improve human health. J Fungi (Basel). 2022, 8:444. 10.3390/jof8050444
20. Kelesidis T, Pothoulakis C: Efficacy and safety of the probiotic Saccharomyces boulardii for the prevention and therapy of gastrointestinal disorders. Therap Adv Gastroenterol. 2012, 5:111-25. 10.1177/1756283X11428502
21. Neut C, Mahieux S, Dubreuil LJ: Antibiotic susceptibility of probiotic strains: is it reasonable to combine probiotics with antibiotics?. Med Mal Infect. 2017, 47:477-83. 10.1016/j.medmal.2017.07.001
22. Pais P, Almeida V, Yilmaz M, Teixeira MC: Saccharomyces boulardii: what makes it tick as successful probiotic?. J Fungi (Basel). 2020, 6:78. 10.3390/jof6020078
23. McFarland LV, Goh S: Preventing pediatric antibiotic-associated diarrhoea and Clostridium difficile infections with probiotics: a meta-analysis. World J Meta-Anal. 2013, 1:102-20. 10.13105/wjma.v1.i3.102
24. Jindal M, Gupta S, Gautam P, et al.: Prophylactic role of Saccharomyces boulardii in prevention of antibiotic associated diarrhoea in children in Indian population. Nov Sci Int J Med Sci. 2013, 3:346-50.
25. Szajewska H, Kolodziej M: Systematic review with meta-analysis: Saccharomyces boulardii in the prevention of antibiotic-associated diarrhoea. Aliment Pharmacol Ther. 2015, 42:793-801. 10.1111/apt.13344
26. Yang C, Zhang L, Zhang S, Yaya Y, Cairong Z: Efficacy and safety of Saccharomyces boulardii in the prevention of antibiotic associated diarrhoea in children: meta analysis. Her Med. 2016, 35:1211-9.
27. Padayachee M, Visser J, Viljoen E, Musekiwa A, Blaauw R: Efficacy and safety of Saccharomyces boulardii in the treatment of acute gastroenteritis in the pediatric population: a systematic review. S Afr J Clin Nutr. 2019, 32:358-69. 10.1080/16070658.2018.1449378
28. Szajewska H, Kolodziej M, Zalewski BM: Systematic review with meta-analysis: Saccharomyces boulardii for treating acute gastroenteritis in children-a 2020 update. Aliment Pharmacol Ther. 2020, 51:678-88. 10.1111/apt.15659
29. Ragavan PS, Kaur A, Kumar M, et al.: Retrospective analysis of EMR database to assess the effectiveness of Saccharomyces boulardii CNCM I-745 in children with acute diarrhoea during routine clinical practice. New Microbes New Infect. 2020, 38:100766. 10.1016/j.nmni.2020.100766
30. McFarland LV, Srinivasan R, Setty RP, et al.: Specific probiotics for the treatment of pediatric acute gastroenteritis in India: a systematic review and meta-analysis. JPGN Rep. 2021, 2:e079. 10.1097/PG9.0000000000000079
31. Fu H, Li J, Xu X, Xia C, Pan Y: Effectiveness and safety of Saccharomyces boulardii for the treatment of acute gastroenteritis in the pediatric population: a systematic review and meta-analysis of randomized controlled trials. Comput Math Methods Med. 2022, 2022:6234858. 10.1155/2022/6234858
32. McFarland LV: Deciphering meta-analytic results: a mini-review of probiotics for the prevention of paediatric antibiotic-associated diarrhoea and Clostridium difficile infections. Benef Microbes. 2015, 6:189-94. 10.3920/BM2014.0034
33. Vineeth S, Saireddy S, T Keerthi, Mantada PK: Efficacy of Bacillus clausii vs Saccharomyces boulardii in treatment of acute rotaviral diarrhoea in pediatric patients. Indones J Clin Pharm. 2017, 6:91-8. 10.15416/ijcp.2017.6.2.91
34. Blaabjerg S, Artzi DM, Aabenhus R: Probiotics for the prevention of antibiotic-associated diarrhea in outpatients-a systematic review and meta-analysis. Antibiotics (Basel). 2017, 6:21. 10.3 390/antibiotics6040021
35. Vidjeadevan D, Vinoth S, Ramesh S: Role of Saccharomyces boulardii and Bacillus clausii in reducing the duration of diarrhea: a three-armed randomised controlled trial. Int J Contemp Pediatr. 2018, 5:1811-4. 10.18203/2349-3291.ijcp20183511
36. Johnston BC, Wiebe N, Crumley E, Supina AL, Vohra S: Probiotics for the prevention of pediatric antibiotic- associated diarrhea. Cochrane Database Syst Rev. 2004, CD004827. 10.1002/14651858.CD004827
37. Li Z, Zhu G, Li C, Lai H, Liu X, Zhang L: Which probiotic is the most effective for treating acute diarrhea in children? A Bayesian network meta-analysis of randomized controlled trials. Nutrients. 2021, 13:4319. 10.3390/nu13124319
38. Altcheh J, Carosella MV, Ceballos A, et al.: Randomized, direct comparison study of Saccharomyces boulardii CNCM I-745 versus multi-strained Bacillus clausii probiotics for the treatment of pediatric acute gastroenteritis. Medicine (Baltimore). 2022, 101:e30500. 10.1097/MD.0000000000030500
39. Nougayrède JP, Chagneau CV, Motta JP, et al.: A toxic friend: genotoxic and mutagenic activity of the probiotic strain Escherichia coli Nissle 1917. mSphere. 2021, 6:e0062421. 10.1128/mSphere.00624-21
40. Olier M, Marcq I, Salvador-Cartier C, et al.: Genotoxicity of Escherichia coli Nissle 1917 strain cannot be dissociated from its probiotic activity. Gut Microbes. 2012, 3:501-9. 10.4161/gmic.21737
41. Moré MI, Swidsinski A: Saccharomyces boulardii CNCM I-745 supports regeneration of the intestinal microbiota after diarrheic dysbiosis - a review. Clin Exp Gastroenterol. 2015, 8:237-55. 10.2147/CEG.S85574
42. Hennequin C, Kauffmann-Lacroix C, Jobert A, Viard JP, Ricour C, Jacquemin JL, Berche P: Possible role of catheters in Saccharomyces boulardii fungemia. Eur J Clin Microbiol Infect Dis. 2000, 19:16-20. 10.1007/s100960050003
43. Feizizadeh S, Salehi-Abargouei A, Akbari V: Efficacy and safety of Saccharomyces boulardii for acute diarrhea. Pediatrics. 2014, 134:e176-91. 10.1542/peds.2013-3950
44. Yachha SK, Sarma MS, Mohan N, et al.: Indian Academy of Pediatrics Consensus Guidelines for probiotic use in childhood diarrhea. Indian Pediatr. 2022, 59:543-51.
45.Szajewska H, Berni Canani R, Domellöf M, et al.: Probiotics for the management of pediatric gastrointestinal disorders: position paper of the ESPGHAN Special Interest Group on Gut Microbiota and Modifications. J Pediatr Gastroenterol Nutr. 2023, 76:232-47. 10.1097/MPG.0000000000003633
46. Szajewska H, Guarino A, Hojsak I, et al.: Use of probiotics for the management of acute gastroenteritis in children: an update. J Pediatr Gastroenterol Nutr. 2020, 71:261-9. 10.1097/MPG.0000000000002751
47. Szajewska H, Canani RB, Guarino A, et al.: Probiotics for the prevention of antibiotic-associated diarrhea in children. J Pediatr Gastroenterol Nutr. 2016, 62:495-506. 10.1097/MPG.0000000000001081
48. Guarner F, Snaders ME, Eliakim R, et al.: World Gastroenterology Organisation Global Guidelines: Probiotics and Prebiotics. World Gastroenterology Organisation , Milwaukee, USA; 2017. https://www.worldgastroenterology.org/UserFiles/file/guidelines/probiotics-and-prebiotics-english- 2017.pdf.
49. Cruchet S, Furnes R, Maruy A, et al. : The use of probiotics in pediatric gastroenterology: a review of the literature and recommendations by Latin-American experts. Paediatr Drugs. 2015, 17:199-216. 10.1007/s40272-015-0124-6
50. Hojsak I, Fabiano V, Pop TL, et al.: Guidance on the use of probiotics in clinical practice in children with selected clinical conditions and in specific vulnerable groups. Acta Paediatr. 2018, 107:927-37. 10.1111/apa.14270
51. Cameron D, Hock QS, Kadim M, et al.: Probiotics for gastrointestinal disorders: Proposed recommendations for children of the Asia-Pacific region. World J Gastroenterol. 2017, 23:7952-64. 10.3748/wjg.v23.i45.7952
Gopalan S., Ganapathy S., Mitra M., et al. Unique properties of yeast probiotic Saccharomyces boulardii CNCM I‑745: a narrative review. Cureus. 2023 Oct 1; 15 (10): e46314. DOI: 10.7759/cureus.46314.