30 червня, 2023
Функціональні гастроінтестинальні розлади та зовнішньосекреторна недостатність підшлункової залози: патофізіологічні взаємозв’язки і роль замісної ферментної терапії
Функціональні гастроінтестинальні розлади (ФГІР) – група хвороб, яким притаманні хронічні симптоми з боку травного тракту (біль у животі, дисфагія, диспепсія, діарея, закрепи та здуття живота) за відсутності видимого при обстеженнях патологічного стану. В наш час вважається, що ФГІР виникають унаслідок порушень міжорганної комунікації між мозком і кишечником (Fikree A., Byrne P., 2021).
Загальносвітова поширеність ФГІР становить 40%; вони є поширенішими в жінок, ніж у чоловіків, хоча з віком ця розбіжність нівелюється (Sperber A. D. et al., 2020). На частку ФГІР припадає 12% усіх консультацій на первинній ланці медичної допомоги та 30% усіх гастроентерологічних амбулаторних консультацій (Jones M. P. et al., 2007; Shivaji U. N., Ford A. C., 2014). Наявність ФГІР часто асоціюється із хронічним болем та іншими функціональними розладами, наприклад, синдромом хронічної втоми, а у ⅔ пацієнтів із ФГІР розвивається тривожність або депресія (Petersen M. et al., 2020). За оцінками науковців, у цих хворих спостерігається дуже низька якість життя, гірша за аналогічний показник в осіб із застійною серцевою недостатністю ІІІ функціонального класу чи ревматоїдним артритом (Spiegel B. et al., 2009). Низька якість життя та значні витрати на лікування ФГІР обумовлюють потребу в їх швидкій діагностиці та своєчасному лікуванні (Fikree A., Byrne P., 2021).
У IV Римських критеріях виокремлюють 33 ФГІР дорослих і 20 ФГІР дітей; найпоширенішими ФГІР є синдром подразненого кишечнику (СПК) та функціональна диспепсія (ФД) (Drossman D. A., 2016).
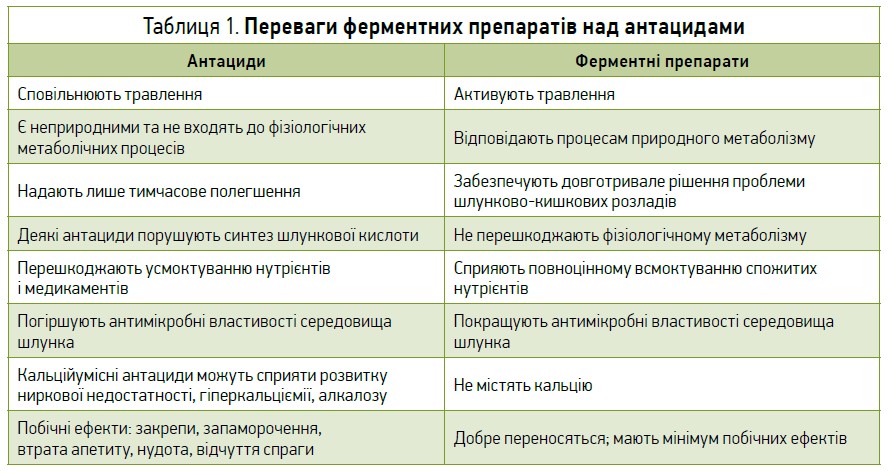
Відповідно до IV Римських критеріїв, ФД характеризується наявністю ≥1 із таких симптомів: постпрандіальне відчуття переповнення, раннє насичення, біль та печія в епігастральній ділянці. Ці симптоми мають бути наявними впродовж попередніх 3 міс і розпочатися щонайменше за 6 міс до встановлення діагнозу (Stanghellini V. et al., 2016). Повідомлено, що диспепсія може бути атиповим проявом ураження підшлункової залози (ПЗ) і порушення її екзокринної функції (Sahai A. V. et al., 2000). Так, у дослідженні M. Wakabayashi та співавт. (2018) у 50% пацієнтів із рефрактерною до інгібіторів протонної помпи ФД спостерігалися патологічні зміни рівня панкреатичних ферментів, а у випробуванні S. Hashimoto і співавт. (2017) у 76,2% учасників – відхилення від норми вмісту трипсину. Зв’язувальними патогенетичними ланками між зовнішньосекреторною недостатністю ПЗ (ЗНПЗ) і диспепсією в такому випадку є розлади спорожнення шлунка та запалення дванадцятипалої кишки (ДПК). Окрім захворювань ПЗ, нестачу панкреатичних ферментів можуть провокувати й інші чинники, наприклад, хірургічні втручання у верхніх відділах травного тракту, несприятливі звички (погане пережовування їжі, прийом їжі пізно ввечері), порушення дієти (зловживання алкоголем, рафінованими вуглеводами та жирами, велика кількість м’яса в раціоні), вік (вироблення травних ферментів поступово знижується з віку 40 років). Для лікування ФД застосовується низка фармакотерапевтичних засобів, у т. ч. прокінетики, антибіотики (з метою ерадикації гелікобактерної інфекції), антидепресанти, кислотознижувальні препарати (інгібітори протонної помпи), антациди та ферменти. Хоча антациди є дуже популярними в зменшенні проявів ФД, ферментні препарати мають низку переваг над ними (табл. 1) (Soni N. K. et al., 2020).
Іще одним різновидом ФГІР є постпрандіальний дистрес-синдром. Показано, що в ≈70% осіб із цим станом спостерігається ЗНПЗ (Fujikawa Y. et al., 2017). Недостатність ПЗ супроводжується зменшенням секреції бікарбонатів, унаслідок чого унеможливлюється нейтралізація соляної кислоти шлунка в проксимальних відділах ДПК. Постійний кислотний «опік» спричиняє запалення слизової оболонки ДПК, яке, своєю чергою, поглиблює дисфункцію ПЗ за рахунок розвитку синдрому дірявого кишечнику: збільшення надходження антигенів із просвіту кишки з подальшою активацією імунної системи та руйнуванням β-клітин ПЗ (Futagami S., Wakabayashi M., 2022).
ЗНПЗ асоціюється також із синдромом надмірного росту бактерій у тонкому кишечнику. Цей синдром є наслідком, зокрема, погіршеного синтезу антимікробних пептидів у ПЗ, погіршеною моторною функцією верхніх відділів травного тракту й аномальним утворенням хімусу в просвіті тонкої кишки (Futagami S., Wakabayashi M., 2022).
СПК (а саме його діарейний варіант) також нерідко асоціюється із ЗНПЗ. У таких пацієнтів доцільним є призначення замісної ферментної терапії (ЗФТ). Так, у дослідженні J. S. Leeds і співавт. (2009) пацієнтам із діарейним варіантом СПК призначали ферментний засіб у дозі 30 000 ОД 3 р/добу. Через 12 тиж лікування частота випорожнень в осіб із рівнем фекальної еластази <100 мкг/г знизилася із 6 до 1,5 раза/день, а оцінка консистенції калу за Брістольською шкалою – із 7 до 4,5 бала. 57,9% хворих також повідомили про зменшення абдомінального болю. Частка відповіді на лікування склала 94,7% осіб. Середня маса тіла учасників дослідження зросла із 72,5 до 74,3 кг, що свідчить про значне покращення нутритивного статусу. Значущих побічних ефектів ЗФТ зафіксовано не було; в деяких пацієнтів спостерігалася незначна нудота, але жоден із них не припинив лікування передчасно.
Загалом виокремлюють 3 основні групи пацієнтів із ФГІР, які можуть отримати переваги від ферментної терапії:
1) особи із симптомами, схожими на СПК, але у верхніх відділах травного тракту (тобто із ФД);
2) особи з диспепсією, асоційованою з харчуванням (із відчуттям розтягнення шлунка, здуттям живота, абдомінальним болем і печією після їжі);
3) особи з діарейним варіантом СПК (Graham D. Y. et al., 2018).
Застосування ЗФТ при ФГІР добре вивчено, найдавніші дослідження сягають 1950-х рр. У масштабному постмаркетинговому дослідженні за участю 2125 осіб із ФД застосування мультиферментного препарату, що містив амілазу, протеазу, ліпазу, лактазу та альфа-галактозидазу, вже через 2 тиж зумовило зниження сумарної оцінки симптомів (флатуленція, здуття живота, відчуття переповнення шлунка, відрижка, печія та погіршення апетиту) із 6,34 до 0,57 бала. 55% лікарів, які призначали цей препарат, оцінили його ефективність як відмінну, а 41% – як хорошу. Схожу оцінку дали і пацієнти (51% – відмінно, 44% – добре) (Khandke D. A. et al., 2013). У ретроспективному аналізі даних 104 хворих із СПК, за якими спостерігали протягом 10 років, прийом комплексного ферментного препарату перед кожним вживанням їжі забезпечував зникнення або зменшення симптомів у 82,5% учасників. Автори пропонують застосовувати ферментну терапію як першу лінію лікування пацієнтів із частими випорожненнями після прийому їжі незалежно від наявності болю (Money M. E., Camilleri M., 2012).
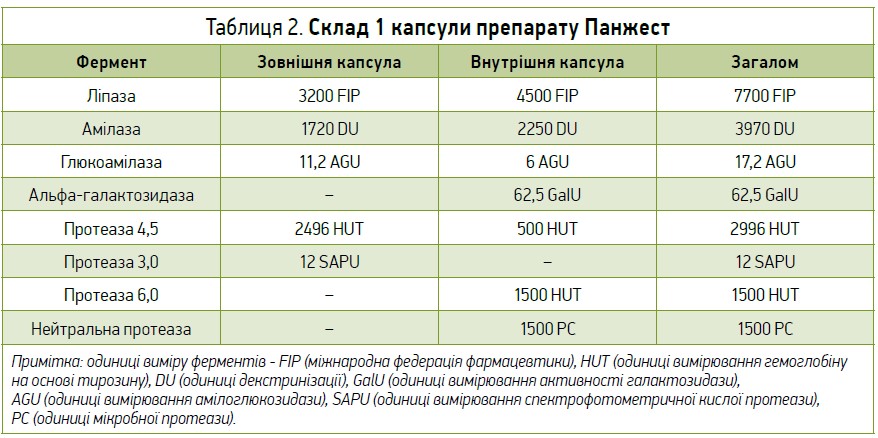
Серед ферментних препаратів для ЗФТ при ЗНПЗ та асоційованих із нею ФГІР увагу привертає Панжест (фармацевтична компанія «Фармак», Україна). Панжесту притаманна низка переваг, зокрема мікробне, а не тваринне походження ферментів; наявність у складі альфа-галактозидази (табл. 2); високотехнологічна форма випуску («капсула в капсулі»), яка перешкоджає руйнуванню активних речовин при різних значеннях рН шлунково-кишкового тракту. Ця інноваційна система доставки та захисту ферментів дозволяє прицільно доставляти активні речовини до певних відділів травної системи, оскільки ферменти розподілені в зовнішній та внутрішній капсулах залежно від оптимального для них рН середовища. Зовнішня капсула розпадається після потрапляння до шлунка, де травні ферменти, обрані для вивільнення в шлунку, розщеплюють їжу на менш складні й легше засвоювані поживні речовини. Ці ферменти є активними та стабільними в умовах кислого рН шлунка. Внутрішня капсула, виготовлена з рослинного полімеру, розпадається в тонкому кишечнику; її уміст стимулює подальше перетравлення їжі замість власних ферментів ПЗ. Попереднє перетравлення їжі в шлунку запобігає розвитку його розладів і відчуттю переповнення за рахунок формування добре засвоюваного хімусу.
Під час проведення досліджень було доведено, що ферменти Панжесту, які мають мікробне походження, є ефективнішими в перетравленні жиру, ніж тваринний панкреатин. Так, спостерігалося посилення ліполізу на вході в ДПК у 19 разів. Гліколіз, індукований ферментами Панжесту, розпочинався через 20 хв після прийому їжі, а через 2 год у шлунку він був у 7 разів ефективнішим, ніж за використання тваринного панкреатину. Ефективність протеолізу під впливом Панжесту була очевидною протягом 2 год травлення в шлунку; в кишечнику ферменти зберігали протеолітичну активність протягом ще 2 год. Загалом ферменти мікроорганізмів мають більшу ефективність, стабільність, стійкість до нагрівання та інактивації шлунковою кислотою, а також вищу активність при ширшому діапазоні рН порівняно із травними ферментами тваринного походження. Більша потужність мікробних ферментів порівняно із тваринними дозволяє використовувати для еквівалентного результату меншу кількість цих ферментів.
Додатковою вагомою перевагою Панжесту є наявність у складі альфа-галактозидази, завдяки якій зменшується утворення кишкових газів після прийому їжі з високим умістом клітковини. Альфа-галактозидаза входить до складу слини та панкреатичного соку. Якщо продукція цього ферменту недостатня, нерозщеплені чи частково розщеплені гліколіпіди та глікопротеїни потрапляють до товстого кишечнику й метаболізуються анаеробними бактеріями, а продукти їхнього розпаду спричиняють болі в животі, посилюють газоутворення, сприяють розвитку дріжджових інфекцій. Достатнє екзогенне надходження альфа-галактозидази дозволяє розщеплювати складні вуглеводи на фруктозу, глюкозу та галактозу до надходження до товстого кишечнику, запобігаючи їхній анаеробній ферментації (Fabris E. et al., 2021). У дослідженні за участю пацієнтів із СПК призначення добавок альфа-галактозидази знижувало вираженість симптоматики й дозволяло вживати навіть продукти, збагачені галактоолігосахаридами (боби, горіхи), які часто спричиняють газоутворення та біль у животі (Tuck C. J. et al., 2018).
Отже, в основі значної частини ФГІР нерідко лежить ЗНПЗ, подолати яку можна за допомогою оптимальної ЗФТ. Обираючи ферментний препарат, варто звернути увагу на сучасні засоби, які мають низку переваг, як-от Панжест, що містить комбінацію 8 ферментів мікробного походження та має інноваційну двокапсульну систему їхньої доставки.
Експертна думка
 Кандидат медичних наук, професор О.В. Швець:
Кандидат медичних наук, професор О.В. Швець:
– Хронічний панкреатит (ХП) – це патологічний процес, який характеризується фіброзом і запаленням ПЗ в осіб із генетичними, зовнішніми й іншими факторами ризику, наприклад, гіпертригліцеридемією. Морфологічні, патофізіологічні / клінічні прояви ХП включають атрофію, фіброз, стриктури, деформації протоків залози, її кальцифікацію та дисплазію, порушення ендо- й екзокринної функції, хронічний абдомінальний біль, порушення нутритивного статусу (Whitcomb D. C. et al., 2016). Больові відчуття в животі після їжі так сильно турбують пацієнтів із панкреатитом, що вони свідомо обмежують її вживання (ситофобія).
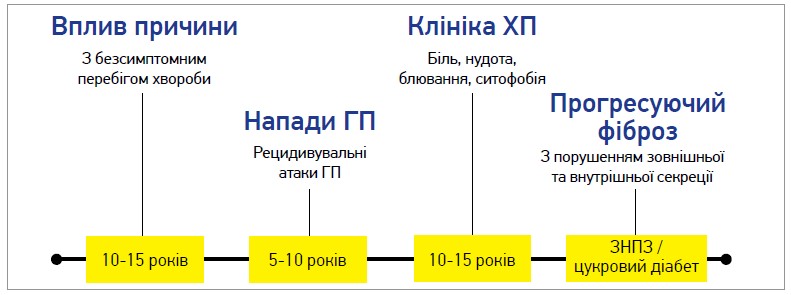
Мальнутриція за уражень ПЗ виникає досить пізно. Перші напади гострого панкреатиту (ГП) з потужним больовим синдромом зазвичай спостерігаються через 10-15 років безсимптомного перебігу хвороби, а виражений фіброз із порушенням секреції спостерігається ще через 15-25 років (рис. 1). Цікаво, що терміни виникнення панкреатичної недостатності та недостатнього харчування відрізняються залежно від етіології процесу. Так, при алкогольному панкреатиті латентний період до появи перших ознак і симптомів (біль, мальнутриція) є коротшим, ніж при ідіопатичному панкреатиті й інших етіологіях ураження ПЗ; триває 5-10 років.
Рис. 1. Природний перебіг ХП
Тривала ситофобія з подальшими несприятливими змінами тканини ПЗ зрештою зумовлює значне погіршення інкреторної та екскреторної функцій залози, отже, різке зниження всмоктування нутрієнтів (насамперед жирів). Із часом мальабсорбція, мальдигестія, зниження синтезу протеаз і запальний процес у ПЗ спричиняють зниження маси тіла та виснаження організму загалом.
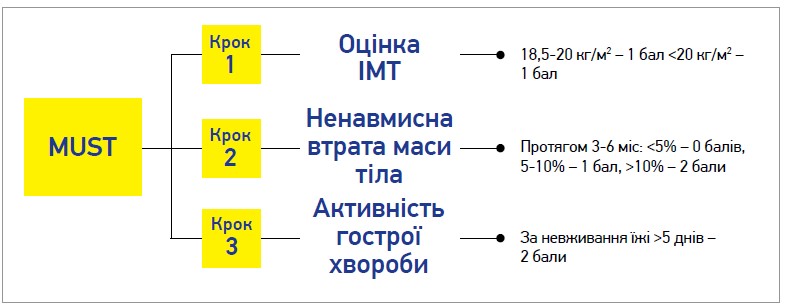
Для оцінки нутритивного статусу пацієнта із ХП використовуються антропометричні показники (індекс маси тіла (ІМТ), м’язова маса), протеїнограма й інші лабораторні аналізи, відтворення дієти (за допомогою щоденників харчування, фотофіксації, мобільних застосунків). Інструментом для скринінгу мальнутриції є також шкала MUST (рис. 2).
Рис. 2. Скринінг мальнутриції MUST
Відповідно до результату скринінгу, пацієнти низького ризику в разі перебування в домашніх умовах підлягають повторній оцінці стану 1 р/рік, за перебування в закладах догляду – 1 р/міс, у разі стаціонарного лікування – щотижня. Для хворих середнього ризику частота повторних обстежень у разі перебування в домашніх умовах становить 1 р/2-3 міс (для закладів догляду і стаціонару – аналогічно низькому ризику). Пацієнтів високого ризику необхідно скерувати до дієтолога з метою оптимізації харчування та складання плану його подальшого моніторингу.
Ключовими напрямами лікування хворого із ХП є модифікація способу життя (припинення куріння та вживання алкоголю), оптимізація надходження ключових нутрієнтів, компенсація цукрового діабету, адекватне знеболення, усунення дисбіотичних змін, ЗФТ. При нормальному нутритивному статусі дієта має бути адекватною енергетичним потребам за калорійністю, за мальнутриції – гіперкалорійною з високим умістом білка (підвищити калорійність раціону можна за допомогою висококалорійних напоїв, упровадження перекусів між основними прийомами їжі). Рестриктивних дієт і надмірного вживання харчових волокон слід уникати. Для запобігання чи компенсації дефіциту нутрієнтів у раціоні мають бути присутніми збагачена цими нутрієнтами їжа, а також дієтичні добавки. Найчастіше за панкреатиту виникає дефіцит вітамінів K, D та E, а також магнію, заліза, цинку, селену. Всі дієтичні інтервенції мають ураховувати вихідний нутритивний статус, наявність ЗНПЗ і харчові звички пацієнта.
Фундаментальною основою лікування ХП є ЗФТ, яку доцільно розпочинати ще до появи стеатореї. Мета застосування ферментів – стабілізація та поліпшення нутритивного статусу, зниження вираженості симптомів. Окрім того, ефектами правильно призначеної ЗФТ є компенсація дефіциту поживних речовин, нормалізація маси тіла, відновлення якості життя, зниження ризику ускладнень та смертності.
Ферментні препарати приймають на початку чи в середині процесу вживання їжі; стартова доза має становити 50 000 ОД на основний прийом їжі та 25 000 ОД на перекус. У наш час ферментам тваринного походження є альтернатива – ферменти мікробного походження, які входять до складу препарату Панжест (фармацевтична компанія «Фармак», Україна). Панжест являє собою комплекс із 8 біотехнологічних мікробних ферментів з інноваційною технологією доставки «капсула в капсулі», яка забезпечує стійкість препарату за різних значень рН. Раннє використання Панжесту (до розвитку стеатореї) допомагає забезпечити стабільний нормальний нутритивний статус, а ефективність та безпечність застосування цього препарату підтверджені в доклінічних і рандомізованих клінічних дослідженнях.
Підготувала Лариса Стрільчук
Медична газета «Здоров’я України 21 сторіччя» № 10 (546), 2023 р.