19 червня, 2024
Стратегії вибору антибактеріальних препаратів для лікування інфекцій шкіри та м’яких тканин
За матеріалами конференції
 Восени минулого року в рамках семінару «Академія хірургії, анестезіології та інтенсивної терапії від А до Я: Хірургічні аспекти лікування гострого панкреатиту та його ускладнень. Анестезія у пацієнтів високого ризику» відбулася сателітна сесія, присвячена ефективним стратегіям антибіотикотерапії хірургічної інфекції шкіри, м’яких тканин і кісток. У своїй доповіді доцент кафедри загальної хірургії Львівського національного медичного університету ім. Данила Галицького, кандидат медичних наук Всеволод Васильович Ващук висвітлив сучасні класифікації інфекцій шкіри та м’яких тканин (ІШМТ), ключові принципи контролю джерела інфекції, а також актуальні рекомендації щодо лікування синдрому діабетичної стопи (СДС).
Восени минулого року в рамках семінару «Академія хірургії, анестезіології та інтенсивної терапії від А до Я: Хірургічні аспекти лікування гострого панкреатиту та його ускладнень. Анестезія у пацієнтів високого ризику» відбулася сателітна сесія, присвячена ефективним стратегіям антибіотикотерапії хірургічної інфекції шкіри, м’яких тканин і кісток. У своїй доповіді доцент кафедри загальної хірургії Львівського національного медичного університету ім. Данила Галицького, кандидат медичних наук Всеволод Васильович Ващук висвітлив сучасні класифікації інфекцій шкіри та м’яких тканин (ІШМТ), ключові принципи контролю джерела інфекції, а також актуальні рекомендації щодо лікування синдрому діабетичної стопи (СДС).
Ключові слова: інфекції шкіри та м’яких тканин, синдром діабетичної стопи, виразка стопи, інфекції стопи, антибіотикотерапія.
Інфекції шкіри та м’яких тканин у практиці хірурга: актуальність проблеми
ІШМТ охоплюють різноманітні патологічні стани, які вражають шкіру та підшкірну клітковину, фасції або м’язи. Тяжкість ІШМТ варіює від простих поверхневих до тяжких некротичних інфекцій, що зустрічаються значно рідше, але супроводжуються генералізацією процесу, розвитком сепсису або септичного шоку з ризиком для життя.
Хірургічна інфекція шкіри та м’яких тканин (ХІШМТ) є однією з найпоширеніших бактеріальних інфекцій у світі. Так, частота госпіталізації пацієнтів із цією патологією до хірургічних стаціонарів США становить 10%, тоді як у Європі цей показник сягає 36%. При цьому 75% випадків ХІШМТ припадає на осіб працездатного віку, 27% – на «глибокі» форми, у 10% пацієнтів спостерігається залучення у патологічний процес внутрішніх органів, а загальна летальність сягає 4,7-5% (Герич І.Д. та співавт., 2012). Експерти визначають ХІШМТ як нагальну проблему хірургічної галузі та сфери охорони здоров’я в цілому з огляду на високу інцидентність, поліваріантність клінічних сценаріїв розвитку та високі показники летальності при прогностично несприятливих формах інфекції (у середньому – 24%, за наявності некротичних форм – до 73%).
Всесвітнє товариство з невідкладної хірургії (WSES), Глобальний альянс із хірургічних інфекцій (GAIS), Європейське товариство з хірургічних інфекцій (SIS-E), Всесвітнє товариство з хірургічних інфекцій (WSIS) та Американська асоціація хірургії травми (AAST) спільно розробили та опублікували в 2022 році глобальні стандарти медичної допомоги при ІШМТ (WSES/GAIS/WSIS/SIS-E/AAST global clinical pathways for patients with skin and soft tissue infections, 2022).
У 2021 році також були представлені оновлені рекомендації Товариства з хірургічних інфекцій (SIS) щодо зазначеної проблеми. Відповідно до оновленого визначення гострої бактеріальної інфекції шкіри і м’яких тканин (ГБІШМТ) Управління з нагляду за якістю харчових продуктів і медикаментів США (FDA, 2018), вона визначається як бактеріальна інфекція шкіри з площею ураження ≥75 см2. При цьому розмір ураження вимірюється площею почервоніння, набряку або ущільнення. До ГБІШМТ відносять флегмону, бешиху (еризипелоїд), ранові інфекції та великі шкірні абсцеси.
Найбільш поширені класифікації ХІШМТ
Сучасні класифікаційні підходи передбачають стратифікацію ХІШМТ за етіологією, характером і рівнем ураження тканин, клінічними проявами, поширенням, ускладненнями, а також ступенем генералізації або тяжкості. Імплементація в клінічну практику нових класифікацій сприяє полегшенню прийняття рішення щодо раціональної лікувальної стратегії, зокрема вибору антибіотикотерапії. Отже, найбільш загальна класифікація ХІШМТ, яка застосовується практикуючими лікарями, передбачає поділ інфекцій на три групи:
- інфекції, які підлягають консервативному лікуванню (наприклад, еризипелоїд, імпетиго, фолікуліт);
- інфекції, які потребують оперативного втручання (наприклад, діабетична стопа);
- тяжкі інфекції, які потребують ургентної хірургічної допомоги (наприклад, некротичний фасциїт).
У США більш поширена інша класифікація, яка передбачає стратифікацію ХІШМТ на дві форми: неускладнені та ускладнені (ураження глибоких м’яких тканин, ризик розвитку сепсису та імуносупресії, а також інфекції, які потребують великого за обсягом оперативного втручання).
Т. Файл (2003) запропонував наступну стратифікаційну модель ХІШМТ:
1) первинні піодермії – найпоширеніші серед усіх інфекцій шкіри, здебільшого спричинені Staphylococcus aureus і піогенними β-гемолітичними стрептококами (найчастіше – групи А);
2) вторинні інфекції – виникають на фоні супутніх захворювань (наприклад, пролежні, діабетична виразка стопи, післяопераційні інфекції);
3) некротизуючі інфекції – найтяжчі форми ХІШМТ.
Класифікація Eron et al. (2003) передбачає розподіл пацієнтів із ХІШМТ на чотири класи з урахуванням клінічних проявів інфекції та наявності супутньої патології:
- клас 1 – без ознак чи симптомів системної інтоксикації або супутніх захворювань;
- клас 2 – наявність супутніх захворювань (наприклад, ожиріння, цукровий діабет [ЦД]), які можуть ускладнити або затримати процес лікування;
- клас 3 – ознаки інтоксикації та погіршення стану (лихоманка, тахікардія, тахіпное й/або гіпотензія);
- клас 4 – синдром сепсису та інфекція, яка загрожує життю (наприклад, некротичний фасциїт).
У 2015 році WSES опубліковало рекомендації щодо лікування ІШМТ на основі нової дефініції, відповідно до якої зазначені інфекції поділяються на три основні групи:
1) інфекції в місці хірургічного втручання:
- інцизійні (поверхневі – шкіра та підшкірна клітковина; глибокі – клітковинні простори, м’язи, фасції);
- орган і орган/порожнини;
2) ненекротизуючі ІШМТ;
3) некротизуючі ІШМТ.
Ненекротизуючі ІШМТ, включаючи бешиху, імпетиго, фолікуліт, простий і складний абсцес, можна лікувати антибіотиками або лише дренажем. Некротизуючі ІШМТ потребують хірургічного втручання, зокрема дренування та видалення некротичної тканини, на додаток до антибіотикотерапії.
Хірурги часто використовують у своїй практиці класифікацію ІШМТ за рівнем ураження (Ahrenholtz D.H. et al., 1991):
- I рівень – ураження власне шкіри (фурункул, лімфангоїт, бешиха, еризипелоїд);
- II рівень – ураження підшкірної клітковини (карбункул, абсцес, мастит, флегмона, гідраденіт);
- III рівень – ураження поверхневої фасції (фасциїти різної етіології, діабетична стопа, гангрена Фурн’є);
- IV рівень – ураження м’язів і глибоких фасціальних структур (піоміозит, міонекрози та ін.).
Ключові принципи контролю джерела інфекції при ІШМТ
Контроль джерела інфекції є найважливішою детермінантою результату некротизуючої ІШМТ. Запізнілий або неадекватний контроль призводить до збільшення випадків ускладнень та смертності, яким можна було б запобігти.
Автори глобальної клінічної настанови з менеджменту ІШМТ (Sartelli M. et al., 2022) закликають лікарів дотримуватися ключових принципів контролю джерела інфекції, які включають:
- дренування інфікованих рідин;
- обробка інфікованих м’яких тканин;
- видалення інфікованих пристроїв або сторонніх тіл;
- заходи для виправлення будь-яких анатомічних порушень, що призводять до тривалого мікробного забруднення;
- відновлення оптимальної функції уражених сегментів.
Синдром діабетичної стопи: поширеність в Україні та світі
СДС – специфічний симптомокомплекс ураження стопи у хворих на ЦД, основою патогенезу якого є діабетичні мікро- й макроангіопатії, периферична нейропатія нижніх кінцівок та остеоартропатія. Ці процеси розвиваються паралельно, взаємно обтяжуючи один одного, із приєднанням тяжких гнійно-некротичних уражень, які характеризуються особливим складом мікрофлори і перебігом на фоні глибоких обмінних порушень та імуносупресії.
За даними Всесвітньої організації охорони здоров’я, на сьогодні у світі налічується приблизно півмільярда хворих на ЦД, при цьому кожні дві хвилини вісім із них помирають. Проблеми стопи стають причиною найбільшої кількості ліжко-днів серед усіх госпіталізацій хворих на ЦД. Статистичні дані свідчать про те, що у 1-4% пацієнтів із ЦД щорічно діагностують виразку стопи. Загалом 45-75% ампутацій пов’язані саме із СДС. За статистикою, 2/3 пацієнтів похилого віку після ампутації не повертаються до активного способу життя. В Україні станом на 1 січня 2019 року нараховувалося понад 1,5 млн хворих на ЦД, серед яких 93,1% – хворі на ЦД 2-го типу. СДС становить до 60% (а в деяких регіонах – до 90%) усіх випадків нетравматичних ампутацій (приблизно 3,4 тис. щороку). Післяопераційна летальність серед пацієнтів із виразкою стопи складає 7%. Доповідач наголосив, що за умови своєчасної діагностики та раціонального підходу до лікування можна запобігти до 85% ампутацій.
Враховуючи патогенетичні особливості розвитку СДС, у 1991 році в Нідерландах були визначені три форми ураження стопи:
- нейропатично-інфікована;
- ішемічно-гангренозна;
- змішана.
У 2/3 пацієнтів із СДС відзначається тріада: нейропатія, деформація стопи (Шарко) і виразки від компресії (Buyng-Joon et al., 2017).
Актуальні рекомендації щодо менеджменту синдрому діабетичної стопи
Доповідач звернув увагу на існуючий стандарт нагляду за виразкою, який слід застосовувати в усіх випадках СДС:
- вчасне виявлення інфекції;
- санація виразки, видалення мозоля;
- оцінка тактильної чутливості монофіламентом;
- оцінка циркуляції крові (пульсація, доплерографія);
- використання адекватних методів розвантажування;
- антибіотикотерапія при інфікуванні виразки або прилеглих тканин;
- вторинна профілактика основних подій, пов’язаних із ЦД.
Фахівці Національного інституту здоров’я і досконалості допомоги Великої Британії (NICE, 2019) надали наступні рекомендації щодо менеджменту пацієнтів із СДС:
- Необхідно здійснювати нагляд протягом перших годин перебування хворого у стаціонарі.
- У кожній лікарні має бути протокол нагляду за пацієнтами із СДС, які потребують стаціонарної допомоги.
- Рекомендовано контролювати загальний стан пацієнта та вчасність надання допомоги медичними працівниками.
- Рекомендовано звернутися до фахівця з лікування діабетичної стопи протягом перших 24 год після первинного огляду ніг пацієнта.
- Медичні працівники повинні нести відповідальність за нагляд за пацієнтом із СДС.
- Терапевтичний підхід до лікування діабетичної стопи має бути мультидисциплінарним, а команда має включати спеціалістів у таких галузях: діабетологія, подологія, судинна хірургія, мікробіологія, травматологія та ортопедія, радіологія, догляд за ранами + спеціалісти з реабілітаційної медицини, пластичної хірургії, психологи та дієтологи.
- Необхідно враховувати будь-які ускладнення, включаючи порушення зору, при плануванні та наданні допомоги пацієнтам із ЦД.
Для визначення глибини ураження та тяжкості інфекційного процесу при СДС спеціалісти використовують класифікацію СДС за шкалою PEDIS:
- ступінь 1 – неінфікована діабетична стопа;
- ступінь 2 – залучення до інфекційного процесу шкіри та її структур (поверхнева виразка, панарицій, підшкірний абсцес, бешиха, целюліт);
- ступінь 3 – глибокий абсцес, флегмона, виразка або ураження глибоких тканин (фасциїт, тендовагініт, міонекроз, остеомієліт, гангрена);
- ступінь 4 – наявність ознак системної запальної відповіді (лімфангоїт, бактеріємія, інтоксикація).
Вибір препаратів для проведення емпіричної антибіотикотерапії при СДС залежить від тяжкості інфекції (табл. 1).
|
Таблиця 1. Оцінка тяжкості інфекції при СДС (модифікація за Cosgrove et al., 2015) |
|
|
Ступінь тяжкості інфекції |
Клінічні прояви |
|
Інфекція відсутня |
Немає ознак запалення і нагноєння |
|
Легка |
Наявність гною і >1 ознаки запалення*, флегмони (якщо є) ≤2 см, обмеженої тільки ураженням шкіри і підшкірної клітковини |
|
Середня |
Вищезазначене плюс мінімум одне з наступних: флегмона >2 см, висхідний лімфангоїт, ураження поверхневої фасції, глибокі абсцеси, гангрена з ураженням м’язів, сухожилків, кісток |
|
Тяжка |
Усе вищезазначене плюс прояви системної інтоксикації та значні метаболічні порушення організму |
|
* Еритема, біль, напруження тканин, набряк, індурація, локальна гіпертермія. |
|
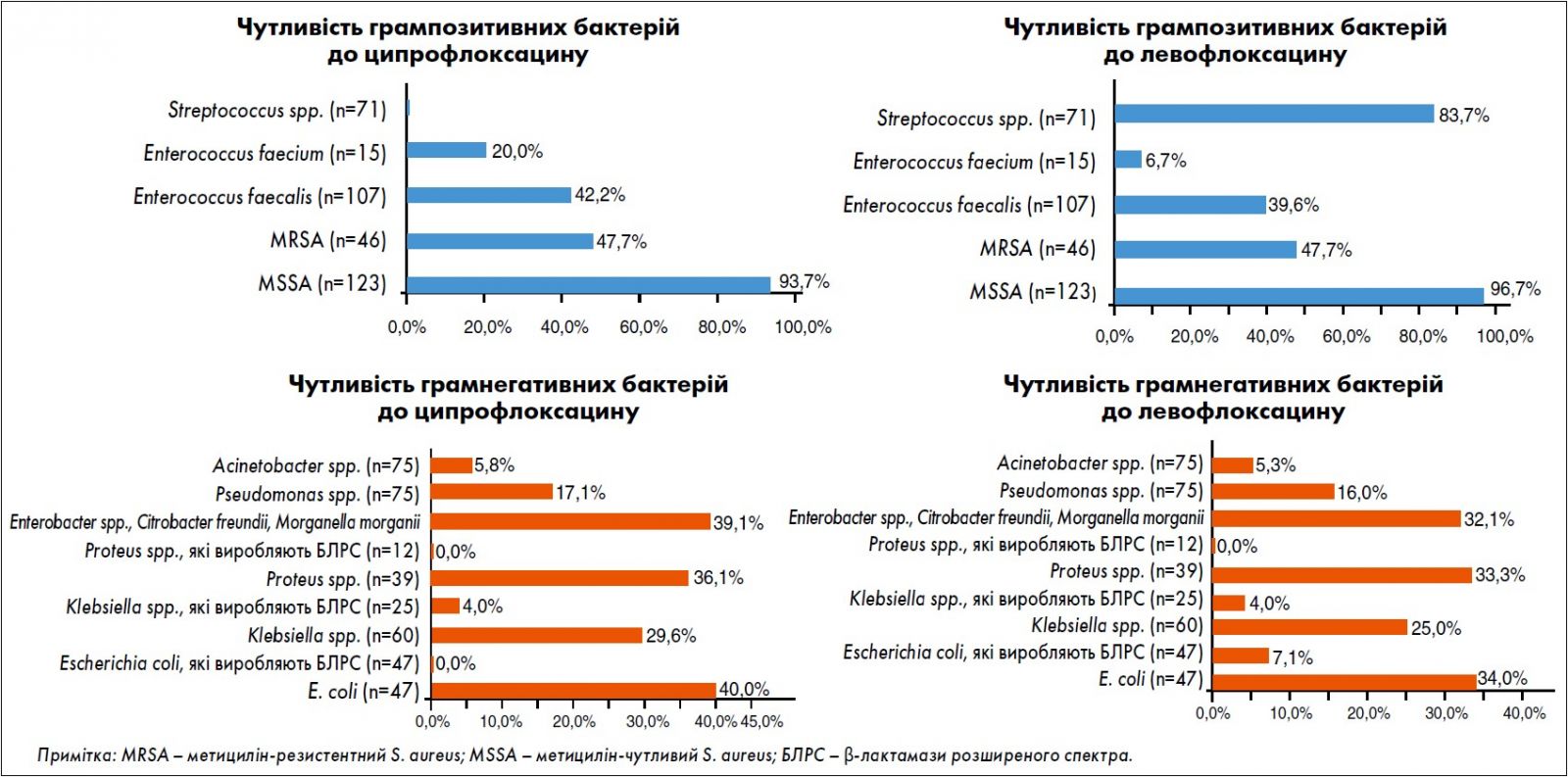
Спікер представив результати дослідження АУРА (2019), метою якого було визначення чутливості до 23 антибактеріальних препаратів на підставі мікробіологічних досліджень патологічного вмісту ран при інфекціях шкіри та м’яких тканин, інтраабдомінальних інфекціях, інфекціях кісток та суглобів (рисунок).
Рис. Результати визначення чутливості патогенів на підставі мікробіологічних досліджень патологічного вмісту ран при ІШМТ, інтраабдомінальних інфекціях, інфекціях кісток та суглобів в Україні за 2018-2019 роки (Березняков І.Г. Стан антибіотикорезистентності в Україні: результати дослідження АУРА, «Здоров’я України», «Хірургія. Ортопедія. Травматологія. Інтенсивна терапія», № 4 (41), 2020, с. 31-34).
Відповідно до висновків авторів, найчастішими збудниками ранової інфекції в Україні є Staphylococcus spp. Серед усіх стафілококів частка чутливих до метициліну становить 65%, а серед S. aureus (MSSA) – 72,8%. MSSA зберігають чутливість 100% майже до всіх β-лактамних антибіотиків, глікопептидів, оксазолідинонів і гліцилциклінів. Дуже високу (>95%) чутливість встановлено до ліпопептидів, аміноглікозидів, тетрацикліну, фторхінолонів. За необхідності призначити антибіотик, активний щодо метицилін-резистентного S. aureus (MRSA), слід робити вибір між лінезолідом і тейкопланіном.
Основними принципами лікування СДС є хірургічне втручання (за необхідності – реваскуляризація) та раціональна антибіотикотерапія для ерадикації інфекції. Згідно з рекомендаціями NICE (2019), при легкому ступені інфікування у пацієнтів із СДС слід розглянути призначення наступних антибактеріальних препаратів:
- флуклоксацилін – 500 мг 4 рази на добу протягом 7 днів;
у випадку алергії на пеніциліни:
- кларитроміцин – 500 мг 2 рази на добу протягом 7 днів;
- еритроміцин (у період вагітності) – 500 мг 4 рази на добу протягом 7 днів;
- доксициклін – 200 мг у 1-й день, далі – 100 мг 1 раз на добу протягом 7 днів.
У разі тяжкої інфекції слід призначати антибіотик внутрішньовенно (в/в) протягом щонайменше 48 год до стабілізації стану і повторно оцінити потребу в антибіотику. Тривалість курсу базується на клінічній оцінці – мінімум 7 днів для стандартної антибіотикотерапії. У разі остеомієліту рекомендовано застосовувати антибіотик упродовж 6 тижнів, із використанням пероральних форм.
При помірних і тяжких формах інфекції рекомендовані такі антибіотики:
- флуклоксацилін – 1 г 4 рази на добу або 1-2 г 4 рази на добу в/в;
- гентаміцин – 5-7 мг/кг 1 раз на добу в/в, потім – відповідно до концентрації в сироватці крові;
- метронідазол – 400 мг 3 рази на добу;
- амоксицилін/клавуланова кислота – 500/125 мг 3 рази на добу;
- цефтріаксон – 2 г 1 раз на добу в/в.
При підозрі/підтвердженні інфікування Pseudomonas aeruginosa слід віддавати перевагу таким антибіотикам:
- піперацилін/тазобактам – 4,5 г 3 рази на добу в/в;
- кліндаміцин – 150-300 мг 4 рази на добу (до 450 мг 4 рази на добу) або 600 мг‑2,7 г щодня в/в у 2-4 дозах (до 4,8 г на добу);
- ципрофлоксацин – 2 г 1 раз на добу + метронідазол 400 мг 3 рази на добу перорально або 500 мг 3 рази на добу в/в;
- гентаміцин – 5-7 мг/кг 1 раз на добу в/в, потім – відповідно до концентрації в сироватці крові;
- у випадку MRSA варто додати ванкоміцин – 15-20 мг/кг 2-3 рази на добу (макс. 2 г) та лінезолід 600 мг 2 рази на добу.
При діагностуванні флегмони та сепсису емпірична антибіотикотерапія має включати (M. Guarino et al., 2023):
- амоксицилін/клавуланат – 2,2 г 3 рази на добу ± кліндаміцин 600 мг 4 рази на добу (комбінація вибору);
- цефтріаксон – 2 г 2 рази на добу (як альтернатива);
- левофлоксацин – 750 мг 2 рази на добу – (у разі алергії на пеніциліни);
- піперацилін/тазобактам – 9 г, далі – 18 г 2 рази на добу + меропенем 2 г, далі – 2 г 3 рази на добу (за ризику інфікування збудниками, що продукують β-лактамази розширеного спектра);
- даптоміцин – 8-10 мг/кг 2 рази на добу або ванкоміцин 25-30 мг/кг, далі – 20 мг/кг 2 рази на добу (за ризику MRSA).
Якщо у пацієнта діагностована некротична форма діабетичної стопи із приєднанням сепсису, комбінацією вибору у цьому разі є даптоміцин 8-10 мг/кг 2 рази на добу + кліндаміцин 600 мг 4 рази на добу + піперацилін/тазобактам 9 г, далі – 18 г 2 рази на добу. У випадку алергії на пеніциліни піперацилін/тазобактам слід замінити меропенемом.
За даними D. Pittet et al. (1999) і W. Jeffcoate et al. (2013), у разі розвитку остеомієліту діабетичної стопи призначення антибіотикотерапії сприяло настанню ремісії у 60-70% випадків. Через значний ризик клінічних невдач багато лікарів призначають антибіотикотерапію дуже тривалим курсом, хоча рекомендації обмежують її призначення лише 4-6 тижнями. К. Gariani et al. (2020) дослідили ефективність системної антибіотикотерапії тривалістю 3 тижні й отримали зіставну (і статистично не меншу) частоту ремісії та побічних явищ порівняно із 6-тижневим курсом.
Ципрофлоксацин та тинідазол: ефективна комбінація проти ІШМТ
В Україні для лікування ІШМТ успішно використовується препарат Ципролет® (ципрофлоксацин 500 мг). Ципрофлоксацин був схвалений до клінічного застосування у 1987 році FDA. Дія препарату зумовлена пригніченням реплікації ДНК шляхом інгібування бактеріальної ДНК-топоізомерази та ДНК-гірази. Серед фторхінолонів ципрофлоксацин демонструє найсильнішу дію проти грамнегативних бактерій (зокрема, Enterobacteriaceae, таких як E. coli, Salmonella spp., Shigella spp. і Neisseria). Ципрофлоксацин також проявляє активність проти деяких грампозитивних бактерій (Campoli-Richards D. et al., 1988).
Пероральна форма ципрофлоксацину (750 мг 2 рази на добу протягом 6-18 днів) має кращу клінічну та бактеріологічну ефективність порівняно з цефотаксимом (2 г в/в 3 рази на добу впродовж 5-14 днів) при ІШМТ (79% проти 68% відповідно). Ципрофлоксацин у пероральній формі має високу біодоступність (50-85%) і за ефективністю не поступається парентеральному введенню. Препарат створює високі концентрації в суглобах, кістковій тканині та кістковому мозку, що обґрунтовує його застосування при інфекціях цих локалізацій. Ципрофлоксацин можна застосовувати для ступінчатої терапії з переходом із парентеральної форми на пероральну з відповідною корекцією дози (табл. 2).
|
Таблиця 2. Еквівалентні дози ципрофлоксацину для внутрішньовенного та перорального застосування |
|
|
Доза в/в |
Доза рer os |
|
200 мг 1 раз на добу |
250 мг 1 раз на добу |
|
200 мг кожні 12 год |
250 мг кожні 12 год |
|
400 мг 1 раз на добу |
500 мг 1 раз на добу |
|
400 мг кожні 12 год |
500 мг кожні 12 год |
|
400 мг кожні 8 год |
750 мг кожні 12 год |
Ципролет® А – це комбінований препарат, до складу якого входять ципрофлоксацин 500 мг і тинідазол 600 мг. Тинідазол є пероральним антимікробним засобом широкого спектра, який діє проти бактерій, а також деяких найпростіших, таких як Entamoeba histolytica, Giardia duodenalis i Trichomonas vaginalis. Ципролет® А зарекомендував себе як ефективна комбінація проти аеробної флори, включаючи P. aeruginosa і S. aureus (табл. 3).
|
Таблиця 3. Порівняльна характеристика антимікробних препаратів для лікування анаеробної інфекції |
||
|
Ознака |
Метронідазол |
Тинідазол |
|
Період напіввиведення із сироватки крові |
6-7 год |
12-14 год |
|
Кратність застосування |
3 рази на добу |
2 рази на добу (кращий комплаєнс) |
|
Клінічна ефективність у лікуванні парадонтиту |
Нижча (43,5%) порівняно з тинідазолом |
Вища (73,1%) порівняно з метронідазолом |
В окремих випадках, за наявності анаеробної неклостридіальної флори, до ципрофлоксацину слід додавати похідні 5-нітроімідазолу, які найбільш ефективні при таких захворюваннях, як діабетична стопа. Тому при лікуванні СДС застосовують комбіновану терапію, що включає препарати з аеробно-анаеробною активністю (зокрема, тинідазол).
Результати мікробіологічних досліджень пацієнтів із СДС дозволяють розглядати комбінацію ципрофлоксацин 500 мг + тинідазол 600 мг як засіб дієвої боротьби з інфекційними ускладненнями. Ефективність комбінації була доведена в усіх виділених клінічних групах (Nichitailo M. et al., 2013; Shen B. et al. 2007; Шестакова М. та співавт., 2019):
- при гострих гнійних захворюваннях м’яких тканин (фурункули, карбункули, флегмони);
- при післяопераційних гнійних ранах м’яких тканин;
- при посттравматичних гнійних ранах із/без ушкодження кісток;
- при хронічних гнійних процесах м’яких тканин (трофічні виразки, пролежні).
Отже, ІШМТ є актуальною проблемою в хірургічній практиці, яка вимагає комплексного підходу до лікування для попередження її тяжких наслідків. Раціональна антибіотикотерапія є одним з основних ланок успішного контролю джерела інфекції при ХІШТН, зокрема при СДС. Комбінована терапія ципрофлоксацином та тинідазолом (Ципролет® А) може бути стратегією вибору для лікування інфекційних ускладнень.
Підготувала Дарина Чернікова
Статтю підготовлено за підтримки компанії «Др. Редді’с Лабораторіз» для надання професійної інформації спеціалістам у сфері охорони здоров’я. Містить інформацію про лікарські засоби (інформація про які також наведена в супутньому інфоблоці, див.). CIP-28-02-2024-Rx2-7.1, ч. 1