17 червня, 2021
Роль вітаміну D та пробіотиків у підвищенні захисних сил організму дітей із рекурентними респіраторними інфекціями
.jpg) Протягом останнього року панування глобальної пандемії COVID-19 вчені та лікарі в усьому світі зосереджені на питаннях діагностики та лікування коронавірусної інфекції. У зв’язку з цим веденню дітей із повторними епізодами гострих респіраторних інфекцій (ГРІ) приділялося недостатньо уваги, що в майбутньому може призвести до зростання кількості віддалених ускладнень з боку інших органів та систем організму внаслідок тривалого самолікування ГРІ в домашніх умовах.
Протягом останнього року панування глобальної пандемії COVID-19 вчені та лікарі в усьому світі зосереджені на питаннях діагностики та лікування коронавірусної інфекції. У зв’язку з цим веденню дітей із повторними епізодами гострих респіраторних інфекцій (ГРІ) приділялося недостатньо уваги, що в майбутньому може призвести до зростання кількості віддалених ускладнень з боку інших органів та систем організму внаслідок тривалого самолікування ГРІ в домашніх умовах.
З метою зосередження уваги лікарів-педіатрів і профільних фахівців на темі профілактики та лікування ГРІ у період пандемії за спільної ініціативи Національного університету охорони здоров’я імені П.Л. Шупика та групи компаній «МедЕксперт» 17 березня 2021 р. була проведена фахова школа «Практична педіатрія від А до Я», у рамках якої своїм досвідом та власними професійними надбаннями ділилися кращі українські професіонали.
Президент Асоціації педіатрів-гастроентерологів і нутриціологів України, завідувач відділення проблем харчування та соматичних захворювань у дітей раннього віку ДУ «Інститут педіатрії, акушерства і гінекології імені академіка О.М. Лук’янової Національної академії медичних наук України», доктор медичних наук, професор Олег Геннадійович Шадрін у своїй доповіді розглянув одну з актуальних тем сучасної педіатрії, присвячену проблемі зростаючих контактів у дітей із рекурентними респіраторними інфекціями (РРІ) та шляхам її вирішення.
У період пандемії COVID-19 лікарям слід звертати увагу не тільки на діагностику та лікування коронавірусної інфекції, але й не забувати про наявність інших рекурентних захворювань, які також потребують належного лікування. Згідно з даними Всесвітньої організації охорони здоров’я (ВООЗ), у країнах, що розвиваються, та в економічно розвинених державах у перші 3 роки життя діти в середньому хворіють на ГРІ 6-8 разів на рік, при цьому у великих містах – до 7-10 разів. У перші 7 років життя діти, які не відвідували дошкільні заклади освіти (ДЗО), у цей період хворіють на ГРІ на 10-15% рідше, проте у перших класах школи – частіше, ніж їх однолітки з попередньою дошкільною освітою. Перенесення ГРІ у цей період життя має вагоме фізіологічне значення у дозріванні імунітету дітей, сприяючи нормалізації співвідношення T-хелперів-1/T-хелперів-2. Однак в цілому часті ГРІ негативно впливають на стан здоров’я дітей, адже вони є однією з основних причин дитячої смертності у країнах, що розвиваються (Е.Н. Охотникова и др., 2013).
Існує безліч факторів, які призводять до повторного захворювання дітей раннього віку на ГРІ. Сьогодні більшість дослідників говорять про функціональну незрілість імунної системи та її пізнє формування у дітей, оскільки було встановлено наявність змін в імунному статусі у 15-39% таких дітей, навіть у період клінічного благополуччя та відсутності ознак гострих респіраторних вірусних інфекцій (ГРВІ). Інші дані свідчать, що причиною РРІ у дітей є: відсутність «імунного досвіду» у малечі, що не відвідувала ДЗО, наявність соматичної патології, особливостей конституції (відхилень в алергостатусі), первинного або вторинного імунодефіциту, генетичної схильності, фонових станів і захворювань, персистуючої інфекції або вогнищ хронічного запалення. В окремої групи дітей внаслідок РРІ можливий розвиток ускладнень: формування хронічних інфекційних та неінфекційних хвороб, розвиток функціональних змін з боку серцево-судинної та бронхолегеневої систем, порушень нервово-психічного і фізичного розвитку. Сьогодні критерієм встановлення РРІ у дитини є кількість епізодів захворювання: 8 або більше на рік (S.S. Kilic et al., 2004).
Виділяють 3 основні клінічні типи ГРІ (соматичний, отоларингологічний та змішаний) для надання конкретних рекомендацій щодо подальшого диспансерного нагляду. Соматичний тип характеризується високою кратністю гострих захворювань (≥8 разів протягом року), які мають тяжкий перебіг із вираженою інтоксикацією, високою температурою тіла (39-40 °C), частим розвитком ускладнень у вигляді бронхіту і пневмонії та тривалим затяжним кашлем у період реконвалесценції з можливим подальшим розвитком бронхообструктивного синдрому. Отоларингологічний тип не супроводжується вираженою лихоманкою, проте характеризується тривалим, затяжним, нерідко хвилеподібним характером захворювання з частим розвитком ускладнень у вигляді отиту, синуситу та схильністю до затяжного риніту в період реконвалесценції. Змішаний тип – найтяжчий, для нього характерні клінічні особливості двох попередніх клінічних типів (Л.В. Квашніна, 2020).
У дітей із РРІ слід виключити первинний імунний дефіцит, про який може свідчити наявність ≥6 нових інфекцій протягом 12 міс., ≥2 випадків тяжкого сепсису або пневмонії за рік, ≥2 епізодів сепсису або менінгіту, ≥2 міс. прийому антибіотиків із незначним терапевтичним ефектом, відсутність динаміки набору маси тіла і росту, резистентного кандидозу порожнини рота, рецидивних абсцесів, ран, що погано загоюються, опортуністичних інфекцій, ускладнень після вакцинації живими вакцинами, лімфопенії у дітей раннього віку (Е.Н. Охотникова и др., 2013).
Серед бактеріальних збудників, що викликають ГРІ, провідне місце посідають Streptococcus pneumoniae, Haemophilus influenzae, Streptococcus piogenis, Staphylococcus aureus. Вірусні інфекції є етіологічним фактором ГРІ у 65-90% випадків (Л.В. Квашніна, 2020). Шкідлива дія вірусів реалізується не тільки шляхом дії на слизову оболонку дихальних шляхів, а й опосередковано, за рахунок впливу на імунну систему через різні механізми імуносупресії, що сприяє зниженню резистентності організму до дії інших патогенів. Зниження імунітету на тлі персистенції вірусів провокує розвиток бактеріальної інфекції. Крім того, віруси не тільки знижують бар’єрну функцію слизових оболонок, але й володіють алергенним ефектом, тобто вірусна інфекція є тригером розвитку у дітей респіраторних захворювань. Однак завдяки профілактичним заходам можна розірвати замкнене коло мікробної інфекції, рецидивуючого запалення слизових оболонок респіраторного тракту, взаємодії між мікроорганізмами навколишнього середовища і макроорганізмом господаря, а також порушеннями імунної відповіді (J. Bousquet et al., 2005).
У пацієнтів із РРІ корекцію вторинного імунодефіциту проводять за допомогою імунонутрієнтів (вітамінів, омега-3 поліненасичених жирних кислот, мікроелементів) та пробіотиків, що сприяють дозріванню та нормальному функціонуванню клітин імунної системи (Л.А. Щеплигина и др., 2009). Сьогодні особливу увагу приділяють вивченню вітаміну D, який забезпечує підтримку антибактеріального та противірусного імунітету через вплив на усі ланки імунної відповіді (Л.В. Квашніна, 2013). У дослідженні D.J. Berry (2011) за участю 6789 учасників було показано чіткий взаємозв’язок між рівнем вітаміну D3 та рівнем захворюваності на ГРВІ (рис. 1).
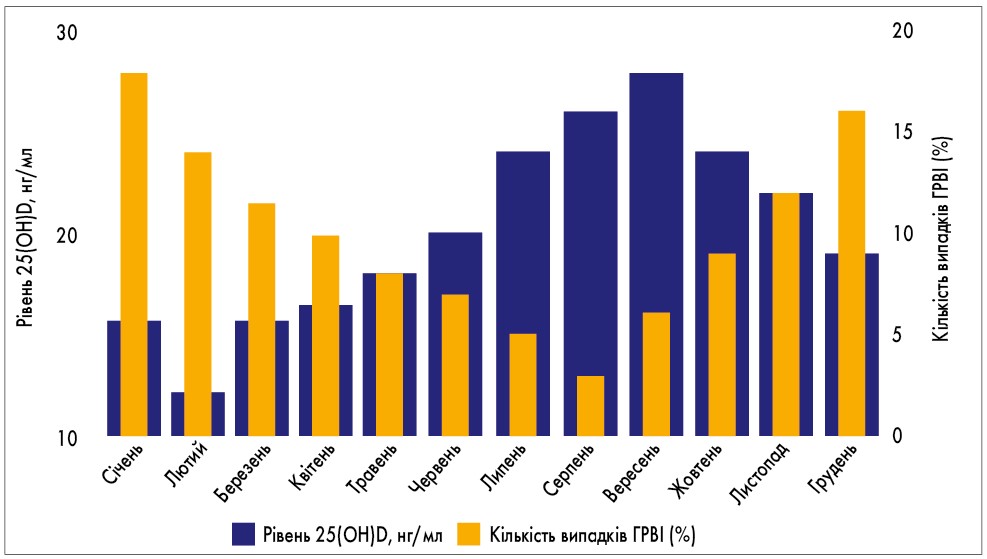 Рис. 1. Зв’язок між рівнем вітаміну D3 та рівнем захворюваності на ГРВІ
Рис. 1. Зв’язок між рівнем вітаміну D3 та рівнем захворюваності на ГРВІ
О.Б. Романцова та співавт. (2017) наводять дані про те, що недостатність 25-гідроксихолекальциферолу (25(OH)D) відмічалася у 43,3% здорових дітей. У тих дітей, яких умовно можна назвати такими, що часто та довго хворіють (ЧДХ), недостатність 25(OH)D була виявлена у 53,3% випадків, а дефіцит – у 43,4%. У групі ЧДХ дітей, які хворіли на ГРІ до 6-7 разів на рік, у 93,4% дітей відмічався дефіцит 25(OH)D, а у 6,6% – його недостатність. При цьому при корекції рівня вітаміну D та нормалізації рівня 25(OH)D у крові кількість епізодів ГРІ у групі ЧДХ із дефіцитом вітаміну D3 зменшилася в 2 рази.
Згідно з даними метааналізу 25 рандомізованих контрольованих досліджень за участю 10 933 осіб, на тлі щоденного прийому вітаміну D3 у дозі 1000-2000 МО/добу на 42% зменшилася кількість випадків ГРВІ, на 16% – потреба у призначенні антибіотиків, на 13% –кількість пропущених днів у навчальному закладі з приводу захворювання та на 17% – кількість випадків госпіталізації через ускладнення з приводу ГРВІ. Таким чином, щоденний прийом вітаміну D3 у дозі 1000-2000 MO зменшує кількість епізодів ГРВІ та частоту розвитку ускладнень (A.R. Martineau et al., 2017). Крім того, протягом 6 міс. спостереження було встановлено, що при рівні 25(OH)D<16 нг/мл кількість пропущених днів у навчальному закладі через захворювання на ГРІ складала 4 дні, у той час як при рівні 25(OH)D>16 нг/мл – 2 дні. Тобто число пропущених днів через захворювання на ГРІ при підвищенні рівня 25(OH)D у крові зменшилося у 2 рази (I. Laaksi et al., 2007). Згідно з даними M. Urashima та співавт. (2010), прийом вітаміну D3 під час епідемії грипу зменшує ризик захворіти на грип A в 1,7 раза та частоту випадків госпіталізації в 3 рази. Крім того, швидше одужували хворі на грип, які приймали вітамін D у дозі 1200 MO, ніж учасники, які приймали 400 MO вітаміну D (J. Zhou et al., 2018).
Нещодавнє дослідження значення рівня вітаміну D у пацієнтів із COVID-19 показало, що зі 172 хворих на коронавірусну інфекцію дефіцит вітаміну D був у 68%, недостатність – у 27,9% учасників та тільки у 4,1% учасників відзначався його нормальний рівень. При цьому в пацієнтів, які померли, дефіцит вітаміну D був визначений у 77% випадків, а недостатність – у 22,9%. Тож можна зробити висновок, що у хворих на COVID-19 із дефіцитом вітаміну D3 ризик тяжкого перебігу та смерті є вищим, ніж у пацієнтів без дефіциту (T.A. Rodriguez et al., 2020; рис.2).
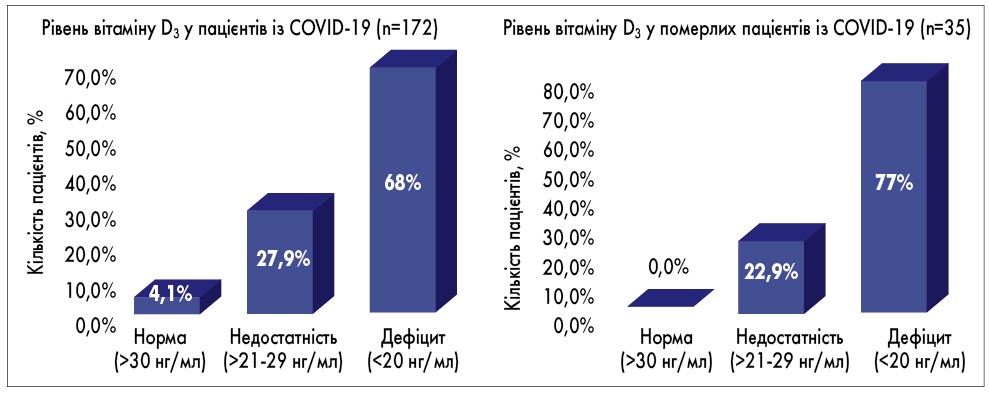 Рис. 2. Порівняння рівнів вітаміну D3 у пацієнтів із COVID-19 та у померлих пацієнтів
Рис. 2. Порівняння рівнів вітаміну D3 у пацієнтів із COVID-19 та у померлих пацієнтів
Сьогодні в Україні реєструють дефіцит вітаміну D3 у 35% малюків віком від 0 до 6 місяців, у 20% дітей віком від 6-12 міс., у 45% осіб на другому році життя, у 62% дітей на третьому році та у 81,9% дорослих (В.В. Поворознюк, 2013). Альтернативним варіантом корекції рівня вітаміну D є забезпечення його потреби за рахунок перебування на сонці, вживання їжі з високим вмістом вітаміну та його застосування у лікарських формах. Однак реалії сьогодення свідчать про те, що у переважної більшості людей відмічається дефіцит вітаміну D через те, що вони отримують тільки невелику його частку під час перебування на сонці та з їжею і не поповнюють його нестачу через додатковий прийом вітаміну D у лікарських формах (Л. Стрільчук, 2018).
Існують декілька видів вітаміну D, які розрізняються за хімічною структурою та формою випуску. Зокрема, масляний розчин ергокальциферолу (вітаміну D2) майже не використовується. Частіше застосовують холекальциферол (вітамін D3), при його прийомі у формі масляного розчину в пацієнтів із захворюваннями шлунково-кишкового тракту (ШКТ) може відмічатися зниження біодоступності засобу, у той час як при використанні водної форми засобу міцельована форма розчину всмоктується незалежно від стану ШКТ чи прийому їжі. Альфакальцидол – активна форма вітаміну D для пацієнтів із порушенням стану нирок, тому його слід приймати тільки під наглядом лікаря через можливий розвиток побічних ефектів. Кальцитріол – високоактивна форма вітаміну D, який слід приймати тільки під наглядом лікаря, за умови індивідуального підбору дози для запобігання розвитку гіперкальціємії (О.А. Громова и др., 2015).
Обов’язковим етапом засвоєння жирів є утворення міцел за допомогою ліпази, жовчних кислот та ферментів. Тобто стан ШКТ може впливати на засвоєння жиророзчинних вітамінів, зокрема вітаміну D3. Так, при деяких порушеннях травлення (зокрема при зниженні здатності до міцелювання у кишечнику) може погіршуватися засвоєння вітаміну D (О.А. Громова и др., 2015). На українському фармацевтичному ринку присутня унікальна форма випуску вітаміну D3 на основі наноміцел – Аквадетрим® (компанії «Польфарма»), що містить готову для засвоєння в кишечнику форму, яка не потребує залучення жовчних кислот, одночасного вживання жирної їжі та володіє в 7 разів вищою біодоступністю (О.А. Громова и др., 2015). Крім того, компанією представлена масляна форма вітаміну D3 – препарат Олідетрим, який випускається у формі крапель та капсул з різним дозуванням: по 1000, 2000 та 4000 МО. Дітям від 2 тижнів до 6 років для підвищення ефективності лікування і профілактики захворювань застосовують Аквадетрим® або Олідетрим Кідс по 2-8 крапель на добу, а дітям від 7 років і дорослим застосовують Олідетрим 1000, 2000 або 4000 по 1-2 капсули на добу залежно від дозування.
Ключову роль у підтримці імунної системи відіграє нормальна мікробіота кишечнику, оскільки вона є первинним бар’єром для патогенів та відповідає за передачу імпульсу із кишкового середовища в імунокомпетентні тканини, від яких залежить злагоджена робота дендритних клітин, стан місцевого та загального імунітету. Роль мікробіоти також полягає у знищенні патогенних мікроорганізмів, стимуляції локального імунітету, підвищенні вироблення слизу та секреторних імуноглобулінів (IgA), тобто створенні своєрідного захисту слизової оболонки кишечнику від проникнення патогенів, стимуляції системного імунітету через підвищення кількості T-лімфоцитів, зменшенні вираженості запальних процесів через знижену продукцію запальних ферментів (Y. Belkaid et al., 2014). Кишкова мікробіота бере учать у процесі травлення (розщепленні харчових волокон, обміні жовчних кислот і ферментів), синтезі певних речовин (вітамінів групи B, K, амінокислот, жирних кислот), захисті від інфекцій (підвищує створення імуноглобуліну, інтерферону, посилює фагоцитоз, пригнічує патогенну флору), знешкодженні токсинів (нейтралізації екзо- та ендотоксинів, небезпечних продуктів обміну речовин) та в обмінних процесах (у нейроендокринній регуляції імунітету, нервової та ендокринної систем). Тому порушення мікробіоти негативно відзначається на роботі всього організму.
Порушення мікробіоти кишечнику може проявлятися кишковими симптомами (діарея, запор, метеоризм, відрижка, неприємний присмак у роті, ознаки порушення всмоктування поживних речовин) та позакишковими (підвищена схильність до ГРВІ, дерматоз, прояви/загострення алергії, ознаки інтоксикації, такі як загальна слабкість, відсутність апетиту, безпричинна субфебрильна температура).
Одним із найбільш вивчених штамів, який активізує імунну систему, є Lactobacillus GG. Згідно з даними фінського рандомізованого плацебо-контрольованого дослідження щодо впливу пробіотика з Lactobacillus GG на дозрівання імунної системи малюків, які знаходяться на ранньому штучному вигодовуванні, виявлено, що у групі дітей, яким додатково призначали пробіотик, спостерігалося збільшення кількості клітин, які виробляють IgA, та зміни розчинного рецептора CD14 (S. Rautava et al., 2006; рис. 3). 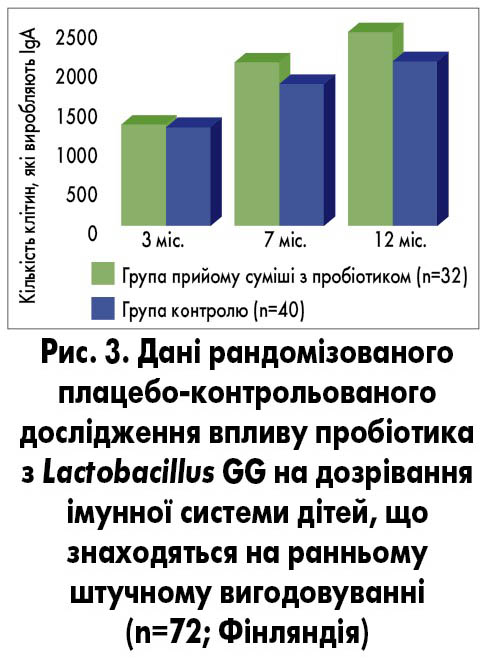
Прийом пробіотика з Lactobacillus GG сприяв зменшенню на 15% кількості днів, пропущених через ГРІ, та на 7% – кількості днів із вираженими симптомами захворювання. Також прийом пробіотика сприяв зменшенню ризику розвитку ускладнень. Зокрема, частота розвитку гострого отиту зменшилася на 22%, гострого синуситу – на 14%, гострого бронхіту – на 10%, а також на 18% зменшилася потреба у прийомі антибіотиків (K. Hatakka et al., 2001). S. Rautava та співавт. (2009) наводять дані про те, що прийом пробіотика з Lactobacillus GG знижував ризик розвитку повторних епізодів ГРІ в 1,96 раза, а отиту – в 1,92 раза.
Синбіотик Ацидолак («Польфарма») містить 4 млрд КУО Lactobacillus rhamnosus GG та фруктоолігосахариди, які активують ріст нормальної мікробіоти кишечнику. Цей засіб може застосовуватися у в дорослих та дітей. Рекомендовано приймати Ацидолак по 1-2 саше на добу протягом 2-3 тижнів.
Таким чином, із метою підвищення ефективності лікування ГРІ та профілактики їх повторних епізодів комплексне поєднання вітаміну D3 (Аквадетрим® чи Олідетрим) та синбіотика (Ацидолак) є оптимальним способом підвищення захисних сил організму дітей із РРІ.
Підготувала Ірина Неміш
Тематичний номер «Педіатрія» № 2 (58) 2021 р.



