22 жовтня, 2021
Нестероїдні протизапальні препарати: докази ефективності, факти, міфи
Терапія болю є одним із першочергових завдань медичної допомоги і посідає важливе місце в роботі лікарів багатьох спеціальностей. У червні в Одесі відбулася науково-практична конференція «НЕПіКа: неврологія, ендокринологія, психіатрія і кардіологія». Єлизавета Давидівна Єгудіна, д. мед. н., професорка, лікарка-ревматологиня МЦ «Клініка сучасної ревматології» (м. Київ), на основі особистого досвіду, даних наукових аналізів та світових досліджень озвучила рекомендації щодо безпеки застосування нестероїдних протизапальних препаратів (НПЗП) і розвіяла міфи, пов’язані з цими ліками.
 Біль – прояв гострих захворювань, травм і хронічних патологій, що істотно знижує якість життя, працездатність і соціальну активність пацієнтів. Найпотужнішим інструментом анальгетичної терапії є НПЗП. Препарати цієї групи мають відомий механізм дії, доведену ефективність, зручні у застосуванні й доступні. При деяких хронічних ревматичних захворюваннях НПЗП відіграють роль патогенетичних засобів, зупиняючи прогресування хвороби. Адже пацієнти з ускладненими ревматичними патологіями приймають їх роками. У разі призначення НПЗП лікар має звертати увагу на моніторинг їх побічних дій.
Біль – прояв гострих захворювань, травм і хронічних патологій, що істотно знижує якість життя, працездатність і соціальну активність пацієнтів. Найпотужнішим інструментом анальгетичної терапії є НПЗП. Препарати цієї групи мають відомий механізм дії, доведену ефективність, зручні у застосуванні й доступні. При деяких хронічних ревматичних захворюваннях НПЗП відіграють роль патогенетичних засобів, зупиняючи прогресування хвороби. Адже пацієнти з ускладненими ревматичними патологіями приймають їх роками. У разі призначення НПЗП лікар має звертати увагу на моніторинг їх побічних дій.
Класифікація та особливості застосування НПЗП
До традиційних НПЗП відносяться неселективні інгібітори циклооксигенази (ЦОГ-)1 і ЦОГ‑2 диклофенак, індометацин, ібупрофен, кеторолак, кетопрофен та напроксен. Селективні інгібітори ЦОГ‑2, які меншою мірою впливають на ЦОГ‑1, включають лорноксикам, мелоксикам, набуметон і німесулід. Високоселективні інгібітори ЦОГ‑2 (коксиби) практично не діють на ЦОГ‑1 (парекоксиб, рофекоксиб, целекоксиб, еторикоксиб).
Тривалість використання НПЗП передбачає такі аспекти, як:
- короткострокове лікування;
- хронічна терапія – пацієнт приймає НПЗП упродовж принаймні чотирьох тижнів незалежно від регулярності чи дозування;
- постійне лікування – особи зі спондилоартритом;
- лікування на вимогу – хворі на остеоартрит приймають НПЗП, орієнтуючись на ступінь больового синдрому.
Кумулятивна частота побічних ефектів залежить від тривалості застосування НПЗП. При короткостроковому прийманні, наприклад для купірування гострого подагричного нападу, гострого неспецифічного болю у спині, при загостренні остеоартриту, показане призначення препаратів, що мають найбільшу протизапальну та знеболювальну активність. Адже у такому разі тривалість використання НПЗП є найменшою і, відповідно, кількість побічних дій – мінімальною.
Диклофенак як золотий стандарт лікування больового синдрому
Нині диклофенак вважається золотим стандартом у лікуванні больового синдрому, оскільки максимально пригнічує синтез простагландину Е2 (PGE2). Застосування диклофенаку дозволяє знизити рівень PGE2 на 93%, що значно (майже на 20%) ефективніше, ніж аналогічні показники як для селективних інгібіторів ЦОГ‑2 рофекоксибу та мелоксикаму, так і неселективних – ібупрофену й напроксену. Крім того, диклофенак дієвіший, ніж мелоксикам відповідно до клінічних показників.
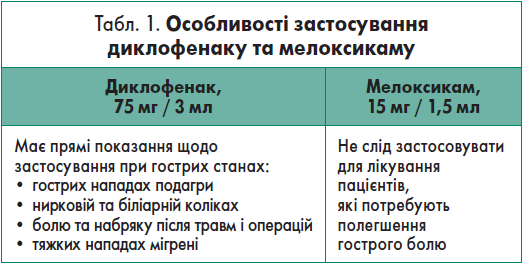
У процесі дослідження MELISSA для зменшення болю пацієнти отримували терапію диклофинаком і мелоксикамом. Учасники групи мелоксикаму на 38% частіше відмовлялися від лікування через його неефективність (80 із 4635 осіб) порівняно з тими, хто використовував диклофенак (48 із 4688 осіб) (Hecken et al., 2000). У таблиці 1 наведене порівняння особливостей застосування диклофенаку та мелоксикаму.
Який же спосіб уведення диклофенаку при купіруванні больового синдрому вважається найбільш ефективним? Було проведено огляд даних 26 рандомізованих контрольованих досліджень (РКД), в яких порівнювали ефект різних методів уведення НПЗП: внутрішньовенного (в/в), внутрішньом’язового (в/м), внутрішньоранового, ректальних свічок та перорального приймання. Показання для призначення НПЗП включали скелетно-м’язові захворювання, післяопераційний біль, ниркову коліку та дисменорею. За отриманими результатами, істотних відмінностей в анальгетичній дії різних лікарських форм НПЗП не спостерігалося. Однак було показано, що в/в використання НПЗП порівняно із пероральним виявилося ефективішим при знеболенні ниркової коліки (Combe et al., 2001).
Слід зазначити, що при інтенсивному гострому болю, як-от травми, хірургічні втручання, ниркова та біліарна коліки, гострий неспецифічний біль у спині й гострий подагричний артрит, швидкість знеболення може мати принципове значення. У цій ситуації перевагу варто віддавати в/в або в/м ін’єкціям НПЗП. Проте таке застосування НПЗП має бути короткостроковим. Після зняття гострого болю можна перейти до використання ректальних свічок чи пероральних форм НПЗП (Motov et al., 2017; Fraquelli et al., 2016).
Порівняння НПЗП та парацетамолу
Оцінка результатів двох однотипних перехресних 12-тижневих досліджень показала, що НПЗП мають значно виразніші знеболювальні властивості, ніж парацетамол чи ібупрофен. Тому 2020 р. у рекомендаціях щодо лікування остеоартриту диклофенак був визнаний найдієвішим препаратом, а парацетамол – менш ефективним зі значною кількістю побічних ефектів.
Сумарна ефективність диклофенаку, оцінена за динамікою індексу виразності остеоартрозу університетів Західного Онтаріо і МакМастер (WOMAC), виявилася приблизно на 40% вищою, ніж парацетамолу (р<0,05). Диклофенак продемонстрував виразніший ефект, ніж парацетамол або ібупрофен для післяопераційної аналгезії у дорослих із видаленням зубів і обробкою глибоких порожнин, оперованих під місцевою анестезією (Gazal, AL-Samadani, 2017).
Основні ускладнення, пов’язані з НПЗП
Необхідність контролю АГ та АТ
За результатами дослідження PRECISION, в якому взяв участь 24 081 пацієнт, тривале застосування НПЗП асоціювалося з відносно низькою частотою розвитку тяжкої артеріальної гіпертензії (АГ), що потребувала госпіталізації. Серед НПЗП, які найчастіше викликали підвищення артеріального тиску (АТ), були ібупрофен, еторикоксиб і рофекоксиб. Під час приймання целекоксибу й напроксену зростання АТ відбувалося вкрай рідко – у 0,3; 0,4 і 0,5% випадків. Збільшення тяжкості АГ було виразнішим у пацієнтів, які отримували інгібітори ангіотензинперетворювального ферменту або блокатори рецепторів ангіотензину ІІ (Nissen et al., 2016).
Враховуючи дані дослідження PRECISION, мультидисциплінарна команда нефрологів, терапевтів, кардіологів, ендокринологів і ревматологів надала рекомендації щодо моніторингу АТ на тлі використання НПЗП:
- Слід вимірювати АТ до початку приймання НПЗП.
- Потрібно повторно вимірювати АТ через чотири тижні після початку застосування НПЗП (або раніше, якщо показано).
- Варто проводити моніторинг АТ у домашніх умовах (ведення щоденника АТ).
- Необхідний самоконтроль затримки рідини за допомогою зважування та перевірки наявності набряку гомілок і стоп.
Приймання НПЗП асоційоване із розвитком серцевої недостатності й атеросклеротичних судинних подій. Ризик особливо зростає на тлі тривалого приймання еторикоксибу, найнижчий – при використанні целекоксибу та напроксену (Bally et al., 2017).
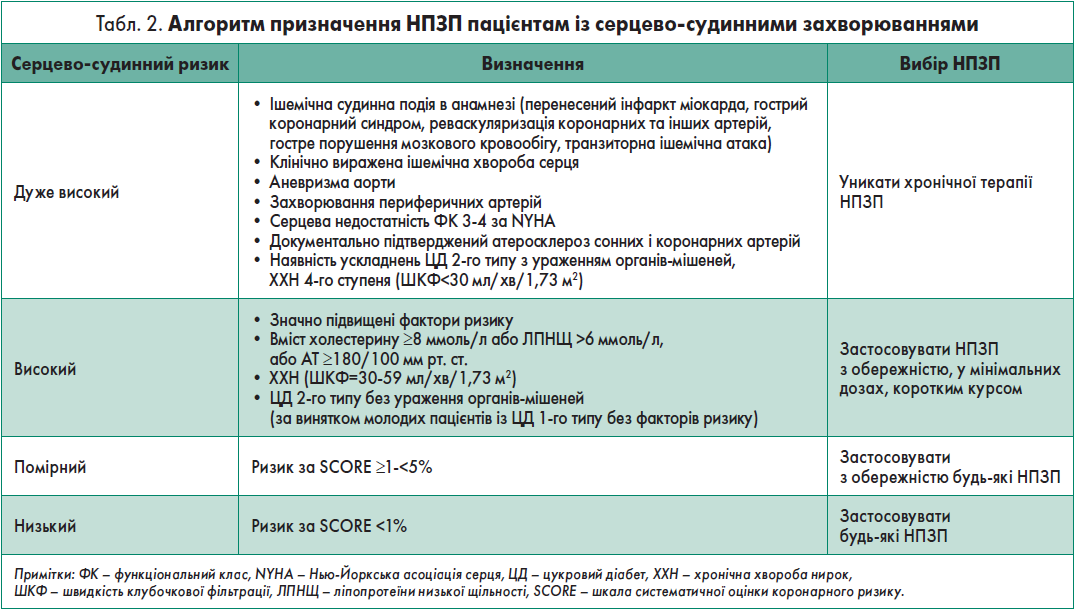
У таблиці 2 наведений алгоритм призначення НПЗП пацієнтам із серцево-судинними захворюваннями.
Адаптовано за S. Cheuk-Chun, 2020
Гастроінтестинальні ризики
Диспепсія – найпоширеніше небажане явище, що виникає у 20‑30% хворих, які регулярно приймають НПЗП. Цей стан не загрожує життю, але істотно впливає на його якість і є основним суб’єктивним критерієм переносимості НПЗП. Через диспепсію більш ніж 10% хворих припиняють застосовувати призначені НПЗП (Mallen et al., 2011).
Рекомендації щодо використання НПЗП у пацієнтів із різними гастроінтестинальними ризиками та їх профілактики:
- Для лікування диспепсії, пов’язаної з прийманням НПЗП, слід використовувати інгібітори протонної помпи (ІПП). Метааналіз даних 30 досліджень показав, що комбінація неселективних НПЗП та ІПП знижує ризик диспепсії на 66%, тоді як приймання лише селективних НПЗП – на 12%. Однак у такій клінічній ситуації не рекомендовано застосовувати антациди або антагоністи Н2-рецепторів. За результатами систематичного огляду шести РКД, ІПП були ефективнішими, ніж антагоністи Н2-рецепторів або антациди для лікування неспецифічної НПЗП-диспепсії (Cheuk-Chun et al., 2020).
- Для профілактики ускладнень з боку верхніх відділів шлунково-кишкового тракту особам із помірним ризиком виразкової хвороби необхідно призначати терапію комбінацією неселективних НПЗП та ІПП або селективних НПЗП. Пацієнтам із високим ризиком розвитку виразкової хвороби рекомендоване сумісне застосування селективних НПЗП та ІПП. За даними S. Cheuk-Chun et al. (2020), кумулятивна частота рецидивних виразкових кровотеч за 18 місяців становила 5,6% у групі целекоксиб + омепразол і 12,3% – напроксен + омепразол.
- Пацієнтам із залізодефіцитною анемією через незрозумілі причини, які потребують призначення НПЗП, рекомендовано використовувати селективні НПЗП та спрямувати їх на консультацію до гастроентеролога. Близько 10‑15% осіб, які тривалий час приймають аспірин чи інші НПЗП, мають залізодефіцитну анемію, імовірно пов’язану з гастроінтестинальною кровотечею легкого ступеня тяжкості (Cheuk-Chun et al., 2020).
Серед факторів ризику розвитку НПЗП-гастропатій варто відзначити такі (Chintse Reumations Data Center, 2017):
- виразковий анамнез;
- наявність в анамнезі шлунково-кишкових кровотеч;
- супутнє приймання препаратів, що впливають на систему згортання крові (зокрема низькодозового аспірину);
- наявність Нelicobacter pylorі й одночасне приймання НПЗП підвищують ризик шлунково-кишкових кровотеч у 6,13 раза;
- ерадикація Н. pylorі дозволяє істотно знизити ризик розвитку НПЗП-гастропатій (після і без неї частота виразок становила 6,4 та 11,8% відповідно);
- похилий вік (>65 років);
- куріння;
- приймання глюкокортикоїдів;
- наявність диспепсії в анамнезі.
Алгоритм призначення НПЗП з метою запобігання гастроінтестинальним ускладненням представлений у таблиці 3.
Гепатотоксичні та нефротоксичні ризики
Усі НПЗП можуть викликати порушення функції печінки. Частота гепатотоксичних реакцій, що супроводжуються клінічно вираженим холестазом або розвитком гострої печінкової недостатності, становить ≤1 випадку на 10 тис. пацієнто-років (Unzueta, Vargas, 2013).
Згідно з результатами європейського епідеміологічного дослідження за участю 400 тис. осіб, які приймали НПЗП, не відзначено істотних відмінностей щодо гепатотоксичності німесуліду та низки інших препаратів цієї групи, таких як диклофенак та ібупрофен, порівняно з іншими НПЗП (Traversa et al., 2003; Donati et al., 2016). У популяційному дослідженні (2010‑2014), яке включало 2232 пацієнтів, науковці прагнули проаналізувати гепатотоксичні ризики (розвиток гострої патології печінки). Було показано, що сумарний ризик для НПЗП становив 1,89%, німесуліду – 2,1%, ібупрофену – 1,92%, диклофенаку – 1,5%, парацетамолу – 2,97% (Traversa et al., 2003; Donati et al., 2016).
Рекомендації щодо використання НПЗП для запобігання їх нефротоксичному впливу (Cheuk-Chun et al., 2020):
- Слід уникати приймання НПЗП пацієнтам із тяжкою хронічною хворобою нирок (ХХН) 4-го та 5-го ступеня.
- У всіх пацієнтів перед початком терапії НПЗП необхідно визначити швидкість клубочкової фільтрації для оцінки функції нирок.
- Потрібно провести моніторинг ниркової функції через один тиждень після початку використання НПЗП.
Таким чином, НПЗП є потужним й ефективним інструментом анальгетичної та протизапальної терапії. Досліджений механізм дії, доведена ефективність, безпека (за дотримання належних рекомендацій), зручність у застосуванні й доступність роблять НПЗП препаратами першої лінії терапії при травмах, хірургічних втручаннях, ниркових та біліарних коліках, болю у спині, артриті та багатьох інших захворюваннях.
Підготувала Людмила Тепла
Тематичний номер «Неврологія, Психіатрія, Психотерапія» № 3 (58) 2021 р.