21 грудня, 2024
Спонтанний інфаркт спинного мозку: сучасні знання та систематичний огляд даних
Спонтанний інфаркт спинного мозку (СІСМ) – це рідкісний стан, що призводить до значних неврологічних порушень. Однак консенсусу щодо діагностичних критеріїв та настанов з лікування СІСМ натепер ще немає, що може створювати труднощі для лікарів. Представляємо до вашої уваги огляд статті M. Gharios et al. «Spontaneous spinal cord infarction: a systematic review» видання BMJ Neurology Open (2024; 6 (1): e000754). У ній наведено дані комплексного систематичного огляду публікацій, присвячених епідеміології, клінічним проявам, факторам ризику, діагностуванню, лікуванню та прогностичним неврологічним наслідкам СІСМ.
СІСМ становить приблизно 6% усіх гострих мієлопатичних синдромів і 1,2% усіх інсультів (Ros Castellо et al., 2021; Kim et al., 2022). СІСМ може виникати або в періопераційному періоді, що пов’язано із патологією аорти та хірургічним втручанням, або як спонтанне захворювання (Rigney et al., 2015; Spencer et al., 2014). Подібно до церебральних інсультів, розвиток СІСМ асоційований із комбінацією судинних факторів ризику, таких як цукровий діабет (ЦД), артеріальна гіпертензія (АГ) та гіперліпідемія (Zalewski et al., 2019). Однак точна етіологія СІСМ залишається нез’ясованою (Elksnis et al., 1991).
Клінічні прояви СІСМ варіюють від тимчасових сенсорних порушень до тяжкої пара- або тетраплегії (Hsu et al., 2019). Проте одним із характерних проявів є гострий сильний біль у спині у ~70% випадків із подальшим швидким розвитком неврологічних дефіцитів (Zalewski et al., 2019; Ros Castellо et al., 2021). До того ж можуть спостерігатися порушення автономних функцій, включно із дисфункцією сечового міхура та кишківника (Rigney et al., 2015; New et al., 2013).
Диференційна діагностика становить серйозну проблему, оскільки симптоматика СІСМ є аналогічною такій за інших неврологічних станів, як-то запальні мієлопатії, розсіяний склероз, новоутворення та інфекційні мієлопатії (Struhal et al., 2011; Rigney et al., 2015). Магнітно-резонансна томографія (МРТ) відіграє важливу роль у діагностичному процесі. N. L. Zalewski et al. (2019) запропонували критерії для діагностування як спонтанного, так і періопераційного СІСМ, що базуються на клінічній картині та результатах радіологічних досліджень і аналізу ліквору.
На даний час немає затверджених протоколів лікування СІСМ. Стратегії ведення пацієнтів відображають підходи, що використовуються при церебральному інсульті. Це, зокрема, антитромбоцитарна терапія, контроль судинних факторів ризику та інтенсивна неврологічна реабілітація (Tubbs et al., 2011).
Хоча СІСМ є рідкісним діагнозом, його наслідки для пацієнта є руйнівними, а обмеженість знань щодо етіології, діагностики та варіантів лікування підкреслюють необхідність подальших досліджень. Тож метою M. Gharios et al. було висвітлити сучасні знання про СІСМ та здійснити систематичний огляд наявних даних.
Матеріали та методи
Пошук публікацій здійснювали в базах даних PubMed, Web of Science і Embase. До аналізу включали дані щодо пацієнтів із СІСМ, незалежно від віку, етнічного походження та статі. Ризик упередженості оцінювали за допомогою шкали Ньюкасла – Оттави (NOS).
Результати
У результаті здійсненого авторами пошуку до систематичного огляду було включено дані 33 досліджень, що охоплювали 440 пацієнтів із СІСМ. Стать була вказана для 406 осіб, серед яких 48% становили чоловіки. Середній вік хворих коливався від 58 до 64 років (Pikija et al., 2022). Інформація про судинні фактори ризику була наявна в 17 дослідженнях, що охоплювали 264 пацієнтів (Artemis et al., 2017). Найчастішим фактором ризику була АГ, виявлена у 40% хворих, далі йшли тютюнокуріння (30%), дисліпідемія (29%) і ЦД (16%), тоді як у 28% не було виявлено судинних факторів ризику.
Дані про клінічні прояви у пацієнтів із СІСМ були представлені в 19 дослідженнях (Stenimahitis et al., 2023; Sechi et al., 2021; Pikija et al., 2022). Найчастіше на момент звернення повідомлялося про такі симптоми: моторний дефіцит (92%), сенсорний дефіцит (85%), автономна дисфункція (76%) та біль (70%).
Про неврологічні функції на момент госпіталізації повідомлялося у восьми дослідженнях за участю 106 пацієнтів (Zalewski et al., 2018; Ashton et al., 2020). Проте для 11 пацієнтів індивідуальні показники за шкалою порушень Американської асоціації травми спинного мозку (ASIA) не були надані, оскільки автори вказали лише, що дев’ять пацієнтів мали бали A, B або C, а двоє – бал D (New et al., 2012). Таким чином, індивідуальні показники за ASIA були надані для 95 осіб. Серед них 18 хворих (19%) мали бал A, 13 (14%) – бал B, 34 (36%) – бал C і 32 (32%) – бал D. Жоден пацієнт не був неврологічно інтактним при надходженні.
Крім того, інформація про час настання найгіршого стану неврологічної функції була знайдена в чотирьох дослідженнях, що охоплювали 182 пацієнтів (Bar et al., 2017; Zalewski et al., 2019; Yadav et al., 2018; Stenimahitis et al., 2023). Серед них у 148 (81%) найгірший стан спостерігався через 12 год, у 20 (11%) – через 12‑24 год, і у 14 (7,7%) – через 24 год.
МРТ використовували для оцінки стану 371 учасника. У 279 пацієнтів були виявлені патологічні дані при першому МРТ-дослідженні. Інформація про час до проведення першої МРТ була надана для 162 хворих. Більшість із них (90%) обстежувалися в перші дні, переважно між першим та другим днями від початку захворювання, меншість (10%) –протягом першого дня після звернення. У 92 пацієнтів результати першої МРТ виявилися нормальними. У 52 із них зображення було отримано протягом перших 24 год після появи симптомів, у двох – після першої доби, а для решти ця інформація не була надана. Для 90 осіб із нормальними первинними даними МРТ через 1,5‑42 доби після госпіталізації було проведено повторну МРТ, і у 83 із них було виявлено патологічні зміни, що відповідали ознакам СІСМ. Лише для 87 учасників були отримані дифузійно-зважені МРТ-зображення (ДЗЗ), на яких виявлені обмеження дифузії у 71 (82%) з обстежених.
Найчастіше ураженими були грудні сегменти хребта (33%), потім – шийні (24%), грудні через поперекові (26%), шийні через грудні (13%), ізольований конус спинного мозку (5%) і шийні через ізольований конус (0,5%).
Дані щодо аналізу ліквору були представлені в 13 дослідженнях за участю 174 пацієнтів (Zalewski et al., 2018; Park et al., 2020; Stenimahitis et al., 2023). Результати виявилися у нормі в 70 (40%) пацієнтів. Підвищений рівень білка в лікворі був найпоширенішим свідченням патології, зафіксованим у 85 (49%) хворих. Олігоклональні смуги були зареєстровані у двох випадках (1%).
Дані щодо стану пацієнтів під час подальшого спостереження були отримані з 20 досліджень (Ashton et al., 2020; Park et al., 2020; Stenimahitis et al., 2023). Узагальнений середній час спостереження, розрахований на основі даних 16 випробувань, що охоплювали 143 пацієнтів, становив 35 місяців (Rigney et al., 2015; Zalewski et al., 2019). Середній час спостереження був представлений у двох дослідженнях і становив від 1 до 1,9 місяців (Artemis et al., 2017; Zalewski et al., 2019). В одному випробуванні за участю шести пацієнтів період спостереження коливався від 15 до 41 тижня (Yadav et al., 2018). Ще в одному дослідженні не було вказано тривалість спостереження (Alblas et al., 2012).
Серед пацієнтів, щодо яких була надана інформація про можливість пересування (n=204), більшість (42%) були здатні самостійно пересуватися, 29% могли це робити за допомогою допоміжних засобів, 29% були залежними від колісного крісла і лише один (0,5%) був прикутий до ліжка. Показники за шкалою ASIA були зафіксовані для 190 хворих: для 21 (11%) бал A, для 6 (3%) бал B, для 31 (16%) бал C, для 129 (67%) бал D і для 4 (2%) бал E. Згідно із даними семи досліджень за участю 29 пацієнтів, 23 з них мали моторний дефіцит під час подальшого спостереження, але конкретні бали за шкалою ASIA не були вказані. У 12 хворих були сенсорні порушення, а 33 мали автономну дисфункцію. Рівень смертності серед учасників був розрахований як 5% (16/297).
До встановлення діагнозу СІСМ найпоширенішим методом лікування була терапія кортикостероїдами. Інші, менш поширені, включали введення внутрішньовенного імуноглобуліну, плазмаферез, тромболізис, застосування азатіоприну, мікофенолату та ритуксимабу. Після встановлення діагнозу СІСМ 193 пацієнтам було призначено антитромбоцитарну терапію, 12 отримували антикоагулянти, а двом було здійснено тромболізис.
У двох дослідженнях було виявлено, що молодший вік на момент початку захворювання був предиктором несприятливих результатів (Zalewski et al., 2018; Cheng et al., 2008). У першому випробуванні молодший вік (<55 років) статистично значуще корелював із поганим моторним відновленням (Cheng et al., 2008). У другому пацієнти, прикуті до ліжка на момент виписки, частіше були молодшими (середній вік – 57 років), ніж особи з іншими функціональними станами (змушені користуватися колісним кріслом, здатні ходити зі сторонньою допомогою і самостійно пересуватися – середній вік був 63 роки) (Zalewski et al., 2018). У двох інших дослідженнях вік не був пов’язаний із рівнем смертності (New et al., 2013; Stenimahitis et al., 2023).
У трьох випробуваннях порівнювали результати в осіб із СІСМ різної етіології та не виявили статистично значущої різниці в рівнях виживання через 1 та 5 років (New et al., 2013; Bar et al., 2017; Stenimahitis et al., 2023). Пацієнти з СІСМ, не пов’язаним із хірургічним втручанням, мали кращі результати (з поліпшеними показниками за ASIA) та частіше відновлювали здатність ходити при подальшому спостереженні, ніж такі з періопераційним СІСМ (Stenimahitis et al., 2023). У педіатричній когорті моторне відновлення було кращим при ідіопатичному СІСМ (Bar et al., 2017). У цьому ж випробуванні СІСМ частіше виникав внаслідок ураження передньої частини спинного мозку порівняно з іншими етіологіями (Bar et al., 2017).
В одному дослідженні, в межах якого аналізували локалізацію ураження за даними МРТ і результати для пацієнтів із СІСМ, ураження шийного відділу із синдромом ураження передніх корінців спинного мозку асоціювалися з кращими результатами порівняно з ураженнями на кількох рівнях (Zalewski et al., 2018). В іншому ж не було виявлено зв’язку між рівнем ураження і виживанням (New et al., 2013). Іншими предикторами несприятливих результатів були гіперліпідемія та сильна початкова слабкість за шкалою оцінки сили м’язів Британської ради медичних досліджень (MRCS) ≤2, що корелювало із поганими результатами. Інші судинні фактори ризику (як-от ЦД, АГ, серцево-судинні/аортальні захворювання та попередній церебральний інсульт) і дисфункція сечового міхура не чинили статистично значущого впливу (Cheng et al., 2008).
У двох дослідженнях порівнювали клінічні, візуалізаційні та електрофізіологічні дані пацієнтів із СІСМ та осіб, у яких було діагностовано гострий поперечний мієліт (Sechi et al., 2021; Park et al., 2020). Було продемонстровано, що хворі на СІСМ мали значно вищий рівень нейрофіламентів легких ланцюгів у сироватці крові, тривалішу латентність соматосенсорних викликаних потенціалів від великогомілкових нервів і меншу довжину ураження на МРТ. Автори досліджень запропонували використання нових інструментів для полегшення діагностування СІСМ. Е. Sechi et al. (2021) показали, що СІСМ можна точно відрізнити від гострого мієліту за співвідношенням рівня нейрофіламентів легких ланцюгів і найбільшої сагітальної площі ураження на МРТ. D. Park et al. (2020) запропонували використовувати викликані потенціали як тест для підтвердження правильності діагнозу СІСМ.
Інше дослідження, в якому оцінювали користь даних електрофізіологічних досліджень для прогнозування результатів, показало зв’язок між балом E за ASIA і нормальними моторними викликаними потенціалами. Було виявлено тенденцію до зв’язку між несприятливими результатами (бал за ASIA ≤C) і патологічними результатами щодо моторних викликаних потенціалів, але він не досяг статистичної значущості (Artemis et al., 2017).
Обговорення
Хоча СІСМ становить лише невелику частину мієлопатичних синдромів і ще меншу частину всіх інсультів, його наслідки можуть бути руйнівними. Для поліпшення результатів лікування пацієнтів потрібні зусилля, спрямовані на вдосконалення діагностичних стратегій. У 2019 р. N. L. Zalewski et al. запропонували діагностичні рекомендації для СІСМ. Діагностичні категорії використовуються для визначення якості підтверджувальних знахідок. Таким чином, остаточний діагноз СІСМ базується на типових клінічних ознаках та даних МРТ.
Наразі лікування зосереджене на контролі серцево-судинних факторів ризику, визначених при інсульті. Хоча СІСМ і церебральні інсульти мають багато спільного, вони залишаються різними за своєю природою.
Виявлено дві етіології СІСМ: періопераційний і такий, що трапляється без хірургічного втручання. Періопераційний СІСМ часто виникає як ускладнення судинних операцій, що впливають на кровопостачання спинного мозку. Патофізіологія за решти випадків СІСМ подібна до такої за церебральних інсультів. Оскільки знання про діагностування, лікування та профілактику СІСМ обмежені, M. Gharios et al. ставили мету надати всебічний огляд сучасних знань про спонтанний СІСМ.
Фактори ризику СІСМ
Аналіз даних зведеної когорти пацієнтів із СІСМ показав, що принаймні один судинний фактор ризику був зареєстрований у 72% пацієнтів, причому найпоширенішими виявилися АГ та тютюнокуріння. Належний контроль відомих серцево-судинних факторів ризику, таких як дисліпідемія, ЦД, АГ та тютюнокуріння, є важливим як для первинної, так і для вторинної профілактики інсульту, і, ймовірно, для СІСМ також (Allen et al., 2008; Teo et al., 2021; Arboix, 2015). Однак вплив серцево-судинних факторів ризику на патофізіологію СІСМ ще не до кінця зрозумілий (Wei et al., 2022).
Діагностування СІСМ
Нині МРТ залишається найважливішим інструментом для встановлення діагнозу СІСМ. Характерні діагностичні знахідки на МРТ-зображеннях включають двобічні гіперінтенсивні ураження в передніх рогах (ефект «совиних очей») на поперечних зрізах, гіперінтенсивні «олівцеподібні» зони на сагітальних послідовних зрізах і гіперінтенсивності, що відповідають передній спінальній артерії. Згідно із даним зведеним аналізом, МРТ було здійснено 371 пацієнту, з яких позитивні результати виявлені у 279. Більшість хворих були обстежені протягом 48 год від появи симптомів, і лише 10% – упродовж перших 24 год.
Повідомляється, що чутливість ранніх МРТ-сканів є надзвичайно низькою (Zalewski et al., 2019; Monteiro et al., 1992). До половини отриманих Т2-зважених зображень можуть не виявляти уражень спинного мозку протягом перших 24 год після появи симптомів (Yadav et al., 2018; Zalewski et al., 2019). Зведений аналіз виявив, що чверть початкових сканувань не могли підтвердити остаточний діагноз. У 92% пацієнтів із початково нормальною МРТ-картиною при повторному МРТ-досліджені, здійсненому через 1,5‑42 дні, були виявлені знахідки, що відповідали симптомам СІСМ. Загалом відносно висока позитивна прогностична цінність МРТ у зведеній когорті підкреслює важливість МРТ для діагностування СІСМ. Автори наголошують, що хоча діагностичну цінність ранніх звичайних МРТ-сканів можна поставити під сумнів у цьому контексті, важливо враховувати роль цих сканів для виключення інших диференційних діагнозів, які, ймовірно, потребують іншого невідкладного лікування. Повторні ж сканування можуть дати остаточні результати для підтвердження діагнозу СІСМ.
Відомо, що ДЗЗ є більш чутливими, ніж звичайні МРТ-зображення для виявлення ранніх ішемічних уражень у пацієнтів з інсультом (Thurnher et al., 2006). Аналогічно, ДЗЗ можуть поліпшити діагностичну точність МРТ при СІСМ (Nogueira et al., 2012). Однак кілька анатомічних і фізіологічних аспектів візуалізації спинного мозку ускладнюють використання ДЗЗ у таких випадках. Це гетерогенність структур хребта, варіабельність кровопостачання та пульсуючий рух цереброспінальної рідини і спинного мозку (Cheng et al., 2008; Thurnher et al., 2006). Незалежно від цього використання ДЗЗ може бути корисним при встановленні остаточного діагнозу СІСМ та полегшити виключення інших диференційних діагнозів.
Лікування пацієнтів зі СІСМ
Здійснений M. Gharios et al. систематичний огляд показав, що 41% пацієнтів отримували лікування кортикостероїдами на підставі клінічної підозри на мієліт до встановлення остаточного діагнозу СІСМ. Доцільність використання кортикостероїдів для лікування СІСМ із метою зменшення оксидативного стресу не підтверджено достатніми доказами і здебільшого базується на даних окремих звітів про клінічні випадки (Shah et al., 2013; Focke et al., 2021). Кортикостероїди можуть чинити серйозні побічні ефекти, тому їх застосування слід обмежити до встановлення остаточного діагнозу. Подібним чином, внутрішньовенний тромболізис був здійснений лише невеликій кількості пацієнтів, що не дозволяє зробити остаточні висновки щодо ефективності цього варіанта лікування (Focke et al., 2021).
Дані про підходи до лікування після встановлення остаточного діагнозу СІСМ свідчать, що антитромбоцитарну терапію призначали в більшості випадків (93%). Антикоагулянти застосовували в обмеженій кількості випадків (6%), а тромболізис – у двох випадках (1%). Проте ефективність цих методів лікування для запобігання подальшому погіршенню стану невідома через брак контрольованих досліджень. Такі стратегії, як підвищення середнього показника артеріального тиску та дренаж ліквору, спрямовані на поліпшення перфузії спинного мозку, використовувалися для пацієнтів із періопераційним СІСМ, але їх роль для лікування решти осіб із СІСМ досі погано досліджена (Pelser et al., 1993).
Неврологічне відновлення та можливість пересування
Відновлення після травми спинного мозку є складним процесом, за якого належні підтримка та ведення пацієнта мають першочергове значення. Слід враховувати як фізичні, так і психологічні аспекти. Складність реабілітації спинного мозку та значна потреба в індивідуальному підході свідчать про необхідність залучення спеціалізованих медичних працівників. Доступні дані досліджень підкреслюють важливість контролю вторинних ускладнень та застосування підходу, спрямованого на сприяння реінтеграції пацієнта в суспільство (Scivoletto et al., 2006; Kwon et al., 2019). Реабілітацію слід починати якомога раніше після стабілізації гострого стану, хоча навіть відстрочена реабілітація може сприяти значному поліпшенню стану та неврологічному відновленню (Shah et al., 2013).
Неврологічна функція частково відновлюється протягом періоду реабілітації після СІСМ, і потенціал для відновлення є більшим у випадках спонтанного СІСМ порівняно із періопераційним (Weidauer et al., 2002; Zalewski et al., 2019; Robertson et al., 2012). Відповідно до зведеного аналізу, кількість пацієнтів із симптомами тяжкого ураження спинного мозку, що мають показники A або B за ASIA, зменшилася на 18% під час спостереження. Частка осіб із легкими дефіцитами (показники C або D за ASIA) збільшилася на 38% після періоду спостереження із середньою тривалістю 35 місяців, а чотири пацієнти мали повне неврологічне відновлення (показник E за ASIA).
Зведений аналіз даних показав, що 71% хворих змогли ходити із допоміжними засобами або без них після періоду спостереження середньої тривалості 35 місяців. Частота відновлення здатності до ходьби відрізняється у різних дослідженнях і, ймовірно, відображає різні співвідношення випадків спонтанних та періопераційних СІСМ (New et al., 2013; Robertson et al., 2012). Спонтанні СІСМ були пов’язані з більшим потенціалом для відновлення здатності ходити порівняно із випадками пері операційного СІСМ (New et al., 2013).
Смертність при СІСМ
Протягом середнього періоду спостереження, що становив 2,5 роки, смертність оцінювалася в 5%. Цей показник значно нижчий за попередні оцінки, які становили 22‑23% у змішаних когортах осіб зі спонтанними та періопераційними випадками СІСМ (Nedeltchev et al., 2004; Hanson et al., 2015). Відповідно до зведених даних, К. Nedeltchev et al. (2004) повідомляли про рівень смертності 9% у змішаній когорті, де лише в 16% пацієнтів були випадки періопераційного СІСМ. Ці дані свідчать, що спонтанний СІСМ пов’язаний із нижчою смертністю та кращими результатами порівняно з періопераційним СІСМ, і важливість довгострокових стратегій залишається значною (Stenimahitis et al., 2023).
Висновки та перспективи майбутніх досліджень
СІСМ – це рідкісне і часто неправильно діагностоване захворювання. Багато можливих діагностичних альтернатив та брак діагностичних настанов і протоколів лікування спонукають до подальших досліджень. Діагностичні критерії для СІСМ, як-от запропоновані N. L. Zalewski et al. (2019), мають бути інтегровані в структуровані рекомендації щодо ведення пацієнтів із гострою мієлопатією (рисунок). Систематичне та єдине визначення і підхід до ведення осіб із СІСМ створили б основу для докладання подальших клінічних та наукових зусиль. Наразі лікування обмежується заходами вторинної профілактики. Краще розуміння патологічних механізмів, що передують СІСМ, може дозволити ідентифікувати та лікувати осіб, які перебувають у зоні ризику. Подальші дослідження щодо ролі серцево-судинних факторів ризику є вкрай необхідними.
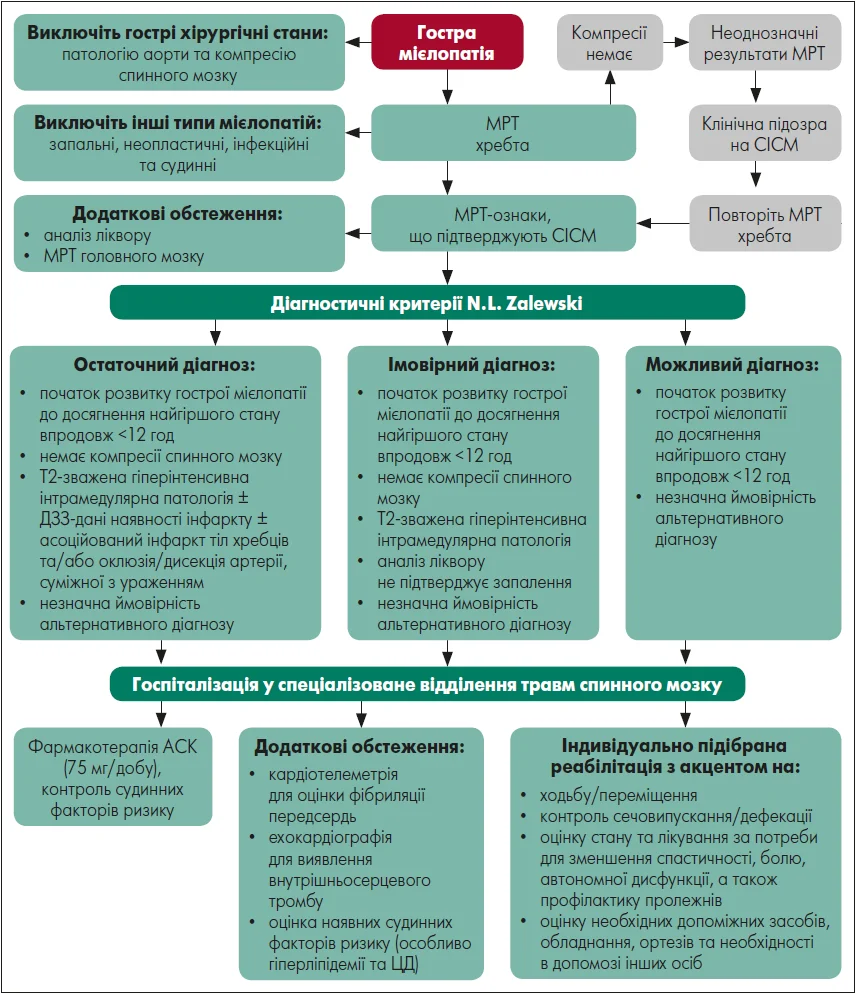 Примітки: АСК – ацетилсаліцилова кислота.
Примітки: АСК – ацетилсаліцилова кислота.
Рисунок. Алгоритм ведення пацієнтів із гострою мієлопатією
Адаптовано за N. L. Zalewski et al. (2019)
Після розвитку СІСМ рекомендовано застосовувати фармакотерапію інгібіторами агрегації тромбоцитів, однак їх ефективність залишається не до кінця з’ясованою. Виявлено лише чотири випадки застосування тромболізису. Труднощі у швидкому встановленні остаточного діагнозу можуть частково пояснювати, чому тромболізис використовується так рідко. Проте можливість прямого впливу на провокувальний чинник розвитку СІСМ залишається привабливою, тож потрібні подальші дослідження в цьому напрямі. У випадках церебрального інсульту рекомендоване використання нейропротекторних засобів, але досліджень щодо їх застосування при СІСМ бракує (Mehta et al., 2019). Аналогічно, модифікація імунної відповіді може відігравати певну роль у майбутніх схемах лікування (Salvador de la Barrera et al., 2001).
Відносно високий потенціал функціонального відновлення, включно із можливістю самостійного пересування, підкреслює необхідність застосування спеціалізованих мультидисциплінарних реабілітаційних послуг, здатних забезпечувати довготривале ведення пацієнтів із СІСМ (Stenimahitis et al., 2023).
Підготувала Ірина Климась
Тематичний номер «Неврологія. Психіатрія. Психотерапія» № 4 (71) 2024 р.



