31 березня, 2023
Ефективність комбінації іксазомібу, леналідоміду та дексаметазону в лікуванні рецидивуючої множинної мієломи
За результатами рандомізованого плацебо-контрольованого дослідження ІІІ фази TOURMALINE-MM1
Іксазоміб – новий селективний інгібітор протеасоми (ІП) 20S, який зв’язується з її субодиницею β5, що має хімотрипсиноподібну активність. У дослідженнях in vitro показано, що іксазоміб запускає апоптоз як по внутрішньому (каспаза-9), так і по зовнішньому (каспаза-8) сигнальних шляхах через активацію проапоптотичних білкових систем р53-р21, індукує стрес ендоплазматичного ретикулуму та ядерний фактор каппа В (NF-kB). Імуномодулюючий агент леналідомід успішно застосовується як підтримуюча терапія на всіх етапах лікування множинної мієломи (ММ). Дексаметазон потенціює дію більшості протимієломних препаратів, індукує апоптоз пухлинних клітин через фактори транскрипції NF-kB та активуючого білка АР-1 і тому включений майже у всі схеми терапії ММ.
Іксазоміб – перший препарат для перорального прийому, який у комбінації з леналідомідом і дексаметазоном рекомендується для лікування ММ. У дослідженні вивчена комбінація іксазомібу з леналідомідом і дексаметазоном у пацієнтів з рецидивуючою ММ. Показано, що застосування комбінації забезпечує 35% виживаність без прогресування (ВБП; відношення ризиків – ВР – 0,54; р=0,012). Медіана виживаності у пацієнтів з високим цитогенетичним ризиком поліпшувалася та становила 21,4 проти 9,7 міс у контрольній групі (ВР 0,74; р=0,021), а у підгрупі пацієнтів зі стандартним ризиком – 20,6 проти 15,6 міс (ВР 0,64; р=0,007). Поєднання іксазомібу з леналідомідом і дексаметазоном супроводжувалося мінімальною додатковою токсичністю. Найпоширенішими небажаними явищами ≥3 ступеня в групі іксазомібу були шлунково-кишкові порушення, висип і тромбоцитопенія.
У подвійне сліпе плацебо-контрольоване дослідження ІІІ фази TOURMALINE-MM1 включали пацієнтів із рецидивуючою, рефрактерною або рецидивуючою та рефрактерною ММ для перорального прийому комбінації іксазоміб + леналідомід + дексаметазон (група іксазомібу) або плацебо + леналідомід + дексаметазон (група плацебо). Первинною кінцевою точкою була ВБП.
Результати лікування ММ за останні 15 років значно покращилися завдяки впровадженню ІП та імуномодулюючих препаратів [1, 2] як основи терапії ММ [3]. Результати дослідження ІІІ фази з використанням трикомпонентної комбінації показали її кращу ефективність як першої лінії терапії [4-6] та при рецидиві захворювання [7, 8], ніж двокомпонентних схем. Крім того, спостерігається оптимізація протоколів лікування ММ у бік розширеної терапії для подальшого поліпшення довгострокових результатів [9]. Це зумовлює необхідність пошуку додаткових ефективних препаратів із прийнятними профілями безпеки, які дозволять пацієнтам отримувати терапію протягом тривалого часу.
Іксазоміб належать до класу пероральних ІП та є пептидом борної кислоти. За хімічною структурою та фармакологічними властивостями відрізняється від бортезомібу [10, 11]. У доклінічних дослідженнях показано, що іксазоміб діє синергічно з леналідомідом [12]. У дослідженні іксазомібу на ранній фазі препарат призначався перорально один раз на тиждень у комбінації з леналідомідом і дексаметазоном пацієнтам із раніше не лікованою ММ. Продемонстрована обнадійлива ефективність комбінації (58% оцінених пацієнтів мали повну відповідь або дуже хорошу часткову відповідь) та керовані побічні явища (ПЯ), які включали периферичну нейропатію. За результатами цього дослідження лікування можна продовжувати більше 4 років [13, 14].
Результати ранньої фази клінічних досліджень надали обґрунтування для проведення ІІІ фази рандомізованого подвійного сліпого плацебо-контрольованого дослідження TOURMALINE-MM1. У ньому порівнювали ефективність і безпеку комбінації іксазоміб (вводився щотижня) + леналідомід + дексаметазон та плацебо + леналідомід + дексаметазон у пацієнтів із рецидивуючою, рефрактерною або рецидивуючою та рефрактерною ММ.
Пацієнти
Усього в дослідженні з 28 серпня 2012 по 27 травня 2014 р. було зареєстровано 722 дорослих пацієнти із 147 центрів у 26 країнах світу, що мали рецидивуючу, рефрактерну або рецидивуючу та рефрактерну ММ.
Дизайн дослідження
Пацієнтам у 28-денних циклах рандомізовано призначали пероральний прийом іксазомібу 4 мг або відповідного плацебо у 1-й, 8 та 15-й день. Крім того, всі пацієнти отримували перорально леналідомід у дозі 25 мг у 1-21-й дні (10 мг для пацієнтів з кліренсом креатиніну <60 або <50 мл на 1,73 м2) і дексаметазон 40 мг у 1-й, 8, 15 і 22-й дні. Рандомізацію здійснювали відповідно до кількості попередніх курсів терапії (1 проти 2 або 3), відносно попереднього впливу ІП (не отримували чи отримували лікування) та стадії захворювання за Міжнародною системою стадіювання (I або II проти III, з більш пізніми стадіями, що вказували на запущене захворювання).
Лікування продовжували до прогресування ММ або розвитку непереносних токсичних ефектів. Тромбопрофілактика була необхідна всім пацієнтам (97% пацієнтів групи іксазомібу і 98% пацієнтів групи плацебо отримували відповідні препарати), а також дозволене супутнє лікування. Дозволялося коригувати дозу, що викликала токсичну дію, відповідно до встановлених рекомендацій, зазначених у протоколі, або згідно з інструкцією для застосування кожного досліджуваного препарату.
Основною кінцевою точкою була ВБП, яка визначалася як час від дати рандомізації до дати першої документації прогресування захворювання або смерті з будь-якої причини за оцінкою незалежного контрольного комітету, члени якого не знали про завдання дослідницької групи. Попередньо визначеними ключовими вторинними кінцевими точками були загальна виживаність (ЗВ) у групі досліджуваного лікування та ЗВ у пацієнтів з делецією хромосоми 17p (del(17p)). Інші вторинні кінцеві точки включали загальну швидкість відповіді, швидкість повної відповіді, дуже хорошу часткову відповідь, тривалість відповіді, час прогресування захворювання, ВБП у пацієнтів із високим ризиком цитогенетичних аномалій, безпеку та зміну загального стану здоров’я.
Дослідження проводилося відповідно до рекомендацій Міжнародної конференції з гармонізації належної клінічної практики та відповідних нормативних вимог. Всі пацієнти надали письмову інформовану згоду.
Відповіді в дослідженні оцінювали кожного циклу до прогресування захворювання на підставі результатів центральної лабораторії, критеріїв Міжнародної робочої групи з мієломи (2011), а також висновків незалежного контрольного комітету, члени якого не знали про завдання дослідницької групи, та оцінки дослідників. Спостерігали всіх пацієнтів за критерієм виживаності після прогресування захворювання (через кожні 12 тижнів до смерті або припинення дослідження). Цитогенетичні аномалії оцінювала центральна лабораторія під час скринінгу. Вони включали високий ризик аномалій, визначений як del(17p), транслокації між хромосомами 4 і 14 [t(4;14)] або 14 і 16 [t(14;16)]. Пов’язану зі здоров’ям якість життя оцінювали на основі анкет пацієнтів, рекомендованих Європейською організацією з вивчення і лікування онкологічних захворювань. Базова анкета якості життя – модуль Questionnaire-Core 30 (EORTC QLQ-C30) і модуль, специфічний для мієломи (EORTC QLQ-MY20).
Виконано статистичний аналіз первинної кінцевої точки ВБП і ключових вторинних кінцевих точок ЗВ і ЗВ у пацієнтів з del(17p) Було заплановано три послідовні проміжні аналізи та остаточний аналіз, скориговані для виявлення 30% різниці в ЗВ (відношення ризиків – ВР – смерті у групі іксазомібу 0,77; р=0,05). Завданням дослідження було виявлення переваги іксазомібу над плацебо стосовно ВБП (ВР 0,74). Проміжний аналіз планувався тоді, коли приблизно у 36% пацієнтів спостерігалася подія (прогресування захворювання або смерть).
Під час першого попередньо визначеного аналізу при середньому спостереженні приблизно 15 міс продемонстровано, що прийом іксазомібу забезпечував значні переваги щодо ВБП порівняно з плацебо. Згідно з протоколом дослідження продовжувалося подвійним сліпим способом. Другий планований аналіз для оцінки ЗВ був проведений при середньому спостереженні приблизно 23 міс.
Результати
Результати цитогенетичного аналізу були доступні для 76% пацієнтів, 19% із яких мали високий ризик цитогенетичних аномалій, у тому числі 10% – del(17p). Істотних відмінностей між двома групами в зазначених характеристиках не спостерігалося. Рефрактерність до будь-якої попередньої терапії ІП була визначена спонсором у сліпому клінічному огляді. Всі пацієнти, за винятком одного пацієнта з групи плацебо, мали рефрактерність до попередньої терапії талідомідом. Основні результати дослідження представлені в таблиці 1. Результати ВБП були послідовні в усіх ключових попередньо визначених підгрупах пацієнтів (рис. 1, 2), включаючи осіб із поганим прогнозом, таких як пацієнти з високим ризиком цитогенетичних порушень, III стадією захворювання, старші 75 років і ті, хто отримував дві або три попередні лінії терапії. Медіана ВБП у пацієнтів із високим ризиком цитогенетичних аномалій (75 пацієнтів у групі іксазомібу та 62 пацієнти в групі плацебо) становила 21,4 та 9,7 міс відповідно (ВР прогресування захворювання або смерті в групі іксазомібу 0,54; 95% довірчий інтервал – ДІ – 0,32-0,92; р=0, 02). Медіана ВБП у пацієнтів з del(17p) (36 пацієнтів у групі іксазомібу та 33 у групі плацебо) становила 21,4 та 9,7 міс відповідно (ВР 0,60; 95% ДІ 0,29-1,24), а у пацієнтів з t(4;14) без del(17p) або t(14;16) (36 пацієнтів у групі іксазомібу та 25 у групі плацебо) – 18,5 та 12,0 міс відповідно (ВР 0,65; 95% ДІ 0,25-1,66).
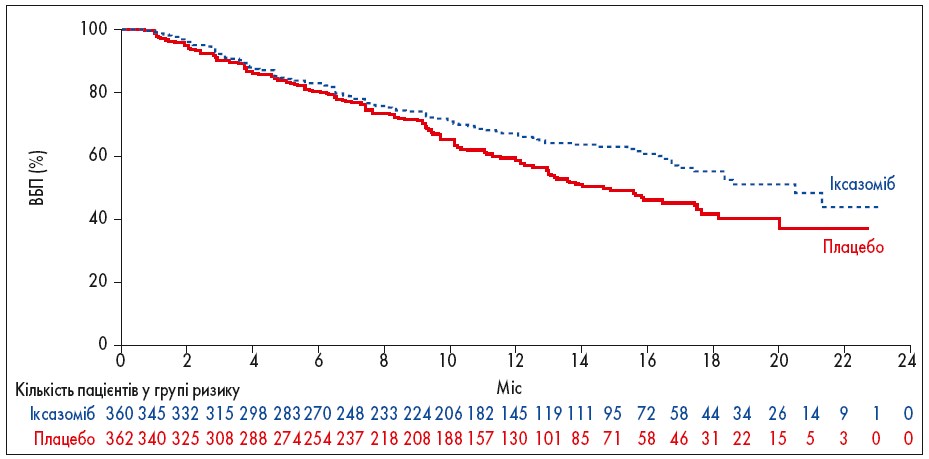 Рис. 1. ВБП в ITT-популяції дослідження TOURMALINE-MM1
Рис. 1. ВБП в ITT-популяції дослідження TOURMALINE-MM1
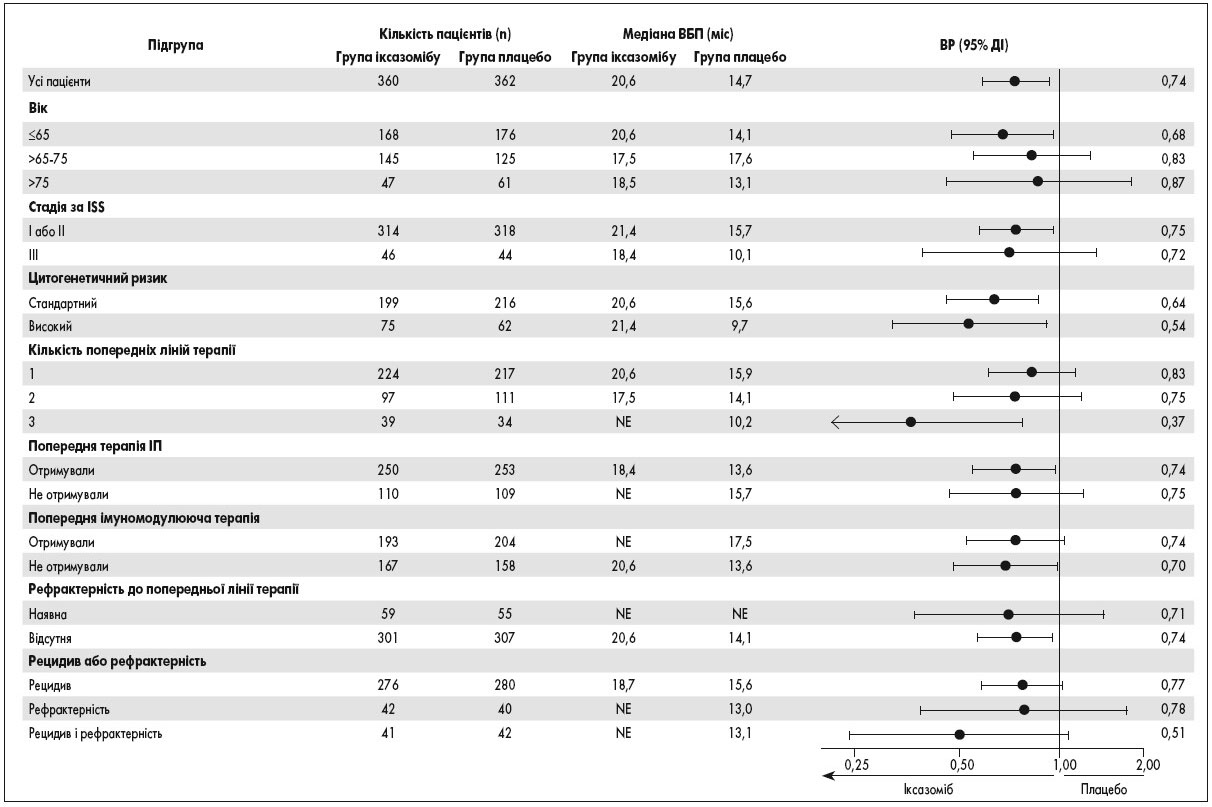
Рис. 2. Результати підгрупового аналізу дослідження TOURMALINE-MM1
ISS (The Multiple Myeloma International Staging System) – Міжнародна система стадіювання ММ; NE – не оцінено.
Загальна частота відповіді становила 78,3% в групі іксазомібу та 71,5% в групі плацебо (p=0,04; табл. 1). Відповідь була швидкою, тривалою та покращувалася при подовженні тривалості лікування (тобто більше пацієнтів мали відповідь, а тип відповіді також покращувався з часом, при цьому збільшувалася частка пацієнтів, які мали дуже хорошу часткову або повну відповідь).
Оскільки ВБП була значно довшою в групі іксазомібу, ніж у групі плацебо, а групи істотно не відрізнялися щодо ЗВ при першому аналізі, подальший аналіз ЗВ проведено 12 липня 2015 р. Медіана спостереження становила 23 міс. Медіана ЗВ ще не була досягнута в жодній із досліджуваних груп. За результатами 23-місячного аналізу зафіксовано 171 випадок смерті (81 у групі іксазомібу та 90 у групі плацебо), що становить 35% від попередньо визначеної кількості смертей, необхідних для остаточного аналізу ЗВ, тому спостереження було подовжено.
Безпека
Профіль безпеки оцінювали в обох аналізах. Профіль безпеки з більшою тривалістю впливу (другий аналіз) відповідав такому з меншою тривалістю впливу (перший аналіз). При 23-місячному аналізі безпеки вибірка включала 361 пацієнта в групі іксазомібу і 359 в групі плацебо. Пацієнти групи іксазомібу отримували досліджувані препарати в середньому 17 циклів, а групи плацебо – 15 циклів (48 і 43% пацієнтів у відповідних досліджуваних групах отримували лікування протягом >18 циклів, а 20 і 19% – упродовж >25 циклів). Призначене лікування було припинено у 62% пацієнтів з групи іксазомібу та у 63% пацієнтів групи плацебо. Основними причинами припинення терапії були прогресування захворювання (у 34% пацієнтів групи іксазомібу і 40% групи плацебо) та ПЯ (у 17 і 14% пацієнтів відповідно). Середня відносна інтенсивність дози леналідоміду та дексаметазону була подібною в обох досліджуваних групах; медіана відносної інтенсивності дози для іксазомібу становила 97,4%, а для плацебо – 98,8%.
Профілі безпеки при 23-місячному аналізі зведені в таблиці 2. Критерії серйозних ПЯ: припинення лікування через ПЯ та смерть під час лікування (зафіксовано через 30 днів після отримання останньої дози досліджуваного препарату або плацебо) були подібними в групах іксазомібу та плацебо.
Тромбоцитопенія як ПЯ терапії, що спостерігалась при застосуванні іксазомібу та леналідоміду з дексаметазоном [14, 17-19], була зареєстрована у 31% пацієнтів групи іксазомібу та у 16% пацієнтів групи плацебо; тромбоцитопенія 3 і 4 ступеня виникала частіше в групі іксазомібу (19%), ніж у групі плацебо (9%). Транзиторне і циклічне зниження кількості тромбоцитів виявляли в обох досліджуваних групах. Схема переливання тромбоцитів була подібною в обох групах (8% у групі іксазомібу та 6% у групі плацебо), як і частота тяжкої тромбоцитопенії (2% у кожній групі) та припинення лікування через тромбоцитопенію (по 1% у кожній групі).
Негематологічні ПЯ, які спостерігалися як при застосуванні іксазомібу, так і леналідоміду з дексаметазоном, включали шлунково-кишкові події та висип [14, 17-19]. Шлунково-кишкові події були більш поширеними в групі іксазомібу, ніж у групі плацебо, але вони виникали переважно протягом перших 3 міс терапії, були нетяжкими та керованими підтримуючою терапією. 22% пацієнтів групи іксазомібу і 19% групи плацебо отримували протидіарейні засоби, а 21 і 13% відповідно – протиблювотні препарати. Усунення діареї включало використання протидіарейних засобів (в першу чергу лопераміду) та коригування дози леналідоміду або іксазомібу. Частота висипу становила >36% в групі іксазомібу і 23% в групі плацебо. Різниця між групами була зумовлена насамперед ПЯ 1 та 2 ступеня. Висип на шкірі виникав переважно в перші 3 міс дослідження і часто не потребував лікування. 21% пацієнтів групи іксазомібу і 12% групи плацебо повідомили, що ПЯ минули без втручання. Лікування висипу включало застосування антигістамінних препаратів (передусім цетиризину) або місцевих кортикостероїдів і корекцію дози для контролю симптомів.
Периферична нейропатія є відомим ПЯ при лікуванні бортезомібом, першим ІП у своєму класі [20]. Частота периферичної нейропатії становила 27% у групі іксазомібу та 22% у групі плацебо. Не зареєстровано тяжкої периферичної нейропатії. Частота периферичної нейропатії з болем становила 4% в групі іксазомібу і 3% в групі плацебо.
Ніяких міжгрупових відмінностей не спостерігалося щодо частоти серцевої недостатності (4% у кожній досліджуваній групі) й аритмій (16% у кожній групі).
Крім того, повідомлялося про аритмію 5 ступеня у двох пацієнтів групи іксазомібу та трьох пацієнтів групи плацебо, а також про тромбоемболію 5 ступеня в одного пацієнта в кожній групі. Гіпотензія 5 ступеня була зареєстрована в одного пацієнта групи іксазомібу; серцева недостатність 5 ступеня зафіксована в одного пацієнта групи іксазомібу і трьох пацієнтів групи плацебо. Інфаркт міокарда 5 ступеня був зареєстрований в одного пацієнта групи іксазомібу та двох пацієнтів групи плацебо.
Проведено ретельний моніторинг появи нової первинної злоякісної пухлини. При 23-місячному аналізі не спостерігалося істотної різниці в частоті цього показника (5% у групі іксазомібу і 4% в групі плацебо). Представлені дані щодо гіпертонічної хвороби (6 і 5% відповідно) й інфаркту міокарда (1 і 2%) у досліджуваних групах не відрізнялися. Аналіз 23-місячних показників EORTC QLQ-C30 та QLQ-MY20 вказував на подібну якість життя, про яку повідомляли пацієнти, у групах іксазомібу та плацебо.
Обговорення
У представленому дослідженні продемонстровано, що у пацієнтів з рецидивуючою, рефрактерною або рецидивуючою та рефрактерною ММ лікування пероральним іксазомібом з леналідомідом і дексаметазоном асоціювалося зі значно довшою ВБП з медіаною тривалості приблизно 6 міс, ніж плацебо з леналідомідом і дексаметазоном. Переваги щодо ЗВ поки не показані. Переваги прийому іксазомібу щодо ВБП спостерігалися послідовно у всіх ключових попередньо визначених підгрупах, у тому числі у пацієнтів з несприятливим прогнозом, таких як пацієнти літнього віку, особи, що отримували дві або три попередні лінії терапії, пацієнти із запущеною стадією захворювання, а також з високим ризиком цитогенетичних порушень, для яких комбінація леналідоміду з дексаметазоном була менш ефективна [22]. Згідно з медіаною ВБП, досліджувана схема прийому іксазомібу може сприяти покращенню прогнозу для пацієнтів із високим ризиком цитогенетичних порушень, які традиційно пов’язані з несприятливим прогнозом, шляхом подовження ВБП до такої межі клінічних проявів, що характерні для пацієнтів зі стандартними цитогенетичними ознаками. Заявлена клінічна користь у цьому дослідженні узгоджується з результатами попередніх звітів (особливо два попередніх дослідження комбінації леналідоміду з дексаметазоном і третім препаратом порівняно з лише леналідомідом і дексаметазоном у пацієнтів з раннім рецидивом ММ [8, 24]), які показали, що трикомпонентні схеми є більш ефективними, ніж двокомпонентні [4-8].
Отримані результати щодо клінічної користі застосування іксазомібу узгоджуються з висновками попередніх звітів, які продемонстрували, що трикомпонентна терапія є ефективнішою порівняно з двокомпонентними режимами лікування рецидивуючої ММ. Однак результати щодо частоти відповіді та медіани ВБП у дослідженнях відрізняються. У представленому дослідженні медіана ВБП становила 20,6 міс у групі іксазомібу та 14,7 міс у групі плацебо; у дослідженні Stewart та співавт. [8] медіана ВБП дорівнювала 26,3 міс у групі, яка отримувала карфілзоміб + леналідомід + дексаметазон, і 17,6 міс у групі, яка приймала лише леналідомід з дексаметазоном. У дослідженні Lonial та співавт. [24] медіана ВБП становила 19,4 міс у групі, яка отримувала елотузумаб + леналідомід + дексаметазон, і 14,9 місяців у групі, що застосовувала лише леналідомід із дексаметазоном. Однак перехресні порівняння вносять розбіжності через відмінності в дизайні, методах дослідження та вибірках пацієнтів (наприклад, відмінності у включенні пацієнтів з порушенням функції нирок, первинним рефрактерним захворюванням і рівнями захворювання). Проте відносна оцінена перевага таких трикомпонентних схем над леналідомідом з дексаметазоном виявилася послідовною з ВР 0,74 (поточне дослідження) та 0,69 [8] і 0,70 [24].
Підвищена увага до безперервної терапії [8, 9, 17, 26, 27] посилила потребу в схемах, які мають прийнятні профілі безпеки, легко вводяться та дозволяють підтримувати задовільну якість життя. Тривалість терапії комбінацією з іксазомібом була значною, майже половина пацієнтів отримували лікування щонайменше 18 циклів згідно з 23-місячним аналізом. Показники дотримання схем прийому іксазомібу та плацебо виявилися високими і були зіставними в обох групах, що узгоджується зі спостережуваними профілями ПЯ. Це свідчить, що схема перорального прийому іксазомібу була простою та зручною для пацієнтів, як і схема плацебо. У цьому подвійному сліпому дослідженні пацієнти групи іксазомібу не повідомляли про негативний вплив лікування на якість життя. Розглядаючи цей висновок у контексті даних про якість життя з інших досліджень, слід зазначити, що існує тенденція до переоцінки користі для якості життя у відкритих дослідженнях [28]. Цей висновок слід також розглядати в контексті обмежень наявних інструментів [29, 30].
Частота серйозних ПЯ, припинення лікування через ПЯ та смерті протягом дослідження була подібною в обох групах. Єдиним ПЯ 3 ступеня або вище, для якого існувала принаймні 5% різниця між групами іксазомібу та плацебо, була тромбоцитопенія, відомий побічний ефект бортезомібу та карфілзомібу [31, 32], явних клінічних наслідків якої не встановлено. Розвиток ПЯ з боку серцево-судинної системи, нирок або дихальних шляхів при використанні іксазомібу не зафіксований. Додавання іксазомібу до леналідоміду та дексаметазону зумовлювало вищу частоту периферичної нейропатії (27% у групі іксазомібу та 22% у групі плацебо), а у 2% пацієнтів у групі іксазомібу відмічені події 3 ступеня (порівняно з 6% пацієнтів, які отримували підшкірно бортезоміб [33], та 3% у пацієнтів, які отримували карфілзоміб [8] в інших дослідженнях). У 2015 році іксазоміб зареєстрований Управлінням з контролю якості харчових продуктів і лікарських препаратів США як перший пероральний ІП та затверджений у комбінації з леналідомідом та дексаметазоном для лікування пацієнтів, що отримали хоча б одну попередню лінію терапії.
Висновки
Додавання іксазомібу до схеми леналідомід + дексаметазон сприяло досягненню значно довшої ВБП у пацієнтів з рецидивуючою, рефрактерною або рецидивуючою та рефрактерною ММ та обмеженими додатковими токсичними ефектами. Відповідно до отриманих даних, загальна частота відповіді становила 78% у групі іксазомібу та 72% у групі плацебо. Частота повної відповіді та дуже хорошої часткової відповіді становили 48 та 39%. Медіана часу до отримання відповіді складала 1,1 міс у групі іксазомібу та 1,9 міс у групі плацебо, медіана тривалості відповіді – 20,5 та 15,0 міс відповідно. Протягом періоду спостереження, який загалом склав 23 міс, медіана ЗВ не була досягнута в жодній із груп, наразі спостереження триває.
Частота серйозних ПЯ була подібною в обох групах дослідження – 47% у групі іксазомібу та 49% у групі плацебо; це також стосується і смертності – 4 та 6% відповідно. ПЯ від мінімального до тяжкого ступеня зафіксовані у 74 та 69% пацієнтів відповідно. Тромбоцитопенія 3 та 4 ступеня тяжкості реєструвалася частіше в групі іксазомібу (відповідно у 12 та 7% пацієнтів), ніж у групі плацебо (відповідно 5 та 4% пацієнтів). Висип, так само як і ПЯ з боку шлунково-кишкового тракту, виникали частіше в групі іксазомібу, ніж у групі плацебо (36 проти 23%).
Таким чином, отримані результати продемонстрували, що додавання іксазомібу до схеми лікування леналідомідом і дексаметазоном асоціювалося зі значно кращою ВБП; додаткові токсичні ефекти були обмежені [34]. Через профіль ПЯ та ефективність цей режим перорального застосування є додатковим терапевтичним варіантом для пацієнтів з рецидивуючою, рефрактерною або рецидивуючою та рефрактерною ММ.
Список літератури знаходиться в редакції.
За матеріалами Moreau P. et al. Oral Ixazomib, Lenalidomide, and Dexamethasone for Multiple Myeloma. N Engl J Med. 2016; 374: 1621-34. Doi: 10.1056/NEJMoa1516282.
Підготувала Валентина Момот
VV-MEDMAT-81807
Тематичний номер «Онкологія. Гематологія. Хіміотерапія» № 1 (80) 2023 р.