15 січня, 2021
Клінічні настанови ESMO щодо діагностики, лікування та спостереження пухлин із невідомим первинним вогнищем
 Пухлини з невідомим первинним вогнищем (ПНПВ) – гетерогенна група метастатичних пухлин, при яких стандартна діагностика не дає змоги ідентифікувати місце походження первинної пухлини. ПНПВ становлять 3-5% усіх злоякісних новоутворень. Унікальна біологія цих пухлин залишається майже не відомою [1]. Тим не менше, сучасні дані свідчать про те, що метастатична дисемінація може відбуватися за відсутності росту первинної пухлини внаслідок метастатичної агресивності, властивої раковим клітинам. Явище хромосомної нестабільності нещодавно було запропоновано як пояснення частини незвичайних клінічних проявів, хіміорезистентності та поганих результатів лікування пацієнтів із ПНПВ [2].
Пухлини з невідомим первинним вогнищем (ПНПВ) – гетерогенна група метастатичних пухлин, при яких стандартна діагностика не дає змоги ідентифікувати місце походження первинної пухлини. ПНПВ становлять 3-5% усіх злоякісних новоутворень. Унікальна біологія цих пухлин залишається майже не відомою [1]. Тим не менше, сучасні дані свідчать про те, що метастатична дисемінація може відбуватися за відсутності росту первинної пухлини внаслідок метастатичної агресивності, властивої раковим клітинам. Явище хромосомної нестабільності нещодавно було запропоновано як пояснення частини незвичайних клінічних проявів, хіміорезистентності та поганих результатів лікування пацієнтів із ПНПВ [2].
Діагностика, патологія та молекулярна біологія
Діагностика ПНПВ потребує для оцінки високоякісного зразка тканини пухлини. Ці пухлини за морфологічною формою класифікуються на:
- добре і помірно диференційовані аденокарциноми;
- плоскоклітинний рак;
- карциноми з нейроендокринною диференціацією;
- погано диференційовані карциноми (включаючи погано диференційовані аденокарциноми);
- недиференційовані новоутворення.
Імуногістохімічне дослідження слід застосовувати [3, 4], щоб визначити тканину походження та виключити чутливі до хіміотерапії та потенційно виліковні пухлини, тобто лімфоми та пухлини із зародкових клітин (табл. 1; III; A). Якщо встановлюється діагноз карцинома або аденокарцинома, рекомендується проводити імуногістохімічне дослідження для визначення рівня простатичного специфічного антигену (PSA) у пацієнтів чоловічої статі й рецепторів естрогену та прогестерону у жінок із метастазами у пахвових лімфатичних вузлах, щоб виключити чутливі до гормонів пухлини, які піддаються специфічній терапії. Дослідження експресії кератинів CK7 і CK20 надають інформацію щодо первинного місця походження пухлин, хромограніну А та синаптофізину – необхідні для підтвердження нейроендокринного походження пухлин (рис. 1). Окремими прикладами специфічних досліджень є визначення експресії CK7+, WT‑1+, PAX8+, CK20- (рак яєчника) та RCC+, PAX8+ (рак нирки).
 Рис. 1. Базові імуногістохімічні дослідження у хворих із ПНПВ [5]. CEA – карциноембріональний антиген; GCDFP-15 – рідинний білок-15 грубої кістозної хвороби; WT-1 – ген 1 пухлини Вільмса
Рис. 1. Базові імуногістохімічні дослідження у хворих із ПНПВ [5]. CEA – карциноембріональний антиген; GCDFP-15 – рідинний білок-15 грубої кістозної хвороби; WT-1 – ген 1 пухлини Вільмса
Персоналізована медицина
Для пацієнтів із ПНПВ доступні декілька досліджень профілювання експресії генів із заявленою ефективністю ідентифікації первинної пухлини та ймовірної тканини походження у близько 80% випадків [6, 7] (III). Ці аналізи базуються на зворотній полімеразній транскрипційній ланцюговій реакції (RT-PCR) мРНК або міРНК чи технологіях олігонуклеотидного мікрочипування [8-10]. При порівнянні профілів експресії мікроРНК у метастазах ПНПВ, біологічно віднесених до первинної тканини походження, із метастазами типових солідних пухлин відомого походження істотних відмінностей не виявлено [11]. Ці тести можуть допомогти у визначенні місця локалізації первинної пухлини у деяких пацієнтів [12]. Однак їх вплив на результат лікування пацієнта залишається сумнівним і не доведеним у рандомізованих дослідженнях [13] (IV; C). Результати великого проспективного нерандомізованого дослідження II фази, яке включало 252 пацієнти, дозволяють припустити, що виживаність можна покращити за допомогою специфічної до місця розташування пухлини терапії, яка визначається аналізом профілю експресії генів пухлиною [7].
Стадіювання й оцінювання ризиків
ПНПВ за визначенням є метастатичним раком, і прогноз для пацієнтів з ПНПВ, як правило, поганий. Однак невелика кількість пацієнтів із ПНПВ може розраховувати на користь від мішеневої терапії. Діагностичні рекомендації для хворих із попереднім діагнозом ПНПВ наведені в таблиці 2.
Ретельне фізикальне обстеження, загальний і біохімічний аналіз крові, комп’ютерна томографія (КТ) грудної клітки, живота та малого таза забезпечують мінімальну базову діагностичну оцінку (IV; B). Ендоскопічне дослідження виконується за показаннями. У пацієнтів чоловічої статі пропонується визначення сироваткового α-фетопротеїну, хоріонічного гонадотропіну, хромограніну А та PSA у плазмі крові для виключення потенційно виліковних екстрагонадних пухлин із зародкових клітин, нейроендокринних пухлин і раку передміхурової залози, що піддається гормональному лікуванню.
Позитронна емісійна комп’ютерна томографія (ПET/КТ) може сприяти лікуванню пацієнтів з аденопатією шийки матки, викликаною ПНПВ, і пацієнтів з поодиноким метастазуванням ПНПВ (IV; B). Для інших ПНПВ значення позитронно-емісійної томографії з використанням фтордезоксиглюкози (FDG-PET) обмежене [14, 15], що робить цю процедуру візуалізації не обов’язковою (III; C).
Для пацієнтів із переважним ураженням лімфатичних вузлів серединної лінії (midline lymph node) слід виключити лімфому або екстрагонадну пухлину із зародкових клітин.
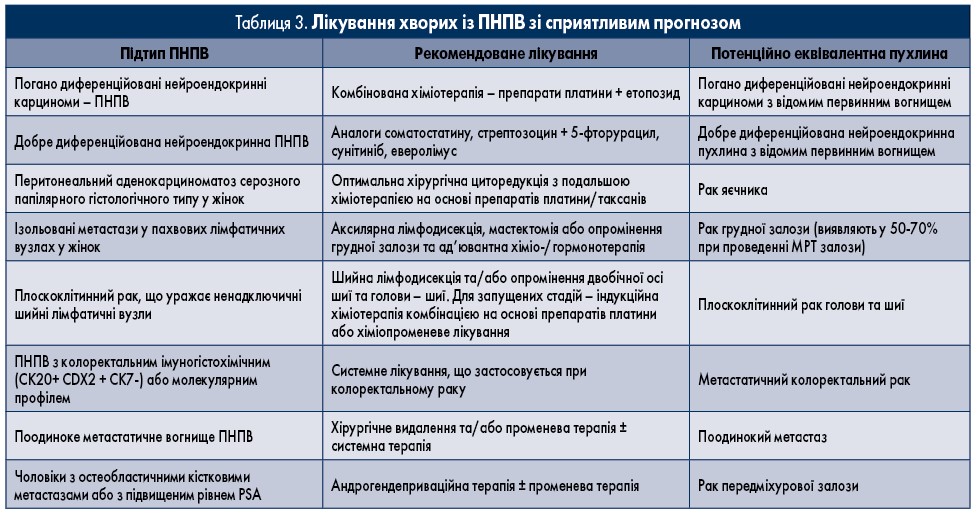
На основі клінічних і патологічних критеріїв визначені окремі підгрупи пацієнтів із ПНПВ зі сприятливим прогнозом, схеми лікування цих хворих наведено у таблиці 3 [2]. При ПНПВ з колоректальним молекулярним профілем за даними імуногістохімічного дослідження прогноз також, мабуть, кращий (імовірно, завдяки більш активному системному лікуванню) [16].
Серед пацієнтів із ПНПВ можна виділити дві прогностичні групи:
- пацієнти, у яких хороший рівень працездатності (0-1) і нормальний рівень лактатдегідрогенази (ЛДГ), із середньою тривалістю життя 1 рік;
- пацієнти, у яких наявні один або обидва із зазначених прогностичних факторів (низький рівень працездатності та підвищений рівень ЛДГ у сироватці крові), із середньою загальною виживаністю лише близько 4 міс [17].
Рекомендації щодо практичного ведення пацієнтів з ПНПВ, у тому числі поділ на підгрупи, виключення новоутворень, не пов’язаних із ПНПВ, і використання прогностичних параметрів у клінічній практиці, наведено на рисунку 2.
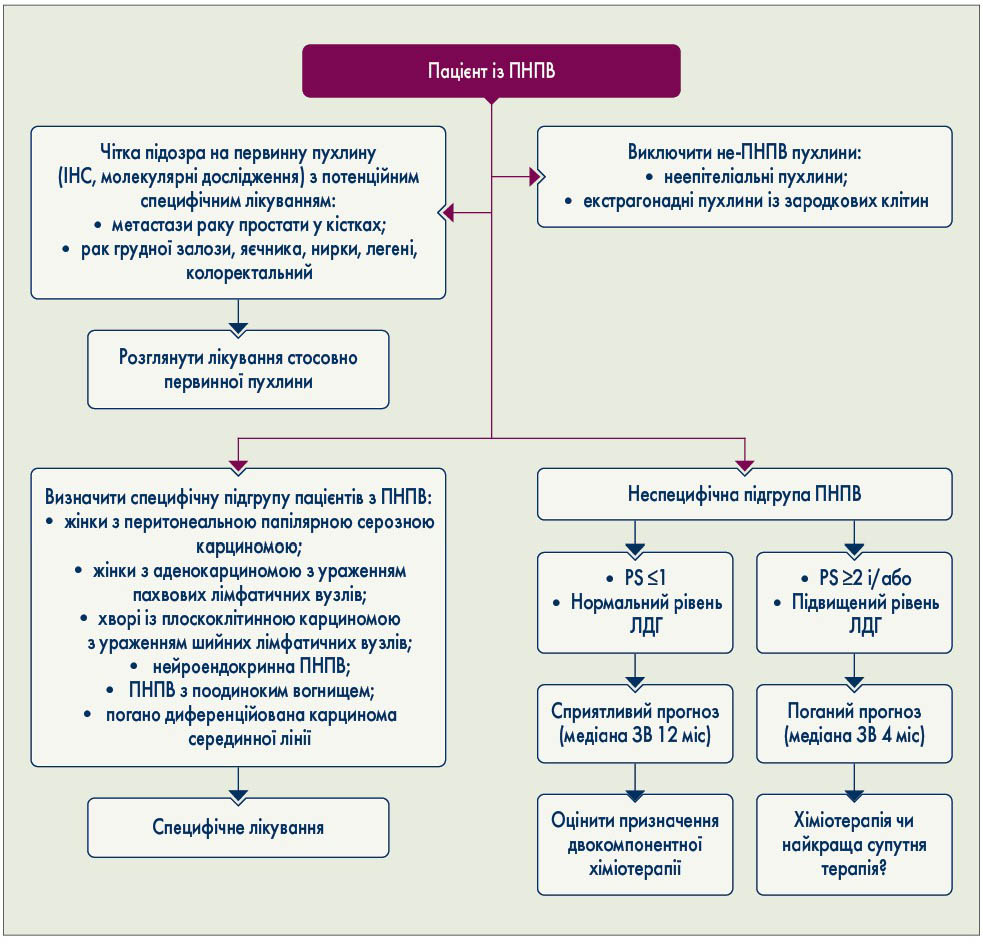 Рис. 2. Клінічне ведення пацієнтів з ПНПВ. IHC – імуногістохімічне дослідження; PS – загальний стан; ЗВ – загальна виживаність
Рис. 2. Клінічне ведення пацієнтів з ПНПВ. IHC – імуногістохімічне дослідження; PS – загальний стан; ЗВ – загальна виживаність
Лікування
Терапія має бути індивідуально розроблена відповідно до належності пацієнта до клініко-патологічної підгрупи з чітким прогнозом (III; B). Наполегливо рекомендується звернення до спеціалізованих центрів. Пацієнтів із ПНПВ підгрупи сприятливого прогнозу (10-15%) слід лікувати подібно до хворих із відповідними відомими первинними пухлинами з метастатичною дисемінацією (IV; B). У 30-60% цих пацієнтів досягається тривалий контроль захворювання, і оптимальне ведення є ключовим для тривалої виживаності (табл. 3). Ретроспективні дослідження підтверджують, що клінічна поведінка, біологія, клінічна відповідь і результати лікування пацієнтів із ПНПВ зі сприятливим прогнозом не відрізняються від подібних метастатичних пухлин із відомою первинною локалізацією [18‑22].
Пацієнти з ПНПВ підрупи поганого прогнозу мають невтішний прогноз, незважаючи на введення різноманітних хіміотерапевтичних комбінацій у невеликих клінічних дослідженнях [23]. Дослідження, проведені у 2000-х роках, не дали змоги виявити вищої ефективності будь-якого із застосовуваних режимів, що включають солі платини, таксани або цитотоксичні сполуки нового покоління (гемцитабін, алкалоїди барвінку чи іринотекан) [24]. У рандомізованому проспективному дослідженні III фази у 198 пацієнтів із поганим прогнозом порівнювали гемцитабін/іринотекан з паклітакселом/карбоплатином/пероральним етопозидом та повідомляли про значно нижчу токсичність при використанні двох препаратів і зіставні показники виживання (II; A) [25]. Проте виявлено, що співвідношення ефективності й токсичності комбінації цисплатин/гемцитабін є кращим, ніж режиму цисплатин/іринотекан у рандомізованому дослідженні II фази (I; A) [26]. Було також повідомлено про кращий результат при застосуванні цисплатину/гемцитабіну із двома препаратами у порівнянні з цисплатином окремо, хоча це не оцінювали у великому рандомізованому дослідженні ІІІ фази [27]. Помірне подовження виживаності та зменшення симптомів зі збереженням якості життя на сьогодні є єдиними реалістичними цілями терапії для цих пацієнтів (II; A), хоча повідомлялося про рідкісні випадки одужання [28]. Отже, низькотоксичні зручні для пацієнта схеми хіміотерапії слід вводити пацієнтам з ПНПВ із поганим прогнозом. Якщо оцінка демографічних показників пацієнта, метастатичної картини, результатів клінічних і лабораторних досліджень, даних візуалізації, патологічних оцінок та експресії генів є відносно однозначною, може бути розглянуто конкретне лікування, хоча проспективних доказів того, що це краще, ніж емпірична хіміотерапія, поки що недостатньо.
Чи слід застосовувати мішеневі препарати у пацієнтів з ПНПВ, все ще не відомо [29]. Хоча у хворих із ПНПВ були протестовані лише декілька нехіміотерапевтичних препаратів, беліностат був оцінений випадково, і це не покращило результати режиму карбоплатин/паклітаксел [30]. Попередні ретроспективні дані дозволяють припустити, що у пацієнтів із ПНПВ з імуногістохімічним та/або молекулярним профілем колоректальної карциноми частота відповіді та виживаність після «колоректальної» специфічної терапії (тобто FOLFOX або FOLFIRI) є подібною до такої у пацієнтів з відомими поширеними колоректальними карциномами [16, 31] (IV; B). Ці дані отримані у невеликої кількості пацієнтів, і для підтвердження попередніх висновків необхідна додаткова проспективна перевірка.
Пацієнтів, у котрих місце локалізації первинної пухлини припускається на основі імуногістохімічних досліджень чи мікрочипування, слід настійно заохочувати до участі у клінічних дослідженнях, у яких оцінюють комбінації цитотоксичних сполук із мішеневими препаратами або специфічну терапію.
За матеріалами Fizazi K. et al. Cancers of unknown primary site: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 26 (Supplement 5): v133-v138, 2015. doi:10.1093/annonc/mdv305.
Підготував Назар Лукавецький
Тематичний номер «Онкологія, Гематологія, Хіміотерапія» № 6 (67) 2020 р.