4 січня, 2021
Найважливіші досягнення в лікуванні солідних пухлин

 Конгрес Європейського товариства медичної онкології (ESMO) відбувся в запланований час, 18-22 вересня, але у віртуальному просторі (формально його приймав Мадрид). Пандемія коронавірусу, безумовно, негативно відображається на клінічних дослідженнях у галузі онкології, але цьогорічні повідомлення на ESMO ґрунтувалися на аналізі результатів, отриманих ще у попередні роки. Зупинимося на повідомленнях, які вже найближчим часом можуть зумовити зміни у щоденній клінічній практиці, а також на тих, які окреслюють перспективні шляхи лікування хворих зі злоякісними пухлинами.
Конгрес Європейського товариства медичної онкології (ESMO) відбувся в запланований час, 18-22 вересня, але у віртуальному просторі (формально його приймав Мадрид). Пандемія коронавірусу, безумовно, негативно відображається на клінічних дослідженнях у галузі онкології, але цьогорічні повідомлення на ESMO ґрунтувалися на аналізі результатів, отриманих ще у попередні роки. Зупинимося на повідомленнях, які вже найближчим часом можуть зумовити зміни у щоденній клінічній практиці, а також на тих, які окреслюють перспективні шляхи лікування хворих зі злоякісними пухлинами.
Рак грудної залози
Упродовж останніх років у клінічних дослідженнях чітко розмежовують імуногістохімічні підтипи раку грудної залози (РГЗ): потрійний негативний (ПН) РГЗ, гормон-рецепторпозитивний (HR+) HER2-негативний РГЗ і HER2-позитивний РГЗ.
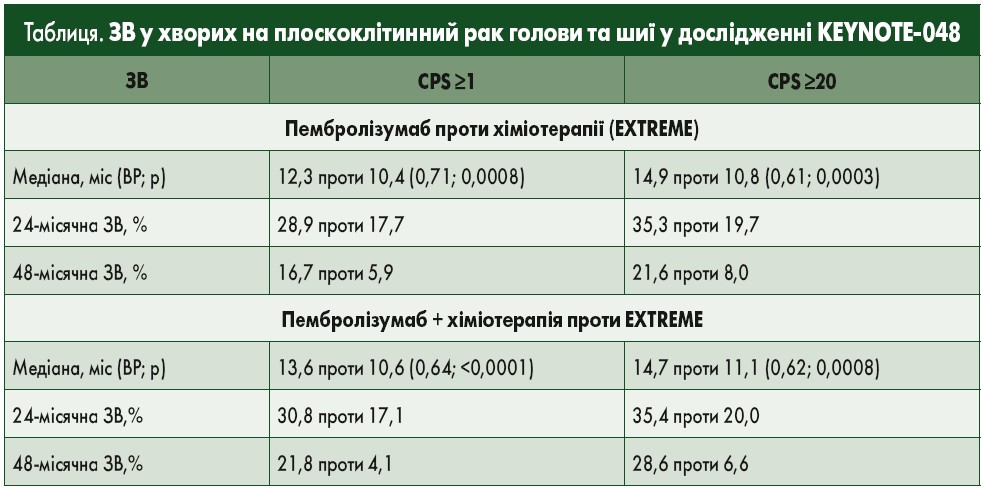
Найбільші надії щодо лікування найагресивнішого на сьогодні підтипу – ПН РГЗ – покладаються на імунотерапію. Ще у березні 2019 р. Управління з контролю якості харчових продуктів і лікарських препаратів США (FDA) схвалило комбінацію атезолізумабу з наб-паклітакселом (препарат не зареєстрований в Україні) для лікування PD-L1-позитивного ПН РГЗ (враховувалася інфільтрація пухлини імунними клітинами ≥1%, тобто IC ≥1%) за результатами дослідження IMpassion130, у якому брали участь і чотири українські онкологічні центри. На конгресі ESMO‑2020 повідомлялися фінальні результати цього дослідження щодо загальної виживаності (ЗВ) пацієнтів. Зокрема 3-річна ЗВ при PD-L1-позитивних пухлинах склала 36 проти 22% на користь імунотерапії (рис. 1). Медіана ЗВ відповідала раніше повідомленим даним: 25,4 проти 17,9 міс; відношення ризиків (ВР) дорівнювало 0,69 (Emens L.A. et al. Abstr. LBA16).
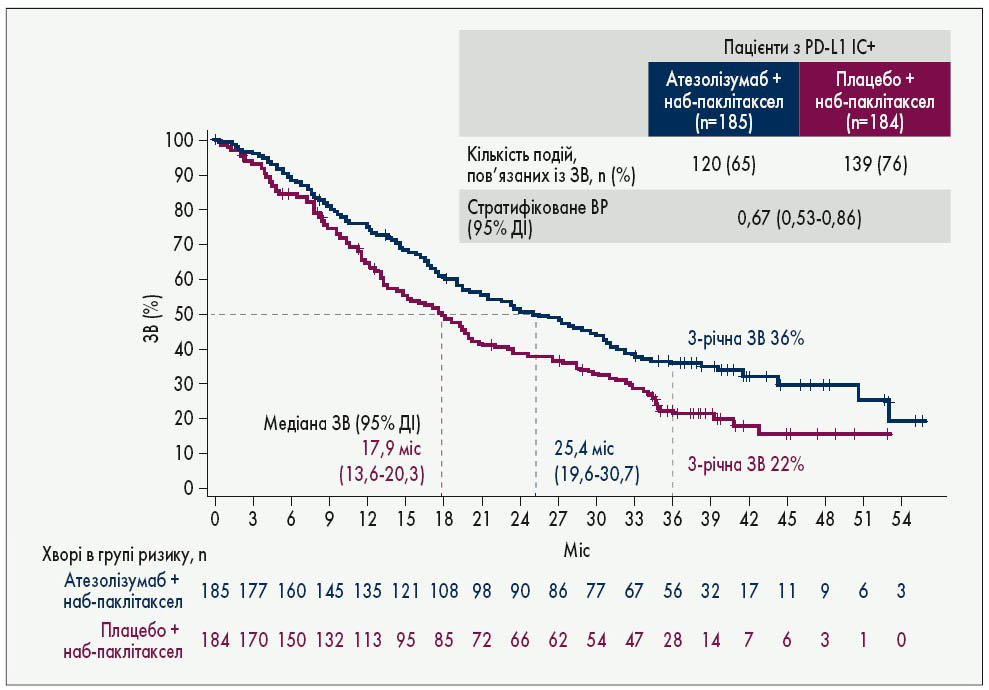 Рис. 1. ЗВ хворих на PD-L1-позитивний ПН РГЗ у дослідженні IMpassion130. ДІ – довірчий інтервал
Рис. 1. ЗВ хворих на PD-L1-позитивний ПН РГЗ у дослідженні IMpassion130. ДІ – довірчий інтервал
В аналогічному за дизайном дослідженні IMpassion131 наб-паклітаксел було замінено на паклітаксел (Miles D.W. et al. Abstr. LBA15). З’ясувалося, що додавання імунотерапії не поліпшило результатів лікування: медіана виживаності без прогресування (ВБП) при PD-L1-позитивних пухлинах склала 6,0 проти 5,7 міс, а медіана ЗВ – 22,1 проти 28,3 міс у групах з імунотерапією і без неї відповідно (рис. 2). Автори аналізували причини цієї невдачі та схиляються до думки, що на результат вплинула необхідність застосування кортикостероїдів у програмі премедикації при застосуванні паклітакселу. FDA 8 вересня 2020 р. видало спеціальне застереження щодо недопустимості заміни наб-паклітакселу на паклітаксел у цьому режимі терапії занедбаного ПН РГЗ.
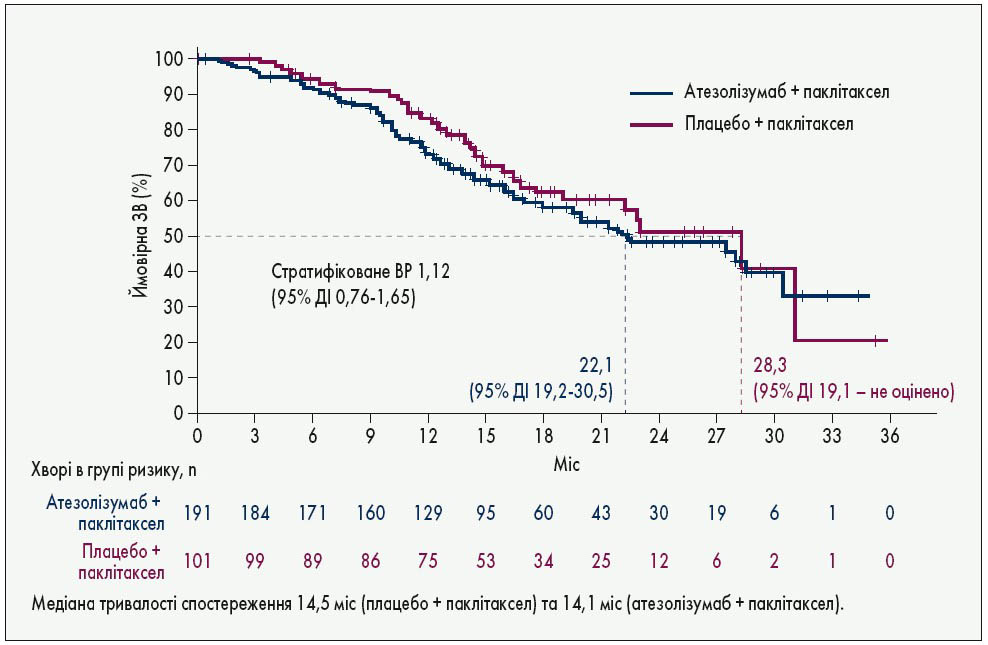 Рис. 2. ЗВ хворих на PD-L1-позитивний ПН РГЗ у дослідженні IMpassion131
Рис. 2. ЗВ хворих на PD-L1-позитивний ПН РГЗ у дослідженні IMpassion131
Доведена ефективність комбінації наб-паклітакселу з атезолізумабом зумовила її застосування в неоад’ювантному режимі. У дослідженні IMpassion031 з’ясовано, що частота повного морфологічного регресування (pCR, яке визначалося як ypT0/isN0) складала 57,6% у групі атезолізумабу з хіміотерапією (наб-паклітаксел щотижнево 12 циклів і доксорубіцин із циклофосфамідом через кожні 2 тижні ще 4 цикли) проти 41,1% (при застосуванні лише хіміотерапії). Різниця спостерігалася як при PD-L1-позитивних (68,8 проти 49,3%), так і при PD-L1-негативних пухлинах (47,7 проти 34,4%). Про віддалені результати говорити передчасно, але дослідники вже відзначили тенденцію до поліпшення безрецидивної і загальної виживаності (Harbeck N. et al. Abstr. LBA11).
Істотним проривом у лікуванні занедбаного ПН РГЗ може стати застосування нового антитіла, з’єднаного з цитостатиком. Антитіло RS7 спрямоване проти антигену TROP‑2, який експресується на клітинах багатьох злоякісних солідних пухлин епітеліального походження (у тому числі ПН РГЗ) і пов’язаний із несприятливим прогнозом. До нього приєднали похідне іринотекану SN‑38 (інгібітор топоізомерази, який більш ніж у 100 разів потужніший від базового препарату). До кожної молекули антитіла приєднано по 7-8 молекул цитостатика (структурний принцип подібний до такого у добре відомого препарату T-DM1, в якому до трастузумабу приєднаний цитостатик мертанзин). Отриманий кон’югат антитіла з цитостатиком назвали сацитузумаб. У кислому пухлинному мікросередовищі SN‑38 вивільняється і проникає у пухлинні клітини. У дослідженні ASCENT (включено 529 хворих) доведено істотні переваги сацитузумабу над традиційною хіміотерапією у хворих, які до того отримували принаймні дві лінії лікування. Медіана ВБП складала 5,6 проти 1,7 міс (ВР 0,41), а ЗВ – 12,1 проти 6,7 міс (ВР 0,48; рис. 3). Цей препарат вже став новим стандартом лікування метастатичного ПН РГЗ (затверджений FDA 22 квітня 2020 р.), а також заслуговує на вивчення у режимах радикального лікування (Bardia A. et al. Abstr. LBA17).
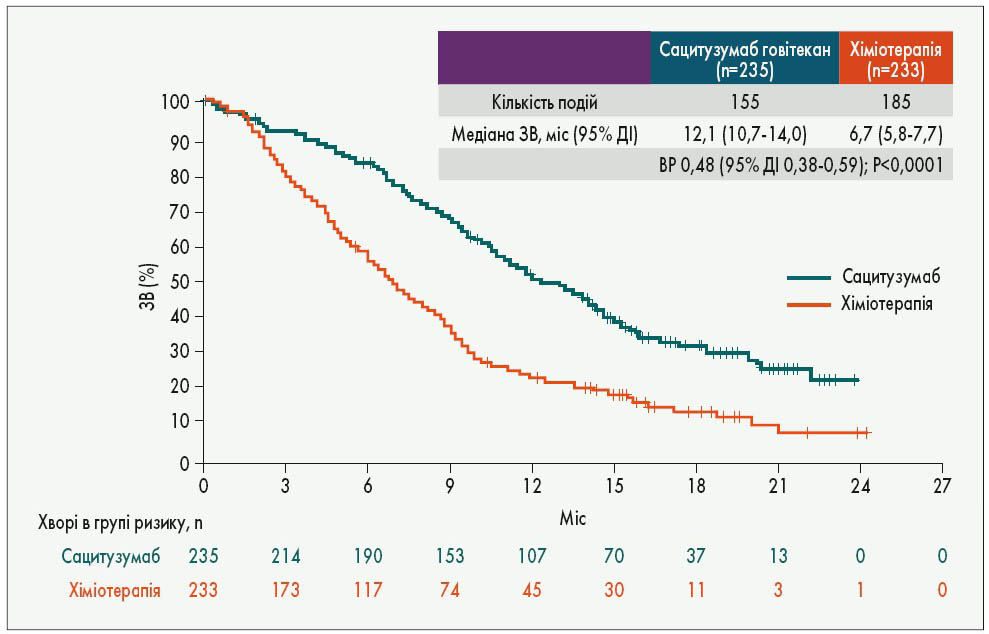 Рис. 3. ЗВ хворих на ПН РГЗ при застосуванні сацитузумабу порівняно з хіміотерапією у дослідженні ASCENT
Рис. 3. ЗВ хворих на ПН РГЗ при застосуванні сацитузумабу порівняно з хіміотерапією у дослідженні ASCENT
Вже понад 5 років інгібітори CDK 4/6 успішно застосовують у комбінації з гормонотерапією при занедбаному HR+/HER2- РГЗ. Традиційними засобами гормонотерапії в цих комбінаціях у першій лінії є інгібітори ароматази, тоді як у другій лінії застосовують комбінацію інгібіторів CDK 4/6 з фулвестрантом. Нещодавно з’ясували, що в режимі монотерапії першої лінії фулвестрант має помірні переваги над інгібіторами ароматази (за результатами дослідження FALCON). Дослідження GEICAM/2014-12 (FLIPPER) довело очікувану, мабуть, перевагу комбінації фулвестранту з палбоциклібом над монотерапією фулвестрантом у першій лінії: медіана ВБП становила 31,8 проти 22,0 міс. Більша різниця ефективності була у первинних (de novo) хворих (Albanell J. et al. Abstr. LBA19).
На конгресі ESMO‑2020 вперше повідомлено результати застосування інгібіторів CDK 4/6 у ад’ювантній терапії. У великому дослідженні monarchE (5637 хворих, у тому числі 105 із 7 центрів в Україні) у пацієнтів з високим ризиком рецидиву (наприклад, ураження 4 і більше лімфатичних вузлів) порівнювали ефективність стандартної ад’ювантної гормонотерапії (5-10 років) і її комбінації з інгібітором CDK 4/6 абемациклібом упродовж перших двох років. Дворічне спостереження продемонструвало поліпшення виживаності без рецидивів інвазивного раку і розвитку віддалених метастазів (рис. 4; Johnston S.R.D. et al. Abstr. LBA5_PR). Експерти відзначають, що це перший успіх ад’ювантної терапії HR+/HER2- РГЗ після того, як ще у 2002 р. доведено перевагу анастрозолу над тамоксифеном.
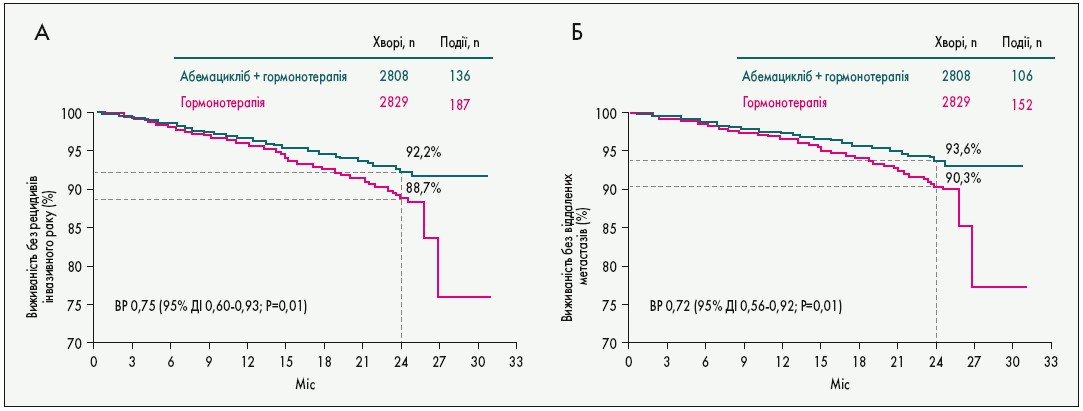 Рис. 4. Виживаність без рецидивів інвазивного раку (А) і віддалених метастазів (Б) при ад’ювантній гормонотерапії в комбінації з інгібітором CDK 4/6 у дослідженні monarchE
Рис. 4. Виживаність без рецидивів інвазивного раку (А) і віддалених метастазів (Б) при ад’ювантній гормонотерапії в комбінації з інгібітором CDK 4/6 у дослідженні monarchE
В аналогічному за дизайном дослідженні PALLAS (5760 хворих) не виявили переваг комбінації гормонотерапії з палбоциклібом над гормонотерапією (Mayer E.L. et al. Abstr. LBA12). У дискусії аналізували причини розбіжностей у результатах. Можливо, вплинуло включення у дослідження monarchE хворих із вищим ризиком розвитку рецидивів (наприклад, ураження лімфатичних вузлів N2/3 у 59% пацієнтів проти 37% у PALLAS), рідшою була необхідність у припиненні прийому інгібіторів CDK 4/6 (16,6 проти 42,2%). Врешті залишаються і глобальні питання, на які ми чекаємо відповіді. Чи перетвориться поліпшення безрецидивної виживаності в підвищення ЗВ? Чи впливають інгібітори CDK 4/6 на пізні рецидиви (вже після закінчення їх прийому)? Яка оптимальна тривалість такої терапії?
Тривають пошуки таргетних препаратів, які можуть бути ефективними при HR+/HER2- РГЗ. Серед можливих мішеней – мутація гена PIK3CA, яка трапляється у 40% пухлин і свідчить про несприятливий прогноз. Алпелісиб – це альфа-селективний інгібітор PI3K. Раніше було показано, що його комбінація з фулвестрантом у другій лінії гормонотерапії поліпшує ВБП порівняно з лише гормонотерапією – 11,0 проти 5,7 міс (ВР 0,65). На конгресі ESMO‑2020 повідомлено остаточні результати дослідження SOLAR‑1 – медіана ЗВ поліпшилася на 7,9 міс: 39,3 проти 31,4 міс; ВР 0,86 (Andre F. et al. Abstr. LBA18). Тривають дискусії щодо послідовності застосування різних видів таргетної терапії при цьому типі РГЗ. Вважають, що спочатку разом з гормонотерапією слід призначити інгібітор CDK 4/6, а вже потім – інгібітор PI3K.
Порушення сигнального шляху PIK3CA/AKT1/PTEN наявне у 50% хворих на HR+/HER2- РГЗ і свідчить про несприятливий прогноз. Дослідники сподівалися, що інгібітор AKT іпатасертиб зможе підвищити ефективність хіміотерапії у таких хворих, бо він посилював дію фулвестранту в другій лінії гормонотерапії. У дослідженні IPATunity130 (146 хворих, у тому числі з 6 центрів в Україні) не виявлено переваг від додавання іпатасертибу до паклітакселу: медіана ВБП в обох групах склала по 9,3 міс (Turner N. et al. Abstr. 283MO).
Недрібноклітинний рак легені
Основними напрямами досліджень щодо лікування недрібноклітинного раку легені (НДРЛ) нині є таргетна терапія та імунотерапія. На конгресі ESMO‑2020 було кілька важливих повідомлень як про нові уточнюючі результати вже відомих досліджень, так і про інноваційні підходи.
Ще за даними дослідження KEYNOTE‑001 5-річна виживаність хворих, які отримували монотерапію пембролізумабом у першій лінії (незалежно від експресії PD-L1) складала 23,2%. На цьогорічному конгресі ESMO оприлюднено результати дослідження KEYNOTE‑024, у якому в пацієнтів із метастатичним НДРЛ та експресією PD-L1 ≥50% 5-річна ЗВ при застосуванні монотерапії пембролізумабом була удвічі вищою, ніж хіміотерапії – 31,9 проти 16,3% (ВР 0,62; рис. 5). Слід зауважити, що 66% учасників групи хіміотерапії після прогресування захворювання отримували імунотерапію, і саме цим можна пояснити відносно високу виживаність у контрольній групі. Бо у дослідженнях, присвячених хіміотерапії метастатичного НДРЛ платиновими дублетами, показники
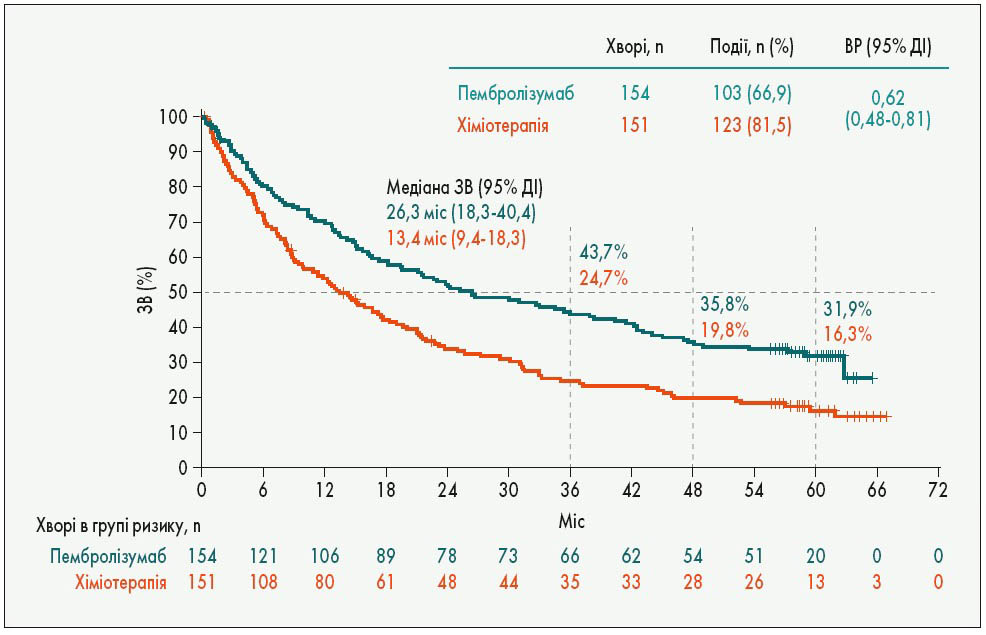 Рис. 5. П’ятирічна ЗВ при імунотерапії НДРЛ з експресією PD-L1 ≥50% у дослідженні KEYNOTE‑024
Рис. 5. П’ятирічна ЗВ при імунотерапії НДРЛ з експресією PD-L1 ≥50% у дослідженні KEYNOTE‑024
Новий анти-PD-L1 засіб цеміплімаб продемонстрував фактично таку ж ефективність, як і пембролізумаб, при експресії PD-L1 ≥50%. У дослідженні III фази EMPOWER Lung 1 (710 пацієнтів зі 188 центрів, у тому числі з 12 в Україні) медіана ВБП у групі імунотерапії склала 8,2 проти 5,7 міс у групі хіміотерапії. Медіана ЗВ у групі цеміплімабу при експресії PD-L1 ≥50% ще не досягнута, тоді як при хіміотерапії вона склала 14,2 міс, а
За результатами дослідження IMpower150 відомо, що одним з оптимальних режимів при неплоскоклітинному НДРЛ є своєрідний триплет: хіміотерапія з препаратами платини + антиангіогенна терапія бевацизумабом + імунотерапія атезолізумабом. Відзначається його потенційно краща ефективність в особливих групах хворих, які не чутливі до монотерапії інгібіторами імунних контрольних точок (наявність мутацій EGFR/ALK, а також печінкових метастазів). Японські онкологи у хворих із високою експресією PD-L1 застосовували комбінацію атезолізумабу з бевацизумабом (без хіміотерапії). Медіана ВБП склала 15,4 міс, а 1-річна ВБП – 54,9% (Seto T. et al. Abstr. LBA55).
Французькі онкологи розпочали кропітку роботу з пошуку біомаркерів, які допоможуть індивідуалізувати імунотерапію, як молекулярно-генетичні дослідження (зокрема, виявлення драйверних мутацій) індивідуалізували таргетну терапію і зробили її високоефективною. У дослідженні PIONeeR вивчали понад 400 біомаркерів. Отримані перші результати не лише накреслюють шляхи подальших досліджень, а й забезпечують можливість у майбутньому інтегрувати в імунограмах кілька різних біомаркерів, що допоможуть у прогнозуванні чутливості та рефрактерності до імунотерапії (Barlesi F. et al. Abstr. LBA53).
За результатами дослідження III фази CROWN розширено коло ALK-інгібіторів третього покоління для терапії НДРЛ з наявністю вказаної перебудови гена. Новий препарат лорлатиніб (подібно до інших засобів з цієї підгрупи алектинібу та бригатинібу) продемонстрував істотні переваги над препаратом першого покоління – кризотинібом. Особливо це стосується метастазів у мозку, які є найчастішою ознакою прогресування ALK-позитивного НДРЛ. Лорлатиніб був ефективним у 82% пацієнтів з метастазами в мозку, причому у 71% із них спостерігалося повне регресування таких метастазів. Однорічна ВБП склала 78,1 проти 38,7% при застосуванні кризотинібу (Solomon B. et al. Abstr. LBA2).
Перші обнадійливі результати дослідження ADAURA (брали участь 4 українських онкологічних центри), в якому при EGFR-позитивному НДРЛ застосовували ад’ювантну терапію осимертинібом, повідомлялися пів року тому на з’їзді ASCO. На конгресі ESMO‑2020 зосередилися лише на інформації щодо метастазів у мозку, які є чи не найчастішою ознакою прогресування EGFR-позитивного НДРЛ. При тривалості спостереження з медіаною 22 міс частота виникнення метастазів у центральній нервовій системі у групі осимертинібу знизилася на 82% (Tsuboi M. et al. Abstr. LBA1). Зауважимо однак, що відносно короткий термін спостереження не дає можливості відповісти на основне питання: чи здатний осимертиніб повністю усунути всі мікровогнища пухлини (так звана мінімальна резидуальна хвороба – MRD) – як місцеві, так і віддалені? Бо є ймовірність, що застосування потужного інгібітора EGFR дає можливість лише істотно подовжити час до прогресування залишкових пухлинних вогнищ (як це доведено у дослідженні FLAURA при метастатичному НДРЛ), а не знищити їх. Тобто про вплив ад’ювантної терапії осимертинібом на виживаність (як безрецидивну, так і загальну) можна буде впевнено говорити лише через кілька років.
Інші пухлини
Андрогенна деприваційна терапія (АДТ) тривалий час була стандартом першої лінії лікування хворих на метастатичний рак передміхурової залози. Кілька останніх років у первинних пацієнтів зі значним кістковим або вісцеральним ураженням разом з АДТ застосовують хіміотерапію доцетакселом. Згодом доведено переваги комбінації абіратерону (+ преднізон) з АДТ над лише АДТ (наприклад, у дослідженні LATITUDE, у якому беруть участь і українські онкологи). На конгресі ESMO‑2020 повідомлено підсумки дослідження STAMPEDE (понад 1000 пацієнтів) щодо ЗВ, медіана якої склала при застосуванні абіратерону 6,6 року проти 3,8 року у контрольній групі (ВР 0,60). Поліпшення ефективності спостерігали як у групі високого, так і низького ризику, як при значному, так і при помірному метастатичному навантаженні (James N.D. et al. Abstr. 611O).
Важливим досягненням, про яке вперше повідомлено на цьогорічному конгресі, є розширення показань до імунотерапії при метастатичному раку стравоходу і стравохідно-шлункового з’єднання. У дослідженні KEYNOTE‑590 (749 хворих) вивчали ефективність додавання імунотерапії пембролізумабом до стандартної для таких процесів хіміотерапії (цисплатин + 5-флуороурацил). Виявилося, що комбінація хіміотерапії з імунотерапією значно поліпшила ЗВ (рис. 6), ВБП і частоту об’єктивної відповіді порівняно з хіміотерапією. Ефект щодо ЗВ був особливо відчутним у підгрупі з PD-L1 CPS ≥10 та плоскоклітинного раку. Дослідники дійшли висновку, що комбінація хіміотерапії з пембролізумабом у першій лінії є новим стандартом лікування хворих на місцево-поширений або метастатичний рак стравоходу (Kato K. et al. Abstr. LBA8_PR).
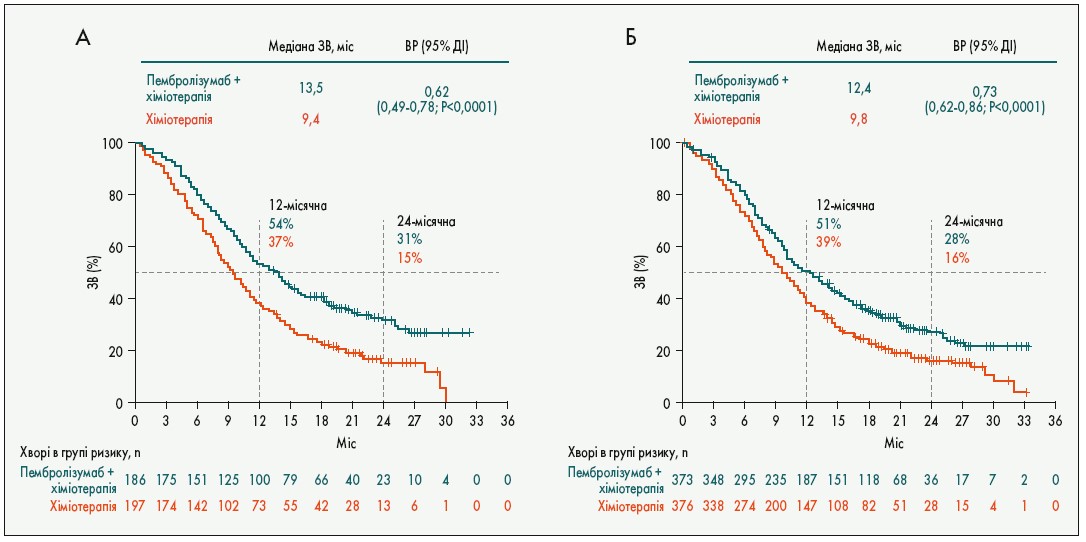 Рис. 6. ЗВ у підгрупі хворих із PD-L1 CPS ≥10 (А) і загальній групі (Б) у дослідженні KEYNOTE‑590
Рис. 6. ЗВ у підгрупі хворих із PD-L1 CPS ≥10 (А) і загальній групі (Б) у дослідженні KEYNOTE‑590
У дослідженні KEYNOTE‑048 раніше доведено переваги пембролізумабу в комбінації з хіміотерапією над хіміотерапією стандартним режимом EXTREME. На конгресі ESMO‑2020 оприлюднено результати тривалого спостереження (понад 4 роки), згідно з якими у хворих з експресією PD-L1 CPS навіть монотерапія пембролізумабом ефективніша, ніж хіміотерапія (таблиця; Greil R. et al. Abstr. 915MO).
Повідомлено оновлені результати дослідження ад’ювантної терапії меланоми ІІІ стадії пембролізумабом (KEYNOTE‑054). Спостереження за хворими упродовж 3,5 року дало можливість констатувати істотне зниження кількості віддалених метастазів – 49,4% у групі пембролізумабу проти 65,3% у групі плацебо (рис. 7), у тому числі віддалених метастазів як першої ознаки рецидиву хвороби – 24,9 та 39,5% (ВР 0,57). Автори зауважили, що поліпшення ЗВ незначне і пояснюють це тим, що в дослідженні дозволено продовжувати лікування пембролізумабом в обох групах після прогресування захворювання. В інших дослідженнях (наприклад, при застосуванні таргетної терапії при BRAF-позитивних пухлинах) у подібній групі хворих такий перехід не практикувався (Eggermont A.M.M. et al. Abstr. LBA46).
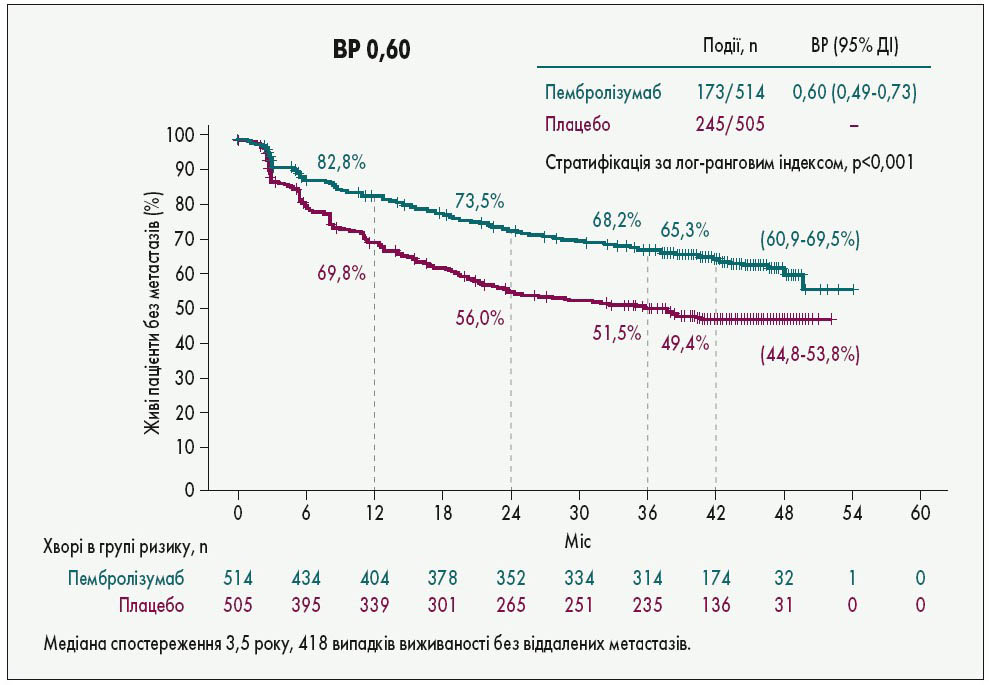 Рис. 7. Виживаність без віддалених метастазів при меланомі ІІІ стадії у дослідженні KEYNOTE‑054
Рис. 7. Виживаність без віддалених метастазів при меланомі ІІІ стадії у дослідженні KEYNOTE‑054
Проте імунотерапія поліпшує результати лікування не при всіх типах пухлин. У дослідженні KEYNOTE‑361 у хворих із занедбаним уротеліальним раком порівнювали три режими першої лінії: хіміотерапію (похідні платини + гемцитабін), пембролізумаб та їх комбінацію. З’ясувалося, що додавання імунотерапії до хіміотерапії не поліпшувало результатів лікування (рис. 8). Однак, за попередніми даними, монотерапія пембролізумабом не поступається за ефективністю хіміотерапії: медіана ЗВ у загальній групі склала 15,6 проти 14,3 міс, а при PD-L1 CPS ≥10 – 16,1 проти 15,2 міс відповідно (Alva А. et al. Abstr. LBA23).
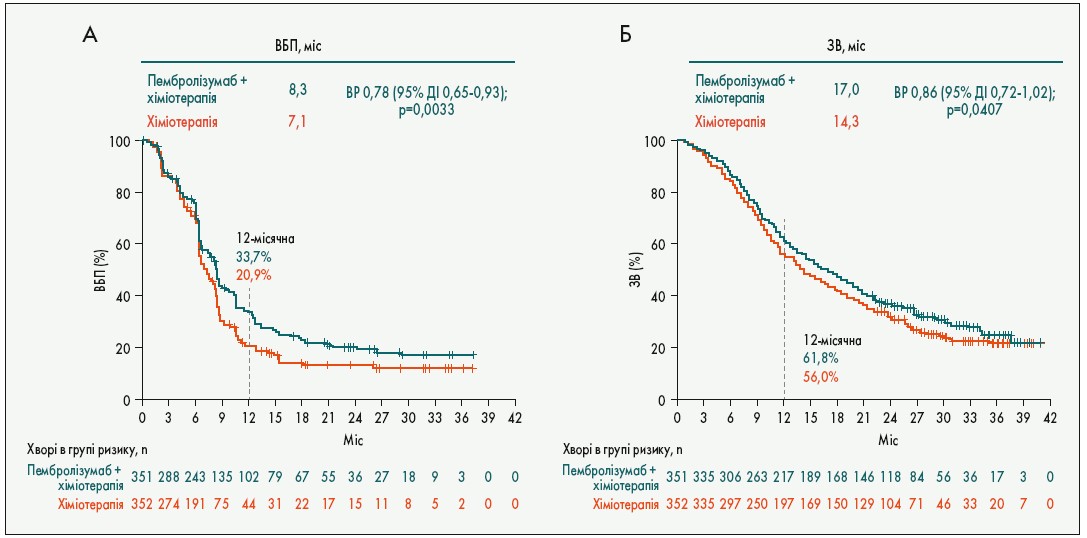 Рис. 8. Виживаність при занедбаному уротеліальному раку у дослідженні KEYNOTE‑361
Рис. 8. Виживаність при занедбаному уротеліальному раку у дослідженні KEYNOTE‑361
Не відомо, чи найбільші конгреси онкологічних спільнот (ASCO, ESMO) наступного року відбудуться у звичайному форматі. Але сподіваємося, що поступ клінічної онкології не спинити, і вже найближчим часом будуть отримані нові обнадійливі результати, які допоможуть поліпшити ефективність лікування і в Україні. Дуже важливо, щоб наші клініцисти брали активну участь у науковому поступі. На жаль, різні не пов’язані з медициною обставини (тиск фіскальних установ, надмірні бюрократичні вимоги державних органів) останнім часом обмежують участь українських онкологічних центрів у міжнародних клінічних дослідженнях. Так, українські центри (на відміну від російських) не брали участі у кількох важливих дослідженнях, які аналізувалися в цій статті (IMpassion131, SOLAR‑1, CROWN, KEYNOTE‑590, KEYNOTE‑048, KEYNOTE‑054). За даними сайту https://www.clinicaltrials.gov/, на середину листопада в Україні в активній фазі перебувають 95 міжнародних клінічних досліджень, присвячених лікуванню солідних пухлин, тоді як у Росії – 280, Польщі – 360, Німеччині – 957, причому лише в Мюнхені – 390, а в Білорусі – 20. З огляду на високий фаховий рівень наших клініцистів маємо підстави сподіватися, що на наступних важливих міжнародних форумах будемо гордитися досягненнями, до яких долучилася й українська медична наука.
Тематичний номер «Онкологія, Гематологія, Хіміотерапія» № 5 (66) 2020 р.