17 червня, 2021
Ювенільна системна склеродермія: діагностика, лікування, профілактика (закінчення)
Продовження. Початок у № 1 (57) на стор. 30-32.
 Лабораторна діагностика. У загальному аналізі крові визначається гіпохромна анемія, незначний тромбоцитоз, підвищення ШОЕ, що не корелює з активністю ССД. У частини дітей виявляється гіперпротеїнемія (більше 85 г/л), гіпергамаглобулінемія (більше 23%). При формуванні ниркової дисфункції у загальному аналізі сечі визначають гематурію, протеїнурію.
Лабораторна діагностика. У загальному аналізі крові визначається гіпохромна анемія, незначний тромбоцитоз, підвищення ШОЕ, що не корелює з активністю ССД. У частини дітей виявляється гіперпротеїнемія (більше 85 г/л), гіпергамаглобулінемія (більше 23%). При формуванні ниркової дисфункції у загальному аналізі сечі визначають гематурію, протеїнурію.
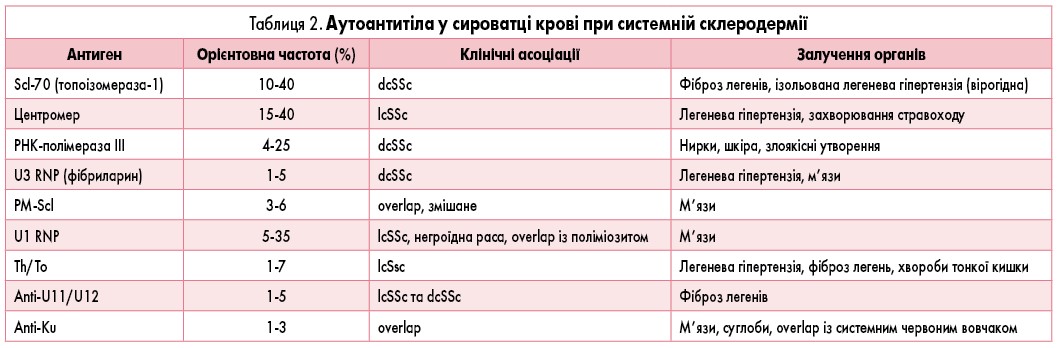
Діагностичне значення має наявність склеродермоспецифічних аутоантитіл. Антитіла до топоізомерази-1 (anti-Scl-70) частіше виявляються у хворих із дифузними формами хвороби, розповсюдженими ураженнями шкіри, при високій активності хвороби та ризику розвитку легеневого фіброзу (табл. 2).
При імунологічних дослідженнях у 81-90% дітей визначають антинуклеарні антитіла. Ревматоїдний фактор і антифосфоліпідні антитіла присутні у 17% пацієнтів із ЮССД і частіше визначаються у хворих при поєднанні склеродермії з синдромом Шегрена або ревматоїдним артритом. Концентрації циркулюючих імунних комплексів підвищуються у 30% дітей переважно на ранніх стадіях захворювання.
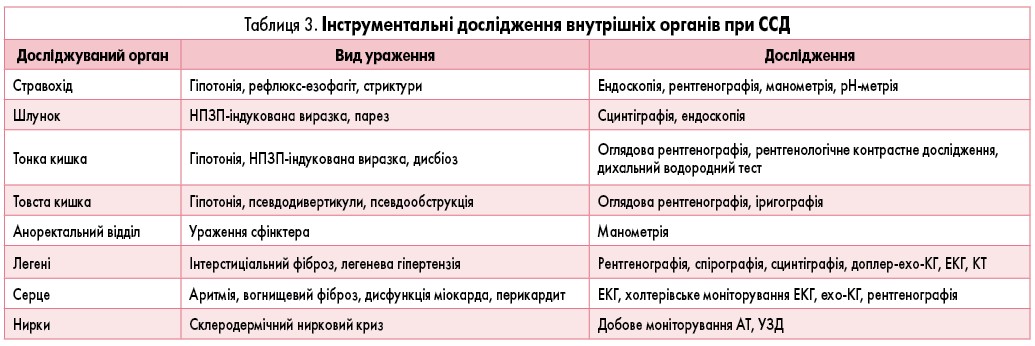
Для своєчасного виявлення і оцінки ступеня ураження внутрішніх органів при ССД проводять інструментальні дослідження (табл. 3). На рентгенографії органів грудної клітки спостерігаються ознаки так званого матового скла.
На початковій стадії клініко-рентгенологічні ознаки пневмофіброзу незначні або відсутні, тому всім хворим із ССД показане планове проведення спірографії для оцінки функціонального стану бронхолегеневої системи.
При рентгенологічному дослідженні стравоходу виявляють його гіпотонію зі зменшенням перистальтичних хвиль, затримкою проходження барію (у нормі 4-10 с), розширенням верхніх 2/3 його частин і звуженням нижнього відділу, інколи розвиваються кили стравохідного відділу діафрагми, ерозія й виразки.
Морфологічне дослідження: біопсія тканин (шкіри, м’язів, фасцій) та органів (стравоходу, легень, нирок) має високу інформативність навіть на ранніх стадіях захворювання. Однак вирішальним фактором у встановленні діагнозу залишається клінічна симптоматика хвороби.
Доплерографія судин – інформативний та перспективний метод, який дозволяє дослідити швидкість кровообігу в артеріях та венах, стан стінок судин, ступінь стенозу судин на ранніх стадіях хвороби.
Капіляроскопія виявляє патологічні зміни капілярів нігтьового ложа. На ранній стадії захворювання спостерігається розширення діаметру судин, у подальшому – редукція капілярів (відсутність кровообігу, «аваскулярні» поля).
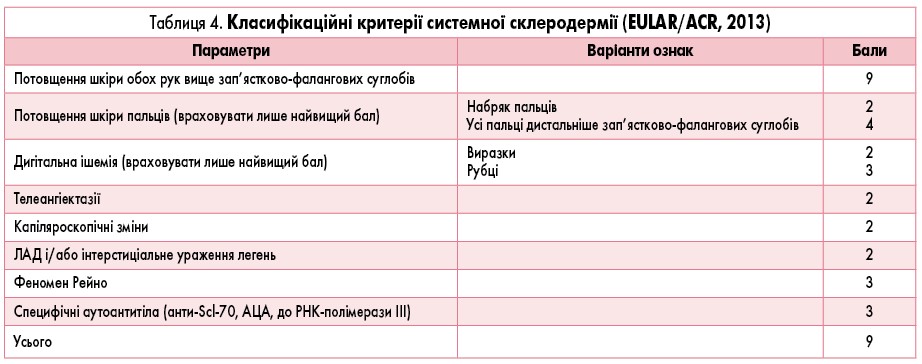
Діагностика ССД у дорослих проводиться при підрахунку балів клініко-імунологічних параметрів (EULAR/ACR, 2013). Достовірним діагноз ССД вважається за наявності більше 9 балів (табл. 4).
З урахуванням особливостей дебюту та перебігу склеродермії у дітей до 16 років, Європейською лігою по проблемам ревматизму (European League Against Rheumatism – EULAR), Європейським співтовариством дитячих ревматологів (Pediatric Rheumatology European Society), Американською колегією ревматологів (ACR) у 2007 р. валідовані діагностичні критерії ювенільної системної склеродермії.
Великі:
- проксимальний склероз/індурація: симетричне потовщення, натяжіння та індурація шкіри;
малі:
- шкіра: склеродактилія;
- периферийні судини: СР, телеангіектазії, ямочкоподібні рубці та стоншення м’яких тканин кінчиків пальців, кистей і/або стоп;
- гастроінтестинальні: дисфагія або гастроезофагеальна рефлюксна хвороба;
- серцеві: аритмія та серцева недостатність;
- ниркові: ниркова криза, артеріальна гіпертензія;
- дихальна система: фіброз переважно в базальних відділах обох легень, що виявляється при стандартній рентгенографії грудної клітки; зниження дифузійної здатності легень та розвиток легеневої артеріальної гіпертензії;
- неврологічні: нейропатія;
- опорно-рухового апарату: тендовагініти, артрит, міозит;
- серологічні: АНА, ССД-селективні антитіла (антицентромірні, антитопоізомерази-1 (Scl-70), антифібриларин, анти-PM-Scl, анти-РНК-полімерази 1, 2 та 3).
При наявності одного великого або двох чи більше малих критеріїв можливий діагноз ЮССД. Чутливість становить 97%, специфічність – 98%.
Оцінка лабораторної активності або тяжкості перебігу хвороби ускладнена. Регулярне спостереження та клінічний огляд є основою моніторингу для визначення активності прогресування. Запропоновані серологічні маркери активності, такі як міжклітинна молекула адгезії 1 (ICAM-1), пропептиди колагену, продукти розпаду колагену I типу, розчинний рецептор до інтерлейкіну-2 (sIL-2), неоптерину або судинної активації (Е-селектин, тромбомодулін, фактор фон Віллебранда) не виявили значної кореляції з клінічним статусом пацієнта. Об’єктивна оцінка необхідна для визначення ураження органів, таких як легеневий фіброз, легенева гіпертензія, патологія нирок. Крім того, необхідними є послідовна реєстрація й оцінка стану шкіри. Для оцінки індексу тяжкості ЮССД розроблено багатовимірний показник ступеня тяжкості (J4S) (F. La Torre, G. Martini, 2012).
У значної частини дорослих перші симптоми ССД формуються в дитинстві, але вчасно не діагностуються та недооцінюються, оскільки повна клінічна симптоматика може формуватися значно пізніше. Для вчасної діагностики системної склеродермії EULAR, EUSTAR (EULAR Scleroderma Trials and Research) и FESCA (Federation of European Scleroderma Association) у 2010 р. запропонований алгоритм (рис. 3).
Диференційну діагностику проводять з іншими захворюваннями склеродермічної групи (локальною склеродермією, склеродермою Бушке, дифузним еозинофільним фасциїтом) та хворобами сполучної тканини (ЮІА, ювенільним дерматоміозитом, системним червоним вовчаком, вузликовим поліартеріїтом, overlap-синдромом та ін.).
Склеродермоподібні зміни шкіри можуть спостерігатися і при деяких неревматичних захворюваннях: фенілкетонурії, прогерії, шкірній порфірії, діабеті, фіброміалгії, ангіоневротичному набряку, афтозному стоматиті, артрогрипозі, аутоімунному хронічному гепатиті, синдромі Гудпасчера, агамаглобулінемії Брутона, гістіоцитозі, гастроезофагеальнорефлюксній хворобі, остеоміеліті, після трансплантації кісткового мозку тощо.
Нефрогенний системний фіброз (NSF) – розлад фіброзу, який спостерігається лише у пацієнтів із нирковою недостатністю. Клінічно шкіра стає потовщеною і спаяною з тканинами, що призводить до зменшення діапазону руху та контрактур. Внутрішні органи (легені, серце, тверда мозкова оболонка, м’язи) можуть залучатися до процесу фіброзу. NSF характеризується потовщенням і затвердінням шкіри над кінцівками і тулубом у зв’язку із CD34-позитивними фіброцитами.
При прогерії (синдром Хатчінсона – Гілфорда) зміни шкіри зазвичай розвиваються протягом першого року життя і характеризуються потовщенням на животі, боках, проксимальних ділянках стегон та сідниць.
Лікування. Метою є корекція судинних порушень і профілактика їх ускладнень; затримка прогресування фіброзу; профілактика і лікування уражень внутрішніх органів; поліпшення якості та збільшення тривалості життя. Хворі на ССД, уперше виявлену чи в період загострення, підлягають стаціонарному лікуванню в спеціалізованих ревматологічних відділеннях лікарень, а в період ремісії потребують нагляду ревматолога за місцем проживання. Ретельно розроблена програма лікування враховує активність, прогресування, тяжкість, залучення життєво важливих органів та включає:
- догляд за шкірою;
- фізичні вправи для підтримки функціональних можливостей;
- судинний захист;
- психологічну та соціальну підтримку;
- фармакологічну терапію, включаючи обговорення доступних варіантів;
- хірургічні процедури (за необхідності);
- допомогу в ознайомленні з хворобою пацієнта та батьків і сприяння дотриманню складного плану лікування.
Нефармакологічні заходи включають:
- заохочення дитини до максимальної фізичної активності;
- фізіотерапію для підтримки функціональної здатності, сили м’язів та руху суглобів, для запобігання контрактурам згинання, яку необхідно виконувати послідовно, оскільки помилкові та нерегулярні схеми менш ефективні;
- використання коригуючих засобів протягом тривалого періоду;
- загальний догляд за шкірою, уникнення подразнюючих речовин та щоденне застосування ланоліну або водорозчинних кремів;
- пацієнтам слід уникати холоду, травм, спеки та інсоляцій;
- застуда і травма можуть посилювати симптоми основного захворювання, діти також сприйнятливі до гіперпігментації від сонячного світла.
Основні види фармакологічної терапії при ССД: імуносупресивна, протизапальна, антифібринозна, судинна, локальна, симптоматична і реабілітаційна.
Консенсус лікування ССД на сучасному етапі розроблений під егідою Європейської ліги проти ревматизму (EULAR) цільовою дослідницькою групою EUSTAR, до якої увійшли дитячі ревматологи.
Активована імунна система може бути важливим стимулом як для фіброзного, так і для судинного ураження при системному склерозі, особливо на ранніх стадіях захворювання. Імуносупресивну терапію включають до складу комплексного лікування ССД при високій активності, вираженому прогресуванні захворювання, фіброзуючому альвеоліті, ураженні нирок.
Метотрексат найбільш ефективний у лікуванні ранньої (<3 років від початку захворювання) дифузної ССД, при розповсюджених ураженнях шкіри, суглобів, м’язів, периартикулярних контрактурах, наявності перехресного синдрому. На початку лікування метотрексат призначають у дозі 7,5-10мг/м2 1 раз на тиждень разом із фолієвою кислотою, поєднують із прийомом глюкокортикоїдів (ГК) у дозі 0,5 мг/кг на добу протягом 6-8 тиж. зі зниженням дози до підтримувальної протягом не менше 2 років.
Препаратом вибору для лікування тяжкої дифузної форми CCД зі швидко прогресуючим перебігом інтерстиціального ураження легень та нирок є циклофосфамід (ЦФ). Використовуються різні схеми його застосування як у монотерапії, так і у комбінації з ГК. Призначають в/в крапельно 15мг/кг 1 раз на місяць протягом 6-12 міс., а потім 1 раз на 2-3 міс. або щоденно per os по 1-2мг/кг на добу.
При наявності інтерстиціального ураження легень рекомендується використовувати азатіоприн у сполученні з низькими дозами ГК як на початку терапії, так і після курсу ЦФ.
Циклоспорин у дозі 2-3 мг/добу пригнічує клітинний імунітет, а також знижує синтез колагену. Однак терапевтичний потенціал циклоспорину при ССД обмежений потенційною нефротоксичністю.
У кількох обсерваційних дослідженнях показана ефективність мікофенолату мофетилу при лікуванні дифузних уражень шкіри та легеневого фіброзу протягом 12 місяців. Однак доказів переваги порівняно з іншими імуносупресивними засобами (метотрексатом та ЦФ) не виявлено.
Амінохінолінові препарати (делагіл, плаквеніл) можуть бути введені у комплексну терапію при хронічному перебігу ССД.
В якості протизапальної терапії при наявності клінічних і лабораторних ознак запальної й імунологічної активності в ранню стадію ССД, при підгострому та гострому перебігу можуть використовуватися ГК. Однак тривале їх призначення у високих дозах є потенційно токсичним і підвищує ризик ниркового кризу. Тому ГК-терапію обмежено слід призначати пацієнтам із прогресуючим дифузним ураженням шкіри, активним міозитом, рефрактерним артритом, серозитом, альвеолітом. Доза коливається в межах 0,5-1 мг/кг із поступовим зниженням до підтримувальної 0,3 мг/кг, найнижча ефективна доза становить 10 мг/добу преднізолону. При вираженому фіброзі та на пізній стадії хвороби ГК мало ефективні та можуть посилювати склеротичні процеси.
Нестероїдні протизапальні засоби (НПЗП) у стандартних дозах застосовують при м’язово-суглобовому синдромі з вираженим больовим синдромом:
а) диклофенак натрію 2-3 мг/кг маси тіла на добу за 3 прийоми;
б) ібупрофен 20-30 мг/кг маси тіла на добу за 3-4 прийоми, але не більше 40 мг/кг на добу;
в) мелоксикам (моваліс) 1 раз на добу в дозі 7,5 мг дітям старше 12 років;
г) напроксен дітям старше 12 років 10 мг/кг маси тіла за 2-3 прийоми.
Із групи антифіброзних засобів у дитячому віці найбільш часто застосовується D-пеніциламін, який впливає як на біосинтез колагену, так і на імунну систему. Один із можливих механізмів полягає в тому, що аутоантитіла проти аутоантигенів при ССД фрагментуються через реактивні види кисню та метали (мідь, залізо), а пеніциламін як хелатор металів може мінімізувати утворення цих аутоантигенів. Показаннями до його призначення є прогресуючий перебіг ССД із дифузною індурацією шкіри та фіброзними змінами внутрішніх органів. D-пеніциламін починають призначати з 2,5-5 мг/кг на добу; при задовільній переносимості доза підвищується кожні 3-5 днів до максимальної – 15-20 мг/кг (не більше 750 мг на добу). Лікування може тривати від 6-12 місяців до 3-5 років із корекцією дози за необхідності та при досягненні терапевтичного ефекту (табл. 5).
У проведених в останні роки дослідженнях повідомлялося про антифібротичний ефект інтерферонів при терапії ССД. Інтерферон γ (IFN-γ) є більш потужним інгібітором синтезу колагену in vitro, ніж інтерферон α (IFN-α). Однак IFN-γ може призвести до активації ССД, тому що сприяє активації макрофагів, експресії антигену класу II (DR, DP, DQ) на клітинах ендотелію та фібробластах, підвищує експресію рецепторів інтерлейкіну-2 та внутрішньоклітинної молекули адгезії-1 на ендотеліальних клітинах, Fc рецепторів імуноглобуліну G (IgG). Ці дані підтверджені у неконтрольованих дослідженнях, в яких IFN-γ асоціювався зі значними судинними побічними ефектами, включаючи нирковий гіпертонічний криз.
При хронічному перебігу захворювання позитивний ефект мають ферментативні препарати (лідаза, ронідаза, лонгідаза), які призначають курсами підшкірних або в/м ін’єкцій, електрофорезу або аплікацій на ділянки контрактур та індуративно змінених тканин.
Для корекції порушень мікроциркуляції використовують препарати різних груп – вазодилататори, дезагреганти, антикоагулянти. Показання до застосування: виражений СР, легенева гіпертензія, ниркова артеріальна гіпертензія.
Блокатори кальцієвих каналів – терапія першої лінії судинних уражень СР у дітей. Із цієї групи найбільш ефективними є дигідропіридинові антагоністи кальцію, які викликають системну периферичну вазодилатацію, зниження периферичного судинного опору, що сприяє зменшенню частоти й інтенсивності епізодів вазоспазму, прискоренню загоєння дигітальних виразок, поліпшенню кровообігу. Доза блокаторів кальцієвих каналів у дітей визначається індивідуально під контролем артеріального тиску з урахуванням віку і маси тіла дитини: ніфедипін (0,25-0,5 мг/кг 2 рази на день,10-30 мг/добу), амлодипін (2,5-10 мг/добу), дилтіазем (2,5-10 мг/добу) курсами або протягом року. Тривалість терапії не менше 6-12 міс.
Інгібітори ангіотензинперетворюючого ферменту (АПФ) – каптоприл, еналаприл, лізіноприл – призначають хворим зі склеродермічною ниркою, вираженою вазоконстрикцією та артеріальною гіпертензією. Позитивна дія препаратів визначається при легеневій гіпертензії, серцевій недостатності, порушеннях мікроциркуляції. Каптоприл дітям призначають з невеликих доз (0,1-0,2 мг/кг на добу), щоб запобігти розвитку гіпотензії після перших прийомів препарату, із поступовим підвищенням до ефективної (0,3-0,5 мг/кг на добу).
Еналаприл застосовують у початковій дозі 0,1 мг/кг на добу за 1-2 прийоми (не більше 2,5 мг/добу) та поступовим збільшенням до ефективної (0,5 мг/кг на добу). Лізиноприл призначають у дозі 0,08 мг/кг 1 раз на добу.
Антагоніст рецепторів ангіотензину II. Ефективність та безпечність застосування лозартану досліджені у дітей старше 6 років у добовій дозі 0,7-1,4 мг/кг (максимально 50-100 мг). Доведено зменшення частоти та тяжкості нападів вазоспазму при лікуванні лозартаном у дозі 25-100 мг/добу.
Вазодилататори доцільно поєднувати з дезагрегантами. У клінічній практиці використовують пентоксифілін в/в крапельно у дозі 20 мг/рік життя на добу за 2 введення протягом 12-14 днів, із переходом на пероральний прийом (0,1-0,3 г/добу за 2 прийоми).
Інгібітор агрегації тромбоцитів (дипіридамол) використовується як антиагрегант, ангіопротектор, вазодилататор міотропної дії, імуномодулятор. Призначають у дозі 5мг/кг маси тіла за 2-3 прийоми. Тривалість лікування до 12 міс.
Препарат простагландинів (альпростадил) є засобом вибору при прогресуючому розповсюдженому СР і тяжких судинних ураженнях із ішемічними некрозами. Фармакологічна дія парентеральних простациклінів проявляється у пригніченні ключових профібротичних факторів (таких як фактор росту сполучної тканини), вазодилатацією, пригніченням активності й агрегації тромбоцитів. Рекомендується повільне (протягом 120-360 хв.) в/в введення препарату в дозі 20-40 мкг/добу, яка вводиться із розрахунку 0,6 мк/кг за год, 10-15 перфузій на курс.
До міжнародних клінічних рекомендацій із лікування легеневої гіпертензії паралельно із патогенетичною терапією ССД включені бозентан – інгібітор ендотеліну (в Україні не зареєстрований) та ілопрост – синтетичний аналог простацикліну (PGI2). Ілопрост використовують для лікування легеневої гіпертензії, критичної ішемії кінцівок, важких судинних уражень із виразково-некротичними змінами на шкірі, при СР у випадках недостатньої ефективності інших лікарських засобів. Крім розширення судин, ілопрост також має антифібротичні властивості. Препарат у вигляді в/в інфузій застосовується тільки в умовах ретельного моніторингового спостереження у спеціалізованих відділеннях дитячих стаціонарів зі швидкістю введення 0,5-2 нг/кг за хв., тривалість курсу для хворих із СР – 3-5 днів.
Антицитокінова терапія. Терапія моноклональними антитілами анти-TNF-α у клінічних дослідженнях виявилася неефективною. Продовжують вивчатися інші стратегії, які включають блокаду IL-6, засновані на асоціації високої експресії IL-6 зі ступенем тяжкості захворювання та на підтвердженні того, що нейтрофільно залежна транс-сигналізація може сприяти мікроваскулопатії при склеродермії. Виявлена також кореляція між високим рівнем циркуляції IL-6 та більшою частотою смертельних випадків або прогресуючим фіброзом легенів.
Потенційно перспективні підходи до лікування ССД. Іматиніб мезилату, інгібітор тирозинкінази, високоефективний для лікування хронічного мієлоїдного лейкозу та стромальних пухлин ШКТ, може бути корисним для пацієнтів із ССД. Селективне пригнічення тирозинкінази заважає синтезу двох головних медіаторів фіброзу – фактора росту, ТФР-β. Невеликі дослідження іматинібу доводять його обмежену користь, однак виявити його загальну перевагу над традиційною терапією не вдалося, що потребує подальших випробувань.
В-клітинна інфільтрація була продемонстрована у шкірних та легеневих біоптатах хворих на ССД. Кілька повідомлень про окремі випадки та невеликі дослідження свідчать про поліпшення стану шкіри та легенів при використанні ритуксимабу. Найбільше дослідження з оцінки впливу ритуксимабу на стан хворих із фіброзом шкіри та легень включало 63 пацієнти з ССД, які отримували ритуксимаб, та 25 дітей із групи контролю. За період спостереження 7 місяців у пацієнтів з інтерстиціальним захворюванням легень ритуксимаб продемонстрував здатність запобігати подальшому зниженню життєвої ємкості легень порівняно з контролем. Однак для встановлення довгострокової ефективності та безпеки ритуксимабу для хворих із фіброзом шкіри та легень потрібні додаткові дослідження, перш ніж рекомендувати його для клінічного використання.
У кількох невеликих неконтрольованих дослідженнях був позитивно оцінений ефект в/в введення імуноглобуліну (IVIG) при фіброзі шкіри.
У стадії вивчення нові методи лікування: трансплантація аутологічних стовбурових клітин, цитокінокоригуюча терапія та ін. (табл. 6).
Аутологічна трансплантація стовбурових клітин (АТСК) продемонструвала ефективність у запобіганні прогресуванню захворювання у хворих на ССС. Однак висока частота ускладнень (смерть, злоякісні новоутворення, інфекції), пов’язана з лікуванням АТСК, обмежила його використання при ССД. Перед АТСК важливим є ретельна оцінка ризиків та ознайомлення з ними пацієнтів і їх батьків. Виходячи з нових даних випробувань АТСК, можна проводити у пацієнтів із раннім, тяжким, прогресуючим перебігом дифузної склеродермії при помірному (але не тяжкому) ураженні внутрішніх органів, незважаючи на початкове застосування імуносупресивної терапії. Процедуру слід проводити у спеціалізованих центрах, які мають досвід її виконання.
Для лікування тяжкого СР можуть призначатися низькомолекулярні гепарини. Ефект спостерігається на 4-ому тижні лікування.
При ураженні травного тракту (пептичному езофагіті, гастриті, дуоденіті) рекомедується призначати антациди, антагоністи гістамінових Н2-рецепторів, метоклопрамід, омепразол. У разі розвитку симптоматичних моторних уражень стравоходу та кишечнику (дисфагії, гастроезофагеального рефлюксу, псевдообструкції) призначають прокінетики.
При гострому швидко прогресуючому перебігу ССД із ураженням нирок терапія поєднується з екстракорпоральними методами детоксикації.
При поверхневих і маловогнищевих формах СД показане місцеве лікування з аплікаціями мазей, що містять гепарин, ККС, троксерутин, хондроїтину сульфат, індометацин, або офіцинальних мазей (гепарину, актовегіну, хондроксиду, метилурацилу, контратубексу).
Система комплексного лікування хворих ССД обов’язково включає курси лікувальної фізкультури, масажу, в період клінічної ремісії – грязьові аплікації, бальнеотерапію, гіпербаричну оксигенацію. Хворим із хронічним перебігом ССД показане санаторно-курортне лікування з включенням сірководневих та вуглекислих ван, фізіотерапії, лікувальної грязі.
Профілактика ССД включає виявлення факторів ризику розвитку захворювання, проведення активної вторинної профілактики загострень і генералізації склеродермічного процесу. Диспансерне спостереження проводиться в поліклініці довічно із систематичним (перший рік кожні 3 місяці, потім – двічі на рік) обстеженням та корекцією лікування в умовах стаціонару.
Прогноз для пацієнтів із ССД при правильному та адекватному лікуванні, крім тяжких форм прогресуючого перебігу, для життя позитивний. У дітей частіше спостерігаються обмежені форми захворювання, асиметрія росту кінцівок (при ураженні однієї кінцівки), відставання в рості та масі тіла. Можливе формування виражених косметичних дефектів, інвалідізація хворих у зв’язку з порушенням функції опорно-рухового апарату і розвитком вісцеральних уражень. Частота виживання при системному склерозі, що розпочався в дитинстві, через 5, 10, 15 та 20 років після встановлення діагнозу становить 89, 80-87, 74-87 та 69-82% відповідно, що значно перевищує показники у дорослих. Смертність серед дітей із ССД віком до 14 років складає 0,04 випадки на 1 млн населення на рік. Найбільш поширені причини летальності – прогресуюча серцево-легенева недостатність, склеродермічний нирковий криз. Кардіоміопатія є провідною причиною ранньої смерті у дітей. Це ускладнення рідкісне і зазвичай пов’язане із дифузним склерозом шкіри та поліміозитом. Агресивне імуносупресивне лікування ефективне для ураження м’язів, шкіри та легень, але не запобігає прогресуванню дисфункції міокарда.
Висновки
- Пацієнти з ювенільним системним склерозом мають значний ризик розвитку тяжких форм захворювання з несприятливим прогнозом.
- ЮССД характеризується симетричним волокнистим потовщенням та індурацією шкіри у поєднанні зі змінами у внутрішніх органах – стравоході, кишковому тракті, серці, легенях та нирках.
- Лікування включає нефармакологічні заходи, терапію, що модифікує захворювання, і терапію ускладнень.
- Відсутність достатньої кількості контрольованих досліджень визначає складність фармакологічної терапії у дітей із системним склерозом. Лікування підбирається з оглядом на індивідуальні потреби пацієнта, конкретні клінічні прояви захворювання та ускладнення у залучених органах.
Література
- Гусева Н.Г. Системная склеродермия. Ревматология: национальное руководство/Под ред. Е.Л. Насонова и В.А. Насоновой. – М.: Медицина, 2010. – С. 447-467.
- Denton C.P. Scleroderma Lung Study II-clarity or obfuscation? Lancet Respir Med 2016; 4: 678.
- Herrick A.L., Pan X., Peytrignet S. et al. Treatment outcome in early diffuse cutaneous systemic sclerosis: the European Scleroderma Observational Study (ESOS). Ann Rheum Dis 2017; 76: 1207.
- Van den Hoogen F., Khanna D., Fransen J. et al. 2013 classification criteria for systemic sclerosis: an American college of rheumatology/European league against rheumatism collaborative initiative. Ann Rheum Dis 2013; 72: 1747.
- Kowal-Bielecka O., Landewe R., Avouac J. et al. EULAR recommendations for the treatment of systemic sclerosis: a report from the EULAR Scleroderma Trials and Research group (EUSTAR). Ann Rheum Dis 2009; 68: 620.
- Khan K., Xu S., Nihtyanova S. et al. Clinical and pathological significance of interleukin 6 overexpression in systemic sclerosis. Ann Rheum Dis 2012; 71: 1235.
- Poelman C.L., Hummers L.K., Wigley F.M. et al. Intravenous immunoglobulin may be an effective therapy for refractory, active diffuse cutaneous systemic sclerosis. J Rheumatol 2015; 42: 236.
- Tashkin D.P., Roth M.D., Clements P.J. et al. Mycophenolate mofetil versus oral cyclophosphamide in scleroderma-related interstitial lung disease (SLS II): a randomised controlled, double-blind, parallel group trial. Lancet Respir Med 2016; 4: 708.
- La Torre F., Martini G., Russo R. et al. A preliminary disease severity score for juvenile systemic sclerosis. Arthritis Rheum 2012; 64: 4143. http://onlinelibrary.wiley.com/doi/10.1002/art.34652/abstract.
- Smith V., Van Praet J.T., Vandooren B. et al. Rituximab in diffuse cutaneous systemic sclerosis: an openlabel clinical and histopathological study. Ann Rheum Dis 2010; 69: 193.
- Sullivan K.M., Goldmuntz E.A., Keyes-Elstein L. et al. Myeloablative Autologous Stem-Cell Transplantation for Severe Scleroderma. N Engl J Med 2018; 378: 35.
- Volkmann E.R., Tashkin D.P. Treatment of Systemic Sclerosis-related Interstitial Lung Disease: A Review of Existing and Emerging Therapies. Ann Am Thorac Soc 2016; 13: 2045.
- Zulian F., Woo P., Athreya B.H. et al. The Pediatric Rheumatology European Society/American College of Rheumatology/European League against Rheumatism provisional classification criteria for juvenile systemic sclerosis. Arthritis Rheum 2007; 57: 203.
- Zulian F. Systemic sclerodermas. In: Textbook of Pediatric Rheumatology, 7th ed., Petty R.E., Laxer R.M., Lindsley C.B., Wedderburn L.R. (Eds), Elsevier, Philadelphia 2016. Р. 384.
Тематичний номер «Педіатрія» № 2 (58) 2021 р.