10 липня, 2023
Довгострокова ефективність антипсихотичних препаратів у дорослих із гострою фазою шизофренії
Більшість випробувань ефективності антипсихотичних препаратів (АП) у пацієнтів із гострою фазою шизофренії тривають лише кілька тижнів, але зазвичай курс терапії є набагато довшим. Метою мережевого метааналізу, здійсненого S. Leucht et al., було перевірити довгострокову ефективність АП першого й другого поколінь на підставі даних досліджень тривалістю щонайменше 6 місяців. Основні результати – вплив на зміну загальної симптоматики шизофренії; проаналізовано також низку вторинних результатів. Пропонуємо до вашої уваги огляд публікації S. Leucht et al. «Long-term efficacy of antipsychotic drugs in initially acutely ill adults with schizophrenia: systematic review and network meta-analysis» у виданні World Psychiatry (2023 Jun; 22 (2): 315‑324).
Шизофренія – це психічний розлад, який, за даними Всесвітньої організації охорони здоров’я, потрапляє до двадцятки основних причин інвалідності і вражає близько 1% населення (Vos et al., 2012). АП є основою лікування шизофренії. Хоча за гострих епізодів часто необхідні курси АП тривалістю кілька місяців (а потім їх часто продовжують приймати як засоби підтримувальної терапії), більшість досліджень ефективності АП є короткочасними: середня тривалість за гострої фази шизофренії становить 6 тижнів, а максимальна – 13 тижнів (Huhn et al., 2019).
Таку невідповідність між звичайним перебігом розладу та тривалістю досліджень його основного лікування піддавали справедливій критиці (Thornley and Adams, 1998). Певні побічні ефекти АП, як-от збільшення ваги, можуть накопичуватися із часом, і тому їх можна адекватно оцінити лише у довготривалих дослідженнях. Висновки щодо ефективності метааналізів, основаних на даних короткострокових досліджень, також можуть бути упередженими. Як зазначають дослідники, деякі препарати – як-от оланзапін, кветіапін і клозапін – мають сильну спорідненість із рецепторами гістаміну, блокування яких призводить до седації (Correll, 2010).
Це може мати вплив на оцінку фактичної антипсихотичної ефективності. Оскільки початкова седація часто слабшає, коли пацієнти звикають до ліків, тривалі дослідження за участю осіб із початковою гострою фазою хвороби, на думку S. Leucht et al., мають достовірніше відображати справжню ефективність АП.
Підсумовані в інших мережевих метааналізах результати довгострокових досліджень, присвячених запобіганню рецидивам, не можуть заповнити зазначену вище прогалину, оскільки отримані для пацієнтів, які досягли стабілізації під час приймання АП упродовж кількох місяців перед рандомізацією. Власне, побічні ефекти вже могли досягати плато на початку таких досліджень, і як наслідок могли бути оцінені повторні загострення симптомів (рецидиви), а не їх зменшення.
S. Leucht et al. вважають, що бракує ланки, яка є дослідженням редукції симптомів і побічних ефектів у довготривалих рандомізованих контрольованих дослідженнях (РКД), проведених за участю пацієнтів із гострою фазою шизофренії. Тому їхньою метою було заповнити згадану прогалину завдяки проведенню мережевого метааналізу ефективності та переносимості АП, який охоплював лише дані РКД тривалістю від 6 місяців за участю пацієнтів із гострим епізодом захворювання.
Матеріали та методи дослідження
Отримані результати було оформлено відповідно до рекомендацій щодо бажаних елементів звітності для систематичних оглядів і метааналізів (PRISMA). Метааналіз уміщував дані досліджень за участю дорослих із початковими гострими симптомами шизофренії (або шизофреноподібного / шизоафективного розладу), присвячених вивченню ефективності АП другого покоління, доступних у Європі та США, а також низки АП першого покоління (як-от бенперидол, хлорпромазин, клопентиксол, флупентиксол, флуфеназин, галоперидол, левомепромазин, локсапін, моліндон, пенфлуридол, перазин, перфеназин, пімозид, сульпірид, тіоридазин, тіотиксен, трифлуоперазин і зуклопентиксол). Власне, АП були представлені у всіх доступних лікарських формах (препарати для ін’єкцій тривалої дії, LAI), крім засобів для внутрішньом’язових ін’єкцій короткої дії (оскільки загалом їх використовують за екстрених ситуацій). Як зазначають дослідники, у включених дослідженнях застосовували гнучке дозування, оскільки дози титрували до оптимальних для окремих пацієнтів. Випробування із застосуванням фіксованих дозувань охоплювали дані щодо доз від цільових до максимальних, відповідно до Міжнародного консенсусного дослідження дозування АП (Gardner et al., 2010). Якщо використовували кілька дозувань, результати для окремих груп усереднювали за допомогою відповідних методів.
Основним результатом була зміна загальної симптоматики шизофренії, виміряна за такими інструментами, як шкала оцінювання позитивних і негативних симптомів (PANSS), коротка психіатрична оцінювальна шкала (BPRS) та інших. Вторинними результатами були дані щодо: припинення лікування з усіх причин; зміни позитивних, негативних симптомів і ознак депресії; якості життя, соціального функціонування, збільшення ваги, застосування протипаркінсонічних препаратів, акатизії, рівня пролактину в сироватці крові, подовження інтервалу QTc і седації.
Для мережевого метааналізу застосовували частотний підхід (пакет netmeta R). Величину ефекту для постійних результатів, отриманих за шкалою, розглядали як стандартизовану середню різницю (СтСР). Середні різниці (СР) використовували щодо збільшення ваги, рівня пролактину в сироватці крові та подовження інтервалу QTc; відношення шансів (ВШ) – для дихотомічних результатів. Усі отримані значення представлено з 95% довірчими інтервалами (ДІ).
Відносні ефекти лікування оцінювали порівняно з препаратом, який застосовували у більшості досліджень (оланзапін). Ефекти лікування інтерпретували, зважаючи на оцінки середніх значень і діапазон 95% ДІ, уникаючи таких термінів, як «статистично значущий» та інших способів дихотомізації результатів на підставі значень p. Для поліпшення інтерпретації кінцеві результати, оцінені ВШ, перетворено на відносні ризики (ВР) із використанням відповідних результатів у групах застосування оланзапіну.
Достовірність доказів для первинного результату оцінювали за допомогою системи CINeMA (Confidence in Network Meta-Analysis), яка дає змогу класифікувати впевненість у результатах на високу, помірну, низьку та дуже низьку (Nikolakopoulou et al., 2020). Для цього було встановлено мінімальну відповідну СтСР±0,1.
Результати дослідження
До метааналізу включено дані 45 досліджень (загалом 11 тис. 238 учасників), 41 із яких було подвійним сліпим, а чотири – сліпими. Середня тривалість досліджень становила 42 тижні (міжквартильний діапазон [МКД]: від 26 до 52). Середній вік учасників – 37,2 року (МКД: від 35,2 до 39,1); 40% були жінки.
У РКД вивчали ефективність амісульприду, арипіпразолу, азенапіну, хлорпромазину, клозапіну, флуфеназину, флуспірілену, галоперидолу, ілоперидону, локсапіну, луразидону, оланзапіну, паліперидону, пенфлуридолу, перфеназину, пімозиду, кветіапіну, рисперидону, тіоридазину, тіотиксену, трифлуоперазину, зипразидону, зотепіну та плацебо.
Щодо АП першого покоління доступні дані лише для незначної кількості учасників, за винятком галоперидолу та перфеназину (для всіх інших – <100 учасників; щодо тіотиксену було відомо, що його з будь-яких причин припинили приймати 105 учасників).
Первинний результат: зміна загальної симптоматики
Загалом 23 дослідження за участю 9 тис. 814 учасників, у яких вивчали ефективність 14 АП, були доступні для мережевого метааналізу первинного результату: зміни загальної симптоматики.
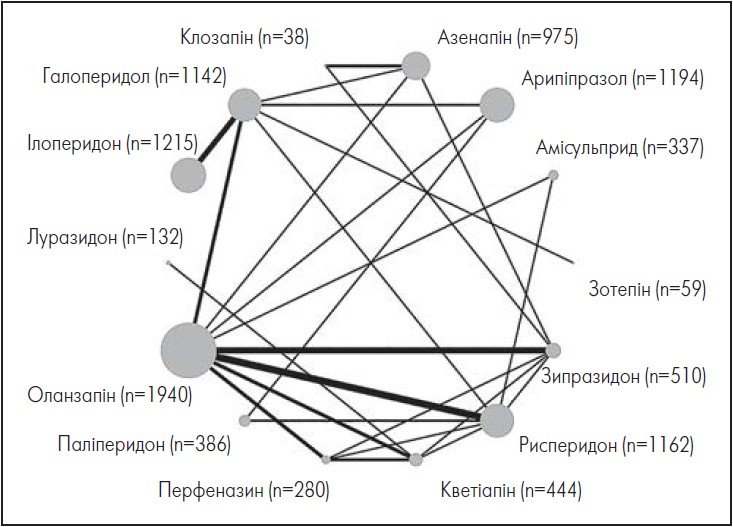
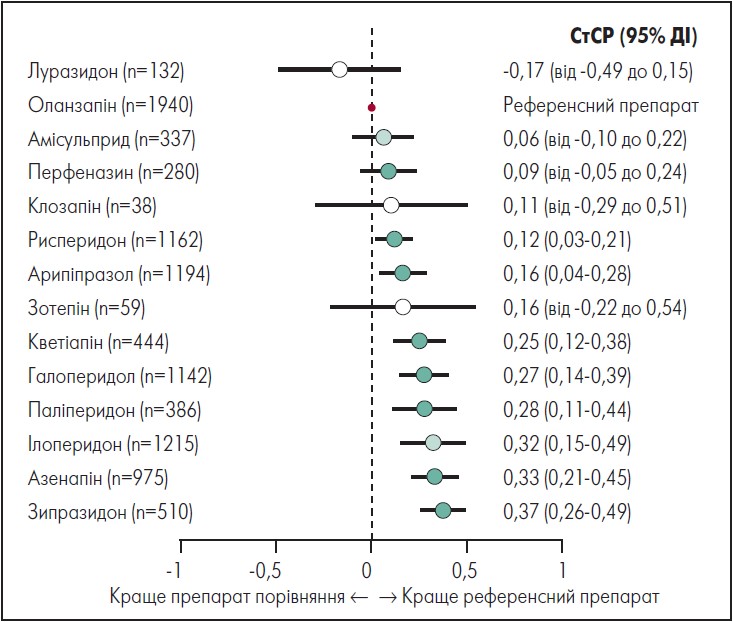
На рисунку 1 представлено мережевий графік, який демонструє зміни загальної симптоматики, а на рисунку 2 – результати мережевого метааналізу (кількісні показники).
Примітка. У дужках вказано кількість учасників випробувань.
Рис. 1. Зміна загальної симптоматики (первинний результат) у вигляді мережевого графіка
Адаптовано за S. Leucht et al. «Long-term efficacy of antipsychotic drugs in initially acutely ill adults with schizophrenia: systematic review and network meta-analysis». World Psychiatry. 2023 Jun; 22 (2): 315‑324.
Примітки: у дужках вказано кількість учасників випробувань; СтСР – стандартизована середня різниця; ДІ – довірчий інтервал; кольори означають ступінь достовірності доказів згідно з системою CINeMA (темно-зелений – помірна, світло-зелений – низька, білий – дуже низька).
Рис. 2. Форест-діаграма, що відображає зміну загальної симптоматики (первинний результат)
Адаптовано за S. Leucht et al. «Long-term efficacy of antipsychotic drugs in initially acutely ill adults with schizophrenia: systematic review and network meta-analysis». World Psychiatry. 2023 Jun; 22 (2): 315‑324.
Як зазначають дослідники, оланзапін був у середньому ефективнішим, ніж зипразидон (СтСР=0,37; 95% ДІ 0,26‑0,49), азенапін (СтСР=0,33; 95% ДІ 0,21‑0,45), ілоперидон (СтСР=0,32, 95% ДІ 0,15‑0,49), паліперидон (СтСР=0,28, 95% ДІ 0,11‑0,44), галоперидол (СтСР=0,27; 95% ДІ 0,14‑0,39), кветіапін (СтСР=0,25; 95% ДІ 0,12‑0,38), арипіпразол (СтСР=0,16; 95% ДІ 0,04‑0,28) і рисперидон (СтСР=0,12; 95% ДІ 0,03‑0,21).
Так, 95% ДІ для оланзапіну порівняно з арипіпразолом і рисперидоном свідчать про можливість отримання незначущих ефектів. Відмінності між застосуванням оланзапіну і луразидону, амісульприду, перфеназину, клозапіну і зотепіну були незначними або невизначеними.
За подальшими результатами мережевого метааналізу, а також даними попарних метааналізів, луразидон, амісульприд, перфеназин, рисперидон і арипіпразол були в середньому ефективнішими, ніж деякі інші препарати, зі значеннями 95% ДІ, які роблять протилежні ефекти малоймовірними (достовірність доказів цих порівнянь – від помірної до дуже низької). Флуфеназин, флуспірілен, пімозид, локсапін і хлорпромазин були виключені з мережевого аналізу.
Під час аналізу чутливості результати істотно не змінилися. Коли дані досліджень, які виконав виробник оланзапіну, були виключені, відмінності застосування оланзапіну порівняно з рисперидоном, арипіпразолом, галоперидолом та ілоперидоном більше не були очевидними, оскільки 95% ДІ передбачали можливість отримання протилежних ефектів (але напрям цих відмінностей залишався таким, як і за основного аналізу).
Припинення лікування з усіх причин
Дані щодо припинення лікування з усіх причин на підставі результатів 26 РКД (загалом 8 тис. 882 учасників) свідчать, що оланзапін був кращим за флуфеназин (ВР=2,00; 95% ДІ 1,44‑2,28), пімозид (ВР=1,93; 95% ДІ 1,04‑2,32), кветіапін (ВР=1,55; 95% ДІ 1,35‑1,72), флуспірілен (ВР=1,53; 95% ДІ 0,36‑2,30), тіотіксен (ВР=1,51; 95% ДІ 1,07‑1,88), паліперидон (ВР=1,47; 95% ДІ 1,29‑1,65), азенапін (ВР=1,46; 95% ДІ 1,31‑1,60), зипразидон (ВР=1,44; 95% ДІ 1,29‑1,58), галоперидол (ВР=1,44; 95% ДІ 1,29‑1,58), зотепін (ВР=1,41; 95% ДІ 0,95‑1,82) і перфеназин (ВР=1,27; 95% ДІ 1,08‑1,46). Амісульприд, арипіпразол і рисперидон також перевершували деякі інші АП.
Позитивні та негативні симптоми
Результати щодо позитивних і негативних симптомів, основані на даних 14 РКД (загалом 6 тис. 155 учасників) були подібними до загальних симптомів.
Щодо редукції позитивних симптомів оланзапін був ефективнішим, ніж хлорпромазин (СтСР=0,51; 95% ДІ 0,09‑0,93), зипразидон (СтСР=0,37; 95% ДІ 0,21‑0,54), паліперидон (СтСР=0,32; 95% ДІ 0,12‑0,52), азенапін (СтСР=0,27; 95% ДІ 0,14‑0,41), зотепін (СтСР=0,19; 95% ДІ від -0,19 до 0,56) та арипіпразол (СтСР=0,18; 95% ДІ 0,05‑0,31). Даних щодо застосування перфеназину, клозапіну та ілоперидону нині бракує. Результати одного дослідження, яке не увійшло до мережевого аналізу, свідчать, що луразидон сприяв редукції позитивних симптомів ефективніше, ніж кветіапін (Loebel et al., 2013).
Щодо негативних симптомів, то оланзапін був дієвішим, ніж хлорпромазин (СтСР=2,35; 95% ДІ 1,84‑2,87), зипразидон (СтСР=0,33; 95% ДІ 0,17‑0,50), галоперидол (СтСР=0,27; 95% ДІ 0,14‑0,40), азенапін (СтСР=0,22; 95% ДІ 0,08‑0,35) і рисперидон (СтСР=0,21; 95% ДІ 0,07‑0,34). Даних щодо перфеназину, клозапіну та ілоперидону бракує. Хлорпромазин найменше сприяв редукції симптомів, але результати базувалися на даних одного невеликого дослідження лише з 50 учасниками (Singam et al., 2011).
Симптоми депресії
Мережевий метааналіз даних щодо впливу на симптоми депресії виконували на підставі результатів 11 РКД (загалом 6 тис. 686 учасників). Більшість результатів були недостовірними відповідно до 95% ДІ. Луразидон був ефективнішим за низку інших препаратів, але ці висновки випливають зі згаданого вище єдиного РКД, у якому його порівнювали з кветіапіном, а решта доказів були непрямими (Loebel et al., 2013).
Якість життя та соціальне функціонування
Результати восьми РКД (загалом 2 тис. 949 учасників) не дали змоги виявити чітких відмінності щодо впливу на якість життя. Так, за даними п’яти РКД (загалом 1 тис. 390 учасників), не виявлено чітких відмінностей щодо впливу на соціальне функціонування.
Збільшення маси тіла
Щодо впливу на цей показник спостерігалася гетерогенність від низького до помірного ступеня (загальний коефіцієнт тау = 1,05), а мережевий аналіз на підставі даних 16 РКД (загалом 7 тис. 542 учасники) був непослідовним (12,5% непослідовних порівнянь; тест на взаємодію дизайн-лікування: p=0,0002). Тому автори представили лише результати попарного метааналізу даних порівняння застосування оланзапіну з іншими АП.
Оланзапін спричиняв значніше збільшення маси тіла, ніж усі інші АП. Значення СР коливалося від -4,58 кг (95% ДІ від -5,33 до -3,83) проти зипразидону до -3,90 кг (95% ДІ від -6,73 до -1,08) проти перфеназину, -3,76 кг (95% ДІ від -4,89 до -2,63) проти кветіапіну, -3,37 кг (95% ДІ від -7,21 до -0,47) проти галоперидолу, -3,30 кг (95% ДІ від -4,20 до -2,40) проти азенапіну, -3,16 кг (95% ДІ від -4,06 до -2,26) проти арипіпразолу, -2,37 (95% ДІ від -3,70 до -1,03) проти рисперидону та -2,30 кг (95% ДІ від -3,35 до -1,25) проти амісульприду.
Протипаркінсонічні препарати
Дані 14 РКД (загалом 7 тис. 794 учасники) вчені аналізували щодо частоти використання протипаркінсонічних препаратів. Зокрема, арипіпразол (ВР=0,71; 95% ДІ 0,54‑0,96) і кветіапін (ВР=0,56; 95% ДІ 0,29‑1,04) перевершували оланзапін за цим показником. Зотепін (ВР=0,92; 95% ДІ 0,43‑1,85;, n=59) приблизно так само асоціювався з використанням протипаркінсонічних препаратів, як оланзапін, тоді як амісульприд (ВР=1,32; 95% ДІ 0,90‑1,89), рисперидон (ВР=1,57; 95% ДІ 1,27‑1,94), паліперидон (ВР=1,59; 95% ДІ 1,13‑2,18), зипразидон (ВР=1,59; 95% ДІ 1,11‑2,23), перфеназин (ВР=1,63; 95% ДІ 1,07‑2,40), галоперидол (ВР=2,35; 95% ДІ 1,87‑2,92) і азенапін (ВР=3,05; 95% ДІ 1,51‑5,10) були пов’язані із частішим їх застосуванням.
Акатизія
За даними 16 РКД (загалом 7 тис. 916 учасників), приймання таких АП, як паліперидон (ВР=0,82; 95% ДІ 0,50‑1,48), амісульприд (ВР=0,95; 95% ДІ 0,54‑1,69), кветіапін (ВР=1,03; 95% ДІ 0,58‑1,79) та арипіпразол (ВР=1,09; 95% ДІ 0,78‑1,52) було пов’язане з приблизно таким самим ризиком акатизії, як і терапія оланзапіном. Рисперидон (ВР=1,32; 95% ДІ 0,96‑1,81), перфеназин (ВР=1,34; 95% ДІ 0,76‑2,30), зипразидон (ВР=1,43; 95% ДІ 0,97‑2,06), галоперидол (ВР=2,39; 95% ДІ 1,72‑3,27), азенапін (ВР=2,57; 95% ДІ 1,54‑4,12) і луразидон (ВР=4,69; 95% ДІ 1,21‑11,01) були пов’язані з вищим ризиком акатизії. Результати щодо застосування рисперидону, перфеназину та зипразидону були невизначеними, оскільки значення 95% ДІ залишали деяку ймовірність отримання протилежного ефекту. Зокрема, 95% ДІ для луразидону порівняно з оланзапіном був дуже широким. Результати щодо терапії флуфеназином, трифлуоперазином, тіотиксеном й тіоридазином було виключено з мережевого метааналізу.
Рівень пролактину в сироватці крові
Результати мережевого метааналізу даних десяти РКД (загалом 5 тис. 152 учасники) були непослідовними (20% непослідовних петель; загальний коефіцієнт тау = 6,15; тест на взаємодію дизайн-лікування: p=0,001). За даними попарних метааналізів, кілька препаратів асоціювалися з нижчими середніми рівнями пролактину, ніж оланзапін: арипіпразол (СР=-8,89 нг/мл, 95% ДІ від -14,87 до -2,91), азенапін (СР=-4,00 нг/мл, 95% ДІ від -7,68 до -0,32) і кветіапін (СР= -3,20, 95% ДІ від -6,81 до 0,41). Зипразидон (СР=2,36; 95% ДІ від -0,75 до 5,48), перфеназин (СР=6,50; 95% ДІ 2,42‑10,58), галоперидол (СР=7,36; 95% ДІ 0,52‑14,20) і рисперидон (СР=30,50; 95% ДІ 19,36‑41,65) були пов’язані з вищими середніми рівнями пролактину, ніж оланзапін.
Подовження інтервалу QTc
У мережевому метааналізі даних семи РКД (загалом 4 тис. 60 учасників) паліперидон (СР= -2,22 мсек, 95% ДІ від -7,13 до 2,68), рисперидон (СР=-0,12 мсек, 95% ДІ від -3,94 до 3,69), азенапін (СР=0,40 мсек, 95% ДІ від -1,83 до 2,63), перфеназин (СР=0,68 мсек, 95% ДІ: від -4,10 до 5,46) і зипразидон (СР=0,71 мсек, 95% ДІ від -1,98 до 3,39) асоціювалися з таким самим середнім подовженням інтервалу QTc, як і оланзапін. Значення для амісульприду (СР=5,00 мсек, 95% ДІ від -1,81 до 11,81), кветіапіну (СР=5,18 мсек, 95% ДІ 0,55‑9,81) і луразидону (СР=8,38 мсек, 95% ДІ від -0,03 до 16,79) були трохи більшими, але 95% ДІ для них були широкими та передбачали можливість отримання протилежних ефектів для луразидону й амісульприду. Дані щодо застосування арипіпразолу та галоперидолу виключено з мережевого метааналізу.
Седація
Мережевий метааналіз даних 16 РКД (загалом 8 тис. 96 учасників) не виявив чітких відмінностей між АП, оскільки результати майже для всіх препаратів продемонстрували широкі 95% ДІ. Єдиним винятком був арипіпразол, пов’язаний із меншим ризиком седації, ніж оланзапін (ВР=0,58; 95% ДІ 0,38‑0,86) та кілька інших препаратів. Дані щодо застосування флуфеназину, флуспірілену, хлорпромазину, тіоридазину та тіотіксену виключено з мережевого метааналізу.
Обговорення
S. Leucht et al. зауважують, що більшість випробувань ефективності АП у пацієнтів із гострою фазою шизофренії тривають лише шість тижнів, хоча ці препарати зазвичай необхідно приймати набагато довше. Зокрема, дослідження, присвячені профілактиці рецидивів у пацієнтів із ремісією або стабільним станом, не можуть заповнити цю прогалину, оскільки вони проводяться за участю пацієнтів з іншою фазою хвороби, у них отримують різнорідні результати, а їхній дизайн зазвичай передбачає відміну препаратів (Ostuzzi et al., 2022; Schneider-Thoma et al., 2022).
Мережевий метааналіз, якому присвячена обговорювана публікація, охоплював дані пацієнтів із гострою фазою шизофренії на початковому етапі, яких згодом спостерігали щонайменше впродовж шести місяців.
Основний отриманий результат полягав у тому, що оланзапін є ефективнішим за інші АП першого та другого поколінь (із показниками СтСР від дуже малих [0,12 проти рисперидону] до малих і середніх [0,37 проти зипразидону]), та асоціюється з найнижчою частотою припинення лікування з усіх причин. Результати були стійкими щодо аналізу чутливості (якщо виключали дослідження, виконані виробником оланзапіну, деякі відмінності не були чіткими, але їхній напрям залишався таким самим, як і за основного аналізу). З іншого боку, за результатами попарного метааналізу, вплив оланзапіну на збільшення маси тіла був вищим, ніж у всіх інших АП, із СР у діапазоні від -4,58 кг (порівняно із зипразидоном) до -2,30 кг (порівняно з амісульпридом).
Оланзапін був одним із найефективніших препаратів у нещодавніх мережевих метааналізах даних короткотермінових досліджень гострої фази та довготермінових досліджень, присвячених запобіганню рецидивам (Huhn et al., 2019; Schneider-Thoma et al., 2022). Він також був дієвішим за інші АП у кількох дослідженнях, які тривали від 14 до 22 тижнів (Dossenbach et al., 2004; Tran et al., 1999), і отже, не були включені ні до поточного мережевого метааналізу даних тривалих досліджень гострої фази, ні до попереднього аналізу результатів короткострокових РКД за участю пацієнтів із гострою фазою шизофренії (Huhn et al., 2019). Перевага цього препарату над іншими АП була також очевидною за даними трьох масштабних досліджень тривалістю 6 місяців, які не включено до поточного метааналізу, оскільки виконувалися за участю пацієнтів, у яких переважали ознаки депресії або негативні симптоми (Buchanan et al., 2012; Kinon et al., 2006). Отже, оланзапін є особливо ефективним АП за різних етапів лікування шизофренії.
Проте різниця між оланзапіном і рисперидоном щодо зміни загальної симптоматики була статистично значущою, але невеликою (СтСР=0,12), а відмінності між оланзапіном і амісульпридом і перфеназином не були значущими (СтСР 0,06 і 0,09 відповідно). Луразидон отримав вищу (незначно) позицію, ніж оланзапін, за загальною ефективністю (рис. 2). Однак його було досліджено лише в одному РКД, у якому він перевершував кветіапін (Loebel et al., 2013). Різниця щодо його ефективності порівняно з іншими препаратами, крім кветіапіну, повністю отримана за непрямими доказами, і достовірність цих результатів часто була дуже низькою.
Тож S. Leucht et al. вважають, що за поточними й попередніми даними, рисперидон та амісульприд наразі можна вважати найкращими альтернативами оланзапіну щодо ефективності у пацієнтів із шизофренією.
Як зазначають дослідники, результати аналізу побічних ефектів збігаються з отриманими раніше (Huhn et al., 2019; Ostuzzi et al., 2022; Schneider-Thoma et al., 2022). Зокрема, рисперидон і паліперидон зумовлюють найбільше підвищення рівня пролактину, а часткові агоністи дофаміну мають найменший вплив на цей показник. Високопотенційні АП першого покоління, як-от галоперидол, викликають більшість екстрапірамідних побічних реакцій. Основною проблемою, пов’язаною з терапією оланзапіном, є збільшення ваги (значніше, ніж за приймання усіх АП, із якими його порівнюють). Цей побічний ефект є особливо актуальним, оскільки коморбідний із серцево-судинними подіями та здатний збільшувати смертність у довгостроковій перспективі (Fleischhacker et al., 2008). Тому оланзапін не є препаратом, який можна беззастережно рекомендувати всім пацієнтам, а у разі його призначення необхідно здійснювати моніторинг серцево-судинних чинників ризику, а також вживати контрзаходів щодо збільшення маси тіла. Для допоміжного приймання метформіну отримано найкращі докази в Кокранівському огляді, а зміни способу життя, як-от дієта та фізична активність, також були визнані ефективними (Agarwal et al., 2022; Bradley et al., 2011).
Висновки
Підсумовуючи отримані результати, S. Leucht et al. дійшли висновку, що оланзапін є ефективнішим, ніж низка інших антипсихотичних препаратів, у довгостроковому лікуванні хворих із гострою фазою шизофренії. Дослідники також зазначають, що високу ефективність препарату слід збалансувати з ризиком збільшення маси тіла. Крім того, під час застосування оланзапіну доцільним є моніторинг серцево-судинних чинників ризику, а також дотримання відповідних профілактичних заходів.
Підготувала Наталія Купко