23 листопада, 2021
Місце біопрепаратів у лікуванні ревматичних захворювань
Сучасна концепція лікування запальних ревматичних захворювань (РЗ) включає ранню діагностику та застосування хворобомодифікуючих антиревматичних препаратів (ХМАРП). Встановлення імунологічної патофізіології РЗ, зокрема ревматоїдного артриту (РА), актуалізувало використання біологічних засобів та стало фундаментальною метою терапії, особливо у резистентних до стандартного лікування пацієнтів. Біологічні хворобомодифікуючі препарати характеризуються інноваційним механізмом дії, що ґрунтується на цілеспрямованому пригніченні специфічних молекулярних або клітинних мішеней, завдяки чому їх використання сприяє поліпшенню прогнозу та досягненню клінічної ремісії.
Ревматологічний пацієнт: переваги та ризики у лікуванні
 Лікар-ревматолог вищої категорії, керівник Клініки сучасної ревматології (м. Запоріжжя), д. мед. н., професор Дмитро Геннадійович Рекалов зазначив, що з кожним роком досліджень, присвячених РА, стає більше. Також збільшується кількість схвалених препаратів (Kim et al., 2021).
Лікар-ревматолог вищої категорії, керівник Клініки сучасної ревматології (м. Запоріжжя), д. мед. н., професор Дмитро Геннадійович Рекалов зазначив, що з кожним роком досліджень, присвячених РА, стає більше. Також збільшується кількість схвалених препаратів (Kim et al., 2021).
Рекомендації Європейської антиревматичної ліги (EULAR) 2019 р. та Американської колегії ревматології (ACR) 2015 р. є основним інструментом для менеджменту пацієнтів із РА, а їх впровадження у рутинну практику вкрай важливе. Ключові оновлення останньої настанови EULAR щодо лікування РА полягають у визначенні відсутності переваг між біологічними (бХМАРП) та таргетними ХМАРП через подібну ефективність. До того ж додавання до терапії засобів групи бХМАРП або таргетних ХМАРП у пацієнтів із недостатньою відповіддю на синтетичні ХМАРП (сХМАРП) і поганими прогностичними факторами було переглянуте з формулювання «має бути розглянуто» на «має бути додано».
На додачу, положення про хворих без відповіді на інгібітори фактора некрозу пухлин α (іФНП-α) + метотрексат (МТХ) або інший сХМАРП наразі трактується як перша можливість переключення на агенти з різними механізмами дії чи інший іФНП-α (Smolen et al., 2019). Останнє є дуже важливим, оскільки часто протягом шести місяців ревматологічні пацієнти не можуть досягти мети та відмовляються від подальшого лікування.
Спікер зауважив, що, за даними проспективних досліджень, лише 21% хворих дотримувалися курсу терапії ХМАРП щонайменше на 80%. Середні значення активності захворювання за DAS28 та рентгенографічна динаміка протягом двох років спостереження в цих пацієнтів були кращими, ніж у тих, хто демонстрував низьку прихильність до терапії. Отже, недотримання режиму лікування ХМАРП призводить до збереження вищої активності захворювання (Waimann et al., 2013). Наслідками низької прихильності до тривалого лікування є погіршення клінічних наслідків, прогресування структурних змін у суглобах, зниження якості життя хворих та збільшення витрат охорони здоров’я.
Якщо за призначення іФНП-α мети не досягнуто, пацієнти можуть отримати препарат з іншим механізмом дії або інший іФНП-α (Smolen et al., 2020).
Інгібітори ФНП-α: порівняльна ефективність, профіль безпеки та прихильність до лікування
У восьмирічному дослідженні ефективності та безпеки застосування іФНП-α в першій лінії терапії при РА у 178 пацієнтів віком від 18 років 74 учасники отримували лікування інфліксимабом, 75 – адалімумабом та 29 – етанерцептом. За отриманими даними, терапія іФНП-α привела до швидкого клінічного поліпшення. Згідно із критеріями EULAR для DAS28, рівень хорошої/помірної відповіді протягом перших шести місяців становив 82% для інфліксимабу, 89,6% – адалімумабу та 95,6% – етанерцепту. Частота відміни препарату через вісім років була 80% для інфліксимабу, 61,4% – адалімумабу та 47,6% – етанерцепту. Основними причинами припинення лікування були алергічні реакції на інфліксимаб (частота відмови – 25,7%), неефективність адалімумабу та етанерцепту.
Дослідники дійшли висновків, що іФНП-α є ефективним терапевтичним варіантом при РА із прийнятним профілем безпеки. Інфекції та алергічні реакції здебільшого виникали при застосуванні інфліксимабу, тоді як частота розвитку серйозних інфекцій на тлі лікування іншими препаратами не відрізнялася. Пацієнти з РА, які отримували інфліксимаб, частіше раніше припиняли терапію порівняно з іншими препаратами (Papadopoulos et al., 2019).
Оскільки біологічні агенти містять протеїн, вони здатні викликати імуногенні ефекти. Імунну відповідь можуть індукувати іФНП-α, ритуксимаб, абатацепт та інгібітори інтерлейкіну-6 (ІЛ‑6) тоцилізумаб і сарілумаб. Ці дані повинні бути враховані у разі призначення тривалого лікування пацієнтів із РА.
Водночас імуногенність іФНП-α на тлі терапії РА суттєво відрізняється. Зокрема, у дослідженні (n=360) було показано, що найбільша кількість антитіл утворюється при застосуванні інфліксимабу – в 28,8% пацієнтів, тоді як найменша – серед тих, хто отримує етанерцепт – у1,4% (рис. 1) (Jung et al., 2014). При цьому сироваткові рівні етанерцепту практично не змінюються при супутньому використанні МТХ за різних РЗ, як-от РА, анкілозуючий спондиліт, ювенільний ідіопатичний артрит (ЮІА), псоріаз (Tyring et al., 2007; De Vries et al., 2009).
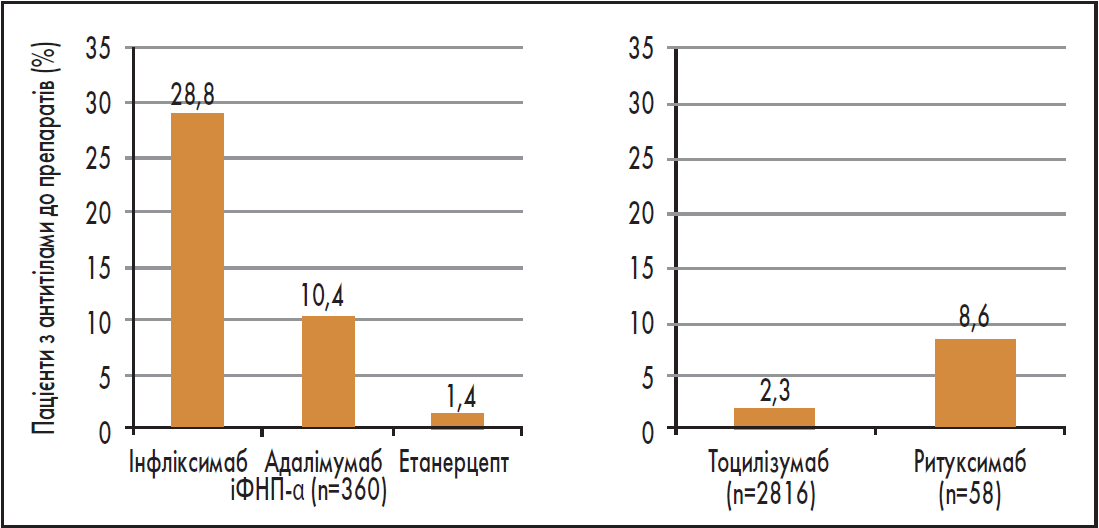 Рис. 1. Імуногенність деяких біологічних препаратів при лікуванні РА
Рис. 1. Імуногенність деяких біологічних препаратів при лікуванні РА
Отже, серед представників своєї групи етанерцепт найменшою мірою пов’язаний із продукцією нейтралізуючих антитіл. До того ж застосування у комбінації з МТХ практично нівелює цю проблему.
Д.Г. Рекалов навів дані ретроспективного дослідження з оцінки лікування різними бХМАРП у монотерапії (17,84%) порівняно з комбінацією із сХМАРП у 4478 пацієнтів з РА, які отримували бХМАРП як препарати першої лінії (Silvagni et al., 2018). Етанерцепт, адалімумаб та інфліксимаб виявилися найчастіше призначуваними бХМАРП. При цьому саме етанерцепт наразі розглядають як еталон монотерапії, оскільки адалімумаб та інфліксимаб асоціювалися з вищим ризиком невдалого лікування.
Вчені дійшли висновку, що на монотерапії етанерцептом пацієнти демонстрували вищий комплаєнс порівняно з адалімумабом та інфліксимабом. Супутні МТХ, лефлуномід та комбінація сХМАРП корелювали із тривалішим використанням бХМАРП.
За даними S.A. van Dartel et al. (2013), етанерцепт (Енбрел) при лікуванні пацієнтів із РА асоціювався зі значно нижчим скорегованим ризиком розвитку тяжких інфекційних захворювань, аніж адалімумаб та інфліксимаб (рис. 2).
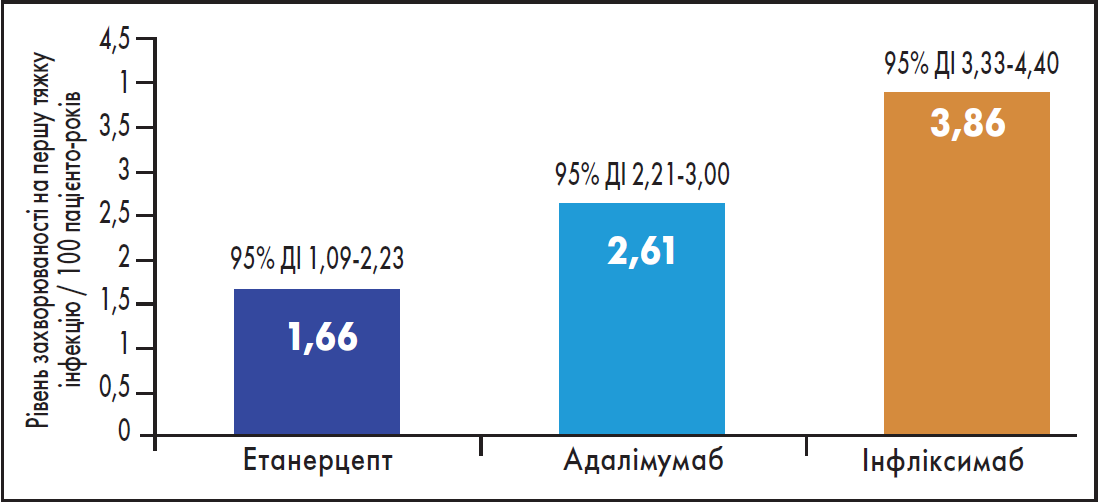 Рис. 2. Нескорегований рівень захворюваності на першу тяжку інфекцію у пацієнтів із РА на тлі застосування деяких біологічних препаратів
Рис. 2. Нескорегований рівень захворюваності на першу тяжку інфекцію у пацієнтів із РА на тлі застосування деяких біологічних препаратів
Тож отримані дані підтверджують ефективність поточної практики вибору етанерцепту як препарату анти-ФНП-α у монотерапії та зміцнення рекомендованих сучасних схем застосування бХМАРП у поєднанні з сХМАРП.
Окрім того, цікавими є результати нещодавнього дослідження, в якому порівнювали клінічну відповідь через 24 місяці та оцінювали побічні явища у пацієнтів із РА, які отримували етанерцепт 50 (розчин для ін’єкцій, наповнений шприц, 50 мг), етанерцепт 25 (ліофілізований порошок для приготування розчину для ін’єкцій, 25 мг), інфліксимаб, адалімумаб або голімумаб (Santos-Moreno et al., 2020). Було встановлено, що застосування етанерцепту 50 супроводжувалося найвищою частотою ремісій та найнижчим показником несприятливих реакцій.
Як відомо, етанерцепт добре переноситься та протягом тривалого часу (10 років) зберігає високий профіль безпеки (Proft et al., 2021). Прихильність пацієнтів до тривалого лікування етанерцептом підтверджений 10-річним досвідом використання у клініці Шаріте та Берлінському університеті Гумбольдта (Німеччина), а також даними великих європейських реєстрів (Hetland et al., 2005; Kristensen et al., 2006; Marchesoni et al., 2009).
! Для дотримання режиму терапії та ефективного контролю активності захворювання необхідним є міждисциплінарний підхід у роботі лікарів-ревматологів та лікарів загальної практики. Ретельний моніторинг дозволяє не тільки оцінити ефективність терапії, але й достовірно визначити її переносимість. На початку лікування важливо пам’ятати, що іФНП-α потенційно можуть викликати побічні явища та мають власне співвідношення користі/ризику, тому ключовим є спільне рішення клініциста та пацієнта.
Вивчення етанерцепту в межах клінічних досліджень
 Старша наукова співробітниця відділу некоронарних хвороб серця та клінічної ревматології ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України (м. Київ), к. мед. н. Олена Олексіївна Гарміш зауважила, що певний час етанерцепт не був препаратом вибору, насамперед, через його відсутність на вітчизняному фармринку. На сьогодні ситуація змінилася: етанерцепт (Енбрел) вже доступний, до того ж з’явилися наукові дані, що дозволили по-новому подивитися на його місце у лікуванні спондилоартриту (СА) та інших ревматичних захворювань.
Старша наукова співробітниця відділу некоронарних хвороб серця та клінічної ревматології ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України (м. Київ), к. мед. н. Олена Олексіївна Гарміш зауважила, що певний час етанерцепт не був препаратом вибору, насамперед, через його відсутність на вітчизняному фармринку. На сьогодні ситуація змінилася: етанерцепт (Енбрел) вже доступний, до того ж з’явилися наукові дані, що дозволили по-новому подивитися на його місце у лікуванні спондилоартриту (СА) та інших ревматичних захворювань.
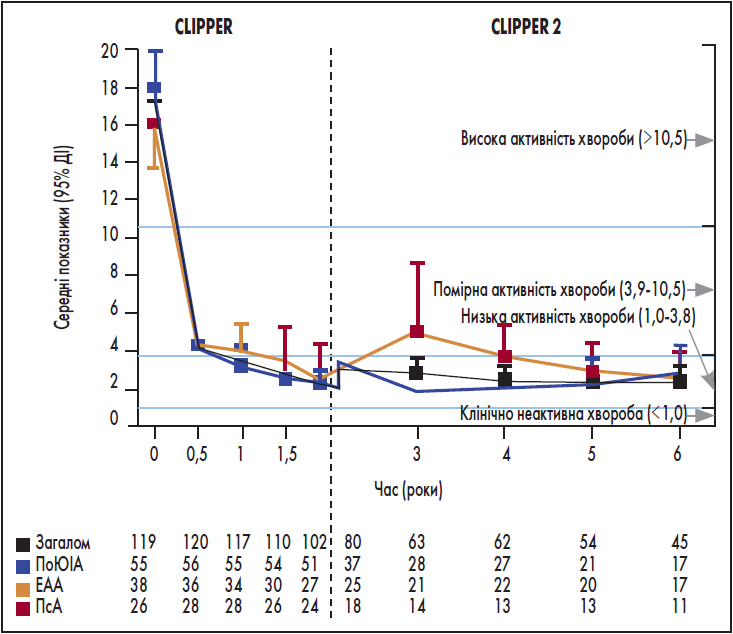
У першому відкритому 6-річному дослідженні CLIPPER вивчали ефективність та безпеку етанерцепту в 127 пацієнтів з ЮІА. У продовженні випробування CLIPPER2 взяли участь 109 осіб (Foeldvari et al., 2019). Після шести років спостереження (2 – CLIPPER і 4 – CLIPPER2) 32% хворих все ще приймали етанерцепт, 11% увійшли у фазу відміни лікування після досягнення низької/неактивної форми хвороби (зокрема семеро пацієнтів відновили приймання препарату), 28% припинили терапію з інших причин, але все ще перебували під наглядом, і 29% завершили лікування назавжди (рис. 3).
Рис. 3. Динаміка активності хвороби протягом шести років: результати CLIPPER та CLIPPER 2
Примітки: ПоЮІА – поширений олігоартикулярний ЮІА, ЕАА – ентезит-асоційований артрит, ПсА – псоріатичний артрит.
Ефективність була зіставною у всіх групах: етанерцепт продемонстрував стабільний ефект, починаючи із 24-го тижня терапії, та сприятливий профіль безпеки. Найпоширенішими небажаними явищами легкого/помірного ступеня виразності виявилися головний біль (22%), артралгія (19%) і гіпертермія (16%). Діарея переважно спостерігалася у групі пацієнтів з ентезит-асоційованим артритом, тоді як головний біль утричі частіше мав місце при псоріатичному артриті на тлі значно меншої кількості інфекцій. При цьому не було зафіксовано жодного випадку активного туберкульозу, демієлінізувальних розладів або летальних випадків.
Парадоксальні ефекти іФНП-α
За словами О.О. Гарміш, у рекомендаціях ACR щодо лікування аксіального СА наголошено, що іФНП-α не мають переваг у цій категорії хворих, за винятком осіб із запальними захворюваннями кишечника або увеїтом. У разі наявності останнього етанерцепт не є препаратом вибору (ACR, 2019). Натомість у власній практиці Олени Олексіївни був зафіксований епізод увеїту в пацієнта, що приймав етанерцепт. Після лікування увеїту терапію етанерцептом було залишено, і протягом наступних п’яти років застосування препарату це офтальмологічне ускладнення більше не виникало.
Певний інтерес представляє метааналіз парадоксальних ефектів іФНП-α (Susanna, Pavesio, 2020). Було показано, що офтальмологічні події є класовим ефектом анти-ФНП-терапії, які минають після відміни препарату. Механізм виникнення цих явищ не встановлений. При цьому, незважаючи на те що адалімумаб схвалений для лікування увеїтів Управлінням із контролю за якістю харчових продуктів та медикаментів США (FDA), Європейським агентством із лікарських засобів (EMA) та Національним інститутом охорони здоров’я і досконалості медичної допомоги Великої Британії (NICE), побічними явищами при його застосуванні є увеїт, оптичний неврит, токсичний вплив на сітківку, офтальмоплегія, рогівкові інфільтрати.
Своєю чергою приймання голімумабу та цертолізумабу може супроводжуватися оптичним невритом, інфліксимабу – увеїтом, оптичним невритом, ендофтальмітом, етанерцепту – увеїтом, оптичним невритом, склеритом, міозитом ока. З цього приводу варто зауважити, що наявність СА та увеїту в анамнезі не виключає інших причин гострої втрати зору.
Стосовно можливих офтальмологічних ускладнень під час терапії іФНП-α слід зазначити, що доза препаратів, достатня для контролю ревматичних симптомів, не є ефективною для лікування увеїтів, які загострюються під час перебігу основного захворювання. Також до можливих причин розвитку увеїтів варто віднести латентні інфекції та зниження толерантності до інфекцій.
Крім того, в експериментальних роботах було показано, що, завдяки особливій структурі етанерцепту, внутрішньоочний період напіввиведення препарату може бути подовжений, що стимулюватиме розвиток ФНП-α-залежного увеїту, доки рецепторно-лігандний комплекс не буде виведений з ока. Отже, рішення про відміну препарату потрібно приймати індивідуально у кожному конкретному випадку.
До проблеми ризику розвитку туберкульозу
Відомо, що чим вищий індекс маси тіла, тим менша ймовірність розвитку туберкульозу при застосуванні іФНП-α. При цьому ризик розвитку туберкульозу є найвищим при застосуванні інфліксимабу, тоді як на тлі терапії етанерцептом він найнижчий та зіставний із сХМАРП (Pettipher, Benitha, 2020). Саме тому етанерцепт рекомендований Британським ревматологічним товариством (BSR) як препарат вибору при латентному туберкульозі (BSR, 2019).
При латентному туберкульозі старт біологічної терапії рекомендований через один місяць від початку хіміопрофілактики. При цьому перевагу слід віддавати етанерцепту, із моніторингом стану пацієнта один раз на три місяці. При активному туберкульозі застосування біологічної терапії необхідно починати через три місяці від початку лікування; за позитивної динаміки препаратом вибору також є етанерцепт.
Лекторка навела цікаві результати з безпеки відновлення терапії іФНП-α в пацієнтів із РА або АС, в яких розвинувся активний туберкульоз на тлі попереднього лікування іФНП-α. Загалом було оцінено дані 1012 осіб із РА або АС, які отримували іФНП-α у період із січня 2003 по липень 2013 рр. Активний туберкульоз розвинувся у 15 хворих (5 випадків при РА і 10 – при АС). Усі пацієнти припинили приймати іФНП-α з початком лікування туберкульозу. Було вилікувано 12 пацієнтів, із них восьмеро відновили застосування іФНП-α через загострення РЗ (після 3‑30 місяців), та їхній стан швидко покращився без рецидиву туберкульозу (спостереження протягом п’яти років).
Таким чином, автори дійшли висновку, що використання іФНП-α може бути безпечно відновлене після початку протитуберкульозного лікування в осіб із РА та СА (Suh et al., 2014).
Особливості лікування пацієнтів із ревматичними захворюваннями під час пандемії COVID-19
Відповідно до рекомендацій EULAR, відсутні докази щодо підвищеного ризику інфікування коронавірусом SARS-CoV‑2 та гіршого прогнозу в разі захворювання на COVID‑19 у пацієнтів ревматичного профілю порівняно із загальною популяцією. Діагностику та лікування COVID‑19 в осіб із РЗ здійснюють спеціалісти з лікування коронавірусної хвороби, а саме пульмонолог, терапевт та лікар-інфекціоніст відповідно до локальних протоколів, при цьому ревматологи є фахівцями з імуносупресивної терапії.
Рішення про відміну або продовження використання ХМАРП необхідно приймати з урахуванням експертної думки ревматолога. За наявності легкого перебігу COVID‑19 у хворих на ревматичні патології рішення щодо зміни базисної терапії має бути індивідуальним (Landewe et al., 2020).
Клінічний випадок
Пацієнтка із РА, 54 роки.
Діагноз від 05.2020. Серонегативний РА, поліартрит, активність захворювання за DAS28 – 6,5. Супутні захворювання: гепатит В (1998), гепатит А (2015).
Лікування. МТХ по 15 мг/тиждень, лефлуномід у дозі 20‑10 мг/добу – непереносимість (біль у печінці, підвищення аланін-/аспартатамінотрансферази).
Призначення від 06.2020: 1 мг/добу метилпреднізолону, 50 мг/тиждень етанерцепту.
Обстеження. Від 11.10.2020 тест методом полімеразної ланцюгової реакції (ПЛР) на SARS-Co-V2 «+». Комп’ютерна томографія (КТ): двостороння полісегментарна пневмонія СО-RADS5, ураження 35‑40% паренхіми.
Від 25.10.2020 ПЛР-тест на SARS-Co-V2 «–». КТ від 27.10.2020: зберігаються фіброзні зміни.
З урахуванням даних щодо можливої індукції фіброзу легень під час застосування іФНП-α, терапію етанерцептом було припинено з метою недопущення посилення легеневого фіброзу.
Клінічні висновки. КТ від 19.11.2020: регрес легеневого фіброзу, терапію етанерцептом поновлено.
! Етанерцепт є препаратом вибору за наявності підвищеного ризику або інфекцій в анамнезі, а також при латентному та активному туберкульозі після адекватного лікування. При виникненні увеїту рішення про відміну препарату приймають ревматолог та офтальмолог. Для підвищення ефективності щодо шкірних проявів псоріазу до лікування доцільно додати МТХ.
При коронавірусній хворобі COVID‑19 терапію етанерцептом може бути поновлено через 7‑14 днів після зникнення клінічних симптомів або через 10‑17 днів після негативного ПЛР-тесту за неускладненого перебігу.
Вплив етанерцепту на мінеральну щільність кісткової тканини у пацієнтів зі спондилоартритом
 Лікар-ревматолог вищої категорії, професорка кафедри внутрішньої медицини № 2 Національного медичного університету імені О.О. Богомольця (м. Київ), д. мед. н. Марта Борисівна Джус нагадала слухачам, що СА – група захворювань, які мають спільні генетичні та клінічні ознаки, як-то сакроіліїт, периферичний артрит, позасуглобові прояви, наявність HLA-B27. Згідно з рекомендаціями ACR (2019), аксіальний СА, який включає анкілозивний спондиліт та нерадіографічний аксіальний СА, є основною формою хронічного запального артриту, що уражає аксіальний скелет.
Лікар-ревматолог вищої категорії, професорка кафедри внутрішньої медицини № 2 Національного медичного університету імені О.О. Богомольця (м. Київ), д. мед. н. Марта Борисівна Джус нагадала слухачам, що СА – група захворювань, які мають спільні генетичні та клінічні ознаки, як-то сакроіліїт, периферичний артрит, позасуглобові прояви, наявність HLA-B27. Згідно з рекомендаціями ACR (2019), аксіальний СА, який включає анкілозивний спондиліт та нерадіографічний аксіальний СА, є основною формою хронічного запального артриту, що уражає аксіальний скелет.
Цілями лікування пацієнтів із СА є (Smolen et al., 2018):
1. Зниження інтенсивності запалення, що проявляється зникненням симптомів і лабораторних ознак запальної активності.
2. Запобігання структурному ураженню осьового скелета (для аксіального СА).
3. Досягнення ремісії (ASDAS <1,3) або низької активності захворювання (ASDAS <2,1).
Контроль запалення та симптомів
Доповідачка зазначила, що пацієнти з аксіальним СА (радіографічним та нерадіографічним) при застосуванні іФНП-α та моноклональних антитіл до ІЛ‑17 за короткий термін досягають 30‑40% відповіді згідно з ASAS40. Досягнення короткострокових результатів (контролю над симптомами та запаленням) може привести до перешкоджання структурним пошкодженням хребта і крижово-клубових з’єднань та запобігти обмеженню функції у довгостроковій перспективі (Deodhar et al., 2020).
Натепер зареєстровано п’ять іФНП-α (етанерцепт, інфліксимаб, адалімумаб, голімумаб, цертолізумаб) та два препарати антитіл до ІЛ‑17 (секукінумаб, іксекізумаб) (Poddubnyy, 2020). Зокрема, етанерцепт затверджений у країнах ЄС для лікування аксіального та нерадіографічного СА (також ці показання для застосування препарату зареєстровані в Україні).
У короткотривалих дослідженнях (12, 14, 24 тижні) вивчали ефективність іФНП-α та антитіл до ІЛ‑17 у пацієнтів з аксіальним СА (Jones et al., 2018; Blair, 2019; Deodhar et al., 2020). Було показано, що зазначені групи препаратів добре контролювали симптоми захворювання та запалення як при радіографічному, так і нерадіографічному СА.
Втрата кісткової тканини у хворих на СА
Відповідно до оновлених рекомендацій ACR, Американської асоціації спондилітів (SAA) й Консорціуму з досліджень і лікування спондилоартриту (SPARTAN) 2019 р. щодо лікування аксіального та нерадіографічного аксіального СА, потрібно визначити додаткові прояви захворювання (кіфоз, прогресуючий артрит кульшових суглобів), а також звернути увагу на ознаки остеопорозу (ОП). ОП хребта є неочікуваним ускладненням у молодих пацієнтів чоловічої статі та нерідко залишається недіагностованим (відповідно, без адекватного лікування). Його частота при аксіальному СА коливається від 3 до 56%, тоді як остеопенії – може сягати 89%.
СА-асоційованими факторами ризику втрати кісткової тканини є тривалість захворювання та високий ступінь за індексами BASFI/BASDAI, а також анкілозування, іммобілізація, приймання глюкокортикоїдів (ГК) (Hamires et al., 2018). Зокрема, в оновлених настановах ГК не рекомендовані для перорального застосування при СА.
Наявність вертебральних переломів посилює біль та обмеження рухів у хребті, що інколи пов’язують із прогресуванням патології (Geusens, 2015). ОП при СА виникає насамперед через гіперпродукцію прозапальних цитокінів (ФНП-α, ІЛ‑1, IЛ‑6, IЛ‑17), відповідно, інгібування останніх зменшує розвиток ОП. Пацієнти зі СА мають бути обстежені на ОП, при цьому подвійна енергетична рентгенівська абсорбціометрія (DХА) є золотим стандартом діагностики (EULAR, 2015). Згідно з рекомендаціями EULAR (2015) щодо діагностики та лікування СА у клінічній практиці, за наявності синдесмофітів аналіз передньозадньої проєкції поперекового відділу хребта є неінформативним. Натомість рекомендовано проводити оцінку стану кісткової тканини хребта у боковій проєкції та/або використовувати показники DХА шийки стегнової кістки, або за можливості виконувати кількісну КТ хребта.
Вплив етенерцепту на маркери резорбції кісткової тканини
Як засвідчила М.Б. Джус, маркерами ремоделювання кісткової тканини при аксіальному СА є так звані маркери формування кісткової тканини – лужна кісткова фосфатаза, остеокальцин, а також резорбції кісткової тканини – С-термінальний телопептид колагену І типу та дезоксипіридинолін (Kilic et al., 2015).
У дослідженні впливу етанерцепту (n=39) та інфліксимабу (n=41) на кістковий метаболізм у пацієнтів з анкілозивним СА було показано, що обидва препарати мали сприятливий вплив на рівень С-реактивного білка (СРБ), швидкість осідання еритроцитів (ШОЕ), але не на лужну кісткову фосфатазу та С-термінальний телопептид колагену І типу. Натомість через 12 місяців при застосуванні двох стратегій лікування спостерігався позитивний ефект на маркери резорбції кісткової тканини (Wangi et al., 2020).
Був проведений метааналіз одного рандомізованого контрольованого й семи тривалих досліджень за участю 568 осіб з анкілозивним СА (вік – 36‑48 років, тривалість захворювання – 9‑17 років). За отриманими результатами, впродовж 12 місяців лікування іФНП-α відбувається приріст кісткової тканини на рівні поперекового відділу хребта до 5%, а через 24 місяці – майже до 9% (Haroon et al., 2014). Встановлено, що етанерцепт покращує мінеральну щільність кісткової тканини (МЩКТ) в осіб із анкілозивним СА (van der Weiden et al., 2016). Через два роки терапії етанерцептом було встановлено, що кількість хворих на ОП зменшилася з 12 до 4%, а на остеопенію – з 45 до 41%. Також наявні дані, що лікування етанерцептом збільшує МЩКТ порівняно з контрольною групою вже через 24 тижні, особливо на рівні поперекового відділу хребта та стегна (Marzo-Ortega, 2003).
Клінічний випадок
Хворий Н., 38 років.
Вважає себе хворим чотири роки, характер болю запальний, стійке підвищення СРБ та ШОЕ, на МРТ – ознаки двобічного сакроіліїту, спондиліту, виразний ОП поперекового відділу хребта (Z-критерій -2,5 SD).
Діагноз. Аксіальний СА, центральна форма, хронічний перебіг, високий ступінь активності (BASFI – 5,2) із переважним ураженням грудного та поперекового відділу хребта, двобічний сакроіліїт, ентезити, рентген-стадія 1, функціональна недостатність суглобів ІІ, HLA-В27-позитивність.
Лікування. Призначено етанерцепт (Енбрел) у дозі 50 мг/1 мл один раз на тиждень підшкірно, мелоксикам по 15 мг/добу за потреби, лікувальну фізкультуру.
Через 12 місяців терапії. При оцінці МЩКТ хребців у латеральній проєкції мало місце збільшення МЩКТ на рівні поперекового відділу хребта, Z-критерій -1,8 SD (приріст кісткової тканини за рік – 7,9%).
! Системна втрата кісткової тканини при СА є мультифакторною та зумовлена сумою загальних факторів ризику ОП та впливу РЗ (насамперед через запалення, гіподинамію, застосування ГК, дефіцит вітаміну D). Інформативність показників DХА та їх інтерпретація у хворих на СА потребує високої кваліфікації дослідника та подальшого широкого впровадження у клінічну практику. Наявність хронічного запалення спричиняє резорбцію кісткової тканини та підсилює її, що потребує прицільної діагностики та за потреби – корекції.
Призначення етанерцепту (Енбрелу) не тільки позитивно впливає на перебіг захворювання, але й поліпшує стан кісткової тканини.
Підготувала Олександра Демецька