11 грудня, 2021
Сучасні принципи ефективного менеджменту гострого больового синдрому: безпека, послідовність, мультимодальність та індивідуальний підхід
За матеріалами конференції
Мистецтво лікування больового синдрому – навик, яким має оволодіти кожен практикуючий лікар. На початку жовтня за участю світових експертів відбувся вебінар «Академія болю», на якому провідні спеціалісти з лікування болю розглянули сучасні аспекти ефективного та безпечного менеджменту больового синдрому.
Ключові слова: гострий біль, нестероїдні протизапальні препарати, мультимодальна аналгезія, менеджмент больового синдрому, декскетопрофен, німесулід.
Доповідь «Лікування гострого болю за допомогою НПЗП: акцент на кардіоваскулярному та гастроінтестинальному профілях безпеки» представив професор Ганс Георг Кресс (м. Відень, Австрія). Базуючись на сучасних наукових доказах, спікер обґрунтував особливості менеджменту гострого болю з урахуванням безпечності знеболювальних препаратів.
Як відомо, внаслідок ушкодження тканин та зумовленого ним запалення активується фермент фосфоліпаза А2, що сприяє вивільненню з фосфоліпідів арахідонової кислоти, з якої за участю ферментів циклооксигенази (ЦОГ) 1 та 2 синтезуються простаноїди (простагландини, простацикліни, тромбоксан А2). Ці високоактивні речовини не лише ініціюють запальний процес, а й сприяють сенсибілізації периферичних ноцицепторів (периферична сенсибілізація), що призводить до виникнення гострого больового синдрому (первинна гіпералгезія), а також сенсибілізації ноцицепторів на спінальному рівні (центральна сенсибілізація), що лежить в основі розвитку вторинної гіпералгезії та хронічного больового синдрому. Нестероїдні протизапальні препарати (НПЗП) пригнічують ферменти ЦОГ‑1 та ЦОГ‑2, зменшуючи таким чином кількість простаноїдів і, відповідно, інтенсивність запального процесу та прояви больового синдрому.
Проте простаноїди володіють не лише руйнівними, а й важливими захисними властивостями. Наприклад, їх гастропротекторна функція реалізується за участю ферменту ЦОГ‑1 за рахунок підвищення виділення слизу слизовою оболонкою шлунково-кишкового тракту (ШКТ), синтезу бікарбонату та посилення кровообігу. Тому при використанні НПЗП, що переважно блокують ЦОГ‑1, підвищується ризик виникнення пептичної виразки та шлунково-кишкової кровотечі. Крім того, простагландини, що утворюються від впливом ЦОГ‑1 та ЦОГ‑2, сприяють розширенню аферентних артеріол у нирках, посилюючи швидкість клубочкової фільтрації (ШКФ), а також підвищують екскрецію натрію та води. Таким чином, НПЗП можуть спричинити затримку останніх, підвищення артеріального тиску та гостре пошкодження нирок. До того ж застосування НПЗП може збільшувати ризик виникнення серцево-судинних захворювань (ССЗ), адже зменшення простацикліну та тромбоксану А2 сприяє вазоконстрикції та зменшенню агрегації тромбоцитів (Cooper C. et al., 2019).
Виходячи з вищезазначеного, абсолютними протипоказаннями до призначення НПЗП є наступні (Gloth F.M. et al., 2011):
- останній триместр вагітності;
- активна пептична виразка або шлунково-кишкова кровотеча;
- шлунково-кишкова кровотеча або перфорація, пов’язані з попередньою терапією НПЗП;
- встановлена ниркова недостатність (ШКФ <30 мл хв/1,73 м²);
- встановлена застійна серцева недостатність (клас II-IV за NYHA);
- ішемічна хвороба серця (інфаркт міокарда в анамнезі або наявна стенокардія);
- цереброваскулярна хвороба з інсультом або транзиторною ішемічною атакою в анамнезі.
Серед відносних протипоказань до застосування НПЗП виділяють такі (Gloth F.M. et al., 2011):
- значні фактори ризику ССЗ (наприклад, недостатньо контрольована гіпертензія, захворювання периферичних артерій, гіперліпідемія, цукровий діабет, куріння);
- інфекція Helicobacter pylori;
- виразкова хвороба в анамнезі;
- одночасне застосування з кортикостероїдами або селективними інгібіторами зворотного захоплення серотоніну.
Спікер зазначив, що за наявності протипоказань лікарі мають в арсеналі альтернативні лікарські засоби для купірування болю, наприклад парацетамол та метамізол. Ці препарати є слабкими інгібіторами ЦОГ, тому несуть менший ризик виникнення кардіоваскулярних та гастроінтестинальних несприятливих подій, але водночас є й слабшими анальгетиками.
Також для зменшення побічних ефектів НПЗП можна застосовувати їхні місцеві форми, що особливо актуально при лікуванні гострого скелетно-м’язового болю. До переваг місцевих форм НПЗП відносять: дія безпосередньо в місці ушкодження, низька системна абсорбція, відсутність системних побічних ефектів та взаємодій із лікарськими засобами, відсутність протипоказань. Серед недоліків місцевих форм НПЗП можна виділити місцеве подразнення та обмежену дифузію до більш глибоко розташованих тканин. Проте дослідження P. Montaster et al. (1994) показало, що кетопрофен перевершує інші місцеві НПЗП у лікуванні гострого болю, оскільки він більш глибоко проникає у тканини й забезпечує там більшу концентрацію (22%) порівняно з піроксикамом (0,5%), німесулідом (4,4%) та диклофенаком (11,2%).
Утім місцеві НПЗП мають обмежене застосування і в багатьох випадках є недостатньо ефективними, що зумовлює потребу у призначенні системних препаратів. Виникають запитання: чи всі НПЗП мають однаковий профіль безпеки та як впровадити наявні наукові дані щодо безпечності й ефективності НПЗП у лікуванні гострого хронічного болю та запалення в лікарську практику?
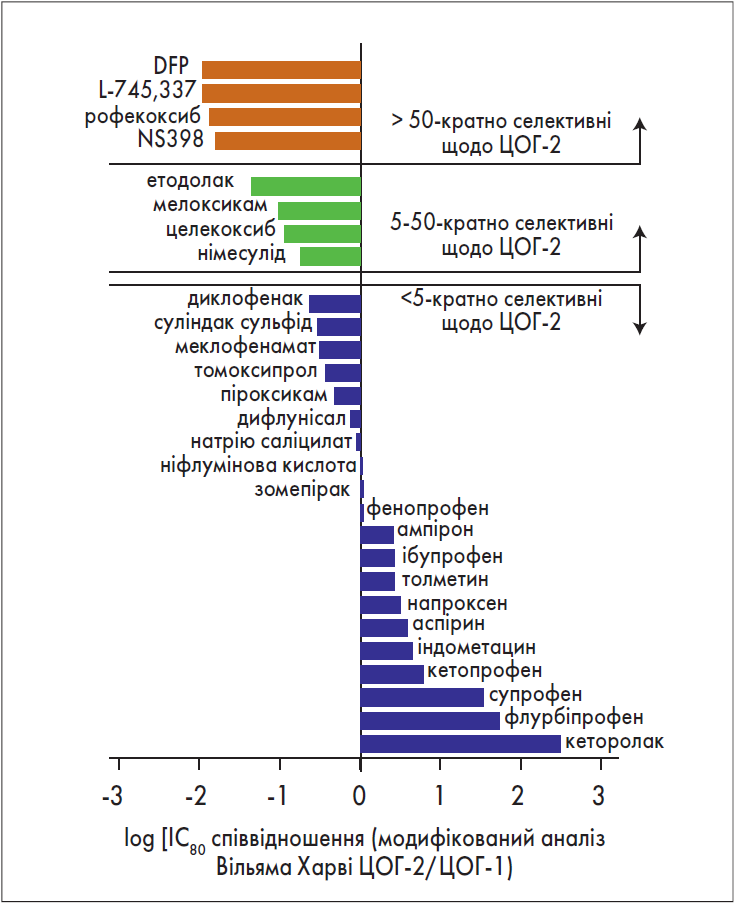
Ще наприкінці ХХ ст. науковці виявили, що селективність НПЗП щодо ЦОГ‑1 прямо пов’язана зі ступенем негативного впливу на слизову оболонку ШКТ, тобто чим вища селективність препарату (рис. 1), тим вища його гастроінтестинальна токсичність (Warner T.W. et al., 1999).
Рис. 1. Селективність НПЗП щодо ЦОГ‑1 та ЦОГ‑2
(Warner T.W. et al., 1999)
Згідно з гіпотезою Фіцджеральда щодо механізмів розвитку негативних серцево-судинних ефектів НПЗП, неселективні молекули пригнічують утворення як тромбоксану, так і простацикліну, а селективні інгібітори ЦОГ‑2 – лише простацикліну, зміщуючи баланс у бік протромботичного ефекту тромбоксану А2. Вважалося, що це підвищує ризик ССЗ, оскільки за таких процесів посилюється агрегація тромбоцитів, вазоконстрикція, підвищується артеріальний тиск. Проте на сьогодні, як зазначив професор Г.Г. Кресс, ця гіпотеза «білого і чорного» не є абсолютно вірною, адже, як виявилось, у ній є багато «відтінків сірого».
Тож чи залежить ризик виникнення ССЗ від селективності НПЗП щодо ЦОГ‑2? Італійське дослідження «випадок – контроль», проведене серед пацієнтів з остеоартритом, спростовує цю теорію, адже, згідно з результатами, серед досліджуваних НПЗП молекулярний склад диклофенаку та кетопрофену асоціювався з підвищенням частоти цереброваскулярних подій (відношення шансів [ВШ] 1,53; 95% довірчий інтервал [ДІ] 1,04-2,24; ВШ 1,62; 95% ДІ 1,02-2,58 відповідно). Натомість при застосуванні целекоксибу та німесуліду не було виявлено такої закономірності (ВШ 1,04; 95% ДІ 0,7-1,54; ВШ 0,37; 95% ДІ 0,15-0,91 відповідно) (Lapi F. et al., 2015).
Дослідження, проведене у чотирьох європейських країнах – Німеччині, Італії, Нідерландах, Великій Британії (n=4 593 778), виявило, що застосування коксибів (ВШ 1,08, 95% ДІ 1,02-1,15) та традиційних НПЗП (ВШ 1,16, 95% ДІ 1,12-1,19) було пов’язане з підвищеним ризиком розвитку ішемічного інсульту. Серед 32 досліджуваних НПЗП найвищий ризик був асоційований із застосуванням неселективного препарату – кеторолаку (ВШ 1,46, 95% ДІ 1,19-1,78). Крім того, ризик, як правило, був вищим в осіб молодшого віку, чоловіків та тих, хто мав ішемічний інсульт в анамнезі. Таким чином, дослідники дійшли висновку, що селективність НПЗП щодо ЦОГ‑2 не впливає на ризик виникнення гострих цереброваскулярних захворювань (Schink T. et al., 2018).
B.R. Gunter et al. (2017) у своєму дослідженні отримали такі ж результати – селективність НПЗП не впливає на ризик ССЗ. Лише при застосуванні рофекоксибу спостерігалось підвищення частоти виникнення інфаркту міокарда або ішемічного інсульту порівняно з усіма НПЗП та іншими коксибами. Натомість при застосуванні целекоксибу частота цереброваскулярних захворювань була зниженою. Жоден НПЗП не досяг статистичної значущості щодо смертності від ССЗ.
Підсумовуючи результати наведених досліджень, спікер наголосив, що всі НПЗП несуть певний ризик ССЗ, включаючи інфаркт міокарда, інсульт та серцеву недостатність, проте деякі з них, наприклад кеторолак та рофекоксиб, є значно небезпечнішими. До факторів ризику розвитку ССЗ, спричинених НПЗП, можна віднести їх тривале застосування та високі дози, захворювання серця або наявність факторів ризику для них. Оскільки той чи інший ризик виникнення кардіоваскулярних захворювань все ж присутній, при виборі НПЗП слід віддавати перевагу препаратам зі зниженим ризиком шлунково-кишкових побічних ефектів.
За результатами дослідження J. Castellsague et al. (2012), було виявлено, що німесулід має проміжний ризик виникнення ускладнень із боку верхніх відділів ШКТ і є за цим показником зіставним із такими часто призначуваними НПЗП, як диклофенак і мелоксикам.
Крім негативного впливу на ШКТ та серцево-судинну систему НПЗП можуть проявляти гепатотоксичність. Ураження печінки є рідкісним побічним ефектом застосування всіх класів НПЗП, і все ж S.E. Gulmez et al. (2013) дослідили частоту проведених трансплантацій печінки через гостру печінкову недостатність у пацієнтів, які зазнали впливу НПЗП або парацетамолу. Результати показали, що частота подій на мільйон років лікування становила 1,9 (95% ДІ 0,8-3,7) для німесуліду, 1,6 (95% ДІ 0,6-3,4) – для диклофенаку та 1,6 (95% ДІ 0,3-4,5) – для кетопрофену. При застосуванні кеторолаку цей показних був найгіршим і становив 19,4 (95% ДІ 2,3-7,2), що в 10 разів вище, ніж для німесуліду.
Отже, жоден НПЗП не є абсолютно безпечним для серцево-судинної системи або ШКТ. Спосіб застосування (доза, тривалість) та супутні захворювання пацієнта здебільшого визначають індивідуальний ризик. Прийняття зважених рішень, фармакологічна компетентність та уважність лікаря, який призначає препарат, є основними ключами до безпечного застосування НПЗП.
На вебінарі було представлено ще одну не менш цікаву доповідь «Менеджмент післяопераційного болю», у якій автор професор Антоніо Монтеро (м. Лерида, Іспанія) зробив акцент на мультимодальній аналгезії як основоположному методі ефективного менеджменту післяопераційного больового синдрому.
Щороку в Європі проводять близько 50 млн операцій. Від сильного болю у перші 24 год страждають 30% прооперованих, а 21% пацієнтів відчувають сильний біль вдома, після виписки зі стаціонару. Відсутність належного менеджменту післяопераційного больового синдрому призводить до відстрочення одужання, більш тривалого перебування пацієнта у стаціонарі, до повторних госпіталізацій та хронізації больового синдрому (Apfelbaum J.L. et al., 2003).
Чому відзначається такий високий відсоток післяопераційного болю? Здавалося б, більш широко почали використовуватися малоінвазивні (лапароскопія, роботизована хірургія), амбулаторні та короткочасні втручання, модифіковане лікування післяопераційного болю. Проте збільшилася й частка оперованих пацієнтів похилого віку, які мають багато супутніх захворювань й отримують з приводу них різні лікарські засоби. Протоколи лікування болю здебільшого були орієнтовані на операції, які вважаються більш болісними (тотальне ендопротезування колінного суглоба, торакотомія, нефректомія та ін.), натомість як так званим малим оперативним втручанням (тонзилектомія, гемороїдектомія, кесарів розтин та ін.) приділялося менше уваги. Крім того, інколи не враховується той факт, що післяопераційний біль не обмежується найближчим післяопераційним періодом (Fuzier R. et al., 2015).
На думку професора А. Монтеро, щоб покращити лікування гострого болю, важливо дотримуватися чотирьох послідовних кроків:
1. Преабілітація: дійте в усі періоди хірургічного процесу:
- визначте ризики виникнення післяопераційного болю;
- проведіть профілактику хронічного післяопераційного болю;
- проведіть інтраопераційний моніторинг аналгезії;
- оцініть больовий синдром під час руху та у спокої.
2. Використовуйте мультимодальну аналгезію:
- використовуйте НПЗП/опіоїди та їх комбінації;
- віддавайте перевагу пероральному прийому лікарських засобів над парентеральними;
- застосовуйте локальну та регіонарну аналгезію.
3. Використовуйте протоколи, адаптовані під конкретного пацієнта та вид оперативного втручання.
4. Навчайте фахівців та оцінюйте результати.
Крок 1. Преабілітація (European Minimum Standards for the Management of Postoperative Pain, 2016)
- Передопераційна
Інформування пацієнта про можливість виникнення у нього больового синдрому, виявлення ризиків виникнення сильного гострого післяопераційного болю, проведення профілактики хронічного післяопераційного болю.
- Інтраопераційна
Проведення постійного моніторингу аналгезії, введення анальгетиків під час операції, застосовування локально-регіонарних методик, інфільтрація хірургічної рани.
- Післяопераційна
Застосування протоколів мультимодальної аналгезії, проводення постійного моніторингу інтенсивності болю (у стані спокою та під час руху), контроль побічних ефектів лікарських засобів.
- Виписка пацієнта
Складання плану аналгезії та виписування рецептів, забезпечення можливості цілодобової комунікації з пацієнтом.
Крок 2. Мультимодальна аналгезія
Згідно з рекомендаціями (Chou R. et al., 2016; Ladha K.S. et al., 2016), сучасний успішний менеджмент післяопераційного болю передбачає дотримання протоколів мультимодальної аналгезії, які включають використання регіонарних методик при специфічних операціях, комбінацій різних груп лікарських засобів для аналгезії (НПЗП, мінімальні дози опіоїдів, антиконвульсанти та ін.), а також перехід на пероральний прийом препаратів якомога раніше.
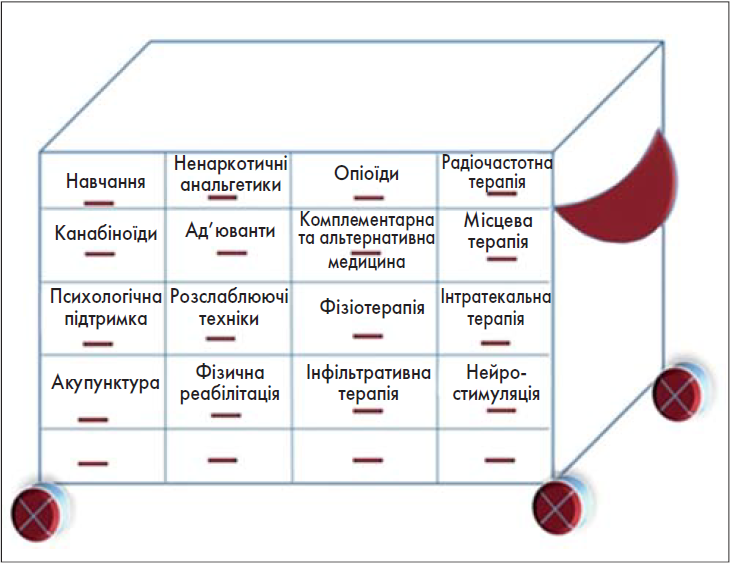
Оскільки біль є складним, багатофакторним процесом, його не можна контролювати за допомогою одного анальгетика, тому найкращою стратегією є використання комбінацій різних груп лікарських засобів, що діють на різних рівнях. Як зазначає Американське товариство з питань болю (Gordon D.B. et al., 2016), лікування болю здійснюється за мультимодальною моделлю з урахуванням патофізіології, інтенсивності, складності симптомів больового синдрому, наявності у пацієнта супутніх захворювань. Відповідно до цих принципів A. Cuomo et al. (2019) вибудували нову концепцію знеболення під назвою «модель знеболювального візка», яка дозволить використовувати індивідуальну терапію з динамічними мультимодальними підходами для ефективного лікування больового синдрому (рис. 2).
Рис. 2. «Модель знеболювального візка» у менеджменті лікування болю (Cuomo A. et al., 2019)
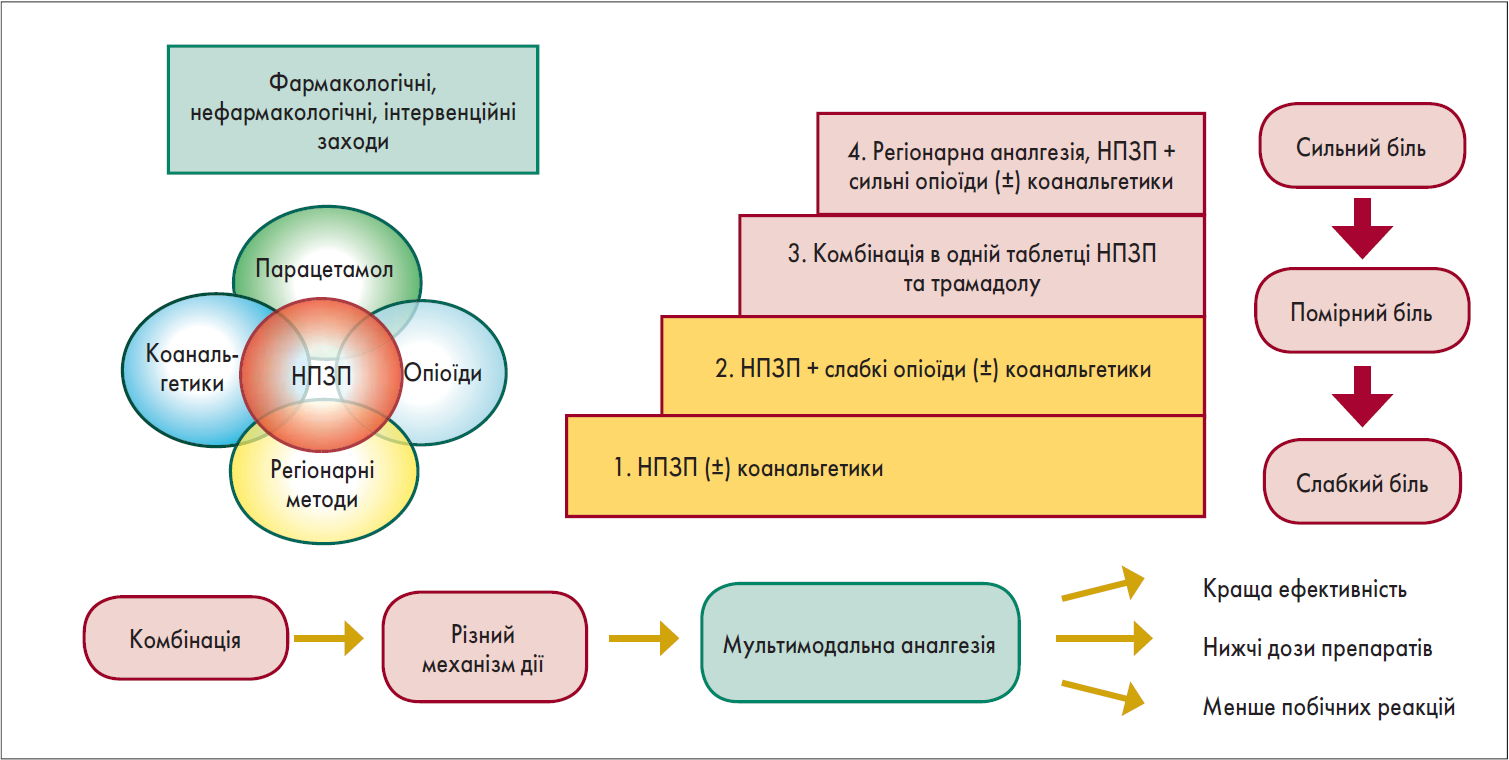
Крім того, актуальною залишається ступінчаста концепція знеболення, запропонована Всесвітньою організацією охорони здоров’я (ВООЗ) у 2018 році, в основі якої лежить покрокове посилення/послаблення аналгезії відповідно до інтенсивності болю (рис. 3). При слабкому больовому синдромі ВООЗ рекомендує використовувати НПЗП у комбінації з коанальгетиками; при помірному – НПЗП у комбінації зі слабкими опіоїдами (трамадол) та коанальгетиками; при сильному болю рекомендовано використовувати НПЗП, сильні опіоїди та коанальгетики, а також регіонарне знеболення. Дотримання принципів мультимодальної аналгезії забезпечує кращу ефективність при використанні нижчих доз препаратів із меншою кількістю побічних реакцій.
Рис. 3. Мультимодальна аналгезія. Низхідна знеболювальна драбина
Професор А. Монтеро зазначив, що він із колегами у своїй практиці у протоколах мультимодальної аналгезії використовують такі препарати: НПЗП (декскетопрофен), опіоїди (трамадол, морфін), коанальгетики (кетамін, лідокаїн, габапентиноїди), а для регіонарних методик – ропівакаїн, левобупівакаїн. Такий вибір базується на підставі наявних доказів безпечності та ефективності цих препаратів, синергізму їх дії в мультимодальних терапевтичних схемах (Varrassi G. et al., 2017).
Ефективність та безпечність декскетопрофену доведена у численних дослідженнях: він виявився достовірно більш ефективним, ніж плацебо, щонайменше еквівалентним за ефективністю препаратам порівняння (інші НПЗП та комбінація «парацетамол/опіоїди») і не викликав серйозних побічних реакцій. Показники кількості пацієнтів, яких необхідно пролікувати (NNT), для декскетопрофену були найнижчими – 2,2 (Moore R.A. et al., 2016).
Декскетопрофен – хіральний НПЗП, який проявляє жарознижувальну, протизапальну й знеболювальну дію шляхом інгібування ЦОГ‑1 та ЦОГ‑2. Декскетопрофену трометамол – це чистий S-(+)-енантіомер, який є активною формою рацемічного кетопрофену і в 40 разів потужнішим за R-(–)-кетопрофен.
Декскетопрофен був розроблений у формі солі трометаміну, що забезпечує наступні переваги (Hаnna M. et al., 2018):
- поліпшення його розчинності та швидкості всмоктування (початок ефекту протягом 30 хв);
- зниження часу контакту зі слизовою оболонкою верхніх відділів ШКТ;
- тривалість дії до 8 год;
- відсутність кумулятивних явищ;
- менший вплив на видільну функцію нирок.
Крім того, систематичний огляд C. Hernandez-Lopez (2009) демонструє, що за результатами різних досліджень при застосуванні декскетопрофену частота призначення морфіну змешується на 25-44,5%.
Ризик виникнення побічних ефектів із боку верхніх відділів ШКТ при застосуванні декскетопрофену є невисоким (ВР 2,9, 95% ДІ 0,6-14,8) і значно нижчим порівняно з кеторолаком (ВР 14,9, 95% ДІ 4,7-46,9) (Liorente M.J., 2002).
M. Hanna et al. (2018) у своєму дослідженні дійшли висновку, що декскетопрофен забезпечує аналогічну до інгібіторів ЦОГ‑2 знеболювальну ефективність у лікуванні гострого болю, має швидкий початок дії, добре переноситься й чинить опіоїд-зберігаючий ефект при застосуванні у якості компонента мультимодальної аналгезії.
Професор А. Монтеро звернув увагу на ще один препарат, який частіше використовує у своїй практиці, – трамадол. Останній має слабку спорідненість до μ-рецепторів (у 10 разів меншу, ніж у кодеїну), пригнічує зворотне захоплення серотоніну та норадреналіну, має нижчий потенціал зловживання та в меншій мірі викликає звикання. Крім купірування гострого болю трамадол також ефективний в усуненні нейропатичного та хронічного больових синдромів (ВООЗ, 2014).
Крок 3. Протоколи мультимодальної аналгезії
Важливо використовувати протоколи мультимодальної аналгезії, адаптовані під конкретного пацієнта (зважаючи на вік, стать, наявність супутньої патології та ін.) та вид оперативного втручання (тип розрізу та техніка, тип анестезії).
Крок 4. Навчання фахівців та оцінка результатів
Навчання медичного персоналу лікувального закладу правильного менеджменту больового синдрому має бути обов’язковим і регулярним. Необхідно покращувати розуміння медиками механізмів та моделей гострого больового синдрому, навчати оцінювати його тяжкість у пацієнта, враховувати фактори ризику й застосовувати ці знання на практиці.
Підбиваючи підсумки доповіді, професор А. Монтеро наголосив на наступних моментах:
- важливе більше залучення пацієнтів до прийняття рішень щодо їх лікування;
- необхідні професійні тренінги персоналу щодо мультидисциплінарного підходу в лікуванні болю;
- слід віддавати перевагу мультимодальній аналгезії як засобу цілеспрямованого впливу на різні ланки больового синдрому;
- використання клінічних протоколів має здійснюватися з урахуванням індивідуальних потреб пацієнтів.
Підготувала Марія Грицуля