17 січня, 2022
Показник BAU як кількісний індикатор нейтралізувальних антитіл у разі COVID-19 за міжнародним стандартом ВООЗ
Перший випадок коронавірусної хвороби (COVID-19), спричинений вірусом SARS-CoV-2, було зареєстровано в грудні 2019 р. (м. Ухань, Китай). У березні 2020 р. Всесвітня організація охорони здоров’я (ВООЗ) оголосила про пандемію, яка триває досі [1]. Із 31 грудня 2019 р. по 20 грудня 2021 р. в 194 країнах було зареєстровано 275 298 531 підтверджений випадок захворювання та 5 373 552 випадки смерті, одужали 247 018 847 осіб [2].
Аналіз антитіл до SARS-CoV‑2 залишається важливим у боротьбі з епідемією COVID‑19 [3-5]. Від початку пандемії Управління з контролю якості продуктів харчування та лікарських засобів США (FDA) видало дозволи на використання в надзвичайних ситуаціях для сотень серологічних наборів із метою лабораторного підтвердження діагнозу COVID‑19 [6]. Дані Фонду інноваційної нової діагностики (FIND) свідчать про те, що станом на квітень 2021 р. існує не менш як 655 імунологічних наборів для визначення антитіл, які або комерційно доступні, або перебувають на стадії розробки. Нині тестування на антитіла може надати цінні дані щодо епідеміологічного нагляду й оцінки для визначення імунізаційного статусу населення [7, 8], діагностики підозрілих випадків у разі негативного тесту на РНК вірусу [9-11], підбору гіперімунної плазми для конвалесцентної плазмотерапії [12, 13], розроблення терапевтичних антитіл [14, 15], визначення імунної відповіді та стійкості вакцин проти COVID‑19 [16, 17].
Перші системи тестування на антитіла до вірусу SARS-CoV‑2 було розроблено для того, щоб відрізнити людей із коронавірусною інфекцією від тих, хто ще не був інфікований новим вірусом [18]. Тому ці імуноаналізи зазвичай розроблялись як якісні, а не кількісні тести й виробники ставили перед собою мету досягнення максимально можливої специфічності та високої чутливості, для чого використовували різні антигени. Фактично можна виділити два типи аналізів: на основі нуклеокапсиду та шиповидного глікопротеїну коронавірусу (S‑білок), який є основною мішенню для нейтралізації антитілами, служить для зв’язування з рецептором і злиття з клітинною мембраною при проникненні вірусу [19]. У більшості інфікованих людей антитіла, спрямовані проти SARS-CoV‑2 на специфічні нуклеокапсидні антигени, рано індукуються через типову сильну імуногенність вірусного нуклеокапсиду. Крім того, дуже висока специфічність досягається за рахунок цільової модифікації антигену нуклеокапсиду таким чином, щоб не було перехресної реактивності навіть із близькими спорідненими вірусами. Проте властивості таких нуклеокапсидів на основі цих антитіл залишаються неясними й ці маркери інфекції навряд чи будуть функціонально значущими для забезпечення захисту або імунітету. З іншого боку, антитіла, які реагують з S‑білком, діють інакше. Було показано, що S‑зв’язувальні антитіла виконують функцію нейтралізувальних антитіл. Отже, не дивно, що численні дослідження виявили хорошу кореляцію між зв’язуванням S‑спайкових білків і нейтралізувальними антитілами [20-22]. У контексті вакцин проти SARS-CoV‑2 саме ці антитіла, що нейтралізують, мають першорядне значення.
Головна мета активної імунізації – отримати багато нейтралізувальних антитіл, специфічних для SARS-CoV‑2, які запобігають проникненню вірусу та системному поширенню захворювання. Деякі з методів для визначення нейтралізувальної активності мають суттєві обмеження. Наприклад, аналізи із живими вірусами потребують 3-го рівня біобезпеки, а метод псевдотипування дуже трудомісткий і характеризується низькою пропускною здатністю [23-25]. Класичні тести на антитіла, які вимірюють реактивність антитіл у сироватці/плазмі з певними антигенами, можуть виконуватися дуже швидко та з високою продуктивністю. У зв’язку з цим дослідження антитіл проти S‑спайкових білків відіграють важливу роль. Утім, ці тест-системи повинні могти надійно визначати кількість антитіл, специфічних для SARS-CoV‑2, рівні яких можна порівняти один з одним, і мати відмінну кореляцію з наявністю нейтралізувальних антитіл. У компанії з вакцинації серед серологічних тестів важливу роль відіграли такі на антитіла проти рецептор-зв’язувального домену (RBD), субодиниці S1 та full spike (S). Однак результати досліджень сильно відрізняються в клінічних ситуаціях через відсутність контрольного матеріалу для стандартизації кількісних тестів у разі визначення нейтралізації SARS-CoV‑2 [26]. Тому виникла потреба в розробленні відповідного кількісного стандарту.
Перший міжнародний стандарт ВООЗ для імуноглобуліну G проти SARS-CoV‑2
У час вакцинації проти COVID‑19 додається ще одна важлива роль серології SARS-CoV‑2, а саме визначення специфічних антитіл після активної імунізації. Для цього було розроблено перший міжнародний стандарт ВООЗ для імуноглобуліну G проти SARS-CoV‑2 (код NIBSC: 20/136) із метою гармонізації оцінки імунної відповіді після природної інфекції або вакцинації [27]. Це спростить стандартизацію серологічних методів SARS-CoV‑2, дасть змогу порівнювати й узгоджувати дані наборів між лабораторіями, що своєю чергою допоможе визначити рівні антитіл, які потрібні для ефективності дії вакцин і терапевтичних засобів, а також покращити розуміння епідеміології вірусів у рамках епідеміологічних та імунологічних досліджень. Розроблення міжнародного стандарту було організовано Національним інститутом біологічних стандартів і контролю (NIBSC) у співпраці з ВООЗ за сприяння Коаліції за інновації в забезпеченні готовності до епідемій (CEPI). Міжнародні стандарти визнані еталонними матеріалами вищого рівня для біологічних речовин, їм надано значення в міжнародних одиницях (МО). Вони використовуються для кількісної оцінки біологічної активності, що присутня в зразку, даючи змогу порівнювати аналізи з різних лабораторій і відображати порівняні результати. Це дає можливість краще визначати як аналітичний параметр – чутливість тестів, так і клінічний параметр – захисні рівні антитіл.
Розроблення міжнародного стандарту ВООЗ для антитіл проти SARS-CoV‑2
Досліджувані зразки
Міжнародним стандартом для антитіл проти SARS-CoV‑2 є ліофілізований препарат пулу плазми від 11 пацієнтів, які одужали від COVID‑19 (Велика Британія). Матеріал було зібрано через 28 днів після появи перших симптомів. Зразки кожного пацієнта оброблено з використанням детергенту, щоб мінімізувати ризик вірусів [28]. Окрім того, вони були перевірені на наявність вірусних маркерів (антитіла до ВІЛ, HBsAg та HCV). Приблизно 3500 скляних DIN‑ампул об’ємом 2,5 мл, що містять 0,25 мл об’єднаної плазми, були ліофілізовані 11 червня 2020 р. Первинне сушіння проводили при -35 °C протягом 40 год у вакуумі 100 мкбар із поступовим збільшенням температури до 25 °C протягом 10 год, вторинне сушіння – при 25 °C протягом 30 год у вакуумі 30 мкбар. Флакони були заповнені сухим азотом до атмосферного тиску та герметизовані.
Учасники дослідження
Брати участь у дослідженні погодилася 51 лабораторія, проте троє учасників із материкового Китаю не змогли отримати зразки для спільного дослідження через час, потрібний для оформлення дозволу на ввезення. Чотири лабораторії не надали результатів вчасно для включення до звіту про спільне дослідження. Отже, 44 учасники, що представили включені результати, були з 15 країн, що охоплюють 6 континентів: Австралія (4), Бразилія (1), Канада (1), Китай (1), Німеччина (3), Індія (1), Італія (1), Японія (1), Кенія (1), Нідерланди (2), Саудівська Аравія (1), Сінгапур (1), Південна Корея (3), Велика Британія (11) та США (12). У дослідженні використано 125 методів, включаючи ELISA, аналізи нейтралізації, проточну цитометрію, імуноаналізи латерального потоку, інгібувальні аналізи й один аналіз подвійного зв’язування антигену. Препарат-кандидат, зразок G, код NIBSC: 20/136, оцінювався як частина сліпої панелі зразків, яка включала плазму та сироватку від пацієнтів, що одужали від COVID‑19, для оцінки комутативності й узгодженості результатів. Чотири пули плазми пацієнтів, які одужали, було включено в дослідження та розподілено на зразки з високим, середнім і низьким титрами антитіл.
Результати дослідження
У листопаді 2020 р. підсумки дослідження було представлено ВООЗ. Результати показали, що міжлабораторна варіація скоротилася більш ніж у 50 разів для аналізів нейтралізації й у 2000 разів для ELISA‑тестів відносно міжнародного стандарту й була прийнята комітетом експертів ВООЗ із біологічної стандартизації 10 грудня 2020 р. Міжнародний стандарт заснований на об’єднаній людській плазмі пацієнтів, які одужали від COVID‑19, ліофілізованій в ампулах, із призначеною одиницею, що становила 250 МО на ампулу для нейтралізації.
Отже, пульовано плазму від 11 пацієнтів із SARS-CoV‑2, зразок G, код NIBSC: 20/136, встановлений як міжнародний стандарт ВООЗ. У початковому проєкті, розісланому учасникам, було запропоновано загальну довільно призначену одиницю 250 МО на ампулу для кількісного визначення нейтралізувальних антитіл проти антигенів SARS-CoV‑2.
Результат аналізу виражається в МО стандарту ВООЗ – BAU (binding antibody units – одиниці зв’язувальних антитіл). Оскільки ці одиниці вимірювання є уніфікованими для IgG SARS-CoV‑2, то вони не потребують перерахунку, на відміну від інших (Од/мл, AU/мл тощо). Щоб привести свою систему до МО, компанія-виробник має придбати таку ампулу. Далі її потрібно розвести в дистильованій воді та виконати тест на антитіла. З огляду на співвідношення BAU (яке відомо) та результат аналізу самої компанії можна отримати коефіцієнт для перерахунку.
Кожна фірма – виробник таких тест-систем повинна перейти на ці нові одиниці виміру. Приведення до єдиного стандарту допомагає в уніфікації серологічних методів діагностики SARS-CoV‑2 та полегшує поточні дослідження імунної відповіді на вірус, пов’язаної з природною інфекцією, вакцинацією та терапевтичним лікуванням. Отже, можливо регулярно проводити дослідження наявних штамів вірусу, відстежувати здатність організму людини захищатися від нової інфекції у зв’язку з мутацією та появою нових штамів, корегувати наявні дані.
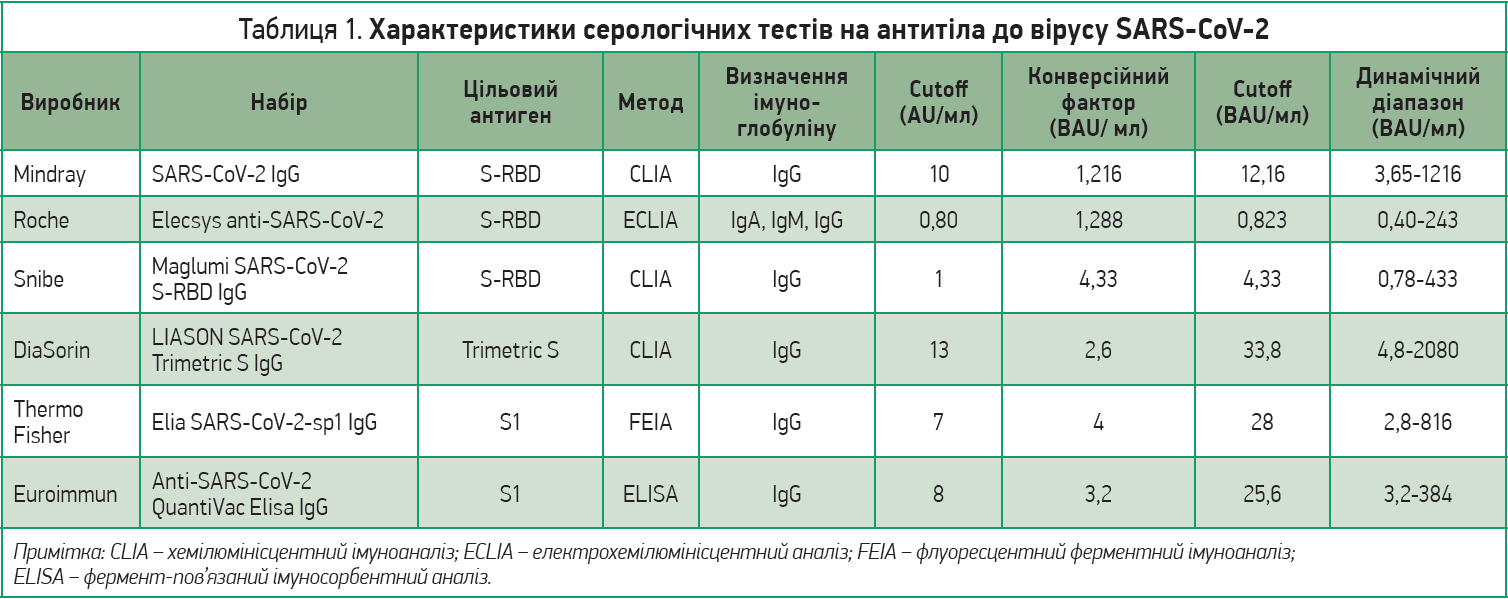
Прикладом є робота, виконана в лабораторії клінічної хімії Університетської клініки «Тор Вергата» (м. Рим, Італія), де було протестовано шість різних комерційних наборів, що використовуються в усьому світі для визначення IgG до SARS-CoV‑2 [29]. Скринінг на антитіла до S‑білка пройшли 88 послідовних зразків сироватки (співвідношення жінок і чоловікок – 1,4:1, середній вік – 57,0±14,0 року). Когорта дослідження складалася зі змішаної популяції (вакциновані пацієнти, які одужали від COVID‑19, і здорові особи). Усі аналізи виконувалися відповідно до вимог виробника й інструкцій. Характеристики різних оцінюваних серологічних тестів представлено в таблиці 1.
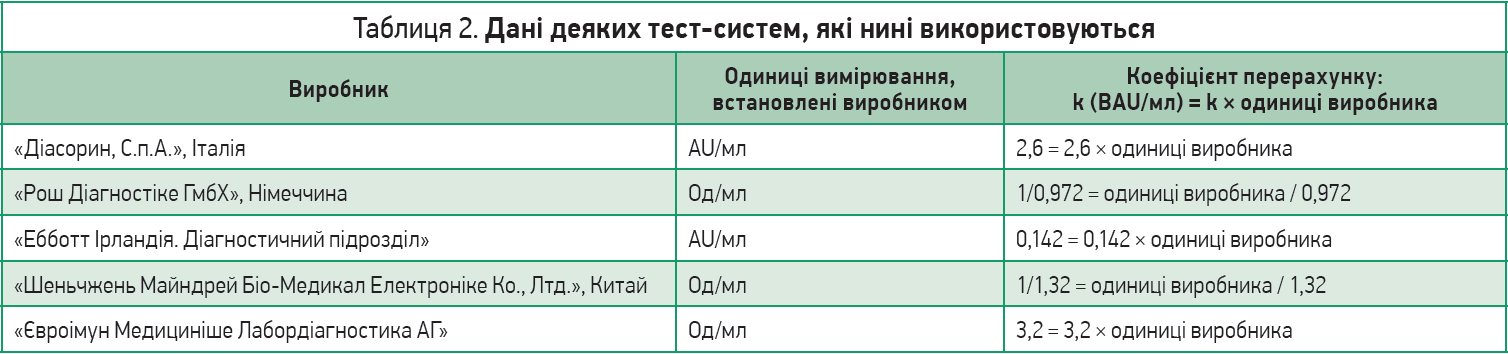
Отже, дані різних тест-систем, які нині використовуються, потрібно привести до єдиного знаменника – міжнародної одиниці BAU. Лабораторії повинні видавати висновки не лише зі своїми цифрами, як було раніше, а й зазначати кількість BAU в 1 мл крові (BAU/мл). Тепер і самі пацієнти можуть перерахувати результати своїх тестів. Для цього потрібно подивитися, тест якого виробника було зроблено раніше (вказано на бланку), й отриманий результат помножити або розділити на коефіцієнт, як зазначено в таблиці 2.
Пацієнти вже зараз мають можливість самостійно розшифрувати свій аналіз, якщо в лабораторіях використовують тест-системи різних фірм і цифри в них сильно відрізняються. Використовуючи дані з таблиці 3, можна легко інтерпретувати отриманий результат.
Висновок
ВООЗ затвердила міжнародний стандарт вимірювання антитіл до SARS-CoV‑2 з одиницею вимірювання BAU. Приведення до єдиного стандарту допоможе в розшифровці та полегшить поточні дослідження імунної відповіді на вірус SARS-CoV‑2, пов’язаної з природною інфекцією, вакцинацією та терапевтичним лікуванням. Для визначення рівнів імуноглобулінів до SARS-CoV‑2 потрібно використовувати набори реагентів для кількісного визначення антитіл, а результати досліджень наводити з використанням умовних одиниць виміру BAU/мл. Стандартизація результатів щодо імунної відповіді на COVID‑19 полегшує порівняння клінічних досліджень. Цей стандарт використовується в наборах для діагностики та моніторингу нещодавно перенесеної коронавірусної інфекції, в тому числі безсимптомного перебігу захворювання, контролю поствакцинального імунітету до S‑білка SARS-CoV‑2 при імунізації, для виявлення перехворілих на COVID‑19 та оцінки ефективності вакцинації.
Список літератури знаходиться в редакції.