27 жовтня, 2021
Мікробіота та модуляція імунної відповіді на вакцинацію
Потреба у високоефективних вакцинах, що забезпечують стійкий і довготривалий імунітет, ніколи не була такою очевидною, як під час пандемії COVID‑19. Однак з недостатньо зрозумілих причин імунна відповідь на вакцинацію може дуже відрізнятися як між окремими людьми, так і серед певних груп населення. На жаль, імуногенність вакцин є часто зниженою саме в тих популяційних групах, які мають найбільший ризик несприятливого перебігу інфекційного захворювання. В цьому огляді наведено погляд австралійських науковців на проблему субоптимальної відповіді на вакцини з акцентуванням їхньої уваги на важливій ролі кишкової мікробіоти у формуванні імунної відповіді. Саме корекція складу кишкової мікробіоти, зокрема за допомогою пробіотиків, на думку дослідників, може бути ефективним способом посилення імунної відповіді серед категорій населення з підвищеним ризиком дисбіотичних порушень (особи похилого віку, пацієнти з ожирінням, нераціональним харчуванням тощо).
З не зовсім зрозумілих причин індивідуальні реакції людського організму на вакцинацію є досить варіабельними. Наприклад, титри антитіл, індукованих введенням інактивованої вакцини проти сезонного грипу, можуть відрізнятися майже в 100 разів, кон’югованої пневмококової чи вакцини проти гемофільної палички типу В – до 40 разів. Достеменно відомо, що імуногенність вакцин часто погіршується в осіб, які живуть у країнах із низьким і середнім рівнем доходу (low- and middle income countries, LMIC; Україна також належить до цієї категорії – Прим. авт.), порівняно з жителями економічно розвинених країн (high-income countries – HIC). Крім того, імуногенність вакцин у здорових дорослих осіб є вищою порівняно з немовлятами та літніми людьми [5, 6]. Ці дані свідчать про існування певних факторів, пов’язаних з рівнем економічного розвитку та вікової категорії осіб, що впливають на якість і тривалість імунної відповіді на вакцинацію. Сьогодні зростає кількість даних, що свідчать про вплив мікробіоти кишечнику як вирішального фактора модуляції імунних реакцій на вакцинацію [10]. Крім того, склад мікробіоти між різними популяціями населення та осіб різних вікових категорій суттєво відрізняється [7-9].
Наразі ми маємо дані клінічних когортних досліджень, інтервенційних випробувань, експериментальних робіт на тваринних моделях, результати яких дозволяють припустити, що мікробіом кишечнику має важливу роль у модулюванні імуногенності вакцин.
Субоптимальні відповіді на вакцину населення LMIC
Імуногенність вакцин в осіб, які проживають у LMIC, є зниженою порівняно з населенням HIC. Зокрема, це стосується таких оральних вакцин, як оральна вакцина проти ротавірусу (ОРВ), оральна вакцина проти поліомієліту (ОПВ) та оральні вакцини проти холери й черевного тифу [11]. Наприклад, середній титр IgA у відповідь на ОРВ у немовлят із LMIC приблизно в 4 рази нижчий порівняно з немовлятами з HIC. Погіршення імуногенності спричиняє зниження ефективності тієї чи іншої вакцини. Нещодавній метааналіз усіх рандомізованих контрольованих випробувань ОРВ (вакцини Rotarix і RotaTeq) виявив, що ефективність вакцинації в осіб з HIC становила 98% через 2 тиж і 94% через 12 міс (порівняно із 66 та 44% в осіб із LMIC відповідно) [27]. Майже в 100% дітей з HIC після імунізації ОПВ спостерігається сероконверсія, тоді як відповідний показник у дітей з LMIC становить ≈70%.
Роль імунного статусу перед вакцинацією
Крім істотних географічних відмінностей, імуногенність вакцин також значно нижча в немовлят і літніх людей [6]. Наприклад, ефективність вакцини проти грипу знаходиться в межах 70-90% у молодих людей порівняно із 30-50% в осіб віком >65 років [6, 26]. Схожу ефективність у літніх осіб мають вакцини на основі пневмококових полісахаридів. Хоча глибоке обговорення змін імунного статусу зі старінням виходить за межі цього огляду, імунний статус особи до щеплення визнається тісно пов’язаним з тим, наскільки добре вона зреагує на вакцинацію. Вихідний імунний статус дозволяє досить точно передбачити імунну відповідь на низку вакцин (проти грипу, гепатиту В, малярії) [27].
Стан імунітету суттєво змінюється в дитинстві та в подальшому житті, а також значно відрізняється між населенням країн з різним рівнем економічного розвитку [27-29], що забезпечує достовірне обґрунтування відмінностей у відповідях на вакцинацію, які спостерігаються в цих популяціях.
Сьогодні серед широкого спектра факторів, здатних впливати на імуногенність вакцин, як-от генетичні особливості, дієта та харчування, материнські антитіла, перенесені раніше інфекції, а також фактори, пов’язані із самою вакциною (наприклад, ступінь збігу між вакциною і циркулювальними штамами), все більше фактів вказує на важливу роль мікрофлори кишечнику у формуванні базового імунного статусу й забезпеченні імунної відповіді організму на вакцинацію.
Вплив мікробіоти на відповідь організму на вакцину
Склад кишкової мікрофлори може значно варіювати між окремими особами, особливо між західними та незахідними популяціями. Крім того, в ранньому дитинстві (до 2-3 років) і в похилому віці мікробіота кишечнику є нестійкою, має низький рівень мікробної різноманітності, що корелює зі зниженням імуногенності вакцин. Саме тому модуляція мікробіому кишечнику за допомогою дієти, пре- та пробіотиків вважається привабливою можливістю підвищення ефективності вакцин в уразливих групах населення, тому дослідження в цьому напрямі тривають. Розглянемо детальніше результати, отримані в клінічних когортних дослідженнях, інтервенційних випробуваннях і на тваринних моделях.
Результати клінічних когортних досліджень
У декількох обсерваційних клінічних когортних дослідженнях повідомлялося про зв’язок між складом мікробіоти немовлят і відповіддю на вакцинацію. Наприклад, у двох дослідженнях (групи немовлят з Гани та Пакистану) був виявлений достовірний зв’язок між фекальною мікрофлорою і відповіддю на ОРВ [31, 32].
У дослідженні з Гани фекальна мікрофлора немовлят, які відреагували на вакцину (n=39), була більш схожою на мікрофлору немовлят з Нідерландів відповідного віку (n=154), ніж у тих, хто на вакцину не зреагував (n=39). Вважалося, що всі діти з Нідерландів відповіли на вакцинацію, оскільки рівень сероконверсії на ОРВ серед немовлят із країн Північної Європи перевищує 90%.
Збільшення відносної кількості Streptococcus bovis у фекальній мікрофлорі тісно корелювало із кращою відповіддю на вакцину, тоді як збільшення відносної кількості представників Bacteroides і Prevotella супроводжувалося зворотним ефектом.
Дослідження серед немовлят з Пакистану виявило підвищення відносної кількості грамнегативних бактерій (особливо протеобактерій) серед пацієнтів, які відповіли на вакцинацію. Цікаво, що у випробуванні, проведеному в Гані, також спостерігалося збільшення співвідношення представників родини ентеробактерій та бактероїдів серед осіб, котрі відповіли на вакцинацію. Дослідники припустили, що посилювати реакцію на вакцину може ліпополісахарид грамнегативних ентеробактерій [31].
Дослідження відповіді на ОПВ у 107 немовлят з Китаю продемонструвало, що відносна кількість біфідобактерій у фекальній мікрофлорі корелює зі збільшенням концентрації поліовірус-специфічного IgA [35]. Інше випробування, проведене серед немовлят в Індії, не виявило істотних відмінностей у відносній кількості різноманітних таксонів фекальних бактерій між респондентами та нереспондентами на ОПВ [36]. Однак в обох дослідженнях більша різноманітність мікробіоти була пов’язана з менш вираженою реакцією на вакцинацію. Відносна кількість біфідобактерій у ранньому дитинстві також була значною мірою пов’язана з реакціями CD4+ Т-клітин і реакціями антитіл на декілька парентеральних вакцин, оцінених у 2-річному віці. Отримані дані свідчать про те, що мікробіота кишечнику здатна модулювати відповідь не лише на оральні вакцини [37].
Докази з експериментальних досліджень
Дані досліджень на тваринних моделях надають переконливі докази того, що мікробіота кишечнику відіграє важливу роль у модулюванні імунної відповіді на вакцинацію. Наприклад, стерильні миші, які отримували антибіотики, мали виражене зростання концентрації IgG та IgA у відповідь на перорально введений штам ротавірусу миші, призначений для моделювання реакцій на ОРВ [46]. Однак стерильні миші, народжені самками, котрі отримували антибіотики, мали знижену відповідь на імунізацію [47].
Переконливими є результати випробування, в якому вивчали вплив мікробіоти на імунну відповідь на введення вакцини проти сезонного грипу. Відзначалося, що стерильні дорослі миші, які отримували антибіотики, мали помітно гіршу реакцію антитіл порівняно з мишами контрольної групи [48]. Схожий ефект спостерігався у випадку введення мишам інактивованої вакцини проти поліомієліту [48].
Нещодавно було виявлено, що мишенята, котрі піддавалися дії антибіотиків, мали значно гіршу реакцію антитіл на 5 різних живих або ад’ювантних ліцензованих вакцин, які вводяться немовлятам у всьому світі [47]. Втім, ситуація змінювалася на краще в разі трансплантації фекальної мікробіоти від мишей відповідного віку, які не отримували антибіотиків.
Здатність спричинених антибіотиками порушень мікробіоти впливати на ефективність вакцинації має важливі наслідки з огляду на те, що із 2000 по 2015 рік споживання антибіотиків у всьому світі зросло на 65% (із 21,1 до 34,8 млрд визначених добових доз), при цьому найбільший приріст їхнього споживання спостерігався в LMIC [49].
Вплив мікробіоти на лімфоцити
У низці інших досліджень підкреслюється важлива роль мікробіоти кишечнику в модуляції реакцій В- і Т-клітин, що частково пояснює здатність мікробіоти впливати на імуногенність вакцин. Наприклад, два нещодавні доклінічні випробування продемонстрували, що мікробіота сприяє формуванню пулу В-клітин, які мають важливе значення в реалізації антиген-специфічних реакцій на вакцинацію [51, 52]. В першому дослідженні дорослі стерильні миші, імунізовані стрептококом групи А, мали значно знижену кількість клонотипів клітин В‑1 та рівень сироваткових антитіл, специфічних до полісахариду клітинної стінки стрептокока [51]. В мишей, котрим у подальшому відновлювали мікробіоту кишечнику, спостерігали нормалізацію імунних реакцій. Ці дані можуть мати важливе значення для вакцин, кон’югованих з полісахаридами. Дійсно, у вищезазначеному дослідженні реакція мишей раннього віку під впливом антибіотиків на введення кон’югованої пневмококової вакцини погіршувалася [44].
Сьогодні більшість робіт зосереджено на ролі мікробіоти в модулюванні реакцій антитіл, спричинених вакциною, однак слід ураховувати, що відповідь клітин Т-хелперів має вирішальне значення для оптимальної реакції В-клітин на вакцинацію [3]. Крім того, вважається, що імунітет, опосередкований Т-клітинами, має вирішальну роль в імунному захисті, зумовленому деякими ліцензованими вакцинами (як-от проти жовтої лихоманки та БЦЖ) і вакцинами, що знаходяться на етапі розробки (наприклад, проти ВІЛ‑1) [3]. Важливість імунітету, опосередкованого Т-хелперами, все більше визнається науковцями у випадку до SARS-CoV‑2 [25]. Сьогодні індукція Т-клітин вакциною проти SARS-CoV‑2 вважається бажаним фактором для забезпечення довгострокового захисту.
Потенційні механізми
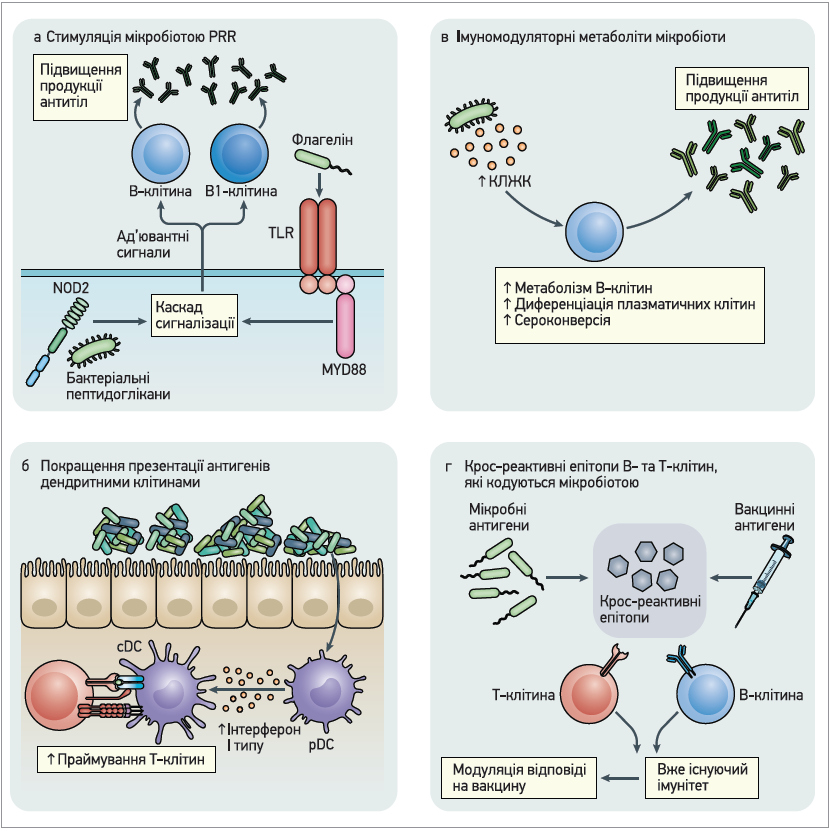
На рисунку представлені потенційні механізми, за допомогою яких кишкова мікробіота й пробіотики можуть модулювати імуногенність та ефективність вакцин.
Рис. Потенційні механізми, за допомогою яких кишкова мікробіота здатна модулювати імуногенність та ефективність вакцин
Імуномодуляторні молекули, які виробляються мікробіотою, як-от флагелін і пептидоглікани, покращують відповідь на вакцинацію як натуральні ад’юванти, що відчуваються патерн-розпізнавальними рецепторами (PRR). До останніх належать Toll-подібні рецептори (TLR) і білок NOD2, експресовані на антиген-презентувальних клітинах. Відповідь на введення вакцини також можуть покращувати інші імуномодуляторні молекули, наприклад, бактеріальні ліпополісахариди.
Ключову роль в імунних відповідях на вакцинацію відіграють дендритні клітини (DC), які презентують вакцинні антигени Т-клітинам і секретують імуномодуляторні цитокіни. Симбіонтні бактерії регулюють продукцію інтерферонів І типу плазмацитоїдними DC (pDC); своєю чергою, це спричиняє специфічний метаболічний та епігеномний стан у звичайних дендритних клітин (cDC), що посилює праймування Т-клітин.
Імуномодуляторні метаболіти, які продукує мікробіота, зокрема коротколанцюгові жирні кислоти (КЛЖК), здатні покращувати метаболізм В-клітин, задовольняючи їхню підвищену потребу в енергії для вироблення антитіл, а також підвищувати експресію генів, залучених до диференціації плазматичних клітин і сероконверсії.
Отже, з’являється все більше даних на користь того, що мікробіота може кодувати епітопи, котрі перехресно реагують з епітопами, кодованими патогенами чи вакцинами. Наявність крос-реактивних В- і Т-клітин може модулювати відповіді на вакцинацію.
Втручання, орієнтовані на нормалізацію мікробіоти, в т. ч. застосування пробіотиків, пребіотиків і синбіотиків, широко досліджуються. Пробіотики вже виявилися ефективними засобами профілактики таких захворювань, як некротичний ентероколіт, гостра діарея та сепсис [82-84]. У низці досліджень також виявлено сприятливий вплив пробіотиків щодо покращення відповіді на вакцинацію (проти грипу тощо) [87-90]. Модуляція імунних реакцій на вакцини, зокрема проти COVID‑19, – це надзвичайно важливе завдання з огляду на глибоке розуміння внеску мікробіоти в регуляцію імунітету загалом.
! Ключові висновки
- В умовах пандемії COVID‑19, що триває, як ніколи актуальною є потреба у вакцинах, які зумовлюють стійкий і довготривалий імунітет.
- У країнах з низьким і середнім доходом (LMIC), до яких належить й Україна, імуногенність вакцин є нижчою порівняно з такою в економічно розвинених країнах (HIC), імовірно, внаслідок неоптимального кількісного та якісного складу кишкової мікробіоти, характерного для населення країн LMIC.
- Модуляція мікробіому кишечнику за допомогою пробіотиків є привабливою можливістю підвищення ефективності вакцин, особливо в уразливих групах населення.
КОМЕНТАР ЕКСПЕРТА
Доктор медичних наук, професор Олена Мирославівна Радченко (Львівський національний медичний університет ім. Данила Галицького)
Існування людської популяції відбувається в нерозривній взаємодії із симбіонтною й умовнопатогенною мікробіотою кишечнику, яка безумовно впливає на ефективність діяльності імунної системи, адже в кишечнику, за різними оцінками, знаходиться від 70 до 80% клітин імунної системи організму. На сьогодні вже достеменно відомо, що кишкова мікробіота також бере участь у формуванні імунної відповіді на інфікування численними вірусами, в тому числі SARS-CoV‑2, та на вакцинацію, що висуває проблему кишкової мікробіоти на чільне місце.
Особливу увагу науковців привернула проблема моделювання імунної відповіді на вакцинацію методом нормалізації кишкової мікрофлори, що описано вище в публікації. Зокрема, мікробіота може модулювати відповідь на вакцину через активацію утворення природних ад’ювантів, котрі й забезпечують адекватну реакцію на імунізацію.
Нормальна мікрофлора шлунково-кишкового тракту людини переважно має належати до лактобактерій та біфідобактерій, але якісний і кількісний склад кишкового мікробіому нестабільний, він змінюється з віком та під впливом численних факторів існування. Так, зміна мікробіому кишок людини значною мірою залежить від особливостей харчування, впливу довкілля, стану здоров’я загалом та органів травної системи зокрема, а найголовніше – від застосування лікарських засобів (антибіотики, нестероїдні протизапальні препарати, глюкокортикоїди, цитостатики). Численні зміни мікрофлори зумовлюють зниження імунної відповіді організму на введення вакцини, а отже, зменшення її ефективності, тобто саме зміни якісного та кількісного складу мікробіоти кишечнику науковці пов’язують зі зниженою імунною відповіддю на вакцинацію як у в дітей раннього віку, так і в осіб похилого віку, а також серед населення країн із низьким рівнем економічного розвитку.
Низька ефективність імунізації – надзвичайно важлива проблема в умовах пандемії COVID‑19, оскільки саме адекватна відповідь імунної системи є провідною умовою подолання хвороби у випадку розвитку COVID‑19.
Посилити імунну відповідь на вакцинацію, а також ліквідувати дисбаланс імунної системи дозволяє нормалізація складу кишкової мікрофлори за допомогою пробіотиків. Слід згадати й те, що пробіотики відіграють певну роль у врівноваженні захисної імунної відповіді людини, стимулюючи бар’єрну функцію слизової оболонки травного каналу та модулюючи відповідь імунної системи. Має також значення й інший механізм позитивного впливу мікробіому кишок, а саме модуляція дії вітаміну D, завдяки якій пробіотики активують бар’єрну функцію слизової оболонки кишечнику. Такі ефекти пробіотиків зумовлюють нормалізацію співвідношення клітин імунної системи, зменшення продукції прозапальних цитокінів (інтерлейкіни 1, 6, 8, інтерферон-γ та фактор некрозу пухлини), збільшення кількості T-регулювальних лімфоцитів, що допомагає підтримувати самотолерантність, одночасно посилюючи захисні вроджені імунні реакції.
Тому перспективним шляхом підвищення імунної відповіді на інфекційну хворобу та на імунізацію від вірусних і бактеріальних агентів, що стало найактуальнішою проблемою в умовах пандемії COVID‑19, стає застосування пробіотиків. Одним з найбільш відомих і вивчених пробіотичних засобів, представлених на ринку України, є багатоштамний пробіотик Лактіалє® Мульті, який включає 14 штамів пробіотичних бактерій із доведеною ефективністю: Lactobacillus casei, Lactobacillus plantarum, Lactobacillus rhamnosus, Bacillus subtilis, Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium longum, Lactobacillus acidophilus, Lactococcus lactis, Streptococcus thermophilus, Bifidobacterium infantis, Lactobacillus delbrueckiis sp. bulgaricus, Lactobacillus helveticus, Lactobacillus salivarius, – сумарно 2,0×109 КУО пробіотичних мікроорганізмів в 1 капсулі. Усі штами мають розшифрований геном і код безпеки (PXN), а також протестовані на кислотостійкість, здатність до адгезії та пригнічувальну дію щодо патогенів. Дія штамів Лактіалє® Мульті є доведеною, тому цю дієтичну добавку можна розглядати як варіант корекції мікробіому кишок з метою оптимізації імунної відповіді на гострі інфекції та, особливо, на протиінфекційну вакцинацію.
За матеріалами: Lynn D. J., Benson S. C., Lynn M. A., Pulendran B. Modulation of immune responses to vaccination by the microbiota: implications and potential mechanisms, Nature Reviews Immunology (2021);
https://doi.org/10.1038/s41577-021-00554-7.
Переклав з англ. В’ячеслав Килимчук