16 листопада, 2021
Скринінг раку шийки матки: ПАП-тест, цитологія, ВПЛ-тест?
 Скринінг – це припустима ідентифікація невиявленої хвороби шляхом використання тестів, аналізів або інших процедур, які можуть бути швидко застосовані. Скринінг-тести дозволяють виділити зовні здорових осіб, які, ймовірно, страждають на ті чи інші захворювання, серед осіб, які, ймовірно, цих захворювань не мають.
Скринінг – це припустима ідентифікація невиявленої хвороби шляхом використання тестів, аналізів або інших процедур, які можуть бути швидко застосовані. Скринінг-тести дозволяють виділити зовні здорових осіб, які, ймовірно, страждають на ті чи інші захворювання, серед осіб, які, ймовірно, цих захворювань не мають.
Ключові слова: скринінг, цитологія, зона трансформації, Bethesda system, рідинна цитологія, ПАП-тест, ВПЛ-тестування.
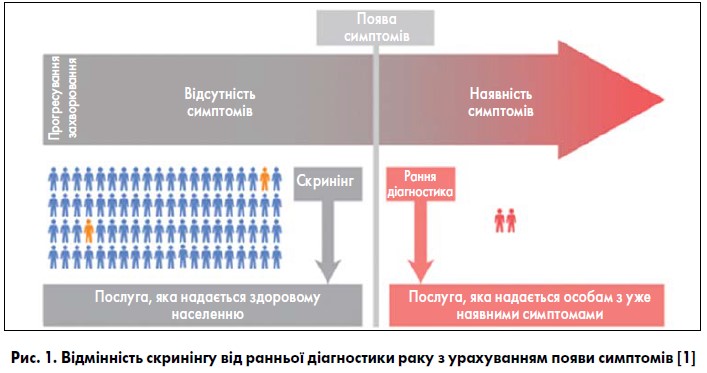
Скринінг і рання діагностика є різними поняттями. Скринінг передбачає тестування безсимптомного населення, натомість рання діагностика призначена для максимально раннього виявлення патологічних станів у пацієнтів з уже наявними симптомами [1] (рис. 1).
Скринінг раку шийки матки (РШМ) – це обстеження безсимптомних жінок, у яких попередні скринінгові дослідження на РШМ були нормальними.
Програма скринінгу РШМ спрямована на зниження захворюваності й смертності від цієї онкопатології за рахунок виявлення та лікування передракових станів.
На сьогодні існують скринінгові програми з виявлення РШМ, які у якості первинного тесту використовують: цитологію (ПАП-тест), або визначення високоонкогенних штамів вірусу папіломи людини (ВПЛ), або котестинг (ПАП-тест у поєднанні з генотипуванням високоонкогенних штамів ВПЛ [2]. Варто зазначити, що велика кількість публікацій, присвячених порівнянню ефективності цих підходів, оптимальній частоті скринінгових візитів для різних вікових груп, викликає у багатьох лікарів відчуття розгубленості.
Принципи скринінгу Wilson і Jungner [3]
1. Виявлення захворювання має бути важливим пріоритетом для здоров’я.
2. Необхідні прийнятні заходи лікування хворих із діагностованим захворюванням.
3. Мають бути в наявності засоби діагностування та лікування захворювання.
4. Захворювання, яке виявляється, має бути на розпізнаваній латентній або ранній симптоматичній стадії.
5. Мають існувати відповідні тести або дослідження.
6. Тести мають бути прийнятними для населення.
7. Слід добре розуміти закономірності природного розвитку захворювання від латентної форми до явної.
8. Має бути узгоджена політика щодо того, хто входить до категорії осіб, які потребують лікування.
9. Витрати на виявлення випадків хвороби (включаючи діагностику та лікування виявлених хворих) мають бути економічно збалансовані з можливими витратами на медичне обслуговування в цілому.
10. Виявлення випадків хвороби має бути безперервним процесом, а не разовою кампанією.
Залежно від країни, віку пацієнтки, її анамнезу та факторів ризику обирають ті чи інші дослідження для скринінгу РШМ. Більшість європейських країн впроваджують у практику скринінгів первинний ВПЛ-скринінг. У Німеччині, Румунії, Польщі застосовується методика котестингу, тобто ПАП-тест + визначення високоонкогенних штамів ВПЛ [2].
РШМ – одна з найбільш поширених онкопатологій в усьому світі, що посідає четверте місце після раку молочної залози, колоректального раку та раку легень.
Всесвітній інформаційний центр із ВПЛ-інфекції повідомляє, що 2018 року в Україні частота захворюваності на РШМ становила 40 випадків на 100 тис. населення серед 35‑55-річних жінок, а смертність з-поміж них становила 50%. Ця приголомшлива статистика відкидає нас до рівня країн, що розвиваються [5].
Сучасні світові тенденції профілактики РШМ
У контексті онкопатології загалом первинна профілактика полягає у зменшенні впливу факторів ризику та онкогенних чинників шляхом законодавчого врегулювання, просвітницьких заходів щодо модифікації способу життя, вакцинації від онкогенних вірусів [6, 7].
У якості первинної профілактики РШМ можуть застосовуватися:
- вакцинація населення проти ВПЛ до статевого дебюту;
- санітарно-просвітницька робота щодо факторів ризику (куріння);
- статеве виховання (запобігання інфекціям, що передаються статевим шляхом [ІПСШ]; застосування презервативів; прихильність до моногамних статевих відносин).
Як свідчить світовий досвід, провідна роль у первинній профілактиці РШМ належить вакцинації [6, 7].
Вторинна профілактика онкологічних захворювань полягає в реалізації скринінгових програм для виявлення передракових станів або ранніх стадій раку, на яких можливе ефективне лікування. Свою ефективність на популяційному рівні довели скринінг РШМ, раку молочної залози і колоректального раку [8, 9].
Основною складовою вторинної профілактики РШМ є цервікальний скринінг. Отримані в останні роки дані щодо ролі кофакторів розвитку РШМ на фоні персистенції ВПЛ (хламідійна інфекція, порушення вагінального біоценозу, куріння) дозволяють у перспективі розглядати вплив на них як складову вторинної профілактики [10, 11].
Третинна профілактика РШМ має на меті запобігти рецидиву захворювання й покращити прогноз/виживаність у таких пацієнтів [6, 7]. Третинна профілактика передбачає лікування відповідно до стадії розвитку захворювання та реабілітації [6, 7].
ПАП-тест методом рідинної або традиційної цитології – це дослідження, яке використовується при проведенні скринінгу на РШМ.
ПАП-тест (традиційним або рідинним цитологічним методом) вивчає морфологічні зміни клітин, і саме на цих висновках будується тактика лікаря. В основі цитологічної діагностики лежить оцінка характеристик ядра та ядерно-клітинного співвідношення. Здійснити цю оцінку найкращим чином дозволяє методика забарвлення клітин за Папаніколау (тест Папаніколау, ПАП-тест, мазок Папаніколау). Це поліхромний спосіб фарбування препаратів, що дозволяє оцінити морфологію, зрілість та метаболічну активність клітин [12].
Первинні принципи фарбування за Папаніколау збереглися і в сучасних методиках, але зазнали технічного вдосконалення й стандартизації, завдяки чому сьогодні є доступним ПАП-тест методом рідинної цитології. У дослідженнях доведена суттєво вища чутливість і специфічність рідинного ПАП-тесту порівняно з традиційним [13].
Загальновизнаною системою оцінки та репортування результатів ПАП-тесту для скринінгу й діагностики патології шийки матки є Bethesda system for reporting cervical cytology. У 2015 році було опубліковане третє видання дефініцій, критеріїв та пояснювальних нотаток системи Bethesda (Bethesda system for reporting cervical cytology. Definition, criteria and explanatory notes) [13].
Відповідно до системи Bethesda щодо традиційного і рідинного ПАП-тесту критеріями адекватного для оцінки зразка цервікального епітелію є [13]:
- правильне маркування;
- достатня кількість добре збережених, добре доступних для візуалізації клітин плоского епітелію;
- коментар щодо присутності клітин зони трансформації, наявності клітин крові або запальних клітин, що погіршують якість мазка.
Слід зауважити, що присутність клітин зони трансформації не є обов’язковим критерієм придатності мазка для оцінки, але завжди має коментуватись, оскільки є непрямою ознакою якості взятого біоматеріалу [13]. Така позиція часто викликає у лікарів здивування, адже перехідна зона є місцем найбільшого ризику розвитку атипових змін. Проте рішення експертів системи Bethesda базувалось на доказах. Дослідження з лонгітудинальним дизайном не підтвердили припущення, що жінки з нормальним результатом ПАП-тесту, у якому були відсутні клітини зони трансформації, мають більший ризик плоскоклітинного інтраепітеліального ураження високого ступеня (HSIL) із плином часу, ніж жінки з нормальними результатами ПАП-тесту з присутніми клітинами зони трансформації [14‑19]. У дослідженні рандомно відібраних осіб із нормальним результатом ПАП-тесту при скринінгу та тестами на ВПЛ (а також жінок із цитологічними відхиленнями або ВПЛ високого ризику) проводили повторний ПАП-тест, кольпоскопію та біопсію. Результати подальшого спостереження не показали значущої різниці у діагностуванні в майбутньому HSIL між пацієнтками з клітинами зони трансформації на початку скринінгу та без них [14]. Нарешті, ретроспективне дослідження «випадок – контроль» не виявило зв’язку між хибнонегативними результатами ПАП-тесту та відсутністю клітин зони трансформації [20]. Так само канадський огляд дійшов висновку щодо відсутності потреби в позаплановому проведенні повторного ПАП-тесту через відсутність клітин зони трансформації без наявності специфічних показань [21, 22]. Крім того, додавання ВПЛ-тестування до ПАП-тесту у жінок старше 30 років забезпечує високу чутливість скринінгу навіть за відсутності клітин зони трансформації у препараті [23, 24].
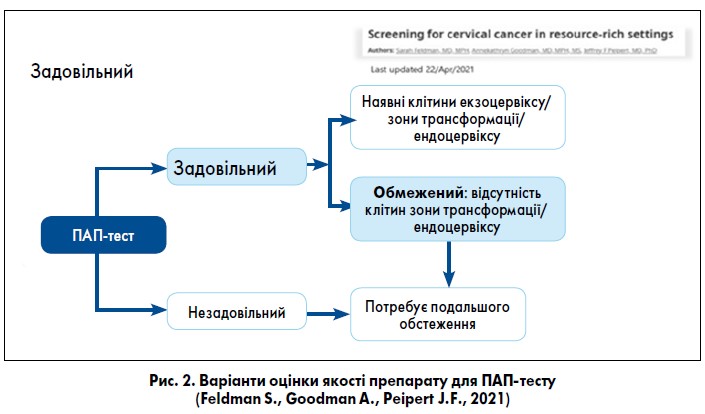
Достатня кількість добре збережених, добре доступних для візуалізації клітин плоского епітелію, або целюлярність, є дуже важливою характеристикою препарату, яка визначає ефективність скринінгу та діагностики патології шийки матки. Саме відповідно до целюлярності препарати розділяють на задовільні й незадовільні для оцінки за системою Bethesda.
Препарат має бути розцінений як незадовільний, якщо [13]:
- недостатня кількість добре збережених, доступних для візуалізації клітин плоского епітелію (<8‑12 тис. клітин для традиційного ПАП-тесту або <5 тис. клітин для рідинної цитології);
- 75% клітин плоского епітелію не можуть бути візуально оцінені через наявність крові, запальних клітин, лубриканту, зліпків клітин, пошкодження клітин внаслідок висушування на повітрі або погану фіксацію. Якщо <75% клітин мають зазначені недоліки, цитолог має зробити відповідний коментар.
Таким чином, відповідно до актуальних, обґрунтованих доказами підходів Bethesda system for reporting cervical cytology за якістю оцінюваного препарату ПАП-тести можна розділити на дві категорії [13]:
- задовільний (включає задовільний обмежений, коли відсутні клітини зони трансформації/ендоцервіксу);
- незадовільний.
У разі отримання результату з характеристикою «задовільний обмежений», ґрунтуючись на індивідуальних характеристиках пацієнтки, лікар може: провести додаткові обстеження (рефлекс-тест статусу ВПЛ), або призначити повторний ПАП-тест через мінімальний дозволений період часу (3 міс), або продовжити звичайне спостереження.
У разі незадовільного препарату для ПАП-тесту необхідно спробувати оцінити причини цього явища і врахувати їх при повторному взятті й плануванні додаткових обстежень (рис. 2).
Як знизити ризик незадовільних або обмежених ПАП-тестів?
Якість препаратів для ПАП-тесту дуже залежить від преаналітичного етапу: правильного взяття біологічного матеріалу, його фіксації у разі традиційного ПАП-тесту та транспортування.
При проведенні ПАП-тесту важливо:
- перед взяттям біологічного матеріалу видалити з поверхні шийки матки слиз;
- стежити за щільністю контакту цервікобрашу з поверхнею шийки;
- здійснити необхідну кількість обертань цервікобрашем;
- враховувати особливості розташування зони трансформації.
Не менш значущу роль відіграє дотримання пацієнткою правил підготовки до обстеження. Якщо є можливість контактувати з пацієнткою, слід нагадати їй про необхідність виключити за 24 год до ПАП-тесту гінекологічний огляд, вагінальне застосування будь-яких хімічних речовин, статеві контакти.
Переваги та недоліки ПАП-тесту
 Статистичні дані свідчать, що у жінок, які регулярно проходять ПАП-тест, частота захворюваності та смертності від РШМ знижується щонайменше на 80%. Водночас слід пам’ятати, що не виключені як хибнопозитивні, так і хибнонегативні результати ПАП-тесту внаслідок певних об’єктивних причин.
Статистичні дані свідчать, що у жінок, які регулярно проходять ПАП-тест, частота захворюваності та смертності від РШМ знижується щонайменше на 80%. Водночас слід пам’ятати, що не виключені як хибнопозитивні, так і хибнонегативні результати ПАП-тесту внаслідок певних об’єктивних причин.
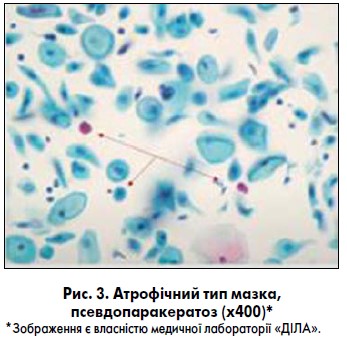
Найбільш поширеною причиною хибнопозитивного аномального ПАП-тесту є стани, які супроводжуються реактивними змінами цервікального епітелію та можуть імітувати картину клітинної атипії (реактивні й репаративні запальні зміни, атрофія (рис. 3), метаплазія, реактивні зміни на фоні застосування внутрішньоматкового контрацептиву.
Основними причинами хибнонегативного результату ПАП-тесту є неможливість внаслідок низької якості препарату розпізнати атипові клітини, а також коли останні не потрапляють у мазок через особливості анатомічної структури шийки матки, деформацію шийки внаслідок втручання або пологів, паракератоз/гіперкератоз.
Переваги ПАП-тесту (цитологія) у медичній лабораторії «ДІЛА»
- Медична лабораторія «ДІЛА» першою в Україні стартувала із сертифікованою методикою ПАП-тесту методом рідинної цитології. Цитологи лабораторії «ДІЛА» мають найбільший досвід роботи з препаратами рідинної цитології.
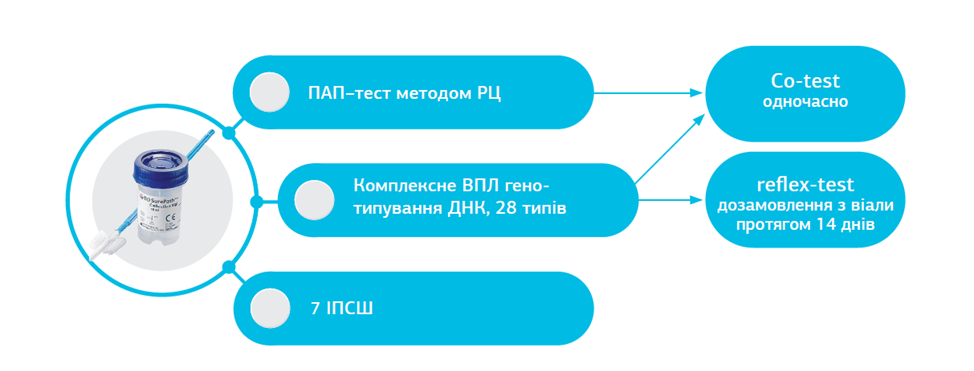
- Професійна команда експертів-цитологів пропонує широкий спектр пропозицій щодо проведення скринінгу РШМ (рис. 4). Лабораторія бере участь у міжнародному контролі якості Labquality.
- Гарантія стандартизації приготування препарату («скельця») завдяки автоматизованій методиці.
- Обладнання, що відповідає стандартам FDA та CE.
- SMS-сповіщення лікарів щодо результатів виявлення CINII, CINI.
Рис. 4. Пропозиції щодо проведення скринінгу РШМ від медичної лабораторії «ДІЛА»
Література
- Программы скрининга: краткое руководство. Повышение эффективности, максимальное увеличение пользы и минимизация вреда. [Screening programmes: a short guide. Increase effectiveness, maximize benefits and minimize harm], ВОЗ, 2020.
- Kyrgiou M. et al. Cervical screening: ESGO-EFC position paper of the European Society of Gynecologic Oncology (ESGO) and the European Federation of Colposcopy (EFC). British Journal of Cancer 123.4 (2020): 510‑517.
- Wilson J. M.G., Jungner G. Принципы и практика обследований на заболеваемость. Женева: Всемирная организация здравоохранения; 1968 (https://apps.who.int/iris/bitstream/handle/10665/37650/WHO_PHP_34.pdf?sequence=17, по состоянию на 27 ноября 2019 г.).
- Vu M. et al. Cervical cancer worldwide. Current problems in cancer 42.5 (2018): 457‑465.
- Human Papillomavirus and Related Diseases in Ukraine. Summary Report 17 June 2019.
- Pimple, Sharmila A. and Gauravi A. Mishra. Global strategies for cervical cancer prevention and screening. Minerva ginecologica 71.4 (2019): 313‑320.
- Burka O. A. et al. Цитологічна складова скринінгу на рак шийки матки: причини хибнонегативних і хибнопозитивних результатів, шляхи їх уникнення. Reproductive Endocrinology 57 (2021): 61‑67.
- Basu P., Ponti A., Anttila A. et al. Status of implementation and organization of cancer screening in The European Union Member States-Summary results from the second European screening report, Int. J. Cancer 142 (1) (2018) 44‑56.
- Brenner H., Stock C., Hoffmeister M. Effect of screening sigmoidoscopy and screening colonoscopy on colorectal cancer incidence and mortality: systematic review and meta-analysis of randomized controlled trials and observational studies, BMJ 348 (2014) g2467.
- Association between Bacterial Vaginosis and Cervical Intraepithelial Neoplasia: Systematic Review and Meta-Analysis. 2012.
- Karim S., Souho T., Benlemlih M. & Bennani B. (2018). Cervical cancer induction enhancement potential of Chlamydia trachomatis: A systematic review. Current microbiology, 75(12), 1667‑1674.
- GP15-A3 Cervicovaginal Cytology Based on the Papanicolaou Technique; Approved Guideline-Third Edition, 2008. www.clsi.org. (accessed February 11, 2021).
- Nayar R., Wilbur D. C. The bethesda system for reporting cervical cytology: Definitions, criteria, and explanatory notes, Springer International Publishing, 2015. doi:10.1007/978‑3‑319‑11074‑5.
- Baer A., Kiviat N. B., Kulasingam S., Mao C., Kuypers J., Koutsky L. A. Liquid-based Papanicolaou smears without a transformation zone component: should clinicians worry? Obstet Gynecol. 2002; 99:1053‑9.
- Bos A. B., van Ballegooijen M., van den Elske Akker-van Marle M., Hanselaar A. G., van Oortmarssen G. J., Habbema J. D. Endocervical status is not predictive of the incidence of cervical cancer in the years after negative smears. Am J Clin Pathol. 2001; 115:85‑5.
- Kivlahan C., Ingram E. Papanicolaou smears without endocervical cells. Are they inadequate? Acta Cytol. 1986; 30:258‑60.
- Mitchell H., Medley G. Longitudinal study of women with negative cervical smears according to endocervical status. Lancet. 1991; 337:265‑7.
- Mitchell H.S. Longitudinal analysis of histologic high-grade disease after negative cervical cytology according to endocervical status. Cancer (Cancer Cytopathol). 2001;93:237‑40.
- Birdsong G.G. Pap smear adequacy: is our understanding satisfactory… or limited? Diagn Cytopathol. 2001; 24:79‑81.
- O’Sullivan J.P., A’Hern R.P., Chapman P. A., Jenkins L., Smith R., al-Nafussi A. et al. A casecontrol study of true-positive versus false-negative cervical smears in women with cervical intraepithelial neoplasia (CIN) III. Cytopathology. 1998; 9:155‑61.
- Elumir-Tanner L., Doraty M. Management of Papanicolaou test results that lack endocervical cells. Can Med Assoc J. 2011; 183:563‑8.
- Massad L. S., Einstein M. H., Huh W. K., Katki H. A., Kinney W. K., Schiffman M. et al. 2012 updated consensus guidelines for the management of abnormal cervical cancer screening tests and cancer precursors. J Low Genit Tract Dis. 2013;17: S1‑27.
- Gao F. F., Austin R. M., Zhao C. Histopathologic follow-up and human papillomavirus DNA test results in 290 patients with high-grade squamous intraepithelial lesion Papanicolaou test results. Cancer (Cancer Cytopathol). 2011;119:377‑86.
- Zhao C., Austin R. M. Human papillomavirus DNA detection in ThinPrep Pap test vials is independent of cytologic sampling of the transformation zone. Gynecol Oncol. 2007; 107:231‑5.