17 квітня, 2021
Особливості менеджменту алергологічної патології: у фокусі — доказова медицина
Поширеність алергічних захворювань у світі, як-от алергічного риніту (АР), бронхіальної астми (БА), кропив’янки, алергічного дерматиту (зокрема, контактного – АКД), зростає катастрофічно швидко. Останні досягнення в їх діагностиці й лікуванні, доказові дані стосовно використання антигістамінних препаратів (АГП) у різних вікових групах, положення настанов регулярно стають темою для обговорення авторитетними експертами у сфері алергопатології.
«Три кити» лікування АР: сучасні стандарти та важливі нюанси
 На сучасних можливостях лікування АР зосередив увагу завідувач кафедри отоларингології Одеського державного медичного університету, доктор медичних наук, професор Сергій Михайлович Пухлік.
На сучасних можливостях лікування АР зосередив увагу завідувач кафедри отоларингології Одеського державного медичного університету, доктор медичних наук, професор Сергій Михайлович Пухлік.
– За даними експертів Всесвітньої організації охорони здоров’я, АР є однією з глобальних медичних проблем; його поширеність у світовій популяції оцінюють у 10-20%, що дає підстави називати його найрозповсюдженішим хронічним неінфекційним захворюванням (Öçal R. et al., 2019). Що 10 років кількість хворих на АР зростає вдвічі (Ciprandi G. et al., 1996). Міжнародне дослідження астми й алергії в дітей (ISAAC; Strachan D. et al., 1997) продемонструвало, що поширеність АР серед дітей віком 6-7 років – 0,8-14,9%, 13-14 років – 1,4-39,7%.
АР – запальне захворювання слизової оболонки носа, що з’являється внаслідок дії алергенів навколишнього середовища (пилку дерев і трав, пліснявих грибів, побутових алергенів тощо). У відповідь на їхній вплив вивільняється імуноглобулін Е, що активує опасисті клітини та базофіли, зумовлюючи синтез вазоактивних медіаторів включно з гістаміном; вони, своєю чергою, запускають каскад запалення (Weber R. W., 2008). Підвищується проникність судин, посилюється продукція слизу, спостерігається подразнення нервових закінчень, що зумовлює появу патологічних симптомів.
Типова клінічна картина захворювання поєднує назальні (закладеність носа, ринорея, свербіння, чхання, утруднене носове дихання, печіння) й очні (свербіння, почервоніння, сльозотеча) симптоми. До непрямих ознак АР належать темні кола під очима, ротове дихання, часті спроби прочистити горло, поперечна зморшка на переніссі («алергічний салют»), відкритий прикус. У багатьох хворих простежується сезонність проявів.
За частотою симптомів АР розподіляють на інтермітуючий (симптоми тривають ≤4 днів/тиж або ≤4 тиж/рік) і персистуючий (≥4 днів/тиж або ≥4 тиж/рік). На тлі тривалої експозиції алергену посилюється синтез прозапальних цитокінів, що збільшує вираженість запалення. У результаті нейрогенного запалення внаслідок АР слизова оболонка носа стає гіперреактивною й починає реагувати на неспецифічні (не пов’язані з дією алергену) стимули, як-от холодне повітря чи сигаретний дим. Прояви АР істотно погіршують сон, працездатність, щоденну активність хворих, здатність до навчання, зумовлюють депресію.
Хочу виокремити декілька проблем, асоційованих із виявленням і лікуванням АР. Оскільки симптоми АР є неспецифічними, вони можуть ховатися за клінічними масками рецидивних гострих респіраторних вірусних інфекцій, аденоїдиту (особливо в дітей). АР часто залишається недіагностованим.
Пацієнти недооцінюють серйозність хвороби та рідко звертаються по кваліфіковану допомогу, обмежуючись самолікуванням. Зазвичай за порадою провізора чи Google епізодично застосовують деконгестанти, котрі швидко зумовлюють звикання, ушкоджують слизову оболонку, негативно впливають на кардіоваскулярну систему. Серед інших «дієвих» схем лікування на власний розсуд – прийом різних АГП без урахування ефективності та профілю безпеки, не дотримуючись ані режиму, ані рекомендованої тривалості курсу; безконтрольне використання кортикостероїдів (КС) пролонгованої дії; вибір гомеопатичних та інших засобів, які не довели свою ефективність; неготовність дотримуватися призначень лікаря (Bousquet J. et al., 2018; Price D. et al., 2015).
Якими ж є типові помилки лікарів? Наприклад, при персистуючому АР у разі викривлення носової перетинки чи гіпертрофії нижніх носових раковин фахівці відразу віддають перевагу оперативному лікуванню (хоча адекватна фармакотерапія має бути пріоритетом!), а деколи призначають для терапії АР лише інтраназальні засоби, забуваючи про необхідність корекції системних порушень (навіть за наявності множинних назальних поліпів, що сигналізує про потребу алергологічного обстеження, після оперативних втручань не завжди застосовується протиалергічна терапія). Відсутність адекватного своєчасного лікування спричиняє погіршення перебігу АР і появу ускладнень і коморбідності: у 20-40% пацієнтів з АР з’являється БА, в 70% – алергічний кон’юнктивіт, у 10% – атопічний дерматит.
«Три кити», на яких засноване лікування АР, – мінімізація контакту з алергенами (зокрема, такими простими способами, як тримати вікна зачиненими, використовувати пилососи з HEPA‑фільтрами тощо), симптоматична фармакотерапія й алергеноспецифічна імунотерапія (АСІТ).
Відповідно до Міжнародного консенсусу в галузі алергії та ринології з лікування АР (International Consensus Statement on Allergy and Rhinology: Allergic Rhinitis, ICAR: AR, 2018) для контролю симптомів хвороби можуть використовуватися декілька класів лікарських засобів, провідне місце серед яких мають системні АГП (табл. 1).
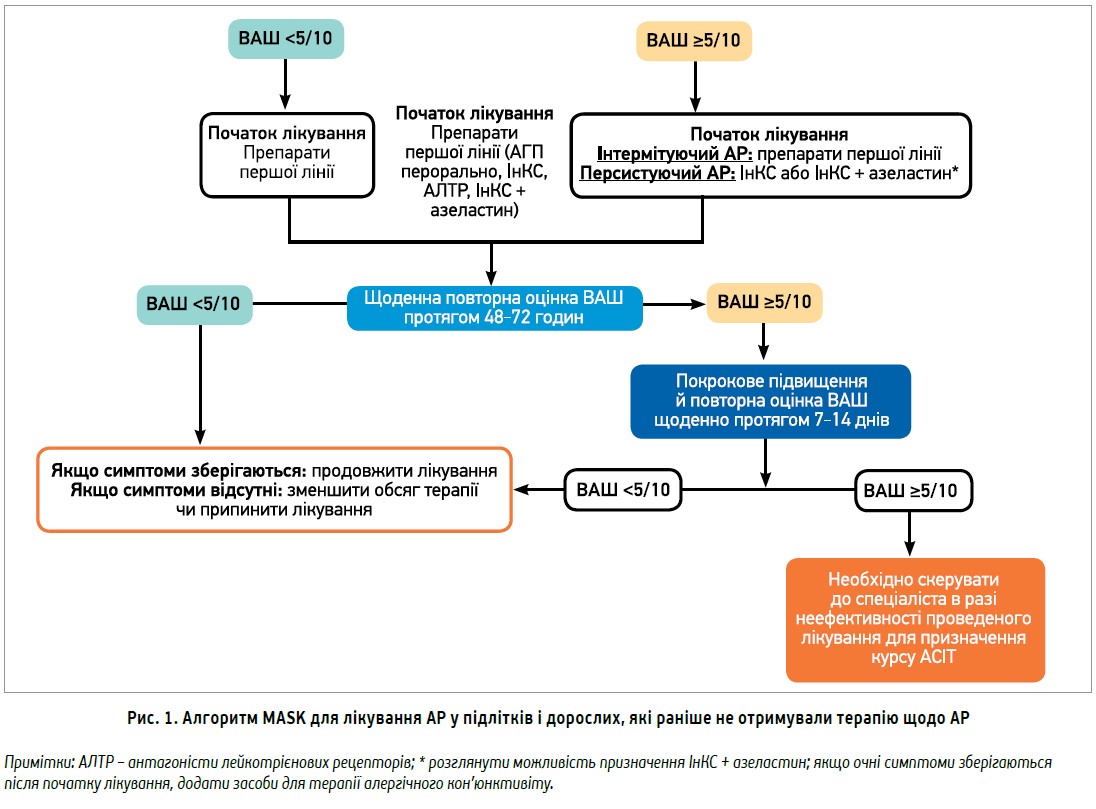
Новий перегляд рекомендацій ARIA (Allergic Rhinitis and its Impact on Asthma, 2019) акцентує увагу на можливостях мобільних цифрових технологій у прийнятті рішень щодо ведення хворих на АР та АР/БА, а також на необхідності дотримання стратегій MASK (Mobile Airways Sentinel Network) і заснованого на показнику візуально-аналогової шкали алгоритму, котрий наведено на рисунку 1 (Bousquet J. et al., 2015, 2016).
Остаточних висновків стосовно порівняльної ефективності пероральних й інтраназальних H1-АГП, доцільності комбінації пероральних H1-АГП та ІнКС ученими не зроблено. Ці класи препаратів продемонстрували ефективність у лікуванні хворих із легким/помірним перебігом АР (при цьому пацієнти віддавали перевагу пероральним формам). Використання H1-АГП I покоління не рекомендується через потенційний седативний ефект.
АР (інтермітуючий і персистуючий) – одне з основних показань для призначення Н1-АГП II покоління (Bousquet J. et al., 2001, 2008; Brozek J. et al., 2010); вони ефективно впливають на основні симптоми захворювання: швидко усувають ринорею, чхання, свербіння в носі й очні прояви.
Відповідно до вітчизняного протоколу лікування АР (2019), за легкого перебігу інтермітуючого АР призначаються пероральні чи інтраназальні Н1-АГП та/або деконгестанти чи АЛТР. За середньотяжкого/тяжкого перебігу інтермітуючого АР і легкого перебігу персистуючого АР показані пероральні чи інтраназальні Н1-АГП та/або деконгестанти, або ІнКС, або АЛТР. За персистуючого АР середньотяжкого/тяжкого перебігу – ІнКС; системні Н1-АГП або АЛТР. У разі неефективності лікування можна здійснити такі кроки: підвищити дозу ІнКС; при свербінні/чханні – додати Н1-АГП; при ринореї – іпратропій; при закладеності носа – деконгестанти; за неефективності – скерувати до отоларинголога для хірургічного лікування, розглянути проведення АСІТ. Пероральні Н1-АГП ІІ покоління є препаратами першого вибору (крім персистуючого АР із тяжким/середньотяжким перебігом). Н1-АГП І покоління не рекомендують застосовувати через несприятливе співвідношення ефективності та безпеки.
Вимогам до сучасних АГП, окресленим експертами ARIA та Європейською академією алергології та клінічної імунології (EAACI/ARIA), повністю відповідає дезлоратадин (активний метаболіт лоратадину), що є безпечним для дітей віком від 6 міс і літніх пацієнтів. Фармакокінетика дезлоратадину в дорослих і дітей відрізняється незначно (Gupta S. et al., 2007).
Період активного вивчення дезлоратадину припав на 2000-2010 рр., у результаті чого була накопичена переконлива доказова база застосування препарату за різних форм АР й інших видів алергопатології.
Метою дослідження C. Bachert і M. Maurer (2010) було оцінити безпеку, переносимість і ефективність дезлоратадину 5 мг 1 р/день у 4 постмаркетингових спостереженнях в осіб із сезонним АР або хронічною спонтанною кропив’янкою (ХСК) у майже 78 тис. пацієнтів в умовах реальної клінічної практики. Переносимість оцінили як відмінну/хорошу 99,1% дослідників і 98,5% хворих. Терапія дезлоратадином значно зменшила вираженість назальних і очних симптомів, свербіння та пухирів, порушення сну й активності. Ефективність дезлоратадину назвали значно вищою 59,4-88,0% осіб, які раніше отримували монотерапію цетиризином, фексофенадином, лоратадином або мізоластином.
За допомогою низки робіт вивчено ефективність дезлоратадину в педіатричній популяції: в дітей віком 6-11 років із сезонним АР регулярне застосування дезлоратадину (як і використання за потреби) забезпечувало хороший контроль симптомів, але в разі реактивності дихальних шляхів перевагу має постійний прийом препарату (Dizdar E. A. et al., 2007); терапія дезлоратадином продемонструвала ефективність і безпечність у підлітків віком 12-17 років з АР (Bousquet J. et al., 2009).
Оригінальний засіб дезлоратадину – Еріус® (Bayer). Рекомендовані схеми прийому препарату Еріус® при АР описано в таблиці 2.
Клінічні маски та сучасні методи контролю АКД
Рівень захворюваності на АКД в Україні оцінюють в 1-3%, а його поширеність у популяції – у 5-10% (Феденко О. С. і співавт., 2016), у дітей – у 20% (Tam I. et al., 2020). АКД являє собою реакцію гіперчутливості сповільненого типу на алергени зовнішнього середовища.
.jpg) Які чинники зумовлюють появу АКД і як нормалізувати стан хворих? Вичерпні відповіді на ці запитання надала заступник керівника Центру алергічних захворювань верхніх дихальних шляхів ДУ «Інститут отоларингології ім. О. С. Коломійченка НАМН України» (м. Київ), доктор медичних наук Інна Володимирівна Гогунська.
Які чинники зумовлюють появу АКД і як нормалізувати стан хворих? Вичерпні відповіді на ці запитання надала заступник керівника Центру алергічних захворювань верхніх дихальних шляхів ДУ «Інститут отоларингології ім. О. С. Коломійченка НАМН України» (м. Київ), доктор медичних наук Інна Володимирівна Гогунська.
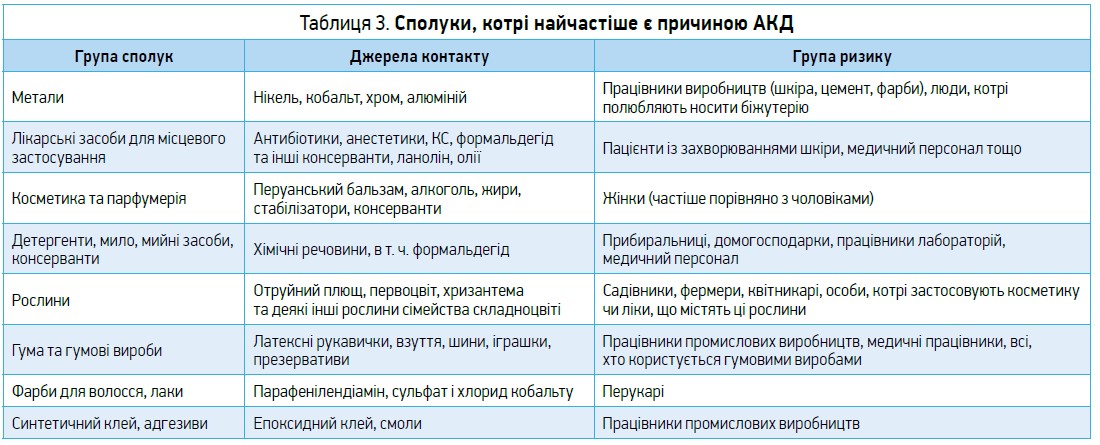
– Сполук, здатних зумовлювати АКД, є надзвичайно багато (табл. 3).
Клінічні прояви АКД – свербіння, почервоніння, набряклість шкіри, поява дрібних пухирців і великих пухирів, наповнених рідиною, які локалізуються в місці безпосереднього контакту шкіри з алергеном. Іноді такі пухирці зливаються, лопаються, утворюючи великі вогнища, що мокнуть, і можуть нагноюватися внаслідок приєднання вторинної інфекції. У тяжких випадках ураження мають генералізований характер.
За системного контактного дерматиту спостерігається локалізоване/генералізоване запалення шкіри при системній реекспозиції алергену. Відзначаються загострення процесу в місцях попередньої локалізації АКД і поява нових вогнищ: везикульозні висипання на кистях рук, дерматит у ліктьових і підколінних згинах, неспецифічні макулопапульозні висипання, васкуліти з пурпурою, т. зв. синдром бабуїна, а також системні розлади (головний біль, артралгії, слабкість, нудота та блювання, діарея).
В основі лікування АКД лежать уникнення взаємодії з алергеном і фармакотерапія (Gonzalez M. E., 2019; Феденко О. С. і співавт., 2016). У схемах фармакотерапії застосовують місцево КС, призначені для використання в дерматології (флутиказон, тріамцинолон, клобетазол, бетаметазон, мометазон); антибіотики (з метою профілактики вторинної інфекції); за відсутності покращення – топічні інгібітори кальциневрину (такролімус, пімекролімус), КС системно, ультрафіолетову терапію, імуносупресанти.
За тяжкого, поширеного та системного АКД необхідна системна терапія. Для зменшення інтенсивності свербіння призначають системні H1-АГП, як-от дезлоратадин, левоцетиризин, фексофенадин та ін., що є активними метаболітами останнього покоління, відрізняються хорошим профілем безпеки та відсутністю седативного впливу, дають змогу зберігати повсякденну активність.
Підходи до лікування АКД у дітей такі самі, як і в дорослих (тільки з корегуванням дози препаратів залежно від віку та тяжкості симптомів). Як вторинну профілактику застосовують зволожувальні та пом’якшувальні креми, емоленти типу «олія у воді».
Нові виклики, з якими довелося зіткнутися у 2020 р., – АКД, спричинений використанням медичних масок і антисептиків. Як зазначає C. Bailey (2020), схожі випадки спостерігалися й у 2002 р. під час пандемії атипової пневмонії. Клінічний розбір АКД унаслідок носіння масок активно обговорюється на заходах American College of Allergy, Asthma and Immunology (Dhamija Y., 2020). Описані випадки ефективного лікування АКД, індукованого носінням медичної маски під час епідемії COVID‑19, за допомогою дезлоратадину (Xie Z. et al., 2020).
Кропив’янка – складне рівняння з багатьма невідомими
 Кропив’янка – поширене дерматологічне захворювання, що зумовлює відчутне погіршення якості життя; клінічні прояви її різних підтипів надзвичайно варіабельні. Крім того, в одного хворого можуть поєднуватися декілька варіантів захворювання. Про підходи до лікування кропив’янки та ролі в ньому АГП розповіла професор кафедри професійних хвороб і клінічної імунології ДЗ «Дніпропетровська медична академія МОЗ України», доктор медичних наук Євгенія Михайлівна Дитятковська.
Кропив’янка – поширене дерматологічне захворювання, що зумовлює відчутне погіршення якості життя; клінічні прояви її різних підтипів надзвичайно варіабельні. Крім того, в одного хворого можуть поєднуватися декілька варіантів захворювання. Про підходи до лікування кропив’янки та ролі в ньому АГП розповіла професор кафедри професійних хвороб і клінічної імунології ДЗ «Дніпропетровська медична академія МОЗ України», доктор медичних наук Євгенія Михайлівна Дитятковська.
– Відповідно до рекомендацій EAACI/GA²LEN/EDF/WAO (2018) терміном «гостра кропив’янка» (ГК) називають появу пухирів та/або ангіоневротичного набряку тривалістю до 6 тиж (буває спонтанна й індукована), «хронічна кропив’янка» (ХК) – понад 6 тиж.
Існують два підтипи ХК:
1) ХСК (не вдається виокремити специфічний фактор, який провокує появу захворювання);
2) хронічна індукована кропив’янка – симптоматичний дермографізм, холодова кропив’янка, кропив’янка сповільненого типу від тиску, сонячна кропив’янка, теплова кропив’янка, вібраційний ангіоневротичний набряк, холінергічна кропив’янка, контактна кропив’янка, аквагенна кропив’янка.
Як свідчать епідеміологічні дослідження, вона належить до найпоширеніших захворювань: різні варіанти хвороби трапляються в 15-25% популяції, приблизно у ¼ хворих виявляється ХК (Zuberbier T. et al., 2018; Maurer M. et al., 2011; Ruggeri M. et al., 2013). Частіше ХК з’являється в жінок віком 20-40 років, у переважній більшості випадків діагностують ХСК. Середня тривалість ХСК становить 1-5 років. У 50% випадків симптоми зникають протягом 6 міс, у 20% – 3 років, у 20% – 3-5 років (і навіть більше), а в поодиноких випадках – зберігаються десятиліттями (Ємельянов О. В., 2015; Toubi E. et al., 2004).
Що стосується педіатричної популяції, то кожна 5-та дитина переносить ГК. У дітей її найчастіше спричиняють інфекційні агенти (віруси, бактерії, паразити), лікарські засоби, значно рідше – продукти харчування, іноді – вода. У віці до 6 міс появу хвороби зазвичай провокує білок коров’ячого молока, від 6 міс до 2 років – ліки й інфекції; майже половина педіатричних пацієнтів мають атопію (Legrain V. et al., 1993). Дані щодо поширеності ХК серед дітей обмежені, здебільшого її оцінюють в 0,8-1% (Caffarelli C. et al., 2019). У 30-50% дітей із ХСК протягом 3-5 років настає ремісія.
Терапевтичний підхід за ХК має бути комплексним і включати елімінацію причинних факторів та уникнення взаємодії з ними, індукцію толерантності та/або фармакотерапію; також він передбачає співпрацю сімейного лікаря, дерматолога, педіатра (за потреби) й алерголога.
Попри те що останнім часом досягнуто покращення в розумінні автоімунного генезу захворювання, призначається лише симптоматична терапія, основою якої є безперервне застосування Н1-АГП (доступні дані стосовно безпеки за постійного прийому цих препаратів упродовж декількох років).
! До речі, в разі деяких варіантів фізичної кропив’янки (зокрема, холодової) замість безперервного лікування доцільніше використовувати АГП за потреби. Прийом АГП за 2 год до очікуваної дії тригера (наприклад, плавання в холодній водоймі влітку) запобігає появі симптомів.
 За наявності кропив’янки без анафілаксії (й на основі власного досвіду, й керуючись положеннями авторитетних настанов) раджу віддавати перевагу H1-АГП II покоління як препаратам першої лінії замість Н1-АГП I покоління. При зіставній ефективності АГП II покоління є безпечнішими, вони не спричиняють холіноблокувальної дії, звикання; їхні результативність і безпечність за ХСК у пацієнтів віком менш як 12 років доведені в роботі H. Cornillier і співавт. (2018).
За наявності кропив’янки без анафілаксії (й на основі власного досвіду, й керуючись положеннями авторитетних настанов) раджу віддавати перевагу H1-АГП II покоління як препаратам першої лінії замість Н1-АГП I покоління. При зіставній ефективності АГП II покоління є безпечнішими, вони не спричиняють холіноблокувальної дії, звикання; їхні результативність і безпечність за ХСК у пацієнтів віком менш як 12 років доведені в роботі H. Cornillier і співавт. (2018).
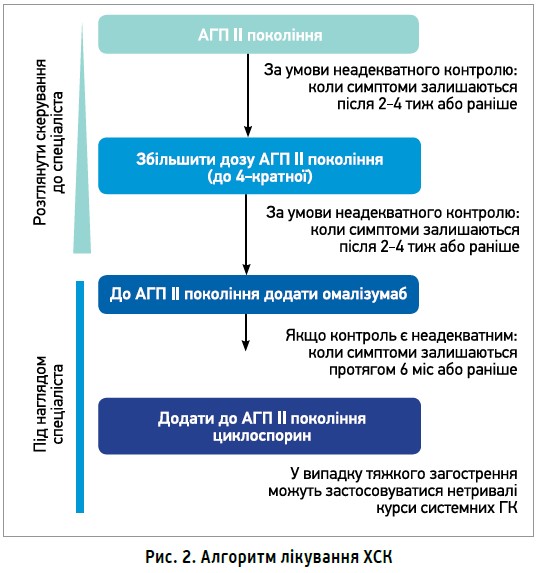
Алгоритм лікування ХСК має етапний характер (рис. 2). Якщо рекомендована доза H1-АГП II покоління не забезпечує покращення та контролю симптомів, її дозволяється підвищити у 2-4 рази. У дитячій популяції така стратегія ретельно не вивчена та може застосовуватися тільки за сприятливого співвідношення «користь/ризик» (Nieto A. et al., 2020) зі врахуванням віку й маси тіла дитини (Ki Min T., Saini S. S., 2019). Стосовно H1-АГП I покоління тактика чотирикратного збільшення дози не підходить, оскільки асоціюється зі зростанням ризику побічних ефектів.
У тяжких випадках ХК застосовують системні КС нетривалим курсом до 10 днів (хоча доказові дані щодо цього підходу є обмеженими). Альтернативні засоби – Н2-блокатори, АЛТР, дапсон тощо.
Переконливу доказову базу щодо ефективності за ГК і ХК має дезлоратадин (Еріус®, Bayer). В огляді, присвяченому оцінці клінічної ефективності дезлоратадину за ХСК, Lawrence DuBuske (2007) наголошує на його численних перевагах: швидкому полегшенні симптомів різного ступеня тяжкості; профілі безпеки, зіставному з плацебо, в популяції віком від 6 міс до 12 років, у підлітків і дорослих; відсутності лікарських взаємодій і зв’язку з прийомом їжі; швидкості та тривалості дії; зручному режимі використання.
Доведені беззаперечні переваги дезлоратадину щодо ефективності та безпеки при застосуванні дозою 5 мг/добу порівняно з Н1-АГП I покоління (Nettis E., 2020). Застосування дезлоратадину дозою 5 мг/добу покращувало контроль симптомів ХСК (свербіння тощо), повсякденну активність, сон і не супроводжувалося побічними ефектами (Ring J. et al. 2001). За даними багатоцентрового подвійного сліпого рандомізованого дослідження J. Ring (2002), дезлоратадин, окрім потужної протиалергічної дії, забезпечував додатковий інгібувальний вплив на медіатори запалення (цитокіни та молекули адгезії), сприяв покращенню контролю симптомів кропив’янки, зменшував кількість і розмір висипань, добре переносився.
Схожі дані отримав і J. P. Ortonne (2007), який відзначив швидкий ефект від застосування дезлоратадину (в 1-й день прийому). У 2010 р. у Німеччині провели проспективне дослідження (приблизно 77 800 учасників) результативності використання дезлоратадину за ХК й АР. 98,5% хворих оцінили переносимість препарату як відмінну/хорошу. Більш ніж половина учасників акцентували увагу на швидшому настанні ефекту при терапії дезлоратадином порівняно з іншими Н1-АГП ІІ покоління (Bachert C., 2010).
В експериментальній роботі китайських учених J. Wang і співавт. (2019) дезлоратадин ефективно зменшував тяжкість ХК, нормалізував Th1/Th2, рівень медіаторів запалення, інгібував дію хемокінів.
Підвищення дози дезлоратадину в 4 рази покращувало контроль симптомів у 75% пацієнтів із ХК, які тяжко піддавалася лікуванню, та не спричиняло проблем, пов’язаних із безпекою терапії (Staevska M. et al., 2010).
У пошуках ідеалу: на що звертати увагу, обираючи Н1-АГП?
 Чи існує «ідеальний» АГП? На які параметри орієнтуватися, щоб не помилитися у виборі? На етапах еволюції АГП і ключових характеристиках класу докладно зупинився завідувач кафедри клінічної фармакології та клінічної фармації Національного медичного університету ім. О.О. Богомольця (м. Київ), доктор медичних наук, професор Микола Валентинович Хайтович.
Чи існує «ідеальний» АГП? На які параметри орієнтуватися, щоб не помилитися у виборі? На етапах еволюції АГП і ключових характеристиках класу докладно зупинився завідувач кафедри клінічної фармакології та клінічної фармації Національного медичного університету ім. О.О. Богомольця (м. Київ), доктор медичних наук, професор Микола Валентинович Хайтович.
– Початком епохи боротьби з алергією й розроблення АГП можна вважати дату відкриття гістаміну та його ролі у виникненні алергічних реакцій – 1910 р. (Cataldi M. et al., 2014). У 1937 р. французькі вчені A. Staub і D. Bouvet з Інституту Пастера (м. Париж) синтезували сполуки, що мали виражену протиалергічну активність, але застосування експериментальних молекул у клінічній практиці унеможливила висока токсичність. За 5 років на ринку з’явився перший протиалергічний засіб – фенбензамін (Ємельянов А. В., 2016). Наразі вдалося ідентифікувати 4 типи гістамінових рецепторів – Н1, Н2, Н3 та Н4.
Залежно від проникнення крізь гематоенцефалічний бар’єр Н1-АГП розподіляють на препарати I (мають седативний, гіпотензивний ефекти; пригнічують когнітивні функції, як-от пам’ять, концентрацію уваги, координацію рухів; характеризуються неселективністю дії, зокрема супроводжуються сухістю в роті, тахікардією, затримкою сечі, закрепами; стимулюють апетит і асоціюються зі збільшенням маси тіла) та II поколінь (не провокують вищезазначені побічні ефекти та позбавлені недоліків Н1-АГП I покоління).
До Н1-АГП I покоління належать дифенгідрамін, клемастин, гідроксизин, хлорфенірамін тощо, до Н2-АГП II покоління – лоратадин, дезлоратадин (активний метаболіт лоратадину), цетиризин, левоцетиризин, акривастин тощо. Н1-АГП II покоління поповнили арсенал лікарів у 80-х рр. минулого століття.
1993 р., коли до клінічного використання був схвалений лоратадин, теж можна назвати знаковим. Завдяки високій клінічній ефективності, тривалій дії, хорошій переносимості препарат не раз отримував звання найпопулярнішого за частотою призначень, його досі використовують як референтний у рамках порівняльних досліджень нових молекул класу АГП. Новою розробкою, синтезованою в 1998 р., став дезлоратадин. З огляду на вдосконалені характеристики його тривалий час виокремлювали в групу т. зв. Н1-АГП III покоління, що можуть використовуватися одночасно з блокаторами цитохрому Р450 і мають сприятливіший профіль безпеки.
Дезлоратадин – активний метаболіт лоратадину, що є конкурентним антагоністом Н1-рецепторів і за антигістамінною активністю істотно (в 10-50 разів) перевершує лоратадин, терфенадин, фексофенадин тощо. Спорідненість до Н1-рецепторів у дезлоратадину є значно вищою, ніж в інших представників групи, а афінність до Н2- та мускаринових рецепторів, навпаки, є меншою в 15-50 разів, що дає змогу вважати препарат селективним. Додаткові протиалергічні ефекти дезлоратадину не пов’язані з дією на Н1-рецептори.
Дезлоратадин майже не проникає в центральну нервову систему. При застосуванні в рекомендованій дозі для дорослих (5 мг) підвищення частоти сонливості порівняно з групою плацебо не зафіксовано. У клінічних дослідженнях дезлоратадин добовою дозою 7,5 мг (одноразово) не впливав на психомоторну активність.
Оригінальним препаратом дезлоратадину, що має найбільшу доказову базу, є Еріус® (Bayer). Засіб представлений у двох лікарських формах: таблетках, укритих плівкою, по 5 мг і у вигляді сиропу 0,5 мг/мл. Сироп дозволений до застосування в дітей віком від 6 міс, таблетована форма препарату – в дітей віком від 12 років і дорослих.
Еріус® відрізняється швидким ефектом: після перорального застосування препарат виявляється в плазмі вже через 28 хв, що збігається з початком дії; максимальний ефект спостерігається через 1-2 год, терапевтичний потенціал препарату реалізується протягом 24 год (Anthes J. C. et al., 2002); він має лінійну дозозалежну фармакокінетику. Період напіввиведення препарату – 27 год, що дає змогу застосовувати його 1 р/добу. На метаболізм дезлоратадину не впливають ані вік, ані стать, ані раса пацієнта (Limon L., Kockler D., 2003; Geha R. S., Meltzer E. O., 2001).
Клінічні переваги та сприятливий профіль безпеки препарату Еріус® неодноразово були підтверджені даними наукових робіт і масштабних метааналізів. Препарат широко застосовується для симптоматичної терапії АР, ГК, ХК, хронічних дерматозів, асоційованих зі свербінням.
Препарат не спричиняє негативних змін у роботі серцево-судинної системи й інших органів; не чинить седативного впливу та не пригнічує когнітивні функції; може застосовуватися в пацієнтів із порушеннями з боку нирок/печінки (Kazmi F. et al., 2015).
Наразі науковці вивчають його вплив на специфічні когорти пацієнтів і нові можливості застосування. Група вчених із Данії (Andersson N. W. et al., 2020) оцінила ризики, пов’язані з використанням дезлоратадину, для здоров’я плода. Проаналізувавши дані про майже 1 млн 300 тис. вагітностей, вони зробили висновок про відсутність статистично значущого підвищення ймовірності несприятливих наслідків, як-от вроджені дефекти, самовільне переривання вагітності, передчасні пологи, народження з низькою масою тіла, мертвонародження (порівняно з аналогічними показниками для лоратадину). Профіль безпеки дезлоратадину відповідав такому Н1-АГП II покоління, рекомендованих у разі вагітності.
Нещодавно всебічно досліджений (на перший погляд) дезлоратадин приголомшив науковців результатами клінічного застосування: в дослідженнях I. Fritz і співавт. (2020) дезлоратадин і лоратадин покращували показники виживання в пацієнтів із меланомою, раком грудної залози (незалежно від віку, стадії, варіанта хвороби). Вчені розцінили отримані результати як перспективні та наголосили на необхідності подальшого клінічного пошуку в цьому напрямі. Позитивний вплив дезлоратадину простежувався в популяції хворих на рак сечового міхура в роботі J. Ma та співавт. (2020).
Це вкотре підтверджує: терапевтичний потенціал препарату є надзвичайно високим – як у площині лікування алергопатології, так і поза її межами.
Підготувала Олександра Марченко