10 січня, 2022
Фармакокінетика і безпека застосування біластину в дітей віком від 6 до 11 років з алергічним ринокон’юнктивітом або хронічною кропив’янкою
Відомо, що:
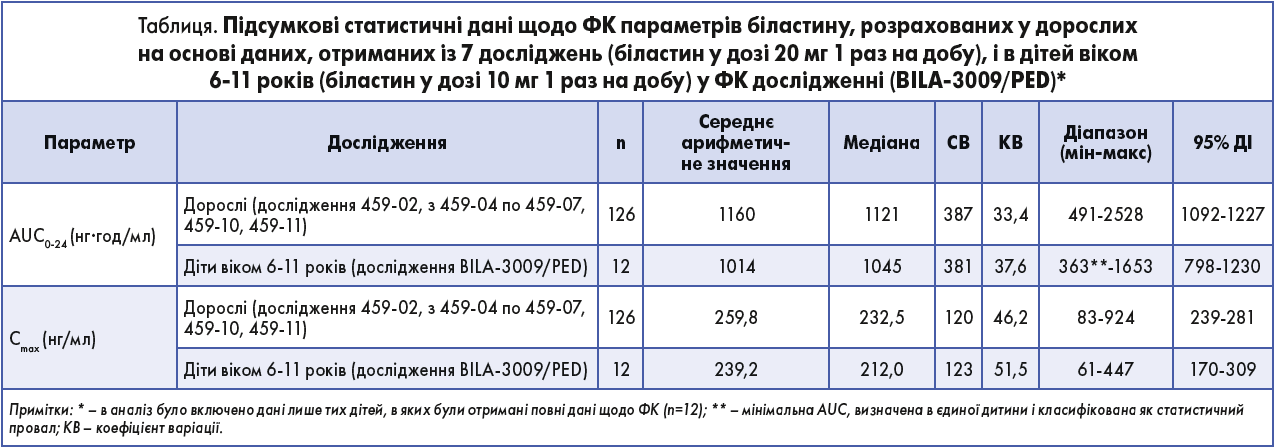
- Біластин – антигістамінний препарат (АГП) II покоління, схвалений в Європі для лікування алергічного ринокон’юнктивіту (АРК) і хронічної кропив’янки (ХК) в дорослих (у дозі 20 мг/добу) і дітей віком ≥6 років (10 мг/добу).
- Онтогенна модель, заснована на даних, отриманих у дорослих і фармакокінетичному (ФК) / фармакодинамічному (ФД) моделюванні, підтвердила вибір дози біластину 10 мг/добу в дітей віком 2-11 років. У великому рандомізованому клінічному дослідженні, фаза III, було продемонстровано, що застосування біластину в дозі 10 мг/добу має профіль безпеки, подібний до такого плацебо, у дітей віком 2-11 років.
Що нового:
- Оскільки біластин схвалений в Європі для застосування в дітей віком від 6 років, це дослідження повідомляє про результати двох ретроспективних аналізів ФК даних і даних щодо безпеки в дітей віком 6-11 років.
- Аналіз ФК даних і даних щодо безпеки в дітей віком 6-11 років підтверджує придатність педіатричної дози біластину 10 мг і підтверджує, що його профіль безпеки подібний до такого плацебо.
Ключові слова: біластин, фармакокінетика, безпека, діти, алергічний ринокон’юнктивіт, кропив’янка.
Біластин – неседативний АГП II покоління, який не проникає крізь гематоенцефалічний бар’єр. Схвалений в Європі для лікування АРК і ХК в дорослих і дітей віком ≥6 років із масою тіла ≥20 кг. Нещодавно біластин також був схвалений у Мексиці для використання в дітей віком від 2 років. Ефективність біластину подібна до такої інших пероральних Н1-АГП ІІ покоління.
ФК/ФД моделювання в дорослих здорових добровольців, доповнене безкамерним аналізом, продемонструвало лінійну кінетику біластину при оральному застосуванні в діапазоні доз від 2,5 до 220 мг. На основі онтогенної моделі з використанням даних, отриманих у дорослих, ФК/ФД моделювання підтримали вибір дози біластину 10 мг/добу в педіатричній популяції віком від 2 до 11 років, що було підтверджено в клінічному ФК дослідженні за участю дітей віком від 4 до 11 років з АРК або ХК.
Оскільки біластин схвалений в Європі для використання в дітей віком від 6 років, згадане дослідження повідомляє про результати двох ретроспективних аналізів ФК і безпеки препарату. ФК дані, отримані Vozmediano та співавт., аналізували, зфокусувавшися передусім на даних дітей віком 6-11 років. По-друге, було проведено ретроспективний аналіз результатів про безпеку використання препарату в тій самій віковій групі. Ці результати було отримано з плацебо-контрольованого рандомізованого дослідження біластину в дозі 10 мг/добу для лікування дітей з АРК або ХК.
Методи дослідження
Фармакокінетичні дані
ФК дані були доступні з багатоцентрового міжнародного адаптивного відкритого повторного дослідження перорального застосування біластину в дозі 10 мг/добу в дітей віком 4-11 років з АРК або ХК (дослідження BILA‑3009/PED; ClinicalTrials.gov Ідентифікатор: NCT01081574), яке було вже детально описано.
Для попереднього ФК популяційного моделювання в дітей було використано дані дітей віком 4-11 років. Цей ретроспективний аналіз фокусувався на результатах дітей віком від 6 до 11 років (n=24) відповідно до затверджених в Європі педіатричних протоколів.
Аналіз із використанням безкамерної моделі
Максимальну концентрацію в плазмі (Cmax) і площу під кривою концентрації в плазмі (AUC0-24) було розраховано за допомогою S-PLUS® (версія 8.2, програмне забезпечення TIBCO, м. Пало Aльто, Каліфорнія, США).
Порівняння показників безкамерного аналізу в дітей і дорослих
Системну експозицію після пероральної дози біластину в дітей (10 мг/добу) і дорослих (20 мг/добу) було порівняно з використанням чисельних і графічних порівнянь, у тому числі – графіка «форест-плот» (графічне зображення результатів метааналізу у вигляді сукупності ліній, що відображають довірчі інтервали. – Ред.), для візуального визначення неоднорідності між дослідженнями. При внесенні педіатричних даних концентрацію біластину в плазмі (Cp) позначали на графіку з урахуванням часу, що минув після прийому препарату (TAD), для обліку відмінностей у графіку відбору зразків у вибірці.
У дорослих для визначення референсних діапазонів AUC0-24 і Cmax було розглянуто два альтернативних підходи: прогнозований у популяції 95% довірчий інтервал (ДІ), на основі популяційної ФК моделі, розробленої на основі даних, отриманих у дорослих, і більш консервативний 95% ДІ на основі отриманих значень у безкамерному аналізі даних із 7 досліджень фази I (дослідження 459-02, 459-04 до 459-07, 459-10 і 459-11) у дорослих після прийому 20 мг біластину.
Дані щодо безпеки
Дані щодо безпеки препарату були отримані у фазі ІІІ подвійного сліпого рандомізованого плацебо-контрольованого дослідження з паралельними групами дітей віком від 2 до 11 років з АРК або ХК, що отримували біластин 1 раз на добу в дозі 10 мг (n=260) або плацебо (n=249) впродовж 12 тижнів. Усі подробиці і результати цього дослідження були опубліковані раніше.
Пацієнти вживали біластин (10 мг) або плацебо перорально один раз уранці щодня натщесерце протягом 12 тижнів. Було дозволено застосування ліків для невідкладної допомоги: місцевих протинабрякових засобів короткочасної дії (очі/ніс), кортикостероїдів або АГП – для купірування симптомів АРК або місцевих кортикостероїдів короткочасної дії для купірування симптомів ХК.
Первинним результатом дослідження була частка дітей із кожної групи без будь-яких побічних ефектів, що виникли впродовж періоду лікування (визначені як будь-які види несприятливих подій, які виникали протягом усього 4-місячного періоду дослідження, тобто 3 міс лікування та 1 міс спостереження), відповідно до вказівок PDCO.
Статистичний аналіз
Статистичну значущість отриманих даних було оцінено за допомогою двосторонніх тестів із показником альфа 0,05, що вважався граничним значенням для демонстрації значущості. Відсутні значення не враховували для статистичних розрахунків. Кількісні змінні описували як кількість суб’єктів, середнє значення, стандартне відхилення (СВ), максимальне, мінімальне і квартильне значення. Якісні змінні були описані за частотою та відсотковим співвідношенням. Оцінювали вторинні категоріальні змінні за допомогою тесту хі-квадрат або точного тесту Фішера, якщо не було дотримано критеріїв відповідності.
Результати дослідження та їх обговорення
Фармакокінетичні дані
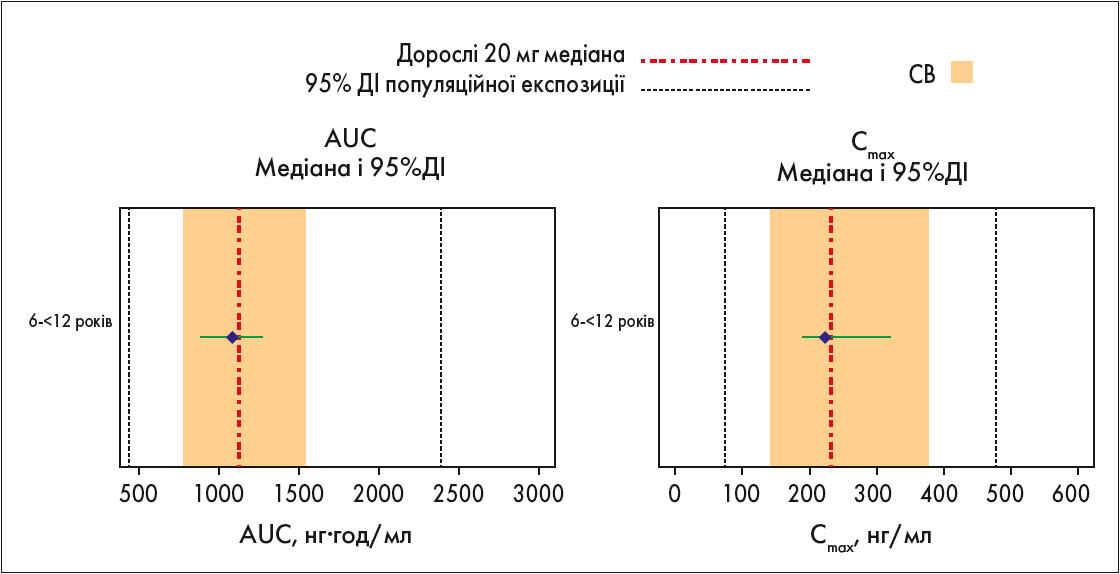
Усього було отримано 88 зразків від 24 дітей віком від 6 до 11 років, що дало можливість охарактеризувати фази абсорбції, розподілу та елімінації ФК профілю препарату в цій когорті. Експозиція та максимальна концентрація в плазмі крові дітей (n=12, що відповідає даним дітей із багатим ФК профілем у разі вибіркового відбору проб) після отримання біластину в дозі 10 мг/добу були подібними до тих, про які було раніше повідомлено в дорослих (n=126), отримані із 7 клінічних досліджень після щоденного вживання біластину в дозі 20 мг (табл.). Медіана (СВ) AUC0-24 у педіатричній і дорослій популяції становила 1045 (381) і 1121 (387) нг·год/мл відповідно, середня Cmax – 212,0 (123) і 232,5 (120) нг/мл відповідно. Концентрація біластину в плазмі крові дітей аналогічна концентрації, виявленій у дорослих, цілком відповідаючи варіабельності серед дорослих, ФК дані мали таку саму форму. Середнє співвідношення AUC0-24 та Cmax у дітей і дорослих становило 0,93 та 0,91 відповідно. Крім того, системну експозицію і Cmax після перорального вживання біластину в дітей (10 мг/добу) порівняли з аналогічними даними в дорослих (пероральний біластин 20 мг/добу) із використанням графіка «форест-плот» (рис.), який продемонстрував, що дитячі ФК показники повністю перебували в межах довірчих інтервалів у дорослих.
Рис. Графік «форест-плот» експозиції біластину (AUC) і Сmax зі спостереження в дітей (віком 6-11 років) у дослідженні BILA‑3009/PED після вживання 10 мг біластину і в дорослих після вживання 20 мг біластину в рамках 7 досліджень (дослідження 459-02, з 459-04 по 459-07, 459-10, 459-11). Сині крапки відображають медіани, а зелені лінії – 95% ДІ у дітей.
Червона лінія й оранжева затінена ділянка відображають медіану та одне СВ в загальній популяції дорослих відповідно. Крім того, 95% ДІ популяційної експозиції, як було передбачено популяційною ФК/ФД моделлю в дорослих після застосування 20 мг біластину (435-2400 нг·год/мл – AUC і 75-475 нг/мл – Cmax), представлено чорною пунктирною лінією
Дані щодо безпеки препарату
Дослідження безпеки препарату було проведено за участю 393 суб’єктів, яких було випадковим чином розподілено на групи для отримання біластину в дозі 10 мг (n=202) або плацебо (n=191). Середній (СВ) вік пацієнтів із групи біластину і плацебо становив 8,5 (1,6) і 8,5 (1,8) року відповідно. У групі біластину 105 (52%) дітей були віком 6-8, а 97 (48%) – 9-11 років; у групі плацебо – 95 (49,7%) і 96 (50,3%) відповідно. У групах біластину і плацебо переважали учасники чоловічої статі (62,9 і 61,8% відповідно) і представники кавказької національності (93,1 і 92,7%). Середній індекс маси тіла (СВ) у двох групах становив 18,0 (3,5) і 18,1 (3,5) кг/м2 відповідно. В учасників діагностували АРК (98,0 і 93,7%) або ХК (2,0 і 6,3%) із середнім часом із моменту встановлення діагнозу (СВ) 4,1 (2,5) і 4,0 (2,7) року відповідно.
Між двома группами не було значущої різниці в частоті виникнення побічних реакцій під час лікування: повідомлено про 137 подій у 67,8% дітей, які отримували біластин, проти 129 подій у 67,5% пацієнтів із групи плацебо (р=0,952). Частка дітей із побічними ефектами, пов’язаними з лікуванням, у групах біластину і плацебо становила, відповідно, 5,4 і 7,9% (р=0,337); частка дітей із серйозними негативними явищами становила 1,0 і 3,1% відповідно (p=0,165), хоча жодне з них не вважалося пов’язаним із лікуванням; 1,0 та 0,5% відповідно побічних ефектів призвели до припинення лікування (р=1,0).
Найчастішими побічними ефектами (≥5%) у групі біластину й плацебо були головний біль (13,4 проти 12,6%), алергічний кон’юнктивіт (9,9 проти 9,4%), кашель (8,9 проти 7,9%), назофарингіт (7,9 проти 4,7%), фарингіт (7,4 проти 6,8%), алергічний риніт (6,4 проти 10,0%), гіперпірексія (5,0 проти 10,0%) і вірусна інфекція (4,5 проти 5,2%) відповідно.
Результати ретроспективного ФК дослідження біластину в дітей віком 6-11 років з АРК або ХК узгоджуються з даними, отриманими з ширшої педіатричної популяції (віком від 2 до 11 років), що свідчить про відсутність вікової залежності ФК біластину.
Цей аналіз ФК обмежувався даними дітей віком 6-11 років, що відповідає затвердженим в Європі показанням до застосування біластину в педіатричній практиці: діти віком ≥6 років із масою тіла ≥20 кг. Педіатричні дані (у дітей 4-11 років) найкраще були описані за допомогою двокамерної моделі, аналогічній моделі, що використовується для опису ФК біластину в дорослих. Показники AUC0-24, і Cmax дуже схожі в дітей віком від 6 до 11 років і дорослих, із повним перекриттям концентрації біластину в крові в дітей і дорослих; співвідношення AUC0-24 і Cmax у дітей і дорослих були близькі до одиниці (0,93 і 0,91 відповідно). Ці результати підтверджують придатність дитячої дози біластину 10 мг.
Дані щодо безпеки були отримані з аналізу частини даних (у дітей віком 6-11 років), отриманих у фазі III плацебо-контрольованого рандомізованого дослідження біластину в дітей віком від 2 до 11 років з АРК або ХК. Ретроспективний аналіз не виявив значної різниці в частоті побічних реакцій у дітей, які отримували біластин (у дозі 10 мг) або плацебо, найчастішим побічним ефектом в обох групах був головний біль (13,4 проти 12,6% відповідно).
Ці результати підтверджують, що в дітей біластин у дозі 10 мг має хороший профіль безпеки і переносимості, подібний до такого в плацебо. У дорослих біластин у рекомендованій дозі 20 мг має дуже хороший профіль безпеки з позитивною толерантністю, а також не спричинює седативні ефекти або кардіотоксичність.
Отже, аналіз ФК і даних безпеки біластину в дітей віком 6-11 років підтверджує придатність його педіатричної дози 10 мг і порівнянність профілю безпеки препарату й плацебо.
Реферативний огляд Mоnica Rodriguez et al. Pharmacokinetics and safety of bilastine in children aged 6 to 11 years with allergic rhinoconjunctivitis or chronic urticaria, European Journal of Pediatrics, 2020.
Підготувала Христина Ключківська