13 червня, 2024
Сучасні стратегії менеджменту алергічного риніту: фокус на ефективність і безпеку
 Алергічні захворювання є глобальною проблемою людства впродовж багатьох років. За даними Всесвітньої організації охорони здоров’я (ВООЗ), поширеність алергії у світі з 2010 року сягнула масштабів епідемії. Одним з найбільш розповсюджених алергічних захворювань у дитячому віці є алергічний риніт (АР). На жаль, в Україні досі актуальною залишається проблема пізньої діагностики АР, що призводить до погіршення якості життя маленьких пацієнтів і підвищує ризик розвитку ускладнень.
Алергічні захворювання є глобальною проблемою людства впродовж багатьох років. За даними Всесвітньої організації охорони здоров’я (ВООЗ), поширеність алергії у світі з 2010 року сягнула масштабів епідемії. Одним з найбільш розповсюджених алергічних захворювань у дитячому віці є алергічний риніт (АР). На жаль, в Україні досі актуальною залишається проблема пізньої діагностики АР, що призводить до погіршення якості життя маленьких пацієнтів і підвищує ризик розвитку ускладнень.
Традиційно АР не розглядається як тяжке захворювання і не асоціюється з ризиком смертності. Проте численні дослідження вказують на суттєвий негативний вплив АР на якість життя пацієнтів. Зокрема, хворі на АР відзначають порушення сну, підвищену втомлюваність, дратівливість, зниження концентрації уваги та здатності до навчання. Це призводить до погіршення академічної успішності дітей шкільного віку і частих пропусків занять у школі та дитячому садку.
АР має тісний патогенетичний зв’язок із бронхіальною астмою (БА). Епідеміологічні дослідження показують, що БА зустрічається у 15-38% пацієнтів із АР. З іншого боку, поширеність АР серед хворих на БА варіює від 6 до 85%. Численні дослідження підтверджують, що АР є фактором ризику розвитку БА. Більше того, наявність АР середнього та тяжкого ступеня, особливо неконтрольованого, асоціюється з гіршим контролем БА. Це пояснюється концепцією «єдиних дихальних шляхів», згідно з якою запалення верхніх і нижніх дихальних шляхів при АР і БА має спільні імунологічні механізми та взаємообтяжуючий вплив (S. Guerra, 2005). Відповідно, якщо БА супроводжується проявами АР, неможливо досягти контролю, якщо не лікувати АР.
Для оптимізації ведення пацієнтів з АР регулярно оновлюються міжнародні узгоджувальні документи, які узагальнюють найкращий клінічний досвід та наукові дані. Зокрема, щорічно публікуються рекомендації робочої групи експертів ARIA (Allergic Rhinitis and its Impact on Asthma – Алергічний риніт та його вплив на астму), які вважаються основним керівництвом з діагностики й лікування АР в усьому світі (J.L. Brozek, 2017). Згідно з документом, діагноз АР встановлюється перш за все на основі характерних симптомів і даних алергологічного анамнезу. Типовими проявами АР є свербіж та/або печіння в носі, ринорея, напади чхання та утруднення носового дихання. Згідно з ARIA, виділяють 2 основні типи АР за характером перебігу і тривалістю симптомів: інтермітуючий та персистуючий (J.L. Brozek, 2017). При інтермітуючому АР симптоми виникають під час контакту з причинним алергеном (пилком рослин), захворювання супроводжується чханням і ринореєю. Саме цей тип АР раніше називали сезонним АР або полінозом. Персистуючий (цілорічний) АР асоціюється з побутовими алергенами і характеризується хронічною назальною обструкцією внаслідок стійкого набряку слизової носа, яка найбільш виражена після сну, вранці. Іноді єдиним проявом АР може бути так званий алергічний салют – потирання носа долонею або тильною стороною кисті.
При риноскопії виявляють набряклість, блідість та ціаноз слизової носа. Однак пацієнтам з тяжким АР доцільно призначити консультацію отоларинголога для виключення інших причин назальних симптомів (анатомічних аномалій, хронічного риносинуситу тощо). При персистуючому АР часто спостерігається також алергічне запалення кон’юнктиви – алергічний кон’юнктивіт. Проте стандартні методи діагностики часто бувають малоінформативними. Наприклад, загальний аналіз крові хоча і рекомендований як скринінговий тест, проте має низьку специфічність. Еозинофілія периферичної крові часто відсутня, особливо в період загострення АР, коли еозинофіли мігрують у слизову носа.
Визначення рівнів загального і специфічних імуноглобуліну (Ig) E у сироватці також широко застосовується в діагностиці АР. Однак загальний IgE має невисоку діагностичну цінність, оскільки підвищується при багатьох захворюваннях. Зокрема, мітогенні фактори вірусів, бактерій, гельмінтів і допоміжних факторів забруднення повітря (цигарковий дим) стимулюють продукцію молекул IgE, не ініціюючи алергенспецифічну IgE-сенсибілізацію. Крім того, рівень загального IgE у 30% пацієнтів з атопією залишається в межах норми. Тому пріоритетним є визначення специфічних IgE (sIgE) до окремих алергенів.
Молекулярна алергодіагностика, яка полягає у визначенні sIgE до окремих алергенних молекул, є новим і високоінформативним методом. Проте через високу вартість і необхідність спеціальних знань для трактування даних вона показана обмеженому колу пацієнтів. Показанням до її проведення є необхідність призначення алергенспецифічної імунотерапії (АСІТ), а також диференційна діагностика перехресних реакцій, справжньої полісенсибілізації та анафілаксії (M.P. Borres, 2011).
Основними завданнями лікування пацієнтів з АР є досягнення контролю над симптомами, профілактика ускладнень, збереження повноцінної фізичної та соціальної активності, запобігання розвитку БА, а також мінімізація побічних ефектів терапії. Іншими словами, лікування АР повинно бути ефективним і безпечним, покращувати якість життя пацієнтів і не обмежувати їхню повсякденну діяльність. Комплексна терапія АР включає кілька ключових компонентів. Перш за все це навчання пацієнтів та членів їхніх родин, які мають стати активними учасниками лікувального процесу. Їм слід докладно пояснити суть захворювання, основні методи лікування і заходи з мінімізації контакту з причинними алергенами.
Наступним важливим кроком є проведення елімінаційної терапії – комплексу заходів зі зменшення експозиції алергену в оточенні пацієнта. Повністю виключити контакт з алергенами, особливо побутовими, практично неможливо, однак навіть часткова елімінація дозволяє зменшити вираженість симптомів АР і потребу в медикаментах. Серед найбільш поширених алергенів приміщень, що спричиняють персистуючий АР, – кліщі домашнього пилу (Dermatophagoides pteronyssinus, Dermatophagoides farinae), епідермальні алергени тварин, цвілеві гриби.
У деяких випадках при АР показана також дієтотерапія, яка є важливою складовою комплексного лікування. За результатами алергологічного обстеження з раціону пацієнта вилучають продукти, які містять причинно-значущі алергени і сприяють сенсибілізації організму. Крім того, обмежують вживання продуктів-гістамінолібераторів, здатних провокувати загострення симптомів АР. Проте недостатньо лише надати пацієнту перелік «заборонених» страв. Лікар повинен скласти докладне меню з урахуванням індивідуальних особливостей і способу життя хворого, щоб забезпечити повноцінність харчування.
Ключову роль у фармакотерапії АР відіграє медикаментозна терапія, яка призначається лікарем індивідуально залежно від характеру і ступеня тяжкості симптомів. Препаратами 1-ї лінії є пероральні антигістамінні препарати (АГП) ІІ покоління та інтраназальні кортикостероїди (ІНКС). Антигістамінні засоби блокують Н1-рецептори гістаміну, усуваючи основні назальні та очні симптоми алергії. При цьому перевагу слід надавати сучасним неседативним препаратам з оптимальним співвідношенням ефективності й безпеки. Пацієнтам із персистуючим середньотяжким і тяжким АР часто призначають ІНКС із потужною протизапальною дією. За потреби застосовують також комбіновані інтраназальні препарати, що містять антигістамінний компонент, та топічні стероїди. Показані також антагоністи лейкотрієнових рецепторів. Допоміжну роль відіграє іригаційна терапія сольовими розчинами для зрошення порожнини носа. А ось судинозвужувальні краплі в ніс слід використовувати з обережністю і лише короткими курсами через ризик медикаментозного риніту.
Згідно з міжнародними настановами, АГП вважаються 1-ю лінією терапії АР. При цьому АГП ІІ покоління мають суттєві переваги над препаратами І покоління завдяки кращому профілю ефективності й безпеки, оптимальній фармакокінетиці, відсутності антихолінергічних і седативних ефектів (G.A. Vena, 2008; J. Bousquet, 2001; T. Zuberbier, 2014). Тому при виборі конкретного АГП для лікування АР слід орієнтуватися на співвідношення користі та ризику, надаючи перевагу сучасним неседативним засобам.
Упродовж останніх десятиліть АГП зазнали істотної еволюції – від класичних препаратів І покоління з вираженою седацією та холінолітичною дією до сучасних селективних лігандів Н1-гістамінових рецепторів із мінімальними побічними ефектами. Новітнім представником АГП ІІ покоління є біластин, що вигідно вирізняється з-поміж інших своїм інноваційним профілем: він має високий рівень доказовості щодо ефективності при АР. Біластин зареєстрований в Україні для застосування у дітей з 6 років і доступний під торговою назвою Ніксар® (компанія «Берлін-Хемі»). Доведено, що біластин швидко і виражено усуває основні назальні та очні симптоми АР, покращуючи якість життя пацієнтів. У ході рандомізованого подвійного сліпого перехресного, поділеного на 4 періоди, одноцентрового дослідження порівнювався потенціал одноразової дози біластину 20 мг проти цетиризину 10 мг, фексофенадину 120 мг і плацебо для полегшення симптомів АР у пацієнтів із безсимптомним сезонним АР, при полінозі, після провокації алергеном (n=75). Згідно з отриманими даними, біластин мав швидкий початок дії до 1 години і тривалу дію понад 26 годин (F. Horak, 2010).
Ключовою особливістю біластину є мінімальна здатність зв’язуватися з Н1-рецепторами в головному мозку, що практично елімінує ризик седативної дії. Тому біластин позиціонується деякими експертами в окрему групу препаратів, які не проникають крізь гематоенцефалічний бар’єр. У дослідженні H. Kawauchi та співавт. (2019) доведено, що біластин у дозі 20 мг не відрізняється від плацебо за здатністю зв’язуватися з H1-рецепторами в мозку (рис.; H. Kawauchi, 2019).
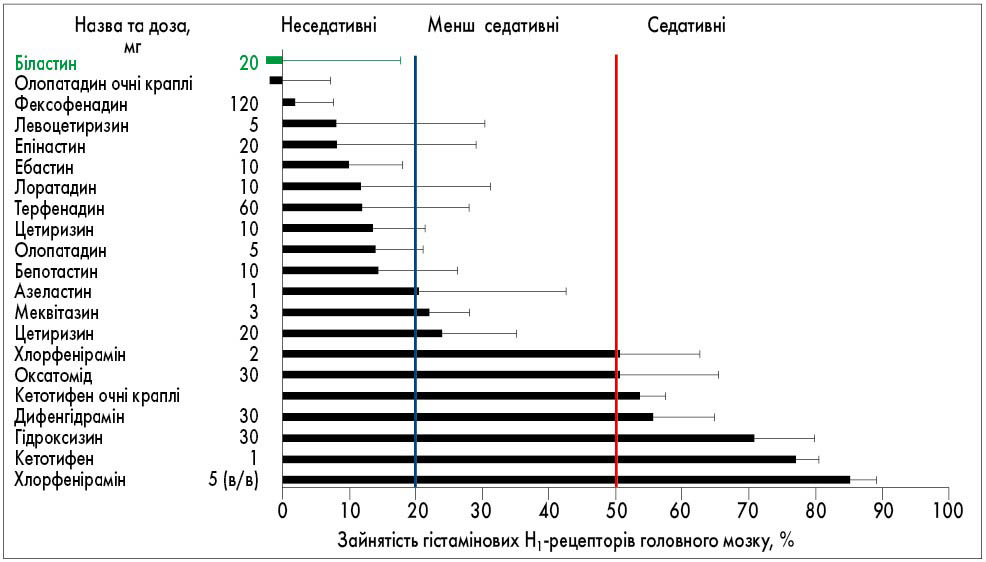 Рис. Зайнятість гістамінових H1-рецепторів головного мозку антигістамінними препаратами (адаптовано з H. Kawauchi et al., 2019)
Рис. Зайнятість гістамінових H1-рецепторів головного мозку антигістамінними препаратами (адаптовано з H. Kawauchi et al., 2019)
Переваги біластину як препарату вибору для лікування АР підтверджені низкою сучасних досліджень. Його безпечність доведена не лише у дорослій популяції, але й у дітей. Зокрема, продемонстровано, що педіатрична доза біластину 10 мг не відрізняється від плацебо за профілем безпеки у пацієнтів віком від 6 до 11 років (M.T. Recto, 2017). Більш того, аналогічні результати отримані навіть у дітей від 2 років, хоча наразі біластин офіційно не зареєстрований для цієї вікової категорії.
Таким чином, АР є глобальною медико-соціальною проблемою, яка істотно погіршує якість життя мільйонів пацієнтів різного віку в усьому світі. Згідно з сучасними рекомендаціями авторитетних міжнародних організацій, препаратами першого вибору для лікування АР визнано пероральні АГП ІІ, серед яких на особливу увагу заслуговує біластин (Ніксар®) – сучасний препарат з оптимальним співвідношенням ефективності та безпеки, який має сприятливий профіль у численних рандомізованих клінічних дослідженнях за участю дорослих і дітей. Біластин вирізняється швидким початком дії, тривалим (до 24 год) контролем усіх назальних і очних симптомів АР, відсутністю седативного та антихолінергічного ефектів, що зумовлює його високу безпечність.
Підготувала Анна Сочнєва
Тематичний номер «Педіатрія» № 2 (73) 2024 р.




