23 січня, 2018
Гормональний гомеостаз та його взаємозв’язок із морфофункціональним станом серцево-судинної системи у хворих на хронічну серцеву недостатність зі збереженою фракцією викиду
Хронічна серцева недостатність (ХСН) зі збереженою фракцією викиду (ХСНзФВ) є синдромом із гетерогенністю патогенезу.
В популяційному аспекті найвагоміший внесок у її поширеність належить артеріальній гіпертензії (АГ) і формуванню концентричної гіпертрофії лівого шлуночка (ГЛШ) із притаманною їй перебудовою ультраструктури міокарда. Важливу роль у розвитку ХСН відводять віковим змінам організму, в тому числі характерному для пізнього онтогенезу перерозподілу жирової тканини (накопичення вісцерального жиру на тлі зменшення підшкірного), пов’язаному з формуванням інсулінорезистентності, розвитком системного запалення, порушенням ендотеліальної функції, проатерогенними зрушеннями в ліпідному спектрі, наростанням протромботичного потенціалу крові. Зв’язок між АГ, атерогенезом та інсулінорезистентністю не випадковий, а визначається спільністю патофізіологічних механізмів. Це, зокрема, активація ренін-ангіотензин-альдостеронової та симпатоадреналової систем, дисфункція в системі мінералокортикоїди-глюкокортикоїди [14, 15, 29].
Метою дослідження було визначення гормонального статусу – рівнів мозкового натрійуретичного пропептиду (Nt-proМНУП), альдостерону, кортизолу, інсуліну та їхніх зв’язків із функціональним станом, антропометричними показниками й параметрами морфофункціонального стану серця та вазомоторної функції судинного ендотелію у хворих похилого віку з гіпертонічною хворобою (ГХ) і початковими стадіями ХСНзФВ.
Обстежені контингенти та методи дослідження
Для вирішення поставлених у роботі завдань було обстежено 120 хворих на ГХ ІІ стадії з АГ 2 та 3 ступенів віком від 60 до 79 років, що перебували на лікуванні у відділенні клінічної та епідеміологічної кардіології ДУ «Інститут геронтології ім. Д.Ф. Чеботарьова НАМН України». На підставі клінічних симптомів, які свідчать про наявність СН, і даних ехокардіографічного (ЕхоКГ) дослідження хворі були рандомізовані у дві групи. До першої групи включено хворих на ГХ без клінічних ознак ХСН (n=30), до другої – на ГХ, ускладнену ХСНзФВ ЛШ (n=90).
Критеріями виключення були вроджені й набуті вади серця, інфаркт міокарда в анамнезі, нестабільна стенокардія, фібриляція передсердь, вторинні АГ, ХСН І та ІV функціонального класу (ФК) за NYHA з ФВ ЛШ <40%, неконтрольована АГ, перенесене гостре порушення мозкового кровообігу, тяжка соматична патологія (хронічні легеневі захворювання з тяжкою дихальною недостатністю, захворювання шлунково-кишкового тракту, печінки в стадії декомпенсації, хронічна хвороба нирок зі значеннями швидкості клубочкової фільтрації (ШКФ) <30 мл/хв/1,73 м2, некомпенсований цукровий діабет), психічні та/або онкологічні захворювання, клінічно значущі зміни лабораторних аналізів.
Діагноз ГХ та ХСН встановлювали на підставі даних анамнезу, клінічного, лабораторних та інструментальних методів дослідження, після виключення симптоматичних АГ відповідно до настанови, рекомендованої Асоціацією кардіологів України, з профілактики та лікування АГ [1] і з діагностики та лікування ХСН [2]. Стадії ХСН встановлювали за класифікацією М.Д. Стражеска та В.Х. Василенка (1935), ФК – згідно з критеріями Нью-Йоркської асоціації серця (NYHA, 1964).
Обстеження пацієнтів проводилося за єдиною програмою після підписання ними інформованої згоди та включало на етапі скринінгу ретельне вивчення анамнезу захворювання, проведення фізикального огляду та антропометричного дослідження – вимірювання ваги, зросту, окружності талії (ОТ) і стегон (ОС) із розрахунком індексу маси тіла (ІМТ).
Оцінка ФК хворих на ХСН проводилася за результатом тесту 6-хвилинної ходьби [8].
Двомірна ЕхоКГ і доплерографічне дослідження проводилися на апараті Xario SSA‑660A фірми Toshiba (Японія) з використанням датчика PST‑30BT 3 та 7,5 МГц за стандартною методикою з опцією тканинної доплерографії [4, 6]. Визначали та розраховували такі показники: систолічний розмір лівого передсердя (ЛП), кінцево-систолічний (КСР) і кінцево-діастолічний розмір (КДР) ЛШ, товщина задньої стінки (ТЗС) і міжшлуночкової перетинки (ТМШП), маса міокарда (ММ) і ФВ ЛШ, систолічний артеріальний тиск у легеневій артерії (САТЛА) [5].
Діастолічна функція ЛШ оцінювалася з урахуванням показників трансмітрального потоку (співвідношення максимальної швидкості раннього (Е) та пізнього (А) наповнення ЛШ – Е/А), а також показників, отриманих при тканинній доплерографії (середня септально-латеральна швидкість ранньої (E’) та пізньої (А’) діастолічної хвилі руху фіброзного кільця мітрального клапана) та співвідношення E/Е’, що відіграє важливу роль у визначенні тиску наповнення ЛШ [2, 19].
Для встановлення діагнозу ХСНзФВ відповідно до рекомендацій поряд із симптомами ХСН ураховували рівні Nt-proМНУП >125 пг/мл, значення ФВ ЛШ >40% і наявність одного додаткового критерію: серед структурних – ГЛШ або індекс об’єму ЛП (ІОЛП) >34 мл/м2, серед функціональних – співвідношення Е/Е’ ≥13 ум. од. або середнє значення септально-латеральної швидкості руху мітрального кільця Е’ <9 см/с [2, 21].
Ендотелійзалежну вазодилатацію (ЕЗВД) оцінювали за методикою D. Celermajer у сучасній модифікації D.H. Thijssen [7, 27].
Забір зразків венозної крові проводився натще в ранковий час (до 9-ї години ранку) з визначенням концентрації креатиніну, глюкози, сечової кислоти, загального холестерину (ЗХС), тригліцеридів (ТГ), холестерину ліпопротеїнів низької (ЛПНЩ) та високої щільності (ХС ЛПВЩ) і гормонів. Рівень Nt-proМНУП – N-кінцевого фрагмента МНУП визначали методом імуноферментного аналізу з використанням тест-системи Biomedica (Німеччина). Визначення рівнів альдостерону проводили за допомогою тест-систем виробництва DRG Aldosterone ELISA, DRG International Inc., США (нормальні значення в положенні лежачи становлять 50,9-157,5 пг/мл, у положенні стоячи – 52,5-231,4 пг/мл), інсуліну – DRG Insulin ELISA, DRG Diagnostics GmbH, Німеччина (нормальні значення в діапазоні 2-25 мкОд/мл) і кортизолу – «СтероидИФА-кортизол», «Алкор Био», Російська Федерація (нормальні значення для здорових осіб – 150-660 нмоль/л).
Для визначення інсулінорезистентності розраховували НОМА-індекс (референтні значення <3 ум. од.) за формулою [18]:
концентрація глюкози в крові (ммоль/л) × концентрація інсуліну в крові (мкОД/л) / 22,5 ШКФ оцінювали за розрахунком кліренсу креатиніну згідно з формулою CKD-EPI [16].
Аналіз і статистична обробка результатів проведені за допомогою програмного пакета Statistica 6.1 for Windows. Вибір методів статистичної обробки визначався типом вихідних даних і характеристиками розподілу параметричних і непараметричних ознак, що вивчалися. Розраховувалися середні величини (M), їхні середні стандартні похибки (m). Порівняльний статистичний аналіз між двома сукупностями проводили параметричним (t-критерій Стьюдента для пов’язаних і непов’язаних вимірювань) і непараметричними (χ2 Пірсона, Колмогорова-Смірнова, Манна-Уїтні та Вілкоксона) методами. Наявність взаємозв’язків між окремими показниками встановлювали, застосовуючи кореляційний аналіз. При значеннях р<0,05 розбіжності вважали статистично достовірними.
Результати та їх обговорення
Середній вік обстежених становив 67,7±1,4 року в групі з неускладненою ГХ та 69,6±1,5 року в групі ХСНзФВ; пацієнти обох груп були зіставні за віком і статтю. Хворі обох груп мали підвищений ІМТ – 29,5±0,9 кг/м2 у групі ГХ та 31,5±0,8 кг/м2 у групі ХСН. Лише в 6 (6,7%) хворих на ХСНзФВ зареєстровано нормальний ІМТ у межах 18,5-24,9 кг/м2 на відміну від 5 (16,7%) хворих на ГХ; надмірну вагу з ІМТ від 25 до 29,9 кг/м2 відзначали у 34 (37,8%) та 9 (30,0%) хворих вищезазначених груп, ожиріння 1 ступеня – у 26 (28,9%) та 16 (53,3%) хворих відповідно. Ожиріння 2 та 3 ступеня виявляли лише в групі ХСНзФВ – відповідно у 18 (20%) та 6 (6,7%) пацієнтів. При цьому значення ОТ були достовірно вищими у хворих на ХСНзФВ (102,0±1,4 см) порівняно з хворими на ГХ (97,1±1,2 см), що свідчить про абдомінальний тип ожиріння. За частотою виявлення цукрового діабету 2 типу досліджувані групи достовірно не відрізнялися.
У всіх пацієнтів із ХСН та ФВ ЛШ >40% із найбільшою частотою реєструвалися ГЛШ – у 93,3% і зменшення середньої септально-латеральної швидкості (Е’) – у 92,2%, що виявилося превалюючим поєднанням додаткових критеріїв незалежно від статі. При цьому в 6,7% хворих, що мали концентричне ремоделювання ЛШ, поєднання додаткових критеріїв ХСНзФВ різнилося залежно від статі. Так, значення Е’ <9 см/с у хворих жіночої статі в 66,7% випадків виявлялися в поєднанні зі значеннями Е/Е’ ≥13 ум. од., тоді як для хворих чоловічої статі характерним було поєднання зі збільшеним ІОЛП.
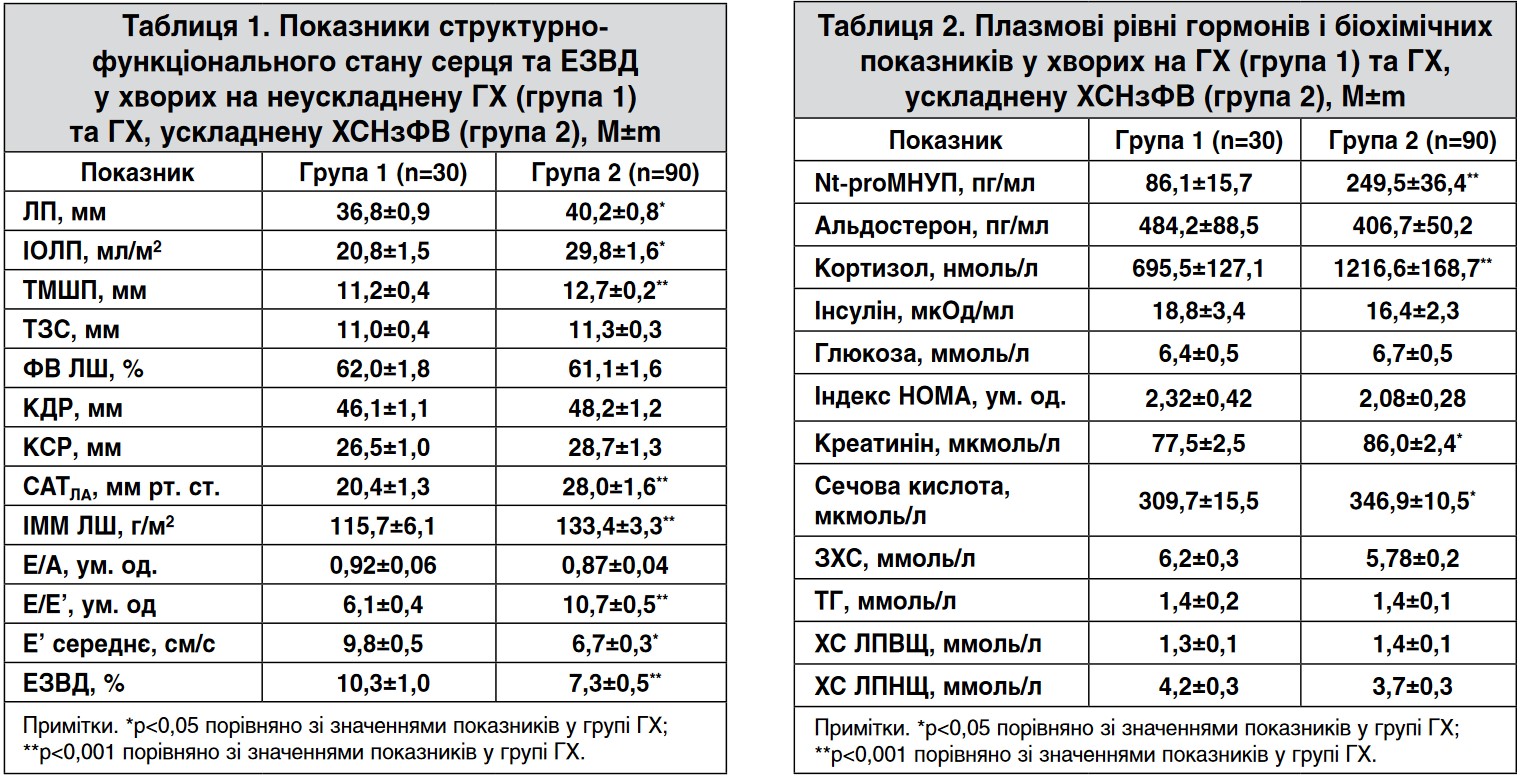
Поряд із підвищеним індексом ММ (ІММ) ЛШ у хворих на ХСН порівняно з пацієнтами з ГХ реєструвалися збільшення розмірів ЛП, товщини стінок ЛШ, порушення діастолічної функції ЛШ, зростання САТЛА та зменшення ступеня ЕЗВД (табл. 1).
Як видно з таблиці 2, у хворих на ХСН порівняно з пацієнтами з неускладненою ГХ вірогідно підвищена концентрація в крові Nt-proМНУП – майже у 2,5 раза. У всіх хворих на ХСН вона перевищувала граничний рівень – 125 пг/мл [2, 21].
Як відомо, зростання концентрацій НУП та Nt-proМНУП відбувається зі зростанням тяжкості СН [23]. Наші результати засвідчують, що це характерно й для гіпертензивного типу ХСНзФВ на ранніх її етапах: коефіцієнт кореляції r між концентрацією Nt-proМНУП і дистанцією 6-хвилинної ходьби дорівнював 0,23 (р<0,05). У групі хворих на неускладнену ГХ не було встановлено скільки-небудь значущих зв’язків між концентрацією Nt-proМНУП і параметрами морфофункціонального стану серця. Водночас у групі хворих на ХСН зростання в крові концентрації Nt-proМНУП асоціювалося зі збільшенням розмірів ЛП (r=0,43; p<0,02). Як відомо, збільшення камери ЛП є маркером порушення діастолічної функції серця [4, 19]. Встановлений зв’язок вказує на включення ЛП у патогенетичну ланку переходу від латентної діастолічної дисфункції до маніфестної СН. Про зв’язок між вираженістю порушення діастолічної функції серця й гіперактивністю серця як ендокринного органа свідчить зв’язок між рівнем Nt-proМНУП та А’ латеральним (r=0,36; p<0,05), що розглядається як найбільш чутливий ЕхоКГ-маркер діастолічної дисфункції у прямому порівняльному дослідженні з використанням тканинної доплерографії й магнітно-резонансної томографії серця [30].
У механізмах розвитку та прогресування СН важливе місце посідає порушення функціонального стану нирок [3]. У хворих із ХСНзФВ реєстрували вищі плазмові концентрації креатиніну, порівняно з хворими на неускладнену ГХ (табл. 2), і зниження ШКФ – 66,3±2,0 проти 78,1±2,8 мл/хв/1,73 м2 у групі ГХ (р<0,001). У результаті кореляційного аналізу була встановлена обернена залежність між концентрацією Nt-proМНУП і ШКФ (r=-0,39; p<0,03), що свідчить про паралелізм між зростанням тяжкості СН і погіршенням функціонального стану нирок уже на початкових стадіях ХСНзФВ, коли рівень креатиніну ще перебуває в межах нормальних значень.
Ще один важливий патогенетичний фактор СН – порушення функціонального стану судинного ендотелію [17]. В обстежених нами хворих ступінь ЕЗВД упродовж перших 60 с був майже втричі менший при ХСНзФВ і становив 2,4±0,7%, тоді як у хворих на неускладнену ГХ – 7,4±1,1% (р<0,001). На пізніших строках реактивної гіперемії (на 180 с) цей параметр становив 7,3±0,5% у групі ХСН проти 10,3±1,0% у групі ГХ (табл. 1). Погіршення моторно-рухової функції ендотелію у хворих із ХСНзФВ асоціювалося з тенденцією до зростанням рівня Nt-proМНУП (r=-0,30; p<0,1).
Отже, рівень Nt-proМНУП підвищується в міру зниження толерантності до фізичного навантаження й має місце паралелізм між зростанням концентрації Nt-proМНУП і порушенням діастолічної функції ЛШ, зростанням розмірів ЛП, погіршенням функціонального стану нирок і судинного ендотелію.
Як видно з таблиці 2, і неускладненій ГХ, і ХСН притаманна гіперфункція кори надниркових залоз, про що свідчать високі концентрації альдостерону та кортизолу. Найбільш значущі відмінності встановлені в рівнях кортизолу: він у хворих на ХСН майже вдвічі вищий, аніж у пацієнтів із неускладненою ГХ. Добре відомо, що гіперпродукція альдостерону є прогностично несприятливою ознакою. Так, у дослідженні CONSENSUS було показано, що підвищені концентрації альдостерону асоціюються зі значним зростанням смертності [26].
Аналогічно несприятливу інформацію щодо виживаності хворих не тільки із серцево-судинною патологією, а й у загальній популяції несе рівень кортизолу крові [20, 22]. Значення кортизолу в умовах СН визначається й тим фактором, що у зв’язку зі значно вищими порівняно з альдостероном концентраціями в крові він здійснює значний агоністичний вплив на мінералокортикоїдні рецептори [11, 12].
У хворих на ХСН зростання концентрації альдостерону поєднувалося зі збільшенням ІМТ (r=0,37; p<0,05), зниженням ХС ЛПВЩ (r=-0,48; p<0,001), що підтверджує дані інших досліджень про тісний зв’язок між гіперальдостеронемією та формуванням метаболічного синдрому крові [15, 25]. Як і в разі НУП, встановлено пряму залежність між зростанням розмірів ЛП як маркера діастолічної дисфункції й концентрацією альдостерону (r=-0,38; p<0,03).
Гіперкортизолемія в обстежених нами пацієнтів зростала в міру збільшення ФК ХСН за NYHA. Про це свідчить негативна кореляційна залежність між концентрацією кортизолу та дистанцією 6-хвилинної ходьби (r=-0,54; p<0,001). Згідно з літературними даними підвищений рівень кортизолу в крові є важливим чинником зниження толерантності до фізичних навантажень, одним із центральних механізмів розвитку саркопенії при кахексії у хворих на ХСН [28].
Зростання рівня кортизолу в крові асоціюється зі збільшенням КСР ЛШ (r=0,46; p<0,01) і демонструє тенденцію до зменшення ударного викиду (r=-0,31; p<0,1), тобто зі зростанням ступеня гіперкортизолемії поєднується погіршення скоротливої функції серця зі збільшенням кінцево-систолічного об’єму крові та погіршується гемодинамічне забезпеченням організму. Негативний вплив кортизолу на структурно-функціональний стан серця – добре відомий факт. Про це, зокрема, свідчить і розвиток дилатаційної кардіоміопатії при синдромі Кушинга [24].
Оскільки об’єктом нашого дослідження була ХСН із діастолічною дисфункцією ЛШ, інтерес викликає питання про співвідношення між гіперкортизолемією й порушенням діастолічного розслаблення ЛШ. Про те, що зростання кортизолемії асоціюється з погіршенням діастолічної функції ЛШ, свідчать виявлені нами кореляційні зв’язки між рівнем кортизолу в плазмі крові та А (л) (r=-0,35; p<0,05). Більше того, виявлена тенденція до зростання систолічного тиску в системі легеневої артерії в міру підвищення концентрації кортизолу (r=0,29; p<0,1) свідчить про важливу роль цього стресового гормона в розвитку легеневої гіпертензії як наріжного каменя формування клінічної симптоматики СН і маркера несприятливого прогнозу [13].
ХСНзФВ – це та форма ХСН, у розвитку якої важливе місце посідає коморбідна патологія. Окрім АГ і хронічного обструктивного захворювання легень, чинне місце належить цукровому діабету та ожирінню [10]. Вивчення ролі кардіометаболічного синдрому для ХСНзФВ представляє собою один з актуальних напрямів дослідження в цій галузі. Про його перспективність свідчать результати цілеспрямованого впливу на толерантність тканин до глюкози з використанням бігуаніду метформіну та дані реєстрів про позитивний вплив статинів [9].
Як видно з таблиці 2, між двома обстеженими групами – пацієнтів із неускладненою ГХ та з ГХ, обтяженою розвитком ХСНзФВ – не було відмінностей ані в рівні інсуліну, ані в показнику НОМА, що характеризує стан інсулінорезистентності. Разом із тим нами вивчені численні кореляційні зв’язки між цими показниками та параметрами морфофункціонального стану серця у хворих на ГХ, ускладнену ХСНзФВ.
Закономірно, що зростання рівня інсуліну в крові поєднується з кількісними значеннями показників, що є критеріями метаболічного синдрому. Так, при проведенні кореляційного аналізу встановлено, що зі зростанням рівня інсуліну в плазмі крові збільшується маса тіла та ІМТ (r=0,54; p<0,001), зростає ОТ (r=0,050; p<0,002). Аналогічні, але кількісно виразніші кореляції цих антропометричних показників виявлено при аналізі зв’язків із НОМА-індексом. Так, кореляція між НОМА та ІМТ становила 0,63 (p<0,0005), з ОТ – 0,55 (p<0,001). У міру збільшення рівня інсуліну в крові збільшується концентрація глюкози (r=0,51; p<0,002) та, навпаки, знижується вміст у крові ХС ЛПВЩ (r=-0,37; p<0,03). Кількісно аналогічна кореляція встановлена між рівнем НОМА-індексу та ХС ЛПВЩ (r=-0,36; p<0,004).
При вивченні зв’язків із показниками морфофункціонального стану серця встановлено, що гіперінсулінемія та зростання інсулінорезистентності насамперед асоціюються з розвитком гіпертрофії серця. Так, між концентрацією інсуліну, значеннями НОМА-індексу та ММ виявлена пряма залежність (r=0,28; p<0,01 та r=0,34; p<0,01 відповідно). Відсутність залежності з ІММ ЛШ може вказувати на те, що частково вплив гіперінсулінемії та інсулінорезистентності на формування ГЛШ реалізується через збільшення маси тіла.
Важливим вбачається той факт, що з гіперінсулінемією асоціюється розвиток ГЛШ саме за концентричним типом – коефіцієнт кореляції між рівнем інсуліну та ТЗС ЛШ становить 0,36 (p<0,05). Із підвищенням рівня інсуліну в крові збільшуються розміри ЛП – про це свідчить пряма кореляція між цими двома параметрами (r=0,55; p<0,001). Такий самий зв’язок одержано й щодо НОМА-індексу (r=0,57; p<0,05).
Висновки
1. Хворим на неускладнену ГХ притаманна гіперкортизолемія та гіперальдостеронемія. Хворі з ХСНзФВ характеризуються підвищенням концентрації в крові proНУП, істотним (удвічі) зростанням рівня гіперкортизолемії.
2. Концентрація proНУП підвищується в міру зростання тяжкості ХСНзФВ, і має місце паралелізм між зростанням рівня Nt-proМНУП і порушенням діастолічної функції ЛШ, зростанням розмірів ЛП, погіршенням функціонального стану нирок і судинного ендотелію.
3. Зростання концентрації альдостерону поєднується зі збільшенням маси тіла, зниженням ХС ЛПВЩ, тобто зі складовими метаболічного синдрому. Встановлено паралелізм між рівнем гіперальдостеронемії та зростанням розмірів ЛП як маркера діастолічної дисфункції ЛШ.
4. Зв’язок між зростанням ступеня гіперкортизолемії та підвищенням ФК ХСН, порушенням діастолічного розслаблення ЛШ, зростанням САТЛА засвідчує важливу роль цього стресового гормона в прогресуванні СН і формуванні легеневої гіпертензії.
5. Зростання концентрації в крові інсуліну та НОМА-індексу як маркера інсулінорезистентності асоціюється з розвитком концентричної ГЛШ. Із підвищенням рівня інсуліну та зниженням толерантності тканин до глюкози збільшуються розміри ЛП як маркера вираженості діастолічної дисфункції.
Література
1. Артеріальна гіпертензія. Настанова та клінічний протокол надання медичної допомоги. Наказ МОЗ України № 384 від 24.05.2012. – К., 2012. – 107 с.
2. Воронков Л.Г. Рекомендації Асоціації кардіологів України з діагностики та лікування хронічної серцевої недостатності (2017) / Л.Г. Воронков, К.М. Амосова, Г.В. Дзяк та ін. // Серцева недостатність та коморбідні стани. – 2017. – № 1. – Додаток 1. – 66 с.
3. Дзяк Г.В., Василенко А.М., Шейко С.О. Кардіоренальний анемічний синдром у хворих із серцевою недостатністю // Серцева недостатність. – 2010. – № 3. – С. 10-17.
4. Долженко М.Н. Эхокардиография у больных сердечной недостаточностью / М.Н. Долженко, С.В. Поташев. – Донецк, 2011. – 216 с.
5. Крахмалова Е.О. Эхокардиография в диагностике легочной гипертензии / Е.О. Крахмалова // Серцева недостатність та коморбідні стани. – 2017. – № 1. – С. 6-14.
6. Фейгенбаум Х. Эхокардиография / Х. Фейгенбаум. – 5-е изд. – М.: Видар, 1999. – 496 с.
7. Celermajer D.S. Non-invasive detection of mediated brachial artery vasodilatation in human subjects / D.S. Celermajer, K.E. Sorensen, V.M. Gooch et al. // Circulat. Res. – 1992. – Vol. 340. – P. 1111-1115.
8. Faggiano P. The 6 minute walking test in chronic heart failure: indications, interpretation and limitations from a review of the literature / P. Faggiano, A. D’Aloia, A. Gualeni // The European Journal of Heart Failure. – 2004. – Vol. 6. – P. 687-691.
9. Feinstein M.J. Do statins reduce the risk of myocardial infarction in patients with heart failure? A pooled individual-level reanalysis of CORONA and GISSI-HF / M.J. Feinstein, P. Jhund, J. Kang et al. // Eur. J. Heart Fail. – 2015. – Vol. 17 (4). – P. 434-441.
10. Fonarow G.C. Characteristics, treatments and outcomes of patients with preserved systolic function hospitalized for heart failure. A report from the Optimize HF registry / G.C. Fonarow, W.G. Stough, W.T. Abraham et al. // J. Am. Coll. Cardiol. – 2007. – Vol. 50, № 8. – Р. 768-777.
11. Funder J.W. Is aldosterone bad for the heart? / J.W. Funder // Trends Endocrinol. Metab. – 2004. – Vol. 15 (4). – P. 139-142.
12. Funder J.W. Mineralocorticoid receptors: distribution and activation / J.W. Funder // Heart Fail. Rev. – 2005. – Vol. 10 (1). – P. 15-22.
13. Goliasch G. Outcome in Heart Failure with Preserved Ejection Fraction: The Role of Myocardial Structure and Right Ventricular Performance / Goliasch G., Zotter-Tufaro C., Aschauer S. et al. // PLoS One. – 2015. – Vol. 10 (7): e0134479. doi: 10.1371/journal.pone.0134479.
14. Hammer F., Stewart P.M. Cortisol metabolism in hypertension / Hammer F., Stewart P.M. // Best Pract. Res. Clin. Endocrinol. Metab. – 2006. – Vol. 20 (3). – P. 337-353.
15. Jia G. The role of mineralocorticoid receptor signaling in the cross-talk between adipose tissue and the vascular wall / G. Jia, A.R. Aroor, J.R. Sowers // Cardiovasc. Res. – 2017. – Vol. 113 (9). – P. 1055-1063.
16. Levey A.S. A New Equation to Estimate Glomerular Filtration Rate / A.S. Levey, L.A. Stevens, C.H. Schmid et al. // Ann. Intern. Med. – 2009. – Vol. 150 (9). – P. 604-612.
17. Marti C.N. Endothelial dysfunction, arterial stiffness, and heart failure / C.N. Marti, M. Gheorghiade, A.P. Kalogeropoulos et al. // J. Am. Coll. Cardiol. – 2012. – Vol. 60, № 16. – P. 1455-1469.
18. Matthews D.R. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man / D.R. Matthews, J.P. Hosker, A.S. Rudenski et al. // Diabetologia. – 1985. – Vol. 28 (7). – P. 412-419.
19. McMurray J.J. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC / J.J. McMurray, S. Adamopoulos, S.D. Anker et al. // Eur. J. Heart Fail. – 2012. – № 14 (33). – Р. 1787-1847.
20. Noordam R. Familial longevity is marked by lower diurnal salivary cortisol levels: the Leiden Longevity Study / R. Noordam, S.W. Jansen, A.A. Akintola et al.; Leiden Longevity Study group // PLoS One. – 2012. – Vol. 7 (2): e31166. doi: 10.1371/journal.pone.0031166. Epub 2012.
21. Ponikowski P. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) / P. Ponikowski, A.A. Voors, St. D. Anker et al. // Heart J. – 2016. – Vol. 37 (27). – P. 2129-2200.
22. Rotman-Pikielny P. Serum cortisol levels in patients admitted to the department of medicine: Prognostic correlations and effects of age, infection, and comorbidity / P. Rotman-Pikielny, V. Roash, O. Chen et al. // Am. J. Med. Sci. – 2006. – Vol. 332 (2). – P. 61-67.
23. Sanders-van Wijk S. Circulating biomarkers of distinct pathophysiological pathways in heart failure with preserved vs. reduced left ventricular ejection fraction / S. Sanders-van Wijk, V. van Empel, N. Davarzani // Eur. J. Heart Fail. – 2015. – Vol. 17 (10). – P. 1006-1014.
24. Shibusawa N. Dilated cardiomyopathy as a presenting feature of Cushing’s syndrome / N. Shibusawa, M. Yamada, T. Hashida et al. // Intern. Med. – 2013. – Vol. 52 (10). – P. 1067-1071.
25. Smekal A., Vaclavik J. Adipokines and cardiovascular disease: A comprehensive review / A. Smekal, J. Vaclavik // Biomed. Pap. Med. Fac. Univ. Palacky Olomouc Czech Repub. – 2017. – Vol. 161 (1). – P. 31-40.
26. Swedberg K. Hormones regulating cardiovascular function in patients with severe congestive heart failure and their relation to mortality. 27. CONSENSUS Trial Study Group / K. Swedberg, P. Enroth, J. Kjekshus et al. // Circulation. – 1990. – Vol. 82 (5). – P. 1730-1736.
27. Thijssen D.H. Assessment of flow-mediated dilation in humans: a methodological and physiological guideline / D.H. Thijssen, M.A. Black, K.E. Pyke et al. // Am. J. Physiol. Heart Circ. Physiol. – 2011. – Vol. 300, № 1. – P. 2-12.
28. Tzanis G. Exercise intolerance in chronic heart failure: the role of cortisol and the catabolic state / G. Tzanis, S. Dimopoulos, V. Agapitou et al. // Curr. Heart Fail. Rep. – 2014. – Vol. 11 (1). – P. 70-79.
29. Vecchiola A. Aldosterone Production and Signaling Dysregulation in Obesity / A. Vecchiola, C.F. Lagos, C.A. Carvajal et al. // Curr. Hypertens. Rep. – 2016. – Vol. 18 (3). – P. 20.
30. Wu V. Evaluation of diastolic function by three-dimensional volume tracking of the mitral annulus with cardiovascular magnetic resonance: comparison with tissue Doppler imaging / V. Wu, J.Y. Chyou, S. Chung et al. // J. Cardiovasc. Magn. Reson. – 2014. – Vol. 6. – P. 71.
Журнал "Серцева недостатність та коморбідні стани" № 3, грудень 2017 р.