24 січня, 2018
Нове у веденні серцевої недостатності за матеріалами світових конгресів
Конгрес Європейського товариства кардіологів (ESC), 26-30 серпня, м. Барселона, Іспанія
Дослідження CASTLE-HF: катетерна абляція покращує результати лікування пацієнтів із серцевою недостатністю та фібриляцією передсердь
У пацієнтів із дисфункцією лівого шлуночка (ДЛШ) фібриляція передсердь (ФП) трапляється значно частіше, ніж у загальній популяції, й асоціюється з підвищеним ризиком госпіталізації та смерті. Ідеального лікування пацієнтів із ДЛШ і ФП дотепер не знайдено через брак клінічних досліджень, які свідчили би про перевагу якоїсь конкретної стратегії.
У дослідженні CASTLE-HF у цієї категорії хворих оцінювали вплив катетерної абляції на загальну смертність і частоту госпіталізацій порівняно зі стандартним лікуванням, рекомендованим Американською асоціацією серця (AHA) та ESC.
Після скринінгу понад 3000 пацієнтів у дослідження включили 397 осіб із симптомною пароксизмальною чи постійною ФП і серцевою недостатністю (СН) із фракцією викиду (ФВ) ЛШ <35%. Усі пацієнти мали імплантований кардіовертер-дефібрилятор із функцією Home Monitoring (моніторинг у домашніх умовах), що дає змогу безперервно спостерігати за ФП. Набір пацієнтів здійснювали з понад 30 клінічних центрів світу, зокрема в Північній Америці, Європі та Австралії.
Пацієнтів рандомізували на дві групи для радіочастотної катетерної абляції чи стандартної фармакотерапії ФП (контроль частоти серцевих скорочень або контроль ритму). Первинна кінцева точка включала комбінацію випадків смерті від будь-яких причин і госпіталізацій із приводу погіршення СН.
Протягом періоду спостереження в середньому 38,8 міс частота первинної кінцевої точки була значно нижчою в групі абляції (28,5%) порівняно з контрольною групою (44,6%) (відносний ризик, ВР 0,62; 95% довірчий інтервал, ДІ 0,43-0,87; р=0,007).
Загальна смертність і частота госпіталізацій через погіршення СН як окремі показники (вторинні кінцеві точки) також були значно меншими в групі катетерної абляції: загальна смертність становила 13,4% у групі абляції порівняно з 25% у контрольній групі (ВР 0,53; 95% ДІ 0,32-0,86; р=0,011), частота госпіталізацій – 20,7 vs 35,9% відповідно (ВР 0,56; 95% ДІ 0,37-0,83; р=0,004).
На думку авторів, головним обмеженням дослідження є те, що всі пацієнти мали імплантований кардіовертер-дефібрилятор, і це могло вплинути на смертність в обох групах. Утім, дотепер у жодному дослідженні не вдавалося продемонструвати, що абляція, протиаритмічні препарати чи інше лікування має переваги в покращенні виживаності та зменшенні госпіталізацій. Утілення результатів CASTLE-HF у клінічну практику дасть змогу не лише рятувати життя пацієнтів із СН та ФП, а й зберегти значні кошти завдяки зменшенню частоти госпіталізацій.
Користь від лікування дефіциту заліза при СН
Дефіцит заліза є поширеним явищем незалежно від рівня гемоглобіну, статі, етнічної належності та ФВ ЛШ. Серед хворих на СН він присутній у кожного другого пацієнта й негативно впливає на функціональний статус, якість життя та прогноз (на відміну від анемії). На пізніх стадіях СН вміст заліза в міокарді зменшується незалежно від анемії; це порушує функцію мітохондрій, про що свідчить зниження активності ферментів циклу цитринової кислоти.
Дефіцит заліза визначають як феритин сироватки <100 мкг/л (або 100-299 нг/мл, якщо насиченість трансферину <20%). У хворого на СН із масою тіла 35-70 кг і рівнем гемоглобіну 10-14 г/дл дефіцит заліза зазвичай становить 1000 мг.
На сателітному симпозіумі конгресу ESC було розглянуто низку досліджень внутрішньовенного (в/в) заміщення заліза в пацієнтів із СН зі зниженою ФВ ЛШ (≤40%; II-IV функціональний клас – ФК за NYHA) та дефіцитом заліза. Зокрема, це були дослідження:
- FAIR-HF (n=459), у якому відзначили покращення загального стану пацієнтів за опитувальником PGA, ФК за NYHA та тесту з 6-хвилинною ходьбою (6MWT) при застосуванні в/в карбоксимальтозату заліза (КМЗ) порівняно з плацебо;
- CONFIRM-HF (n=300), яке продемонструвало значне покращення 6MWT і вторинних кінцевих точок після 24 тиж лікування КМЗ порівняно з плацебо в подібній популяції пацієнтів;
- EFFECT-HF (n=172), де в пацієнтів із СН і залізодефіцитом КМЗ покращував запаси заліза та позитивно впливав на пікове споживання кисню (VO2) порівняно зі стандартним лікуванням.
Ці дані контрастують із результатами дослідження IRONOUT-HF (n=225), у якому оральне заміщення заліза у хворих на СН зі зниженою ФВ ЛШ не змінювало переносимість фізичних навантажень, оцінювану за VO2. На думку спікерів, це зумовлено поганою абсорбцією орального заліза та його нездатністю ефективно відновлювати запаси заліза в пацієнтів із СН.
Актуальне керівництво ESC рекомендує оцінювати статус заліза в усіх пацієнтів з уперше діагностованою систолічною СН і розглядати доцільність призначення в/в КМЗ симптомним хворим на СН зі зниженою ФВ ЛШ і дефіцитом заліза.
Слід наголосити, що параметри, які оцінювали в дослідженнях в/в КМЗ із позитивними результатами, є сурогатними маркерами, тож вплив такого лікування на тривалість життя та інші важливі показники ще має бути продемонстрований.
Високе споживання солі асоціюється з подвоєним ризиком розвитку СН
Відомо, що високе споживання солі (хлориду натрію) є однією з провідних причин високого артеріального тиску (АТ) і незалежним фактором ризику ішемічної хвороби серця (ІХС) та інсульту. На конгресі ESC фінські вчені представили нові дані, які свідчать про вплив споживання солі на ризик розвитку СН.
Автори проспективно спостерігали 4630 випадково відібраних чоловіків і жінок віком від 25 до 64 років на момент включення, котрі в період між 1979 та 2002 роками брали участь у дослідженнях North Karelia Salt Study та National FINRISK Study у Фінляндії. Збір вихідних даних передбачав заповнення опитувальника щодо способу життя, вимірювання зросту, маси тіла й АТ, забір венозної крові для лабораторного аналізу та збір добової сечі.
Споживання солі розраховували за екскрецією натрію із сечею (1 г солі = 17,1 ммоль натрію). Ризик розвитку СН оцінювали за квінтилями добового споживання солі (<6,8; 6,8-8,8; 8,8-10,9; 10,9-13,7 та >13,7 г).
Протягом 12 років новий діагноз СН встановили 121 особі. Аналіз із поправкою на вік, стать, рік дослідження та регіон проживання показав, що порівняно з 1-м квінтилем споживання солі (<6,8 г/ добу) ВР розвитку СН для 2-го, 3-го, 4-го та 5-го квінтилей становив 0,83; 1,40; 1,70 та 2,10 відповідно, а після додаткової поправки на систолічний АТ, загальний холестерин сироватки та індекс маси тіла – 1,13; 1,45; 1,56 та 1,75 відповідно. Отже, люди, які щоденно споживають >13,7 г солі, мають майже вдвічі вищий ризик розвитку СН порівняно з таким в осіб із рівнем споживання <6,8 г/добу.
Нагадаємо, що згідно з рекомендаціями Всесвітньої організації охорони здоров’я добове споживання солі не має перевищувати 5 г, тоді як фізіологічна потреба становить 2-3 г/добу.
XXI Щорічний конгрес Американського товариства СН (HFSA), 16-19 вересня, м. Грейпвайн, США
Дослідження ROPA-DOP: допамін і фуросемід при гострій СН зі збереженою ФВ
При гострій декомпенсованій СН іноді застосовують допамін у низьких дозах для потенціювання ефекту діуретиків, хоча доказова база цього призначення є доволі обмеженою. На конгресі HFSA були представлені результати дослідження, що вказують на недоцільність використання допаміну в пацієнтів із гострою СН зі збереженою ФВ.
У дослідженні ROPA-DOP пацієнтів із гострою декомпенсованою СН зі збереженою ФВ ЛШ (≥50%) і швидкістю клубочкової фільтрації (ШКФ) >15 мл/хв/1,72 м2 рандомізували 2×2 для отримання фуросеміду у вигляді болюса 2 р/добу чи безперервної інфузії ± допамін 3 мкг/кг/хв.
Через 72 год ниркова функція погіршилася в 11,6% пацієнтів, які отримували болюси фуросеміду, та в 36,2% хворих, яким фуросемід уводили безперервно (р=0,02). Незалежно від режиму застосування фуросеміду допамін не чинив істотного впливу на ниркову функцію та діурез.
Раніше в дослідженні ROSE-HF (2013) у пацієнтів із СН зі збереженою ФВ допамін асоціювався зі значно нижчими діурезом і натрійурезом, із вищою частотою смерті та госпіталізацій через 2 міс і вищою смертністю через 6 міс.
Концепція «їжа як ліки» при СН
Обмеження споживання солі (власне натрію) є основою дієтичних рекомендацій пацієнтам із СН, проте в деяких дослідженнях у хворих на гостру чи хронічну СН воно асоціювалося з недостатністю харчування. Це може пояснюватися тим, що обмеження натрію чітко корелює з обмеженням калорій.
GOURMET-HF – невелике пілотне дослідження, метою якого було продемонструвати практичну можливість обмеження солі в раціоні пацієнтів із СН як передумови для масштабнішого випробування.
Пацієнтів віком від 55 років, виписаних після госпіталізації з приводу гострої декомпенсованої СН (за винятком хворих із високими рівнями калію чи низькою ШКФ) розподілили на дві рівні групи. В одній групі пацієнти отримували стандартне ведення, в іншій додаткового до нього раз на тиждень пацієнтам здійснювали доставку додому розфасованих продуктів харчування, що узгоджувалися з дієтою DASH-SRD (Dietary Approach to Stop Hypertension – Sodium Restricted Diet; дієта з обмеженим умістом натрію для запобігання гіпертензії).
Різновид дієти DASH, що застосувався в дослідженні GOURMET-HF, передбачав добову кількість натрію <1500 мг і калію <4500 мг (або <3000 мг у пацієнтів із ризиком гіперкаліємії, наприклад у разі ниркової недостатності, лікування калійзберігаючими діуретиками чи антагоністами альдостерону).
Учасники дотримувалися дієти протягом 4 тиж, після чого їх спостерігали ще 8 тиж. Первинною кінцевою точкою була сумарна оцінка пов’язаної зі здоров’ям якості життя за Канзаським опитувальником кардіоміопатії (KCCQ).
Пацієнти мали можливість обирати з різноманітних продуктів харчування, напівфабрикатів і готових страв, при цьому дослідники, за їхніми словами, доклали максимум зусиль, щоб ці продукти були привабливими, й навіть самі куштували деякі страви.
Учасників не заохочували доповнювати дієтичні страви іншими продуктами, хоча це дозволялося робити. Також дослідники усвідомлювали, що пацієнти можуть вживати «недозволену» їжу – наприклад, на вечірках у друзів, святкуваннях тощо.
Результати показали, що пацієнти дотримувалися дієти DASH у середньому 23 дні протягом 4 тиж.
Після 12 тиж сумарна оцінка KCCQ значно (р<0,001) підвищилася в обох групах, що свідчило про зменшення симптомів СН і фізичних обмежень, проте в основній групі це підвищення становило 18 балів (одне стандартне відхилення), тоді як у контрольній – лише 1,7 бала (р=0,053).
Також в основній групі спостерігалася сильна тенденція до меншої кількості госпіталізацій із приводу погіршення СН (р=0,055) і кількості днів стаціонарного лікування (17 vs 55; р=0,06). На переконання авторів, різниця за цими показниками ледь не досягла статистичної значущості через малу кількість учасників (n=66), однак отримані результати переконливо свідчать про доцільність проведення масштабнішого дослідження.
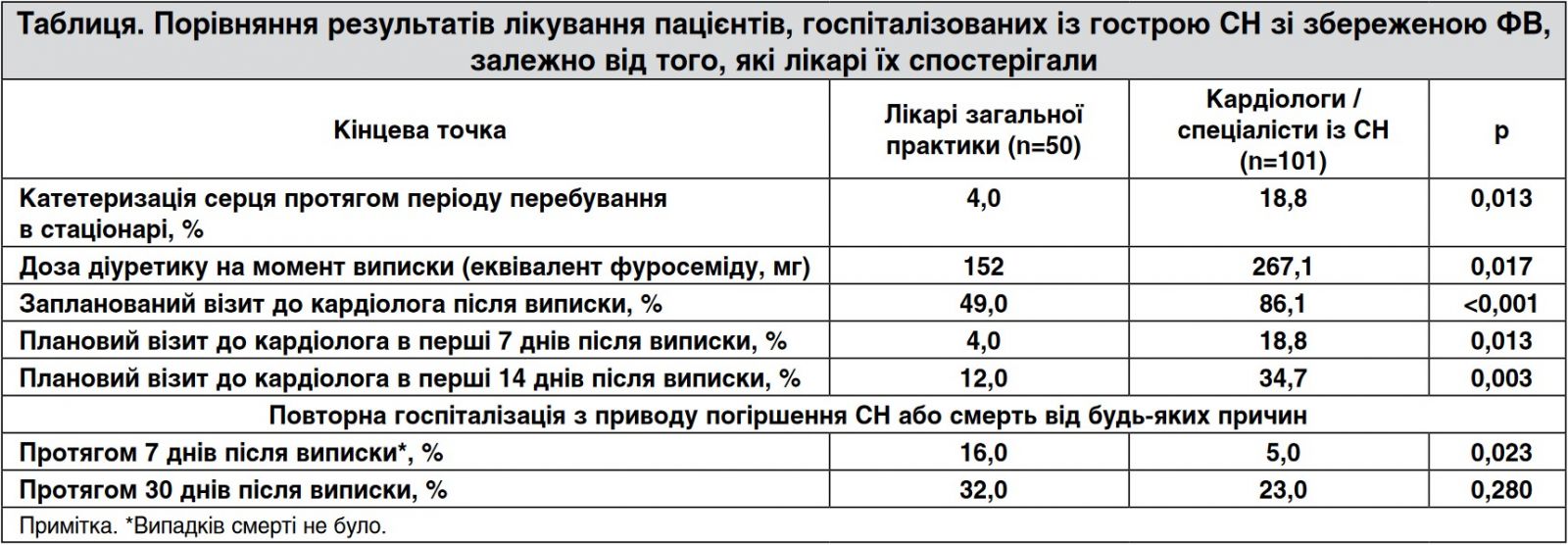
Госпіталізовані хворі на СН зі збереженою ФВ мають кращий прогноз, якщо їх лікує кардіолог або спеціаліст із СН
Доктор Кейтлін Дресчер (США) на конгресі HFSA представила результати ведення пацієнтів (n=151), яких протягом 4 міс госпіталізували у велику академічну клініку Бостона з приводу гострої СН зі збереженою ФВ.
Третина цих пацієнтів (n=50) були доручені лікарям загальної практики, котрі лише у виняткових випадках зверталися по консультацію до кардіолога. Ці пацієнти частіше страждали на некардіальні супутні захворювання, зокрема хронічну обструктивну хворобу легенів і діабет.
З іншого боку, в пацієнтів, яких спостерігали кардіологи чи спеціалісти із СН (n=101), частіше визначали ФП і патологію клапанів. Протягом періоду перебування в стаціонарі та на момент виписки вони отримували значно вищі дози діуретиків. На думку К. Дресчер, інтенсивніше ведення цієї групи хворих забезпечило кращі результати лікування (табл.).
Підводні камені лікування пацієнтів із СН та багатьма супутніми захворюваннями
Безрецептурні ліки є надто слабкими, щоб спричинити будь-яку шкоду, а отже, безпечні. Чи не так?
Ця поширена помилкова думка є великою проблемою в пацієнтів із СН: зазвичай вони мають декілька супутніх захворювань і консультуються різними спеціалістами, кожен з яких «озброєний» власними бланками рецептів і порадами щодо застосування безрецептурних препаратів.
У результаті пацієнти часто отримують від кількох лікарів рекомендації, що конфліктують або прямо суперечать одне одному, та вимушені приймати набір рецептурних і безрецептурних препаратів, які не завжди є сумісними.
Питанням взаємодії між ліками було присвячене спеціальне засідання в рамках конгресу HFSA, на котрому обговорювали стратегії запобігання небажаним взаємодіям та їх наслідкам у пацієнтів із СН, які мають супутні хронічні стани, як-от артрит, діабет або клінічна депресія, чи самостійно застосовують безрецептурні препарати, харчові добавки чи альтернативні методи лікування.
Модератор засідання, доктор Вільям Бейкер (США) наголосив, що ведення супутніх захворювань може бути так само важливим, як і лікування СН, отож потенційні лікарські взаємодії завжди слід брати до уваги.
За спостереженнями доктора Захарії Кокса (США), мотивація до лікування больових хронічних станів є дуже високою, й нестероїдні протизапальні препарати (НПЗП) приймають 83% дорослого населення. Третина пацієнтів переконані, що НПЗП можна безпечно поєднувати з рецептурними препаратами. Лікарі-спеціалісти часто застерігають хворих від прийому НПЗП, але не надають їм кращої альтернативи лікування болю.
Багато пацієнтів із СН також страждають на ІХС. Добре відомо, що НПЗП можуть змінювати антитромбоцитарні ефекти ацетилсаліцилової кислоти (АСК). Більшість НПЗП зв’язуються з циклооксигеназою 1 типу тромбоцитів зворотно, тоді як зв’язок АСК із цим ферментом триває 5-7 днів. Через це НПЗП, зокрема ібупрофен, можуть зменшувати антитромбоцитарну дію АСК, якщо їх приймати до АСК (F. Catella-Lawson et al., 2001). Ібупрофен рекомендовано примати через 30 хв після чи за 8 год до прийому АСК. Однак, якщо ібупрофен приймати постійно, він втручатиметься в дію АСК незалежно від черговості прийому.
Доктор З. Кокс зазначив, що неаспіринові НПЗП у разі хронічного прийому також підвищують рівень АТ і знижують ефективність антигіпертензивних препаратів. У пацієнтів групи ризику, зокрема у хворих із безсимптомною систолічною ДЛШ, НПЗП підвищують імовірність розвитку СН, а в пацієнтів із діагностованою СН асоціюються з її погіршенням.
Окрім того, в пацієнтів із СН НПЗП значущо та дозозалежно підвищують загальну смертність із ВР 1,9 (95% ДІ 1,0-2,8) для ібупрофену та 9,0 (7,4-10,6) для диклофенаку, а також ризик госпіталізації з приводу будь-яких причин – ВР 1,5 (1,2-1,9) та 1,6 (1,2-2,3) відповідно (G.H. Gislason et al., 2009; J. Feenstra et al., 2002).
На думку З. Кокса, альтернативою НПЗП можуть бути парацетамол і топічні НПЗП. Однак ефекти останніх у пацієнтів із СН практично не вивчались, і нижчі системні рівні не обов’язково забезпечуватимуть нижчий ризик кардіоваскулярних подій. Пацієнтам із тяжкою хронічною СН доктор З. Кокс «не соромиться призначати» навіть наркотичні аналгетики коротким курсом, аби уникнути небажаних ефектів НПЗП.
У США налічується близько 55 тис. різних дієтичних добавок, зауважив З. Кокс. Половина дорослого населення країни використовує їх, одночасно приймаючи рецептурні препарати. Імовірність поєднання дієтичних добавок із кардіоваскулярними рецептурними засобами у 2,5 раза вища, ніж із препаратами інших груп.
Опитування показало, що половина споживачів дієтичних добавок не повідомляють про їх використання лікарю, оскільки не вважають це важливим. Першими трьома причинами незгадування про застосування дієтичних добавок під час візиту до лікаря були: «Я передчував, що лікарю це не сподобається», «Я гадав, що це не має значення для мого лікування» та «Ніхто не запитував мене про це».
Навіть якщо не враховувати поєднання дієтичних добавок і препаратів для лікування СН, у США добавки щороку стають причиною 23 тис. госпіталізацій у відділення невідкладної допомоги, найчастіше з приводу кардіоваскулярних симптомів, відзначив З. Кокс. Серед таких випадків 25% пов’язані з добавками для схуднення й 10% – з «енергетичними» продуктами. Багато дієтичних добавок містять інгредієнти, не вказані на упаковці, наприклад анаболічні стероїди чи силденафіл.
Як зазначила доктор Шеріл Чоу (США), інтерес до популярної добавки коензиму Q10 при СН частково пояснюється його біохімічною роллю в мітохондріях, антиоксидантними ефектами та підтриманні цілісності клітинних мембран, а також спостереженнями його знижених рівнів у пацієнтів із СН (S. Sander et al., 2006).
У дослідженні С. Morisco і співавт. (1993) за участю 641 пацієнта із СН III-IV ФК за NYHA додавання коензиму Q10 до стандартної на той час терапії асоціювалося зі зниженням ризику госпіталізацій із приводу погіршення СН (р<0,001).
Пізніше в дослідженні Q-SYMBIO пацієнтів із СН III-IV ФК за NYHA (n=420) рандомізували для прийому дієтичної добавки з коензимом Q10 або плацебо протягом 2 років на додаток до стандартного лікування, що включало інгібітори ангіотензинперетворювального ферменту в 90% хворих і β-блокатори – в 70% (S.A. Mortensen et al., 2014). Ризик первинної кінцевої точки (погіршення СН, кардіоваскулярна смерть, імплантація механічного допоміжного пристрою чи ургентна трансплантація серця) знизився вдвічі в групі добавки (ВР 0,50; 95% ДІ 0,32-0,80; р=0,003), ризик смерті зменшився на 42%. Утім, це дослідження мало суттєві недоліки, зокрема незвично поєднану первинну кінцеву точку, відсутність даних щодо вихідних рівнів коензиму Q10 і неспроможність залучити заплановану кількість хворих (n=550). У будь-якому разі для достатньої статистичної сили в дослідженні мали взяти участь тисячі, якщо не десятки тисяч, пацієнтів, оскільки абсолютна частота клінічних подій була дуже низькою.
Небажані події спостерігалися з однаковою частотою в обох групах, однак, як свідчить клінічний досвід доктора Ш. Чоу, коензим Q10 може знижувати рівень АТ і ослаблювати ефекти варфарину, що потребує частішого контролю міжнародного нормалізованого відношення.
Одними з найпоширеніших у світі рослинних лікарських засобів є препарати та дієтичні добавки з листям, ягодами чи квітами представників роду Crataegus (глід). Ці частини рослини містять низку кардіоактивних глікозидів, дія яких подібна до такої дигоксину. Глід також має вазоактивні властивості завдяки високим концентраціям олігомерних проціанідинів, так само, як чай, какао та червоне вино. Відповідно, він може посилювати ефекти дигоксину та знижувати АТ.
Утім, у дослідженні SPICE, в якому понад 2600 хворих на СН зі зниженою ФВ рандомізували для прийому комерційного екстракту глоду (WS‑1442, Schwabe Pharmaceuticals, Німеччина) на додаток до стандартних ліків, не вдалося продемонструвати значного впливу на первинну кінцеву точку – поєднання випадків раптової смерті, фатального чи нефатального інфаркту міокарда, смерті чи госпіталізації внаслідок прогресування СН після 24 міс терапії (C.J. Holubarsch et al., 2008).
Отож, як зазначила доктор Ш. Чоу, пацієнтів слід інформувати, що глід не є рекомендованим сучасними керівництвами та, ймовірно, не допоможе в лікуванні СН.
Доктор Майкл Моранвіл (США) повідомив, що в пацієнтів із СН клінічна депресія трапляється на 70% частіше, ніж у загальній популяції, асоціюється з триразовим збільшенням ризику госпіталізації та дворазовим підвищенням смертності.
Погіршення прогнозу за наявності депресії може бути зумовлене різними безпосередніми та опосередкованими причинами, як-от підвищена втомлюваність і зменшена увага до себе (пов’язані зі зниженим комплаєнсом), збільшення маси тіла, активація гіпоталамо-гіпофізарно-надниркової осі (підвищення рівня альдостерону), порушення балансу автономної нервової системи (зменшення варіабельності частоти серцевих скорочень і частіші аритмії) тощо.
Досліджень лікування депресії при СН, на жаль, небагато, проте існує велика кількість препаратів, схвалених для лікування депресії взагалі. Керівництва з психіатрії зазначають, що більшість антидепресантів мають приблизно однакову ефективність і не віддають перевагу якомусь конкретному засобу. Тож вибір препарату має ґрунтуватися на побічних ефектах, лікарських взаємодіях і попередньому досвіді антидепресивної терапії.
У деяких дослідженнях за участю пацієнтів із СН антидепресанти покращували ФВ ЛШ, проте в інших навіть погіршували прогноз.
Два визначні дослідження в пацієнтів із клінічною депресією та СН II-IV ФК за NYHA зі зниженою ФВ ЛШ – 12-тижневе SADHART-CHF (n=469) та 2-річне MOOD-HF (n=372) – не виявили шкоди від застосування селективних інгібіторів зворотного захоплення серотоніну (СІЗЗС). З іншого боку, СІЗЗС у цих дослідженнях не чинили будь-якого впливу на тяжкість депресії, частоту госпіталізацій і смертність.
На думку М. Моранвіла, це можна пояснити пильним спостереженням пацієнтів обох груп медсестрами, які пройшли спеціалізоване психіатричне навчання.
Багато препаратів для лікування депресії, зокрема трициклічні антидепресанти (ТЦА), інгібітори зворотного захоплення серотоніну й норадреналіну, а також антагоністи серотоніну та зворотного захоплення, можуть спричиняти ортостатичну гіпотензію. ТЦА та СІЗЗС також можуть подовжувати інтервал QT. Під час лікування СІЗЗС підвищується ризик виникнення кровотеч (серотонін пригнічує агрегацію тромбоцитів), особливо в разі поєднання з антитромбоцитарними препаратами.
Ще недавно кардіологи загалом вважали, що ліки проти діабету є скоріше шкідливими, ніж корисними, через їхні побічні ефекти, які насправді лише імітують симптоми СН, або через підвищення ризику розвитку СН, зазначив доктор Джейкоб Юделл (Канада).
Справді, низка протидіабетичних препаратів сприяє збільшенню маси тіла, що асоціюється з ризиком розвитку СН. Так, метааналіз рандомізованих досліджень засвідчив, що з кожним збільшенням ваги на 1 кг протягом року ризик уперше діагностованої СН зростає на 6% (J.A. Udell et al., 2015).
Сприяти збільшенню маси тіла можуть, зокрема, інсулін, похідні сульфонілсечовини та тіазолідиндіони; призначення цих препаратів, на думку Д. Юделла, хворим на СН необхідно за можливості уникати. Також, імовірно, не слід застосувати (чи принаймні призначати з обережністю) інгібітори дипептидилпептидази‑4, такі як саксагліптин або алогліптин, через потенційне підвищення ризику розвитку СН.
Метформін, один із найстаріших препаратів серед сучасних засобів лікування діабету 2 типу, вважається першою лінією протидіабетичної терапії в пацієнтів із СН. Раніше СН була серед протипоказань до призначення метформіну через ризик лактатацидозу, проте сьогодні доведені його ефективність і безпека в цій популяції хворих. Насправді лікування метформіном може навіть збільшувати виживаність пацієнтів із СН.
Нещодавно були виявлені кардіопротекторні ефекти двох інших класів протидіабетичних препаратів, а саме інгібіторів натрій-глюкозного котранспортера‑2 (SGLT2), таких як канагліфлозин, дапагліфлозин і емпагліфлозин, та агоністів глюкагоноподібного пептиду‑1 (GLP‑1), як-от ліраглутид, семаглутид або ліксизенатид.
Кардіоваскулярні ефекти інгібіторів SGLT2, імовірно, опосередковані натрійурезом. Ці препарати зменшують об’єм плазми (приблизно на 7%), знижують рівень АТ та альбумінурію (на 30-40%). У багатьох хворих на СН завдяки гемодинамічним ефектам інгібіторів SGLT2 можна зменшувати дозування діуретиків.
За матеріалами www.escardio.org, meeting.hfsa.org.
Підготував Олексій Терещенко
Журнал "Серцева недостатність та коморбідні стани" № 3, грудень 2017 р.