13 квітня, 2018
ИАПФ при сердечно-сосудистой патологии: рамиприл как доказательная модель
Роль угнетения активности ангиотензинпревращающего фермента (АПФ) в замедлении прогрессирования состояний, характеризирующих практически все звенья сердечно-сосудистого континуума (ССК), убедительно доказана в многочисленных рандомизированных исследованиях с использованием различных ингибиторов АПФ (ИАПФ).
В то же время на смену представлению об универсальном классовом эффекте ИАПФ по мере накопления данных клинических исследований пришло понимание наличия у разных представителей данного класса клинически значимых различий, обусловленных теми или иными особенностями их фармакологических свойств [1, 2].
В частности, доказаны преимущества рамиприла в лечении артериальной гипертензии (АГ) и регрессе гипертрофии левого желудочка (ЛЖ), хронической почечной дисфункции, постинфарктной дисфункции ЛЖ и хронической сердечной недостаточности (ХСН), а также у пациентов крайне высокого риска сосудистых катастроф, включая хроническую ишемическую болезнь сердца (ИБС) и сахарный диабет (СД).
Фармакологические свойства рамиприла
Фармакологические свойства рамиприла выгодно отличаются от таковых ряда других ИАПФ. Это обусловливает его способность замедлять клиническое прогрессирование разного рода патологических состояний, формирующих различные варианты ССК.
При прохождении через печень рамиприл относительно быстро гидролизируется в активный метаболит – рамиприлат, а также в несколько неактивных метаболитов. По выраженности липофильности, подразумевающей способность препарата растворяться в жирах, рамиприл входит в лидирующую тройку среди всех ИАПФ наряду с периндоприлом и беназеприлом [3]. Благодаря высокой липофильности он легко проникает в ткани и, соответственно, обладает высокой способностью связывать тканевой АПФ (T. Unger et al., 1996). Важность этого обстоятельства трудно переоценить, поскольку известно, что активация именно тканевой ренин-ангиотензиновой системы играет ведущую роль в формировании поражения органов-мишеней (сосуды, миокард, почки) в ходе реализации различных вариантов ССК [1].
Известно, что угнетение АПФ под влиянием его ингибиторов реализуется в два этапа: сперва происходит быстрое связывание активного препарата с вышеуказанным ферментом, после чего данное соединение трансформируется в стабильный изомерный комплекс, скорость диссоциации которого и определяет длительность действия ИАПФ в тканях.
Константа диссоциации изомерного комплекса рамиприлат-АПФ является очень низкой, поскольку период его полураспада составляет 640 мин, в то время как комплекса каптоприл-АПФ и эналаприлат-АПФ – 29 и 105 мин соответственно. Именно поэтому период полувыведения рамиприла в дозах 5-10 мг достигает 17 ч, а 80% рамиприлата сохраняется в организме через 24 ч. Следует отметить, что рамиприл (рамиприлат) характеризуется достаточно быстрым наступлением пика угнетения АПФ (между 1-м и 2-м часом), что сопоставимо с таковым для каптоприла (1 ч) и превосходит данный показатель для эналаприла (3-4 ч).
Рамиприл и его метаболиты имеют сбалансированный (60% – с мочой, 40% – через кишечник) двойной путь выведения. Необходимость в коррекции дозировок препарата в сторону уменьшения возникает при выраженном нарушении функции почек (клиренс креатинина <50 мл/мин) [4].
АГ и регресс гипертрофии ЛЖ
Эффективность и безопасность рамиприла в обычной клинической практике оценивались в крупном постмаркетинговом исследовании CARE (Clinical Altace Real-World Efficacy, 1996). В восьминедельное открытое исследование были включены 11 100 мужчин и женщин в возрасте от 18 до 75 лет с легкой и умеренной АГ. Критериями исключения служили невозможность отмены других антигипертензивных средств, противопоказания к назначению ИАПФ, нестабильные сердечно-сосудистые заболевания или другие медицинские проблемы, не позволявшие принять участие в исследовании, беременность и кормление грудью. Исследование состояло из трех фаз: исходное обследование, титрование дозы (4 нед) и поддерживающая терапия (4 нед). Если больной получал антигипертензивную терапию, то перед назначением рамиприла ее прекращали или постепенно отменяли в соответствии с инструкциями производителя. После исходного визита начинали терапию рамиприлом в дозе 2,5 мг 1 р/сут утром. Во время исследования допускалась сопутствующая терапия, в том числе препаратами, снижающими артериальное давление (АД), например диуретиками при отеках или антагонистами кальция при стенокардии. Если больной до начала исследования получал диуретики, то лечение рамиприлом рекомендовали начинать с дозы 1,25 мг/сут.
При необходимости через 2 и 4 нед стартовую дозу постепенно увеличивали до 10 мг/сут, чтобы добиться снижения диастолического АД в положении сидя ≤90 мм рт. ст. или по крайней мере на 7 мм рт. ст. по сравнению с исходным. Все больные продолжали прием рамиприла в оптимальной или максимальной дозе еще в течение 4 нед (всего 8 нед).
В целом был продемонстрирован отчетливый антигипертензивный эффект суточных доз рамиприла 2,5-10 мг. Снижение систолического АД ≤140 мм рт. ст. или по крайней мере на 20 мм рт. ст. наблюдалось у 70,4% больных с изолированной систолической гипертензией, в том числе у 70,6% женщин, 70,3% мужчин и 69,1% пожилых людей. Снижение диастолического АД ≤90 мм рт. ст. или по крайней мере на 10 мм рт. ст. было достигнуто у 86,0% больных, что соответствует критериям высокой эффективности антигипертензивного лечения, осуществляемого в режиме монотерапии [5].
Следует отметить, что помимо нормализации АД одним из важных критериев эффективности антигипертензивных средств является их способность обусловливать регресс гипертрофии ЛЖ. Ведь наличие и выраженность последней в высокой степени предопределяют риск главных кардиоваскулярных осложнений – смерти от сердечно-сосудистых причин, дестабилизации ИБС / острого инфаркта миокарда (ОИМ), развития СН, мозгового инсульта [6].
В другом исследовании пациенты с АГ, принимавшие в качестве базовой терапии диуретик, были разделены на 3 группы. Первая группа в течение 6 мес принимала рамиприл в дозе 1,25 мг/сут, вторая – рамиприл в дозе 5 мг/сут, третья – плацебо. К концу наблюдения эхокардиографический расчетный показатель массы миокарда (ММ) в группе плацебо возрос в среднем на 9,1 г, в то время как в группах рамиприла 1,25 и 5 мг – уменьшился на 13,0 и 20,0 г соответственно [7]. Отсутствие достоверной разницы в уровнях АД пациентов группы плацебо и тех, кто получал рамиприл в дозе 1,25 мг, показало, что его прием обусловливает регресс гипертрофии ЛЖ независимо от снижения под его влиянием уровня АД. Данный вывод был подтвержден в исследовании RACE (Rate Control Efficacy in Permanent Atrial Fibrillation) с участием 193 пациентов. При одинаковом снижении АД в группах пациентов с АГ, принимавших в течение 6 мес атенолол в дозе 50-100 мг (первая группа) и рамиприл в дозе 2,5-5 мг (вторая группа), индекс ММ снижался достоверно в большей мере в группе лиц, принимавших рамиприл [8]. Таким образом, рамиприл имеет преимущество перед атенололом в уменьшении гипертрофии ЛЖ при одинаковом антигипертензивном эффекте.
Хроническая почечная дисфункция
Несмотря на то что универсальный нефропротекторный эффект ИАПФ был установлен еще в конце 80-х годов прошлого века, наиболее серьезная доказательная база относительно возможности замедления прогрессирования нефропатии различной природы существует именно в отношении рамиприла.
Влияние рамиприла, амлодипина и ретардного метопролола сукцината (CR/XL) на прогрессирование гипертензивной нефропатии у лиц афроамериканской популяции, характеризующейся более ранним частым развитием поражения почек на фоне АГ, сравнивали в крупном многоцентровом исследовании ААSK (African American Study of Kidney disease and hypertension) с участием 1094 пациентов. В исследование были включены пациенты со значениями скорости клубочковой фильтрации (СКФ) 20-65 мл/мин/1,73 м2. Суточные дозы препаратов в соответствующих рандомизированных группах составляли: рамиприл – 2,5-10 мг (436 больных), амлодипин – 5-10 мг (217 больных), метопролол CR/XL – 50-200 мг (441 пациент). В качестве комбинированной клинической конечной точки рассматривали снижение СКФ менее чем на 50% или на >25 мл/мин/1,73 м2 от исходного уровня, либо развитие терминальной почечной недостаточности, либо смерть пациента. Максимальная продолжительность наблюдения составила 6,4 года. Рамиприл в сравнении с метопрололом CR/XL показал снижение риска на 22% (р=0,04), а в сравнении с амлодипином – на 38% (р=0,04) [9].
Исследование ААSK наглядно продемонстрировало преимущество длительного ингибирования АПФ с помощью рамиприла у пациентов с гипертензивной нефропатией по сравнению с длительным применением как селективного β-адреноблокатора, так и антагониста кальция дигидропиридинового ряда.
В свою очередь, результаты исследования REIN (Ramipril Efficacy In Nephropathy) свидетельствуют о том, что у пациентов, страдающих хронической нефропатией с протеинурией, применение рамиприла достоверно снижает риск конечной стадии почечной недостаточности. Так, 352 пациента с недиабетической нефропатией были разделены на 2 группы: с протеинурией в пределах 1-2,9 г/сут (186 больных) и >3 г/сут (166 больных). В свою очередь, каждая из групп была разделена на лиц, принимавших рамиприл в диапазоне доз 1,25-5 мг/сут (с учетом необходимости достижения целевого диастолического АД <90 мм рт. ст.) и плацебо. Помимо рамиприла и плацебо разрешался прием других антигипертензивных препаратов (кроме ИАПФ и антагонистов рецепторов ангиотензина II). Следует отметить, что в течение всего срока наблюдения (в среднем 31 мес – для первой группы и около 24 мес – для лиц с тяжелой протеинурией) АД контролировалось на одинаковом уровне у пациентов, принимавших рамиприл и плацебо. Основными исследуемыми конечными точками являлись скорость прогрессирования снижения СКФ и время до возникновения терминальной (то есть требующей диализа или трансплантации почки) хронической почечной недостаточности (ХПН). Среди пациентов с тяжелой протеинурией скорость прогрессирования снижения СКФ была достоверно ниже у принимавших рамиприл по сравнению с теми, кто получал плацебо (0,53 против 0,88 мл/мин/мес соответственно; р=0,03). На фоне приема рамиприла вдвое по сравнению с плацебо снижался комбинированный показатель «достижение терминальной ХПН или удвоение уровня креатинина плазмы». Уровень протеинурии достоверно (р<0,001) снижался уже через 1 мес приема рамиприла и далее поддерживался на достигнутом уровне в течение всего периода наблюдения, что не наблюдалось в группе плацебо [10]. Вышеуказанные результаты обусловили перевод (через 2 года по этическим соображениям) пациентов с тяжелой протеинурией, принимавших плацебо, на открытый прием рамиприла. В дальнейшем в ходе трехлетнего наблюдения у 30% этих пациентов развилась терминальная стадия ХПН, чего ни в одном случае не наблюдалось среди лиц, принимавших рамиприл с самого начала исследования [11]. У пациентов первой группы (протеинурия – 1-2,9 г/сут) длительный прием рамиприла ассоциировался со снижением в 2,7 раза риска развития конечной стации ХСН и в 2,4 раза – тяжелой протеинурии в сравнении с группой плацебо [12].
Антипротеинурическая эффективность рамиприла была оценена в перекрестном исследовании у 20 пациентов с почечной недостаточностью, протеинурией и АГ (протеинурия <3 г/сут, 150/90 мм рт. ст.). Протеинурию измеряли в течение 24 ч при трех последовательных сборах мочи (утром, днем и ночью) в отсутствие антипротеинурических препаратов и после 10 дней лечения однократным утренним приемом рамиприла в дозе 2,5 или 10 мг. Было показано, что увеличение и/или разделение дозы рамиприла позволяет стабилизировать и максимизировать его антипротеинурическую активность [13].
Постинфарктная дисфункция ЛЖ и ХСН
В исследовании AIRE (Acute Infarction Ramipril Efficacy) проверялась гипотеза о том, что лечение рамиприлом может привести к увеличению выживаемости пациентов с ОИМ, осложненным развитием СН [14].
В 144 центрах 14 стран проводилось многоцентровое международное двойное слепое рандомизированное плацебо-контролируемое исследование. Были включены 2006 больных с ОИМ и клиническими признаками СН. На 3-10-й день ИМ их рандомизировали на 2 группы и назначали плацебо (990 больных) или рамиприл (1014 больных). Из исследования исключали пациентов с тяжелой СН, рефрактерной к обычной терапии, нуждавшихся в назначении ИАПФ. Больные наблюдались в течение по крайней мере 6 мес (в среднем 15 мес).
В выборке intention-to-treat общая смертность среди участников, получавших рамиприл (170 случаев смерти от любых причин; 17%), была значительно ниже, чем у больных группы плацебо (220 случаев; 23%). Относительный риск смерти снизился на 27% (р=0,002). При анализе вторичных конечных точек, предусмотренных в протоколе, было выявлено значительное снижение риска смерти, тяжелой/рефрактерной СН, повторного ИМ или инсульта на 19% (р=0,008).
Пероральное применение рамиприла у больных с клиническими признаками преходящей или сохраняющейся СН на 2-9-й день развития ОИМ способствовало значительному снижению общей смертности. Этот эффект проявлялся уже через 30 дней и был сопоставим в различных подгруппах больных (AIRE Study Investigators, 1993).
У 603 пациентов, проживавших в Великобритании и наблюдавшихся в 30 клинических центрах в рамках упомянутого исследования AIRE, соответствующее наблюдение было продолжено до 5 лет (исследование AIREX). К концу этого срока отмечено снижение смертности (на 36%) в группе лиц, принимавших рамиприл, в сравнении с группой плацебо, что позволило продемонстрировать стабильность долгосрочного прогнозмодулирующего действия данного препарата [14].
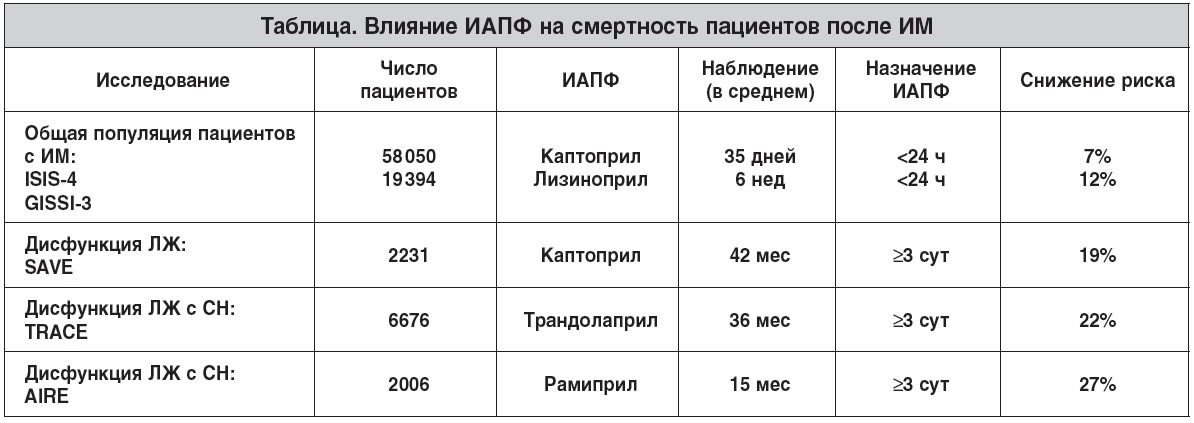
Анализ выживаемости 7512 пациентов после ОИМ в течение 12 мес на фоне применения различных ИАПФ продемонстрировал лучшие результаты для рамиприла (табл.) [15].
Согласно данным «срезового» исследования назначаемости ИАПФ при ХСН в Европе, при «систолической» ХСН (фракция выброса (ФВ) ЛЖ ≤45%; n=4792) рамиприл является наиболее назначаемым препаратом (46%) (эналаприл – 27%, периндоприл – 13%, другие – 14%). В свою очередь, рамиприл лидирует и при ХСН с сохраненной ФВ ЛЖ (>45%; n=1499). Его назначают в 38% случаев (эналаприл – 28%, периндоприл – 22%, другие – 12%) [16].
Пациенты очень высокого риска сосудистых катастроф, включая хроническую ИБС и СД
В широкомасштабном многоцентровом исследовании НОРЕ (Heart Outcomes Prevention Evaluation) было продемонстрировано выраженное редуцирующее влияние рамиприла на риск развития кардиоваскулярных катастроф у пациентов с ИБС. В этом исследовании впервые была установлена способность ИАПФ предупреждать важнейшие сердечно-сосудистые осложнения у пациентов с высоким риском, еще не имеющих систолической дисфункции ЛЖ и признаков СН. С учетом данных исследования НОРЕ рамиприл до настоящего времени остается эталонным средством для достижения данной цели в классе ИАПФ [17].
9297 мужчин и женщин были рандомизированы в группу рамиприла 10 мг/сут (n=4645) и группу плацебо (n=4652). Кроме того, в рамках исследования оценивалась эффективность витамина Е в предупреждении кардиоваскулярных осложнений, в связи с чем пациенты получали соответствующий активный препарат или плацебо.
Критериями включения в исследование было наличие ИБС, нарушений мозгового кровообращения в анамнезе, заболевание периферических артерий, а также СД в сочетании с любым другим фактором риска (АГ, дислипидемией, курением, микроальбуминурией) у пациентов в возрасте 55 лет и старше [18]. ИМ ранее перенесли 53% испытуемых, реваскуляризацию ЛЖ – 44%, гиперхолестеринемия и/или повышение холестерина липопротеинов высокой плотности наблюдались у 84%, АГ – у 47%, СД – у 38% пациентов.
Первоначально планируемый срок наблюдения составлял 5 лет, однако ввиду явного терапевтического преимущества рамиприла перед плацебо исследование по этическим соображениям было прекращено на 6 мес раньше.
К моменту завершения наблюдения, продолжавшегося 4,5 года, в группе рамиприла наблюдалось высокодостоверное (р<0,001) снижение (на 22% по сравнению с плацебо) числа пациентов, достигших первостепенной конечной точки – комбинированного показателя «ИМ, либо инсульт, либо кардиоваскулярная смерть». На основании анализа, проведенного в различных клинических подгруппах пациентов, установлено, что указанный превентивный эффект рамиприла в отношении сердечно-сосудистых катастроф не зависел от возраста и пола, а также от наличия ИБС, АГ, перенесенного ИМ, цереброваскулярной болезни, болезни периферических артерий, микроальбуминурии. При анализе отдельных, так называемых второстепенных, конечных точек выяснилось, что рамиприл достоверно снижал риск смерти от сердечно-сосудистых причин на 26%, ИМ – на 20%, инсульта – на 22%, СН – на 22%, остановки сердца – на 38%, реваскуляризации – на 15%, возникновения новых случаев СД – на 34%. В отличие от рамиприла прием витамина Е не оказывал статистически достоверного влияния на риск кардиоваскулярных событий [17].
Углубленный анализ данных исследования НОРЕ показал, что превентивный эффект рамиприла не мог быть обусловлен лишь снижением под его влиянием уровня АД. В частности, согласно данным Всемирной организации здравоохранения и Международного общества гипертензии, снижение уровня систолического АД на 10-15 мм рт. ст. в течение 4-5 лет позволяет снизить риск развития ИМ на 15%, инсульта – примерно на 40% [19]. Снижение систолического АД на фоне приема рамиприла составило в среднем 3,3 мм рт. ст., чему должно было бы соответствовать уменьшение риска ИМ на 5,5% и инсульта – на 13%. Между тем реально достигнутое снижение риска вышеуказанных осложнений составило в НОРЕ 20 и 32% соответственно и оказалось сопоставимым в группах с различным исходным уровнем систолического и диастолического АД. Полученные результаты позволили сделать вывод о том, что профилактический эффект рамиприла в отношении развития сердечно-сосудистых катастроф прежде всего обусловлен так называемыми негемодинамическими механизмами действия. В качестве таковых обсуждаются свойственные рамиприлу фибринолитическое действие [20], улучшение эндотелиальной функции [21], сопряженное с последним вазопротекторное (антиатерогенное) действие препарата. В частности, наличие вазопротекторного действия рамиприла было продемонстрировано в субисследовании SECURE с участием 732 пациентов НОРЕ, у которых с помощью ультразвукового метода изучали динамику толщины комплекса интима-медиа сонных артерий на фоне терапии рамиприлом (2,5 и 10 мг/сут), витамином Е (400 ЕД) и плацебо. У пациентов в группе рамиприла, в отличие от других групп, было отмечено дозозависимое (особенно выраженное при дозе препарата 10 мг/сут) замедление прогрессирования каротидного атеросклероза, состоявшее в снижении на 37% скорости утолщения комплекса интима-медиа за период четырехлетнего наблюдения (р=0,028) в сравнении с группой плацебо [22].
Следует сказать и о результатах исследования MICRO-HOPE, продемонстрировавших снижение случаев ХПН и микрососудистых осложнений СД. В данное исследование были включены 3577 пациентов с СД в возрасте от 55 лет и старше, у которых оценивалось влияние рамиприла на частоту возникновения макро- и микроваскулярных осложнений. Первая группа (n=1804) в дополнение к стандартной терапии принимала рамиприл в дозе 10 мг/сут, вторая группа (n=1789) получала плацебо. В течение 4 лет наблюдения в группе рамиприла отмечалась достоверно более низкая по сравнению с плацебо частота развития ХПН (на 24%; р=0,027). Комбинированной конечной точки (ХПН, либо диализ, либо потребовавшая лазерной терапии ретинопатия) в группе рамиприла достигли на 16% меньше пациентов [17].
Влияние на клинический прогноз после реваскуляризации миокарда
В исследовании APRES (Angiotensin-converting Enzyme Inhibition Post Revascularization) оценивалась эффективность профилактических средств для предупреждения сердечно-сосудистых осложнений у пациентов, подвергшихся реваскуляризации ЛЖ.
В рамках данного исследования изучалось влияние рамиприла на показатели клинического прогноза пациентов со стабильной стенокардией и умеренной (ФВ в диапазоне 30-50%) систолической дисфункцией ЛЖ без симптомов СН, подвергнутых чрескожному реваскуляризационному вмешательству или аортокоронарному шунтированию. Пациенты, получавшие клинически оптимизированное (кроме ИАПФ) лечение, были рандомизированы на 2 группы. Участники первой группы в течение первых нескольких суток получали рамиприл в дозах 2,5-5 мг, через 1 мес – до 10 мг. Участники второй группы получали плацебо. В обеих группах не было отличий по всем основным клиническим и гемодинамическим показателям, структуре базисной фармакотерапии, а также по проценту пациентов с полной реваскуляризацией (85 и 86% в группах рамиприла и плацебо соответственно). К концу периода наблюдения (33 мес) в группе рамиприла по сравнению с группой плацебо наблюдалось достоверное снижение комбинированного показателя «смерть от сердечно-сосудистых причин, либо нефатальный ИМ, либо появление клинических признаков СН» – на 58% (р=0,031). Такой результат был достигнут преимущественно за счет снижения под влиянием рамиприла частоты смертельных исходов вследствие кардиоваскулярных причин – на 88% (р=0,032). Данные исследования APRES показали, что применение рамиприла в суточной дозе 10 мг является клинически полезным и, следовательно, целесообразным у пациентов с умеренно выраженной дисфункцией ЛЖ даже в случае успешно выполненной его реваскуляризации [23].
Таким образом, для практического врача немаловажным представляется знание того факта, что в настоящее время существует мощный и продолжительно действующий ИАПФ с убедительными доказательствами прогноз-улучшающей эффективности практически на всех этапах ССК в его различных вариантах.
Литература
1. Kwakernaak A. J., Roksnoer L. C., Lambers Heerspink H. J. Effects of Direct Renin Blockade on Renal & Systemic Hemodynamics and on RAAS Activity, in Weight Excess and Hypertension: A Randomized Clinical Trial // PLoS One. – 2017. – Vol. 12, № 1: e0169258.
2. Simonyi G., Ferenci T. One year adherence of ramipril versus ramipril/amlodipine fixed dose combination therapy in hypertension // Orv Hetil. – 2017. – Vol. 158, № 42. – Р. 1669-1673.
3. Brown N., Vaughan D. Angiotensin-converting enzyme inhibitors //Circulation. – 1998. – Vol. 97. – P. 1411-1420.
4. Bunning P. Kinetic properties of the angiotensin converting enzyme inhibitor ramiprilat // J. Cardiovasc. Pharmacol. – 1987. – Vol. 10 (Suppl. 7). – P. S31-S35.
5. Kaplan N. M. The CARE study: a postmarketing evaluation of ramipril in 11 100 patients // Clin. Therap. – 1996. – Vol. 18. – P. 658-670.
6. Levy D., Garrison R. J., Savage D. et al. Prognostic implications of echocardiographically determined left ventricular mass in the Framingham Heart Study // N. Engl. Med. – 1990. – Vol. 322. – P. 1561-1566.
7. Lievre M., Gueret P., Gayet C. et al. Ramipril-induced regression of left ventricular hypertrophy in treated hypertensive individuals // Hypertension. – 1995. – Vol. 25. – P. 92-97.
8. Agabiti-Rosei E., Ambrasioni E., Dal-Palu C. et al. ACE inhibitor ramipril is more effective than the beta-blocker atenolol in reducing left ventricular mass in hypertension. Results of RACE study // Hypertension. – 1995. – Vol. 13. – P. 1325-1334.
9. Wright J. T. Jr., Bakris G. L., Greene T. et al. Effect of blood pressure lowering and antihypertensive drug class on progression of hypertensive kidney disease // JAMA. – 2002. – Vol. 288. – P. 2421-2431.
10. The GISEN Group (Cruppo Italiano di Studi Epidemiologici in Nefrologia). Randomised placebo-controlled trial of effect of ramipril on decline in glomerular filtration rate and risk of terminal failure in proteinuric, non-diabetic nephropathy // Lanzet. – 1997. – Vol. 349. – P. 1857-1863.
11. Ruggenenti P., Perna A., Gherardi G. et al. Renal function and requirement for dialysis in chronic nephropathy patients on long-term ramipril: REIN follow-up trial. Gruppo Italiano di Studi Epidemiologici in Nefrologia (GISEN). Ramipril Efficacy in Nefropathy // Lanzet. – 1998. – Vol. 352. – P. 1252-1256.
12. Ruggenenti P., Perna A., Gherardi G. et al. Renoprotective properties of ACE-inhibition in non-diabetic nephropathies with non-nephrotic proteinuria // Lanzet. – 1999. – Vol. 354. – P. 359-364.
13. Simeoni M., Cianfrone P., Comi N., Gentile I., Fabiano F.F. Is it feasible to improve the duration and the efficiency of Ramipril anti-proteinuric response? // G. Ital. Nefrol. – 2015. – Jan-Feb; 32 (1).
14. Hall A. S., Murray G. D., Ball S. G. on behalf of the AIREX Study Investigators. Follow-up study of patients randomly allocated ramipril or placebo for heart failure after acute myocardial infarction: AIRE Extension (AIREX) Study // Lanzet. – 1997. – Vol. 349. – P. 1493-1497.
15. Pilote L., Abrahamowicz M., Rodrigues E., Eisenberg M.J., Rahme E. Mortality rates in elderly patients who take different angiotensin-converting enzyme inhibitors after acute myocardial infarction: a class effect? // Ann Intern Med. – 2004. – Vol. 141, № 2. – Р. 102-112.
16. Maggioni A. P., Anker S. D., Dahlstrоm U., Filippatos G. Are hospitalized or ambulatory patients with heart failure treated in accordance with European Society of Cardiology guidelines? Evidence from 12 440 patients of the ESC Heart Failure Long-Term Registry. Eur. J. Heart Fail. – 2013. – Vol. 15., № 10. – Р. 1173-1184.
17. The HOPE Study Investigators. Effects of an angiotensin-converting enzyme inhibitor, ramipril, on cardiovascular events in high-risk patients // N. Engl. J. Med. –2000. – Vol. 342. – P. 145-153.
18. Lonn E. M., Yusuf S. Effects of Ramipril and Vitamin E on Atherosclerosis The Study to Evaluate Carotid Ultrasound Changes in Patients Treated With Ramipril and Vitamin E (SECURE) // Circulation February 20, 2001. –
P. 919-925.
19. Chalmers J., Mac Mahon S., Mancia G. et al. WHO-ISH hypertension guidelines committee. 1999 World Health Organisation – International Society of Hypertension guidelines for the management of hypertension // Clin. Exp. Hypertens. – 1999. – Vol. 21. – P. 1009-1060.
20. Minai K., Matsumoto T., Horie H. et al. Bradykinin stimulates the release of tissue plasminogen activator in human coronary circulation: effects of angiotensin-converting enverting enzyme inhibitors // J. Am. Coll Cardiol. – 2001. – Vol. 37. – P. 1565-70.
21. Fang L., Sheng F., Qingyin T. et al. Effect of ramipril on endothelial dysfunction in patients with essential hypertension // Clin. Drug. Invest. – 2002. – Vol. 22. – P. 449-453.
22. Lonn E. M., Yusuf S., Dzavik V. et al. Effect of ramipril and vitamin E on atherosclerosis: the study to evaluate carotid ultrasound changes in patients treated with ramipril and vitamin E (SECURE) // Circulation. – 2001. – Vol. 103. – P. 919-925.
23. Kjoller-Hansen L., Steffensen R., Grande P. The angiotensin-converting enzyme inhibition post revascularization study (APRES) // J. Amer. Coll. Cardiol. – 2000. – Vol. 35. – P. 881-888.
Журнал "Серцева недостатність та коморбідні стани" № 1, квітень 2018 р.