13 квітня, 2018
Современное состояние проблемы миокардитов
О трудностях диагностики и лечения миокардита писал еще в 1749 г. выдающийся французский врач, один из пионеров кардиологии Жан-Батист Сенак в одном из первых трактатов по анатомии, физиологии и болезням сердца «Traite de la structure du coeur, de son action et de ses maladies». Несмотря на все возрастающие возможности диагностических методов и современный арсенал средств терапии, ведение пациентов с подозрением на миокардит и в наше время остается проблемной страницей кардиологии. В связи с многочисленностью инициирующих факторов и патогенетических механизмов миокардит следует рассматривать скорее как группу заболеваний, чем отдельную нозологию. В рутинной практике миокардиты встречаются как совершенно разные по этиологии, патогенезу и вариантам течения заболевания, объединенные наличием воспалительного процесса в сердечной мышце, который не всегда коррелирует с тяжестью состояния пациента. Золотой стандарт диагностики – эндомиокардиальная биопсия (ЭМБ) применяется редко. В связи с этим трудно оценить эпидемиологию миокардита. В сериях наблюдений диагноз миокардита подтверждался после ЭМБ у 9-16% пациентов с необъяснимой неишемической дилатационной кардиомиопатией (ДКМП) [1, 2]. У пациентов с мягкими симптомами и минимальной дисфункцией левого желудочка (ЛЖ) миокардит часто разрешается спонтанно и не требует специфического лечения. Вместе с тем примерно в 30% случаев миокардит прогрессирует до ДКМП с неблагоприятным прогнозом [3, 4].
Четких рекомендаций по ведению таких больных не разработано. Современные представления об этиологии, диагностике и лечении миокардитов изложены рабочей группой Европейского общества кардиологов (ЕОК) по заболеваниям миокарда и перикарда в форме обзора [5], но не имеют статуса рекомендаций. Существует проект национальных рекомендаций, подготовленный рабочей группой по заболеваниям миокарда, перикарда, эндокарда и клапанов сердца Ассоциации кардиологов Украины [6], но он так и не принят официально.
Классификации миокардитов
Европейские эксперты классифицируют миокардиты на три большие группы по этиологии:
- инфекционные: бактериальный, вирусный, грибковый, паразитарный, вызванный спирохетами и др.;
- иммуноопосредованные: аллергический, аллоантигенный (отторжение трансплантированного сердца), аутоиммунный;
- токсические: медикаментозный, вызванный тяжелыми металлами, укусами насекомых и змей, радиационный.
Также предложена гистологическая классификация миокардитов в зависимости от превалирующего типа клеток:
– лимфоцитарный (вирусный или аутоиммунный);
– нейтрофильный (бактериальный, грибковый, ранние формы вирусного);
– эозинофильный (гиперчувствительность, гиперэозинофильный синдром);
– гранулематозный (кардиальный саркоидоз, гигантоклеточный миокардит).
На XVI Национальном конгрессе кардиологов Украины в 2015 г. была принята классификация миокардитов, в основу которой положена терминология, которая соответствует Международной классификации болезней 10-го пересмотра, с дополнениями для клинического применения:
I. Варианты течения:
- острый (до 3 мес от начала заболевания) – I.40;
- подострый (3-6 мес от начала заболевания) – I.40.10;
- хронический (более 6 мес от начала заболевания) – I.51.4;
- миокардиофиброз – I.51.4.
II. Этиология:
- с установленной этиологией – I.40, I.41 (инфекционный – I.40, бактериальный – I.41.0, вирусный – I.41.1, паразитарный – I.41.2, при других заболеваниях – I.41.8);
- неуточненный – I.40.9.
III. Распространенность:
- изолированный – I.40.1;
- диффузный – I.40.8.
IV. Характер течения:
- легкое;
- средней тяжести;
- тяжелое.
V. Осложнения:
- миоперикардит;
- перимиокардит;
- нарушения сердечного ритма и проводимости, тромбоэмболии и др.
VI. Сердечная недостаточность (СН) 0-III стадии, I-IV функциональный класс (ФК) по NYHA:
- со сниженной фракцией выброса (ФВ) ЛЖ;
- с сохраненной ФВ ЛЖ.
Данная классификация не лишена недостатков. Трудности начинаются с определения варианта течения, который привязан к началу заболевания. На практике редко удается установить этот момент. Например, не всегда правильно считать началом миокардита перенесенную острую вирусную инфекцию, так как трудно оценить ее вклад в развитие заболевания: была ли она единственной причиной или последней каплей в процессе ремоделирования миокарда, вызванного другой патологией.
Вопреки существующим представлениям распространенность миокардита не определяет тяжесть заболевания и его прогноз. Очаговый миокардит воспринимается как вариант заболевания с бессимптомным или легким течением без нарушений гемодинамики, который не требует лечения и завершается спонтанным выздоровлением, а диффузный миокардит считается тяжелым, вызывающим симптомы хронической СН (ХСН) и требующим длительного лечения. На самом деле такое представление является серьезной ошибкой. По данным исследований с проведением магнитно-резонансной томографии (МРТ) и радиоизотопной визуализации, распространенность воспалительного процесса в миокарде отражает скорее длительность заболевания, а не его тяжесть. Распространенное накопление меченных аутолейкоцитов (то есть диффузный миокардит) отмечается в дебюте заболевания, а единичные очаги (то есть очаговый миокардит) – при длительно протекающем процессе (более 30 мес) (М.В. Дерюгин, С.А. Бойцов, 2005). При этом диффузный миокардит клинически может протекать намного легче, чем очаговый.
Современные критерии диагностики миокардита
Еще в 1973 г. выдающийся советский кардиолог, профессор А.В. Виноградов так охарактеризовал проблему гипердиагностики миокардитов: «Врачи склонны трактовать боли в грудной клетке, одышку и т.п. как миокардит, считая его логическим следствием любого простудного заболевания». В наше время диагностические возможности несоизмеримо выше, но главный вопрос остается актуальным: на основании чего ставить диагноз миокардита?
Рабочая группа ЕОК по заболеваниям миокарда и перикарда предлагает следующую последовательность обследования пациента:
1. Клиническое обследование (анализ жалоб, сбор анамнеза, осмотр).
2. Электрокардиография (ЭКГ).
3. Лабораторные анализы.
4. Эхокардиография (ЭхоКГ).
5. МРТ сердца.
6. Коронаровентрикулография (КВГ) с ЭМБ; исследование биоптатов иммуногистохимическими методами, полимеразная цепная реакция (ПЦР).
Методы диагностики перечислены по возрастанию их стоимости, и это отражает рациональный европейский подход. С одной стороны, миокардит – воспалительное заболевание миокарда, достоверный диагноз которого может быть установлен только по гистологическим, иммунологическим и иммуногистохимическим критериям. Самым надежным методом подтверждения наличия воспаления и его характера является ЭМБ с исследованием биоптатов, которая настоятельно рекомендуется рабочей группой ЕОК в качестве золотого стандарта диагностики миокардита. МРТ сердца с гадолиниевым контрастом – чувствительный метод определения наличия воспалительной инфильтрации в миокарде (гадолиний накапливается в очагах). Кроме того, МРТ позволяет оценить распространенность (очаговый или диффузный), а также давность процесса (хронический или острый) по наличию фиброзных элементов.
С другой стороны, на практике эти методы не применяются сразу у всех пациентов в связи с высокой стоимостью и ограниченной доступностью. Более доступный метод ЭхоКГ позволяет оценить выраженность дисфункции сердца и потребность в терапии СН. Кроме того, ЭхоКГ позволяет исключить невоспалительные заболевания сердца, например патологию клапанов, а также помогает мониторировать изменения объемов камер сердца, толщины стенок, функцию ЛЖ на фоне проводимого лечения. И только если пациент не отвечает на стандартное лечение СН, он переводится в специализированную клинику, где есть возможность проведения ЭМБ.
На ЭКГ при миокардите обнаруживаются различные нарушения, хотя ни один из признаков не является ни специфичным, ни достаточно чувствительным. Обычно наблюдается элевация или депрессия сегмента ST с инверсией зубца Т. Атриовентрикулярная блокада в присутствии дилатации ЛЖ может быть вызвана рядом причин – болезнью Лайма, кардиальным саркоидозом, гигантоклеточным миокардитом.
Традиционные лабораторные маркеры воспаления, такие как скорость оседания эритроцитов (СОЭ) и уровень С-реактивного белка (СРБ), могут служить дополнительным подтверждением воспалительной природы заболевания в совокупности с оценкой клинической картины и результатами других методов диагностики. СОЭ и уровень СРБ всегда повышаются при миокардитах, но по отдельности не являются основанием для постановки диагноза. Кардиоспецифические маркеры обычно повышаются при остром миокардите, инфарктоподобном течении. Кардиальный тропонин имеет более высокую чувствительность при поражении миокарда, чем креатинфосфокиназа, но также не является специфичным маркером. Его нормальный уровень не исключает диагноз миокардита.
Традиционные серологические исследования не информативны в диагностике миокардитов. Например, антитела к вирусу герпеса сохраняются пожизненно после единичного эпизода инфекции, поэтому не могут подтвердить или исключить этиологическую роль этого вируса. Кроме того, известен факт выработки перекрестного иммунитета к другим вирусам. Определенная информация может быть получена только при обследовании пациентов с гепатитом С, риккетсиозом, болезнью Лайма (в эндемических очагах), ВИЧ.
Клинические проявления миокардита очень разнообразны – от субклинического течения, часто описываемого как «нейроциркуляторная дистония», до молниеносной острой СН. Миокардит может вызывать опасные для жизни состояния, такие как аритмии и внезапная кардиальная смерть, кардиогенный шок, критическое снижение систолической функции ЛЖ.
Наибольшие трудности вызывает инфарктоподобный миокардит, клиника которого очень напоминает острый коронарный синдром (ОКС). Такой вариант вызван поражением эндотелия коронарных сосудов, обычно вирусами. Доказана этиологическая роль парвовирусов, вируса простого герпеса 6 типа, риккетсий. При артериитах, вызванных парвовирусом В19, происходит активация тромбоцитов и возможен тромбоз коронарных артерий. Миокардиальное воспаление может приводить к формированию тромбов в ЛЖ и эмболизации коронарных артерий. Вазоактивные кинины или катехоламины, которые вырабатываются в острой фазе воспаления, могут приводить к спазму коронарных артерий.
В случаях острой загрудинной боли с изменениями сегмента ST на ЭКГ и повышением кардиоспецифических биомаркеров пациента необходимо обследовать и вести в соответствии с протоколом по ОКС. Коронарография исключает необходимость ургентного коронарного вмешательства. При интактных коронарных сосудах или если степень стеноза не соответствует остроте клинических проявлений, следует продолжить диагностический поиск с прицелом на подтверждение миокардита. Если есть возможность, не стоит откладывать МРТ-исследование. МРТ позволяет отличить ишемические или постишемические изменения от воспалительных по их локализации, в том числе по расположению очагов фиброза. При воспалительных заболеваниях распространение фиброза происходит из эпикарда в миокард, а при ишемическом это субэндокардиально-миокардиальное поражение. При ишемической болезни сердца очаги фиброза или других изменений всегда ориентированы по ходу сосудов.
Таким образом, МРТ позволяет подтвердить диагноз миокардита у пациентов с инфарктоподобным течением (симптоматикой ОКС) и, наоборот, может исключить этот диагноз и обнаружить коронарогенные причины ремоделирования сердца, которые могли быть упущены на предыдущих этапах диагностики. Вместе с тем следует помнить, что МРТ не является золотым стандартом диагностики миокардита. Результаты необходимо интерпретировать в контексте клинических проявлений, сроков заболевания.
Миокардит следует заподозрить в случаях остро декомпенсированной СН или ХСН без другой объяснимой причины. Вместе с тем у пациентов с ХСН и кардиомегалией диагноз миокардита следует иметь в виду на последнем месте. Независимо от возраста и наличия или отсутствия проявлений стенокардии больные с кардиомегалией и особенно с графикой блокады левой ножки пучка Гиса на ЭКГ должны проходить КВГ и МРТ. КВГ в большинстве случаев обнаруживает причину в коронарных артериях. Известны случаи, когда после 6 лет лечения пациента с диагнозом ДКМП и низкой ФВ ЛЖ на коронарографии выявлялись критические стенозы коронарных артерий. Если ишемическая природа ДКМП подтверждена, МРТ можно отложить, но если состояние пациента не улучшается на фоне стандартного лечения СН, следует рассмотреть возможность проведения МРТ с гадолинием.
Следует отметить существенные гендерные различия клиники и течения миокардитов. Чаще болеют мужчины в возрасте от 20 до 51 года [4]. Различия иммунного ответа определяются влиянием и выработкой половых гормонов. Эстрогены и андрогены напрямую влияют на иммунный ответ в результате взаимодействия с гормональными рецепторами, которые выявлены на иммунокомпетентных клетках, кардиомиоцитах, эндотелиальных клетках. Возраст клинической манифестации миокардита у мужчин обычно моложе, чем у женщин. У мужчин миокардит характеризуется острым воспалением (участвуют макрофаги, нейтрофилы, Т-клетки), позже начинается выработка антител. Для женщин более характерно хроническое воспаление (первичная антителоиндуцированная патология) с иммунным ответом Th1-типа и ранним развитием фиброза.
Лечение и прогноз
Острые миокардиты завершаются выздоровлением в половине случаев в течение 1-4 нед, однако примерно у 25% пациентов развивается постоянная кардиальная дисфункция, а у 12-20% может наступить острая декомпенсация, смерть или прогрессирование до конечной стадии ДКМП, требующей пересадки сердца [7-9]. Единого стандарта лечения не существует, терапия зависит от клинической презентации, течения и осложнений заболевания. Поскольку крупные рандомизированные клинические исследования не проводились, рекомендации по лечению основываются на консенсусе экспертов [5]. Ключевые принципы – это лечение СН и возникающих на этом фоне аритмий. В отдельных случаях обоснована этиотропная и иммуномодулирующая терапия миокардитов.
Европейские эксперты делят пациентов с миокардитами на две группы: гемодинамически стабильных и нестабильных. Гемодинамически нестабильных пациентов следует вести в соответствии с рекомендациями по лечению СН, в отделении интенсивной терапии с возможностью респираторной поддержки. При фульминантном течении с кардиогенным шоком и тяжелой систолической дисфункцией ЛЖ спасти пациента может только механическая поддержка гемодинамики – экстракорпоральная мембранная оксигенация или устройства помощи ЛЖ как мост к выздоровлению или к трансплантации сердца. Вместе с тем клинический опыт показывает, что долгосрочный прогноз пациентов с молниеносным миокардитом более благоприятный (если пациент переживает критический период 2-4 нед), чем у больных, у которых симптомы миокардита развиваются медленно и клинические проявления не такие тяжелые.
Гемодинамически стабильные пациенты также должны получать стандартную медикаментозную терапию СН. Она показана всем пациентам с кардиомегалией и сниженной ФВ независимо от наличия или отсутствия симптомов. Терапия включает диуретики, β-адреноблокатор, ингибитор ангиотензинпревращающего фермента (АПФ) или блокатор рецепторов ангиотензина II, при недостаточной эффективности – антагонист минералокортикоидных рецепторов.
При лечении миокардита следует обратить внимание на выбор β-блокатора. Четыре препарата этого класса – бисопролол, карведилол, метопролола сукцинат и небиволол – рекомендованы к применению в терапии СН на основании убедительной доказательной базы, но карведилол – единственный β-блокатор, который помогает бороться с воспалением. При миокардитах практическое значение имеют следующие эффекты карведилола:
• местный противовоспалительный эффект (уменьшает инфильтрацию нейтрофилами поврежденной зоны за счет подавления экспрессии молекул адгезии);
• предотвращение апоптоза в миокарде (угнетает экспрессию апоптозопосредующих белков – Fas и TNFα);
• торможение пролиферации и миграции гладкомышечных клеток;
• подавление системной иммуновоспалительной активации.
Для получения кардиопротективного эффекта при СН β-блокатор необходимо титровать до адекватных терапевтических доз. Например, для карведилола оптимальной является доза 50-100 мг/сут. Благоприятные эффекты ингибитора АПФ в отношении обратного ремоделирования камер сердца также развиваются в достаточно высоких дозах. Например, для эналаприла это 20-40 мг/сут.
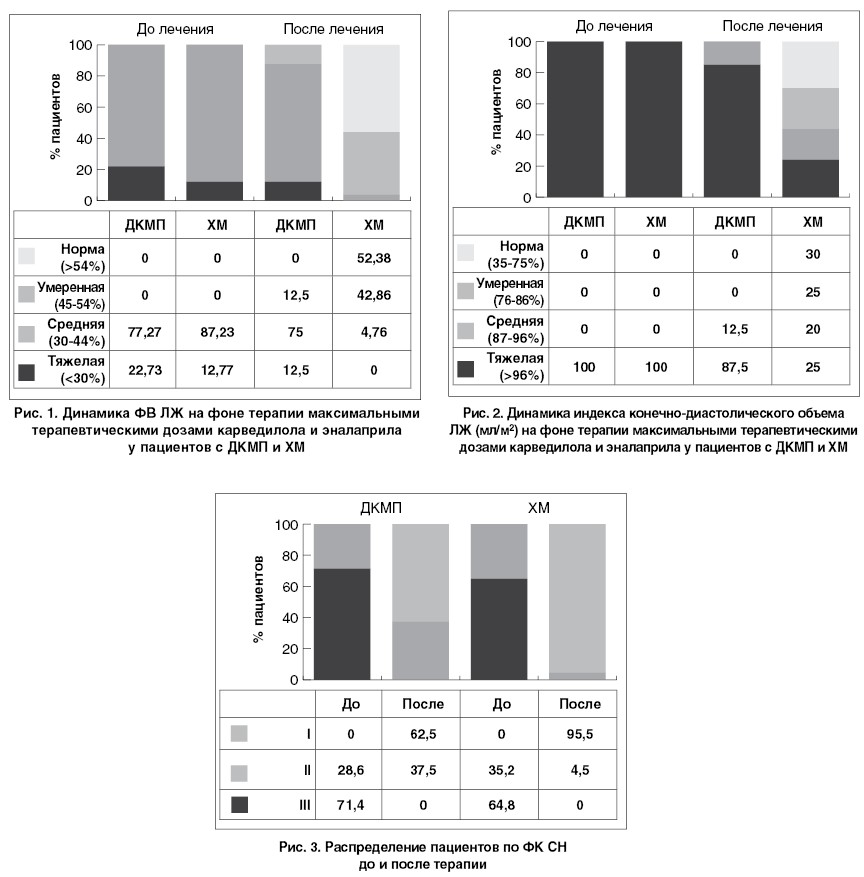
В ННЦ «Институт кардиологии им. Н.Д. Стражеско» НАМН Украины накоплен большой опыт лечения больных с хроническим миокардитом (ХМ) максимальными терапевтическими дозами карведилола и эналаприла. Нормализация ФВ ЛЖ достигнута у 52,4% больных ХМ; нормализация размеров ЛЖ (конечно-диастолического объема) – у 30% (рис. 1, 2). Это сопровождалось переходом пациентов в низшие ФК СН (рис. 3). Среди пациентов с ДКМП и миокардитами 70 и 89% соответственно не нуждались в повторных госпитализациях.
Терапию следует продолжать до восстановления сократительной функции миокарда. Критерии отмены не определены, этот вопрос должен решаться индивидуально. По нашему опыту, кардиальные объемы и ФВ ЛЖ могут нормализоваться в сроки от 8 мес до 8 лет и 8 мес. Неправильно считать, что если миокардит с кардиомегалией не отвечает на лечение в первые недели, то это ДКМП с неблагоприятным прогнозом. На фоне адекватной терапии восстановление может наступить и в более поздние сроки.
Противовирусная и иммуномодулирующая терапия
Для многих вирусных инфекций до сих пор не разработано эффективное этиотропное лечение. Пациентам с подтвержденной герпесвирусной этиологией может быть предложена терапия ацикловиром, ганцикловиром или валацикловиром. Интерферон-β‑1b оказывает наиболее выраженные эффекты при энтеровирусной и аденовирусной инфекции, способствует элиминации вирусного генома, улучшает функцию ЛЖ и ФК СН по NYHA [10, 11]. Однако следует заметить, что роль противовирусной и иммуномодулирующей терапии ограничивается случаями хронической вирусной кардиомиопатии с воспалением или без, когда подтверждена персистенция вируса. По данным, полученным на экспериментальных моделях, вирус покидает миокард максимум через 3 нед. На практике определить наличие вируса и его причинную роль в развитии кардиомиопатии достаточно сложно. Для этого применяются дорогостоящие и не везде доступные методы ЭМБ, ПЦР, иммуногистохимического анализа биоптатов.
Следует подчеркнуть, что короткие курсы иммуномодулирующей терапии (1-2 нед) не эффективны. Показана эффективность интерферона-β‑1b при назначении в дозах 4-6 млн МЕ в течение 21 нед. Внутривенный иммуноглобулин в высоких дозах в течение 1 года после начала острого миокардита ассоциируется с улучшением функции ЛЖ и тенденцией к улучшению 1-летнего прогноза, но не показал преимуществ по сравнению с глюкокортикоидами и не эффективен у детей. Вместе с тем терапия высокими дозами парентерального иммуноглобулина не вызывает серьезных побочных эффектов и поэтому может быть использована у пациентов с миокардитом (как вирусным, так и аутоиммунным), резистентных к стандартной терапии СН [12].
Иммуносупрессивная терапия (глюкокортикоидами, их комбинациями с азатиоприном, циклоспорином) показана в тех случаях, когда после успешной элиминации инфекционного агента сохраняется высокий уровень воспаления в миокарде, а также при аутоиммунных миокардитах, включая гигантоклеточный миокардит и кардиальный саркоидоз. Не следует назначать ее на ранних стадиях заболевания, а также рутинно использовать у пациентов с вирусным миокардитом, так как угнетение раннего иммунного ответа может приводить к хронизации процесса. В зарубежных публикациях обращают на себя внимание высокие дозы и продолжительность терапии. Так, в клинике Charite накоплен опыт использования следующей схемы терапии [12]:
– метилпреднизолон в первые 4 нед в дозе 1 мг/кг массы тела, затем уменьшение на 10 мг каждые 2 нед до дозы 10 мг/сут;
– азатиоприн в дозе 100-150 мг/сут в зависимости от массы тела.
Курс лечения – 3-6 мес. Эффект сохраняется до 2 лет.
Отсутствие крупных рандомизированных клинических исследований не позволяет сформулировать рекомендации по использованию иммуносорбции как метода лечения миокардита. Тем не менее этот метод можно считать патогенетически обоснованным, поскольку его целью является удаление антител и иммунных комплексов, которые, вероятно, определяют воспалительный ответ при данном заболевании. В небольших исследованиях у пациентов с ДКМП иммуносорбция ассоциировалась с улучшением гемодинамики, уменьшением лимфоцитарных инфильтратов в миокарде [13, 14].
Литература
- Mason J.W., et al. A clinical trial of immunosuppressive therapy for myocarditis: The Myocarditis Treatment Trial Investigators. N. Engl. J. Med. 1995; 333: 269-275.Felker G.M., et al. The spectrum of dilated cardiomyopathy. The Johns Hopkins experience in 1278 patients. Medicine, 1999; 78: 270-283.
- Towbin J.A. Incidence, causes, and outcomes of dilated cardiomyopathy in children. JAMA, 2006; 296: 1867-1876.
- Caforio A.L., et al. A prospective study of biopsy-proven myocarditis: prognostic relevance of clinical and aetiopathogenetic features at diagnosis. Eur. Heart J. 2007; 28: 1326-1333.
- Caforio A.L.P., et al. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. European Heart Journal, 2013; 34: 2636-2648.
- Коваленко В.М. та ін. Діагностика та лікування міокардиту: рекомендації робочої групи з хвороб міокарда, перикарда, ендокарда та клапанів серця Асоціації кардіологів України (проект). Український кардіологічний журнал, 2014; 3: 15-21.
- Richardson P., et al. Report of the 1995 World Health Organization / International Society and Federation of Cardiology Task Force on the Defnition and Classification of cardiomyopathies. Circulation, 1996; 93: 841-842.
- Leone O., et al. 2011 Consensus statement on endomyocardial biopsy from the Association for European Cardiovascular Pathology and the Society for Cardiovascular Pathology. Cardiovasc. Pathol. 2012; 21: 245-274.
- Kindermann I., et al. Update on myocarditis. J. Am. Coll. Cardiol. 2012; 59: 779-792.
- Kuhl U., et al. Interferon-beta treatment eliminates cardiotropic viruses and improves left ventricular function in patients with myocardial persistence of viral genomes and left ventricular dysfunction. Circulation, 2003; 107: 2793-2798.
- Schultheiss H.P. The Effect of Subcutaneous Treatment with Interferon-Beta‑1b Over 24 Weeks on Safety, Virus Elimination and Clinical Outcome in Patients with Chronic Viral Cardiomyopathy. Paper presented at: American Heart Association Scientific Sessions; November 11, 2008; New Orleans, LA.
- Schultheiss H.P., Kuhl U., Cooper L.T. The management of myocarditis. Eur. Heart J. 2011; 32: 2616-2625.
- Mobini R., et al. Hemodynamic improvement and removal of autoantibodies against beta1-adrenergic receptor by immunoadsorption therapy in dilated cardiomyopathy. J. Autoimmun. 2003; 20: 345-350.
- Felix S.B., et al. Hemodynamiceffects of immunoadsorption and subsequent immunoglobulin substitution in dilated cardiomyopathy: three month results from a randomized trial. J. Am. Coll. Cardiol. 2000; 35: 1590-1598.
Журнал "Серцева недостатність та коморбідні стани" № 1, квітень 2018 р.