30 жовтня, 2020
Звіт ERS/EACTS щодо ведення пацієнтів зі злоякісним плевральним випотом
Злоякісний плевральний випіт (ПВ) є поширеним ускладненням онкологічного захворювання, яке виникає приблизно у 15% усіх хворих на рак [1]. Більшість випадків ПВ мають симптоматичний характер, а задишка є найчастішим симптомом [2]. Наявність ПВ зазвичай свідчить про поширене або метастатичне онкологічне захворювання, а отже, виживаність таких пацієнтів є поганою, з медіаною від 3 до 12 міс [2]. Лікування при цьому має паліативний характер і спрямоване на полегшення симптомів.
Методи
Робоча група Європейського респіраторного товариства (ERS) та Європейського серцево-легеневого хірургічного товариства (EACTS), що включала 9 фахівців респіраторної медицини та 5 торакальних хірургів з 9 європейських країн, була створена у 2016 р. для розроблення офіційного звіту щодо ведення ПВ. Для висвітлення цієї теми були обрані 6 клінічних питань. У звіті описано сучасну практику ведення пацієнтів з ПВ та узагальнено наявні на даний момент докази. У звіті не подано рекомендацій щодо клінічної практики. Він був схвалений науковим комітетом ERS та комітетом клінічних настанов EACTS і пройшов експертну перевірку експертами-рецензентами Еuropean Respiratory Journal та the European Journal of Cardio-Thoracic Surgery.
? Питання 1: яке лікування пацієнтів із симптоматичним злоякісним ПВ найкраще?
Оскільки у більшості пацієнтів із ПВ рідина після терапевтичної аспірації накопичується повторно, рекомендується істотне лікування [2]. Для цілей цього документа «істотне» лікування розглядається як процедура, призначена для тривалого позбавлення від симптомів ПВ. Торакоцентез не вважається істотним лікуванням і тому не включається у цей огляд.
Хімічний плевродез. A.O.J. Clive та співавт. [1] провели метааналіз стратегій плевродезу ПВ. Відмічено кращий ефект застосування порошку тальку стосовно рівня контролю рідини із чіткою перевагою порівняно з блеоміцином і тетрацикліном. Місцеві ефекти для досліджуваних агентів були подібними, хоча рекомендовано порошок тальку з великими частинками для зниження ризику виникнення гострого респіраторного дистрес-синдрому. Однак інформації про оцінку ефекту лікування самими пацієнтами недостатньо.
Порошок vs розчин тальку. У метааналізі порошок тальку був оцінений вище, ніж розчин, за рівнем контролю рідини [1]. Зростання частоти ускладнень було описано в одному з найбільших досліджень C.M. Dresler та співавт. [11]. У цьому дослідженні 501 пацієнт був рандомізований для використання порошку тальку (n=250) або суспензії неградуйованого тальку (n=251). Основним результатом була відсутність рентгенографічного випоту через 30 днів в осіб, що вижили, і у яких початкове розширення легенів становило >90%. Загальної різниці не було (78 проти 71%), але подальший аналіз у підгрупах хворих на рак молочної залози та легені виявив перевагу порошку (82 проти 67%). У групі, що використовувала порошок тальку, спостерігалася вища частота побічних явищ (14 проти 6% при респіраторних ускладненнях та 8 проти 4% при дихальній недостатності), у тому числі 11 випадків смерті.
Тальк є найефективнішим засобом для хімічного плевродезу при ПВ, тальк із невеликими градуйованими частинками видається безпечним. Дані свідчать про те, що торакоскопічне застосування порошку тальку (за допомогою відеоасистованої торакальної операції – VATS – або торакоскопії) може бути ефективнішим, ніж суспензії [69]. Процедури хірургічного плевродезу не є більш ефективними, ніж використання тальку, особливо при мезотеліомі. Дані рандомізованого контрольованого дослідження показують, що VATS-плевректомія при мезотеліомі пов’язана з тяжчими ускладненнями та тривалішим перебуванням у лікарні без додаткової користі з точки зору успішності плевродезу [70].
Дренажні трубки великого діаметра (наприклад, 24F) асоціюються з більш високими показниками успішності плевродезу тальком, ніж менші трубки (наприклад, 12F). Використання нестероїдних протизапальних препаратів є ефективним варіантом знеболювання, який не погіршує результатів плевродезу. Постійні плевральні катетери виявляються настільки ж ефективними для полегшення симптомів ПВ, як плевродез тальку, і пов’язані зі скороченням часу перебування в стаціонарі, хоча показник несприятливих подій є вищим, ніж для тальку.
Розмір торакального катетера для плевродезу. У більшості досліджень плевродезу тальком використовували великі торакальні катетери (≥24F). Результати численних досліджень свідчать про допустимий рівень ефективності при використанні катетерів меншого діаметра з низкою різних агентів.
Окремі питання плевродезу тальком. Плевродез є дуже болючою процедурою у деяких пацієнтів, і більшість лікарів використовують аналгезію опіатами. Хоча нестероїдні протизапальні препарати є ефективними аналгетиками при гострому болю, їх застосування під час плевродезу уникали через побоювання, що протизапальний ефект може зменшити успіх плевродезу. У дослідженні N.M. Rahman та співавт. [4] (рандомізовано 320 пацієнтів) застосовували високу дозу ібупрофену (800 мг 3 рази на день) або опіат під час плевродезу і не виявили істотної різниці успішності або болючості плевродезу. Отримані результати дають підстави не уникати використання нестероїдних протизапальних препаратів у пацієнтів, які потребують плевродезу з приводу злоякісного ПВ.
Вважається, що застосування тальку у вигляді невеликих частинок (неградуйованого) пов’язане зі значно більшою кількістю побічних ефектів, ніж у вигляді великих частинок (градуйованого), включаючи респіраторний дистрес-синдром та дихальну недостатність [11, 22]. В одному невеликому нерандомізованому порівняльному дослідженні використання дрібночасточкового тальку асоціювалося з вищою запальною цитокіновою відповіддю [37]. Примітно, що вищі запальні реакції були виявлені у пацієнтів після успішного плевродезу тальком порівняно з невдалим плевродезом [38]. Так само вища фібринолітична активність у плевральній рідині була пов’язана з невдалим плевродезом [39].
Хірургічні методи лікування. Хірургічні способи лікування малігнізованого ПВ (крім застосування тальку під час VATS) включають плевректомію та плевродез стирання. Результати кількох досліджень свідчать про те, що часткова й тотальна плевректомія є ефективними методами лікування малігнізованого ПВ [42-44].
У нерандомізованому порівняльному дослідженні плевродезу тальком, стирання та плевректомії при малігнізованому ПВ зафіксовано довше перебування у лікарні, вищий рівень смертності та захворюваності після оперативного втручання [48]. В іншому дослідженні показники плевродезу були нижчими у пацієнтів, які перенесли торакоскопію під місцевою анестезією, порівняно з VATS, але частота післяопераційного дренування, смертність, захворюваність і фінансові витрати також були нижчими у групі лікувальної торакоскопії [49]. Значне покращення фізичного стану у ранній післяопераційний період, загального стану організму і зменшення задишки спостерігалося у групі, що перенесла лікувальну торакоскопію.
Постійні плевральні катетери. Встановлення постійного плеврального катетера є альтернативою плевродезу. Воно забезпечує тривалий контроль симптомів за допомогою регулярного дренування рідини в домашніх умовах. За даними кількох досліджень, що налічували 1533 пацієнти, процедура була корисною при малігнізованому ПВ, зокрема щодо зменшення задишки, інших симптомів та якості життя [50-55].
Комбіновані процедури. Зважаючи на збільшення кількості доказів, що підтверджують ефективність постійних плевральних катетерів, зростає зацікавленість у поєднанні їх використання з іншими процедурами плевродезу. У 3 дослідженнях, що включали 148 пацієнтів, повідомлено про використання постійних плевральних катетерів під час VATS [65] та поєднання з плевродезом тальком [66, 67]. Поєднання плевродезу порошком тальку та постійного плеврального катетера було пов’язане з коротким перебуванням у лікарні (1-3 дні) та видаленням катетера після успішного плевродезу протягом 7 днів. В одному нерандомізованому дослідженні у 60 пацієнтів порівнювали переваги відеоасистованого торакоскопічного втручання та плевродезу порошком тальку і VATS із встановленням постійного плеврального катетера [68]. У групі з катетером зафіксовано коротший термін перебування у лікарні та нижчий рівень ускладнень.
? Питання 2: яке лікування при злоякісному ПВ із «захопленими» легенями оптимальне?
«Захоплені» легені – це ситуація, коли легені не можуть повністю розправитися, щоб заповнити геміторакс, а парієтальна та вісцеральна плевра частково або повністю не прилягають до навколишніх тканин. «Захоплення» легень може виникнути внаслідок потовщення плеври, проксимальної ендобронхіальної непрохідності, що спричиняє дистальний колапс легені або хронічний ателектаз. Деякі автори розмежовують «захоплення» легень, при якому активний процес, такий як малігнізація, призводить до формування вісцеральної плевральної кірки, запобігаючи тим самим розширенню легень, і «захоплення» легень, при якому фіброзна кірка виникла як наслідок віддаленого запалення (вже не активного) у плевральній порожнині [71, 72]. У цій статті термін «захоплені легені» буде використовуватися стосовно обох клінічних сценаріїв.
У системному огляді, присвяченому визначенню оптимального підходу до ПВ, дійшли висновку, що встановлення постійного плеврального катетера показане у випадку «захоплення» легень [79]. Цей висновок ґрунтувався на даних 2 із 14 досліджень, включених до огляду. G.W. Pien та співавт. [80] виконали ретроспективний огляд даних 11 пацієнтів із «захопленими» легенями, яким введено постійний плевральний катетер для використання в домашніх умовах. Усі пацієнти, окрім одного, описали симптоматичну користь такого втручання. Серйозні несприятливі явища, такі як емпієма плеври, блокування та перелом постійного плеврального катетера, мали місце у 3 пацієнтів.
Додаткова інформація щодо застосування постійного плеврального катетера у пацієнтів із «захопленими» легенями доступна в рандомізованому дослідженні T.L. Demmy та співавт. [59], у якому порівнювали його ефективність із плевродезом тальком. У підгрупі досліджуваного втручання з 9 пацієнтів порівняно з групою, у якій використовували плевродез тальком, відзначено вищий рівень контролю ПВ за 30 днів і кращі показники за виконання вправ без розвитку задишки (7,8 проти 4,5; р=0,02).
Існує декілька спостережень щодо значення встановлення постійного плеврального катетера у пацієнтів з малігнізованим ПВ і «захопленими» легенями. Постійний плевральний катетер виявляється ефективним при «захопленні» легень, про симптоматичне поліпшення повідомлялося у >94% пацієнтів у 5 дослідженнях, що загалом охопили 133 пацієнти [51, 80, 82‑84]. За даними 1 дослідження, що включало 8 пацієнтів, рівень полегшення симптомів був низьким – 48% [85]. У 3 із цих досліджень були включені пацієнти після VATS, у яких інтраопераційно діагностували «захоплення» легень та яким встановлено постійний плевральний катетер наприкінці операції [55, 82, 85]. У цих дослідженнях неможливо визначити, яка процедура забезпечувала результати – як симптоматичне покращення, так і небажані події, яких було багато. Тривалість перебування у лікарні була незмінно коротшою для пацієнтів із «захопленими» легенями, яким встановлено постійний плевральний катетер, ніж для групи порівняння (як правило, пацієнти з «незахопленими» легенями, яким застосовували відеоасистований плевродез тальком) [81, 82].
Інші підходи до лікування при «захоплених» легенях включають хірургічну декортикацію та внутрішньоплевральну фібринолітичну терапію. Плевроперитонеальні шунти тривалий час використовували при «захопленні» легень; однак дані, що підтверджують користь процедури, низької якості, рівень ускладнень високий, і зараз цей метод не застосовують у звичайній клінічній практиці [34, 86, 87]. A.P. Yim та співавт. [88] повідомили про хороші з хірургічної точки зору результати у 7 пацієнтів із «захопленими» легенями, яким виконано відеоасистовану торакоскопічну декортикацію. У Великобританії триває рандомізоване контрольоване дослідження, в якому оцінюють роль хірургічної плевректомії/декортикації та встановлення постійного плеврального катетера у пацієнтів із мезотеліомою та «захопленими» легенями (Meso-TRAP).
Не вистачає якісних оприлюднених доказів, проте встановлення постійного плеврального катетера, імовірно, є ефективним варіантом ведення хворих із «захопленими» легенями внаслідок ПВ. Необхідне проведення спеціальних проспективних досліджень, щоб повністю оцінити користь постійного плеврального катетера, а також хірургічного втручання та фібринолітичної терапії.
? Питання 3: яке ведення пацієнтів зі злоякісним ПВ із перегородками та порожнинами?
Багатокамерний ПВ визначається як ПВ з кількома локусами, тобто існує більше одного місця скупчення рідини, або випіт розподіляється по кількох окремих «кишенях». Це відрізняється від ПВ з перегородками, при якому фібринозні смуги утворюються в ПВ, як правило, внаслідок надмірного утворення фібрину через опосередковані запаленням зміни прокоагулянтної та фібринолітичної активності [90]. ПВ з перегородками з часом може стати багатокамерним, але наявність перегородок у ПВ не обов’язково перешкоджає вільному потоку рідини всередині порожнини. На противагу цьому багатокамерність може заважати повному дренуванню плевральної порожнини й обмежити повторне розширення легень та потенційно є протипоказанням до плевродезу або спричиняє недостатнє симптоматичне полегшення у пацієнтів з постійним плевральним катетером.
Внутрішньоплевральне введення фібринолітичних засобів сприяє збільшенню об’єму відтоку рідини та покращенню рентгенологічної картини при багатокамерному ПВ. Однак воно не впливає на клінічні результати, такі як задишка або успіх плевродезу. Застосування обмежене для пацієнтів з багатокамерним ПВ, які не є кандидатами на хірургічне лікування.
? Питання 4: які фактори прогнозу при злоякісному ПВ?
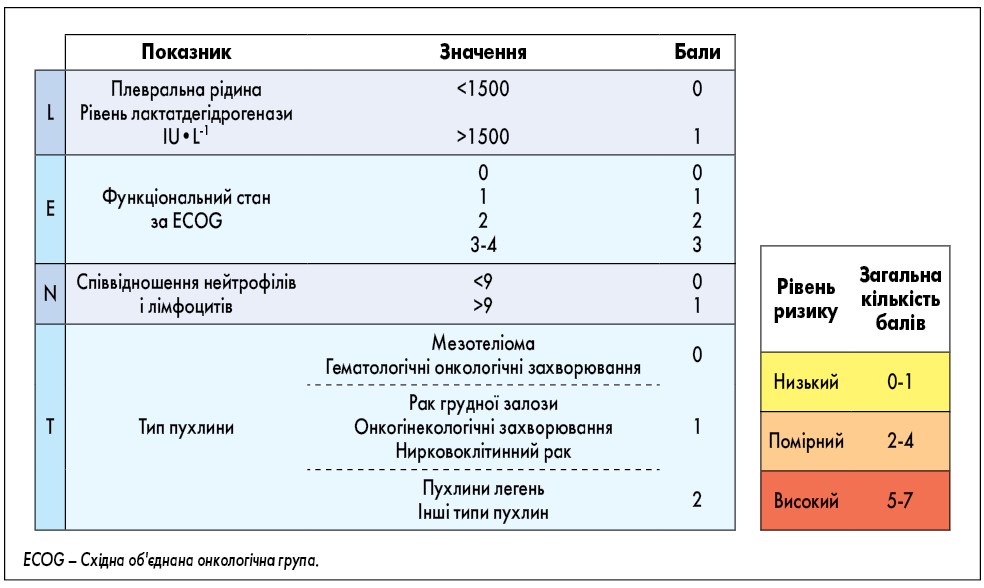
Прогностичними є множинні базові фактори, включаючи тип пухлини, стадію, функціональний стан за ECOG, маркери запалення в крові та плевральній рідині. Незважаючи на те що оприлюднено кілька прогностичних інструментів, лише прогностична цінність шкали LENT була підтверджена у дослідженнях (рис. 1); при мезотеліомі найбільш клінічно корисним є застосування алгоритму Brim’s (рис. 2).
Рис. 1. Розрахунок балів за LENT і прогностичні групи [45]
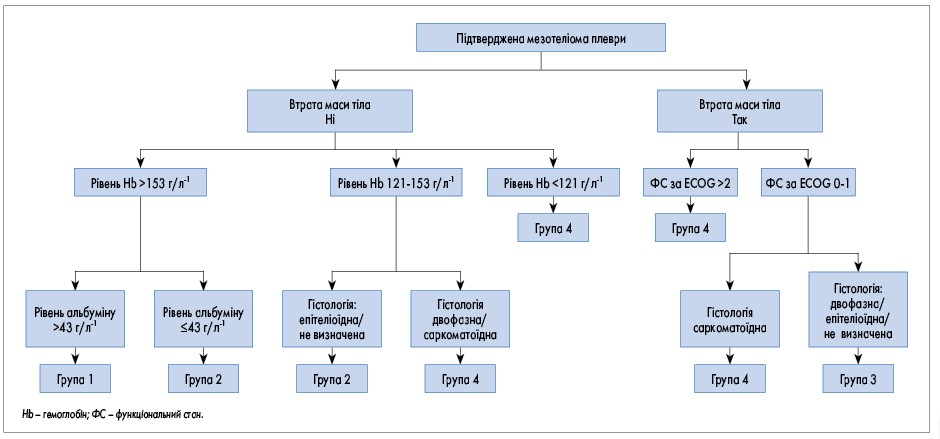 Рис. 2. Алгоритм Brim’s прогнозування перебігу мезотеліоми [192]
Рис. 2. Алгоритм Brim’s прогнозування перебігу мезотеліоми [192]
? Питання 5: чи мають пацієнти зі злоякісним ПВ, у яких пухлина є чутливою до протипухлинного лікування (наприклад, хіміотерапії, імунотерапії, таргетної терапії), отримувати це лікування до початку терапії з приводу злоякісного ПВ? Якщо так, то яких саме онкологічних захворювань це стосується?
Таргетна терапія досліджувалась у пацієнтів із ПВ і недрібноклітинним раком легень (НДРЛ) [203-205]. У звіті про випадок описано зникнення ПВ, вторинного щодо аденокарциноми легень після лікування бевацизумабом, карбоплатином і паклітакселом [205]. У іншому дослідженні (ретроспективному нерандомізованому) використовували моноклональне анти-VEGF антитіло бевацизумаб та хіміотерапію або хіміотерапію з EGFR-TKI у 86 пацієнтів з EGFR-позитивним НДРЛ і ПВ з набутою стійкістю до EGFR-TKI [204]. Однак різниці в загальній виживаності у разі застосування цих методів лікування не було. Відхилення відбору, ймовірно, вплинули на результати обох досліджень.
У низці досліджень вивчали внутрішньоплевральну терапію при ПВ. У 2 дослідженнях І фази оцінювали безпеку внутрішньовенної та внутрішньоплевральної хіміотерапії разом з моноклональними антитілами до ПВ [206, 207]. Профілі безпеки були різними, і цифри були занадто малі, щоб коментувати ефективність. У 2 рандомізованих дослідженнях II фази оцінювали внутрішньоплевральне використання бевацизумабу у пацієнтів з НДРЛ та ПВ [208, 209]. В 1 дослідженні комбінацію бевацизумабу та паклітакселу вводили внутрішньоплеврально, що сприяло зменшенню плеврального випоту та поліпшенню симптомів у 78,6% пацієнтів порівняно з 50,0%, які внутрішньоплеврально отримували паклітаксел [208]. Рівень однорічної виживаності був більшим у групі бевацизумабу (45,8 проти 20,8%), в той час як побічні явища у досліджуваних групах були подібними. У дослідженні ІІ фази порівнювали внутрішньоплевральне введення цисплатину з бевацизумабом або без нього у 70 пацієнтів з неплоскоклітинним НДРЛ та супутнім ПВ [209]. Вища відповідь з огляду на перебіг ПВ (85,7 проти 56,6%) спостерігалася у разі додавання бевацизумабу. У дослідженні II фази внутрішньовенно застосовували бевацизумаб разом із системною хіміотерапією карбоплатином + пеметрекседом. Досягнуто контроль ПВ у 21 (91,3%) з 23 пацієнтів [210].
Сучасна література обмежується переважно результатами невеликих ретроспективних або одноразових проспективних досліджень. Отже, не можна робити висновків щодо значення протипухлинної терапії в лікуванні ПВ. Немає жодних вагомих доказів, які б свідчили про будь-яку шкоду, пов’язану зі стандартним інтервенційним лікуванням постійним плевральним катетером, це, ймовірно, залишатиметься першою лінією лікування, поки не з’являться докази на підтримку альтернативних підходів. Потрібні подальші дослідження, зокрема для підтвердження внутрішньоплеврального використання бевацизумабу у пацієнтів з НДРЛ і ПВ та EGFR-TKI у пацієнтів з ПВ через НДРЛ із мутованим EGFR.
? Питання 6: чи достатнє цитологічне дослідження для лікування злоякісного ПВ?
Цитологічне дослідження може надати корисну діагностичну, прогностичну та терапевтичну інформацію; однак проблемою залишається низька чутливість, особливо при мезотеліомі. Біопсія плеври – золотий стандарт, хоча у випадках, коли морфологічним результатом первинної біопсії є запалення, зазвичай необхідна повторна біопсія або розширене подальше спостереження.
Останнім часом були розроблені високочутливі тести, які дозволяють ідентифікувати циркулюючу пухлинну позаклітинну ДНК, РНК (особливо мікро-РНК) та циркулюючі пухлинні клітини у зразках крові пацієнтів [263, 264]. Ці методи рідинної біопсії виявилися корисними у хворих на рак легень при виявленні базових мутацій EGFR [265, 266] та для визначення мутацій, що зумовлюють стійкість до мішеневої терапії, наприклад T790M [267, 268]. Хоча деякі з цих тестів були затверджені регуляторними органами для використання в клінічній практиці, вони ще не є загальнодоступними. Крім того, для деяких пухлин, наприклад мезотеліоми, не було розроблено стандартизованого підходу, потрібні подальші дослідження [269-271].
Нові технології, такі як рідинна біопсія, можуть у майбутньому замінити біопсію, але для визначення їх оптимальної ролі необхідні подальші дослідження.
Висновки
Цей звіт робочої групи базується на аналізі літературних даних, що стосуються ведення злоякісного ПВ, фокусуючись на питаннях, які можуть бути актуальними у клінічній практиці лікарів-пульмонологів, торакальних хірургів та онкологів.
Доказово підтвердженим оптимальним лікуванням при симптоматичному ПВ є плевродез тальком (як суспензією, так і порошком) та встановлення постійного плеврального катетера. Не з’ясовано, чи застосування порошку тальку є більш ефективним, ніж суспензії, їх тривале використання супроводжується незначною кількістю побічних явищ; водночас встановлення постійного плеврального катетера скорочує термін госпіталізації.
У контексті «захоплених» легень не вистачає доказів щодо переваг якихось ефективних варіантів лікування. Встановлення постійного плеврального катетера часто покращує симптоми, але необхідні проспективні рандомізовані дослідження для підтвердження його вищої ефективності. Зібрано також мало доказів, що внутрішньоплевральний фібриноліз чинить якийсь стійкий вплив на симптоми та самопочуття пацієнта з багатокамерним ПВ.
Що стосується прогнозування, то шкала LENT – це простий перевірений інструмент для прогнозування виживаності при малігнізованому ПВ, тоді як алгоритм Brim’s є найбільш корисним при мезотеліомі. Сьогодні немає надійних доказів, які підтверджували б використання онкологічних методів лікування як альтернативи механічному дренажу, тому необхідні подальші дослідження. Хоча цитологічне дослідження може дати деяку діагностичну інформацію при малігнізованому ПВ, біопсія нині залишається золотим стандартом.
Лікування при малігнізованому ПВ істотно покращилося після опублікування результатів кількох високоякісних рандомізованих контрольованих досліджень, однак залишається низка запитань без відповіді, а отже – й потреба у дослідженнях щодо оптимальної допомоги пацієнтам цієї групи.
Список літератури знаходиться в редакції.
Bibby A.C. et al. ERS/EACTS statement on the management of malignant pleural effusions. Eur Respir J. 2018; 52: 1800349.
https://doi.org/10.1183/13993003.00349-2018.
Переклав з англ. Назар Лукавецький
Тематичний номер «Онкологія, Гематологія, Хіміотерапія» № 4 (65) 2020 р.