9 листопада, 2020
Патогенетична терапія коронавірусної пневмонії при COVID‑19
Уже втретє за останні 20 років у світі виникають спалахи поширених епідемій коронавірусних інфекцій, які характеризуються доволі високою контагіозністю і високим рівнем летальності.
Усі вони були зумовлені вірусами одного й того ж типу – бета-коронавірусами (родина Coronaviridae, підродина Coronavirinae, рід Betacoronavirus).
У 2002 р. це була епідемія SARS (від англ. Severe Acute Respiratory Syndrome), або тяжкий гострий респіраторний синдром, спричинений вірусом SARS, – CoV‑1 (підрід В бета-коронавірусів), у 2012-2015 рр. – епідемія MERS (від англ. Middle East Respiratory Syndrome), або Близькосхідний респіраторний синдром, зумовлений MERS-CoV (підрід С бета-коронавірусів), і вже у 2019 р. – пандемія COVID‑19, або також SARS, спричинений вірусом SARS-CoV‑2. Ця пандемія коронавірусної інфекції (COVID‑19) триває на планеті скоро вже рік.
Усі три інфекції – так звані зоонози, або, точніше, зооантропонози (їх резервуаром і джерелом є тварини, а саме рукокрилі – в ужитку кажани, для MERS – одногорбі верблюди, яким раніше вірус був переданий від рукокрилих, а в людській популяції – власне хворі на коронавірусну інфекцію).
Первинним географічним місцем виникнення був Азіатський регіон: для SARS – Південний Китай; для MERS – Саудівська Аравія; для COVID‑19 – Центральний Китай. Також можна говорити й про періодичність виникнення коронавірусних епідемій в людській популяції – приблизно 7-10 років. Слід також зазначити зворотну залежність у низці SARS→MERS→COVID‑19 між географічною поширеністю, інкубаційним періодом і летальністю.
Так, найбільш поширеним SARS був у країнах Південно-Східної Азії (Китай, Гонконг, Тайвань, Сінгапур, В’єтнам) і в Північній Америці (США, Канада). Усього, за даними ВООЗ, було зареєстровано 8098 випадків хвороби. Механізм передачі – аерозольний і фекально-оральний. SARS мав короткий інкубаційний період – 2-3 доби. Летальність при цій недузі становила приблизно 9-10% (9,55%).
MERS був зареєстрований у 27 країнах світу (Алжир, Бахрейн, Єгипет, Китай, Австрія, Франція, Німеччина, Греція, Ісламська Республіка Іран, Італія, Йорданія, Кувейт, Ліван, Малайзія, Нідерланди, Оман, Філіппіни, Катар, Республіка Корея, Королівство Саудівська Аравія, Таїланд, Туніс, Туреччина, Об’єднані Арабські Емірати, Сполучене Королівство, Сполучені Штати Америки та Ємен). 80% хворих було зосереджено в місці виникнення – у Саудівській Аравії. Передача MERS від людини до людини відбувається тільки в разі тісного контакту, але основним джерелом зараження все ж є верблюди. Усього у світі було зареєстровано 2144 випадки хвороби. Механізм і шляхи передачі інфекції до кінця не вивчені. Основним все ж вважається аерозольний (від людини людині). Шляхи передачі – повітряно-краплинний, контактно-побутовий. Інкубаційний період при MERS становив близько 5 діб. Летальність при MERS досягала 35%.
COVID‑19 – сучасна поточна пандемія з більш як 10 млн хворих. Механізми передачі збудника – аерозольний і фекально-оральний. Шляхи передачі – повітряно-краплинний, аліментарний, контактно-побутовий. Інкубаційний період може подовжуватися до 14 діб. Летальність при COVID‑19 на початок жовтня 2020 р. складала приблизно 2,9% (на той час число хворих на COVID‑19 перевищило 36 млн, померло – понад 1 млн людей). В Україні на той же час було зареєстровано понад 239 тис, померло близько 4,6 тис осіб (смертність на рівні 1,9%).
Таким чином, у низці SARS→MERS→COVID‑19 спостерігається збільшення поширеності від епідемії до пандемії, підвищення контагіозності, але все ж таки зі збільшенням інкубаційного періоду та зниженням рівня летальності.
З доступних інформаційних джерел відомо, що в патогенезі COVID‑19 можна виділити два основні механізми ушкодження легень. Перший – це пряме вірусне пошкодження епітелію легень, передусім гладких епітеліальних клітин дихальних шляхів (ДШ) і альвеолоцитів, а також ендотеліоцитів капілярів і тканинних легеневих фібробластів, оскільки коронавіруси після закінчення реплікації призводять до повного пошкодження клітини хазяїна. Другий – виникнення спочатку інтенсивної локальної (легені), а потім уже й системної запальної реакції, що супроводжується «цитокіновим штормом». Це при тяжкому ступені хвороби спочатку призводить до гострого респіраторного дистрес-синдрому (ГРДС) [1], а потім, при прогресуванні хвороби, – й до так званого синдрому гострої запальної відповіді (SIRS від англ. Systemic Inflammatory Response Syndrome). У вітчизняних джерелах така відповідь ототожнюється із сепсисом, хоча фактично вона в жодному разі не є таким, оскільки віруси не можуть бути збудниками сепсису!
Необхідно зазначити, що SARS-CoV‑2 тропний до ангіотензинперетворювального ферменту ІІ (ACE2) – екзопептидази, що проявляє протеазну активність на поверхні ендотеліальних клітин капілярів легень. З еволюційного погляду, предки сучасних коронавірусів взаємодіяли з цими рецепторами на поверхні найпростіших, і пептидаза розщепляла їхню оболонку, завдяки чому вірусна рибонуклеїнова кислота проникала в клітину і запускала механізм свого розмноження. У міру ускладнення багатоклітинних форм життя ця екзопептидаза стала брати участь у перетворенні ангіотензину I на судинозвужувальну речовину ангіотензин ІІ за тим же механізмом протеолітичного розщеплення, регулюючи в людини артеріальний тиск. Тож SARS-CoV‑2, як і його предки, взаємодіє саме з цими рецепторами. У такий спосіб цей вірус вільно реплікується в альвеолоцитах (в окремих повідомленнях вказують саме на 2-й тип альвеолоцитів), ендотелії капілярів, легеневих фібробластах і ентероцитах – структурах, які містять найбільшу кількість ACE2.
Коронавіруси дуже складно «виростити» в культурах клітин in vitro. Але з публікацій щодо SARS і MERS відомо, що ці віруси вже в наступні після інфікування години, а саме через 7-13 год, накопичуються в клітині-хазяїні у високих концентраціях, досягаючи піку через 12-24 год, і, зберігаючися на високому рівні, призводять до чіткої цитопатичної дії та загибелі клітин. Час від інфікування клітини до її загибелі залежить власне від типу і навіть штаму коронавірусу, а також від культури клітин і становить від 12-24 год до 7-14 діб. Найефективніша реплікація коронавірусів при SARS і MERS відбувається в гладких епітеліальних клітинах ДШ, гірше збудники реплікуються в тканинних фібробластах, далі за зниженням активності реплікації йдуть пневмоцити 2-го порядку, і найнижчий рівень реплікації зазначається в ендотеліоцитах [2].
Згадані пневмоцити типу II (AT2) відповідальні за утворення легеневого сурфактанту – суміші ліпідів і білків, що вистилає легеневі альвеоли зсередини (на межі «повітря-рідина»). Легеневий сурфактант перешкоджає злипанню стінок альвеол при диханні через зниження поверхневого натягу плівки тканинної рідини, що покриває альвеолярний епітелій [3].
SARS-CoV‑2, інфікувавши пневмоцити, спричиняє їх десквамацію в альвеолах, зумовлюючи альвеолярну дисфункцію, набряк і кровотечу, що порушує газообмін в альвеолах і призводить до дихальної недостатності. Водночас відбувається зниження рівня сурфактанту в тканинній рідині, що покриває альвеолярний епітелій, її поверхневий натяг збільшується. Відповідно, здатність легень розширюватися і стискатися під час нормального акту дихання знижується (пацієнт цей стан відчуває як «хрускіт легень» при кожному вдиху). Цей процес може призвести до колапсу легень під час видиху. У міру заповнення альвеол рідиною наростає дихальна недостатність. Смертельний вислід настає при порушенні цілісності альвеолярної мембрани, що призводить до накопичення рідких ексудатів в альвеолярних просторах, механічна вентиляція легень виявляється безуспішною [3].
Важливо, що прогресування ГРДС від набряку альвеол до дифузного альвеолярного пошкодження (diffuse alveolar damage) не залежить від інтенсивності реплікації вірусу і досягнення ним високих титрів. Інфекція призводить до пікових вірусних титрів через 1-2 доби після зараження, разом з оголенням (денудацією) ДШ і утворенням клітинного детриту, що закупорює дрібні бронхи (одна з причин, яка ускладнює виявлення вірусу у верхніх ДШ). Тяжкі ураження паренхіми легень, у тому числі інфільтрати, крововиливи, альвеолярний набряк і утворення гіалінової мембрани, типові для ексудативної стадії дифузного альвеолярного пошкодження, з’являються на 4-7-му добу після зараження, коли вірусне навантаження в паренхімі легень швидко падає і/або стає нижче межі виявлення [3].
На жаль, через небезпеку зараження багатьох померлих від COVID‑19 в Україні взагалі не розтинали, пізніше секцію здійснювали, але нерідко без виконання повноцінних гістологічних досліджень, хоча патогістологічний матеріал забирали і зберігали.
Нижче представлені мікросвітлини (усі фото – авторські) найбільш показових гістологічних зразків легень, нирок і селезінки.
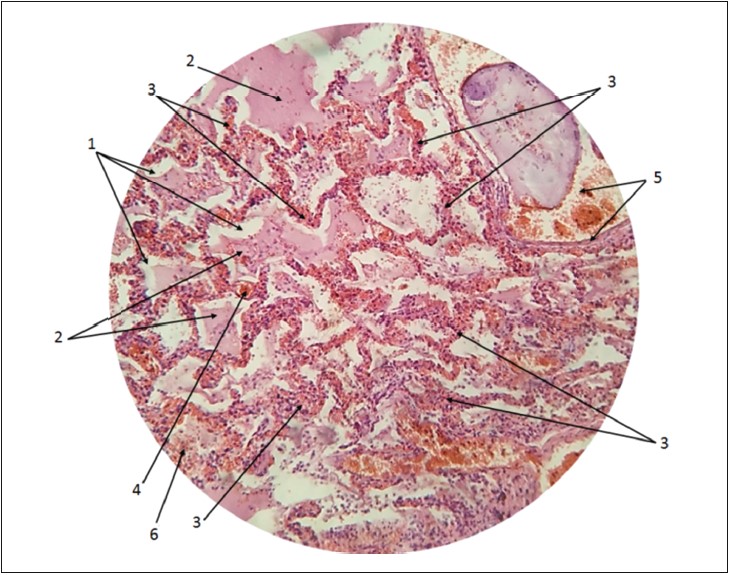
Патогістологічне дослідження легень померлих від COVID‑19 дає можливість виявити деформацію альвеол, велику кількість білкового ексудату з гранулами в їх просвіті, великі організовані білкові глобули, внутрішньоальвеолярний фібрин із ранньою організацією, у просвіті мікросудин множинні стази і червоні тромби, а також гіперпластичні пневмоцити з, можливо, вірусними включеннями. Також на фото помітні вільні еритроцити у просвіті альвеол, чіткі деструктивні зміни в їхній структурі, має місце еритроцитарна і лейкоцитарна інфільтрація інтерстицію [4] (рис. 1).
Рис. 1. Гістологічний препарат легені хворої, яка загинула від COVID‑19:
1 – деформовані альвеоли; 2 – гіалінові мембрани в просвіті альвеол (організовані маси фібрину, клітинний детрит, еритроцити, лейкоцити); 3 – потовщені, деформовані, інфільтровані еритроцитами і лейкоцитами альвеолярні стінки та міжальвеолярні перегородки; 4 – розширений легеневий капіляр; 5 – бронх (у просвіті згусток слизу і скупчення еритроцитів); 6 – скупчення еритроцитів у просвіті альвеол
Аналіз гістологічної картини достовірно ілюструє те, що в таких хворих має місце інтерстиційний та альвеолярний набряк легень. Тому, використовуючи згадане дослідження, можна ще раз підтвердити те, що SARS-CoV‑2 тропний до альвеолоцитів 1-го і 2-го порядку, тканинних фібробластів і макрофагів, а також до ендотелію судин. Непрямим підтвердженням цього можуть бути й дані патогістологічної картини при SARS і MERS, наведені в доступних інформаційних джерелах.
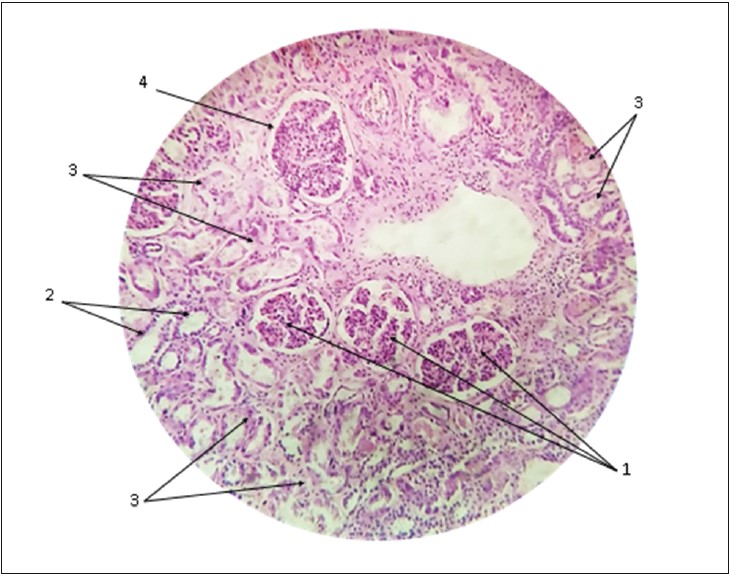
Дуже показові також зміни в тканинах нирок і селезінки (рис. 2 і 3). Так, у нирках спостерігаються дифузні дистрофічні та некробіотичні зміни епітелію звивистих ниркових канальців зі скупченням еритроцитів у просвіті капсул. У селезінці – множинні дрібні ішемічні інфаркти.
Отже, очевидно, що в патогенезі COVID‑19 у разі виникнення тяжкого ступеня хвороби чітко простежується така етапність або стадійність. Після інфікування альвеолоцитів, ендотеліоцитів альвеолярно-капілярного сегменту легень, тканинних фібробластів і макрофагів через недовгий проміжок часу (12-24-48 або 72 год) в цих клітинах (більше в пневмоцитах) виникає виражений цитопатичний ефект, який призводить до швидкого прогресу інтерстиційного набряку легень, а потім і до альвеолярного набряку, який спочатку супроводжується пропотіванням в альвеоли плазми крові, а потім вже й формених елементів. Природно, що вже на перших етапах пошкодження альвеолярно-капілярного сегменту швидко призводить до прогресуючого погіршення газообміну, а також закономірно супроводжується вираженою локальною, а потім і системною запальною реакцією. Важливо, що швидке пошкодження пневмоцитів і структури альвеолярно-капілярного сегменту не може бути компенсоване використанням штучної вентиляції легень (ШВЛ), навіть із високим вмістом кисню в дихальній суміші і підвищеним тиском при ШВЛ на видиху. Реальним і єдино можливим методом інтенсивної терапії в такому разі може бути тільки екстракорпоральна мембранна оксигенація (ЕКМО).
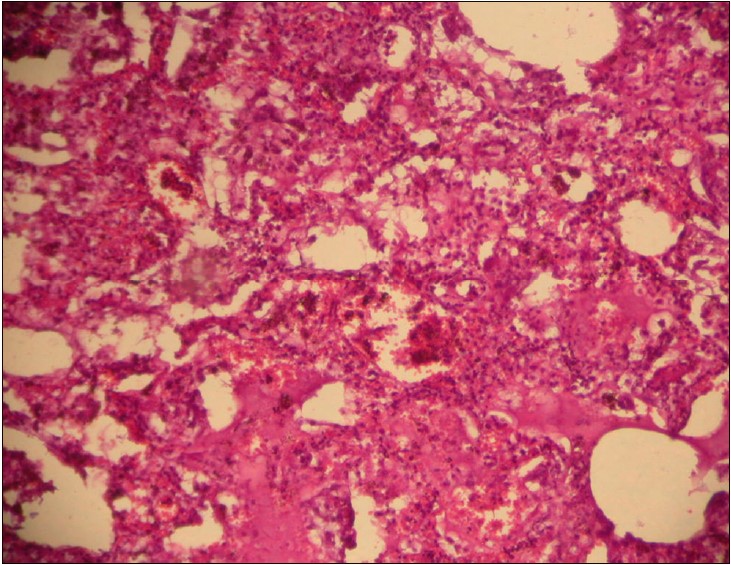
Наведені дані ілюструють дуже високу схожість патогенезів SARS, MERS і COVID‑19 із грипозними «геморагічними пневмоніями», або, точніше, – грипозним геморагічним набряком легень, який, також закономірно (за відсутності адекватної терапії), має два етапи – інтерстиційний, а потім вже й альвеолярний набряк. Зазначена схожість стосується й патогістологічної картини (рис. 1 і 4). Клінічно-діагностичний і терапевтичний алгоритм при грипозному геморагічному набряку легень, наведений в патентах і статтях [5-9], теоретично може з успіхом використовуватися і при COVID‑19.
Рис. 2. Гістологічний препарат нирки тієї ж померлої від COVID‑19:
1 – капілярні клубочки нефронів; 2 – звивисті ниркові канальці; 3 – дистрофічні й некробіотичні зміни епітелію звивистих ниркових канальців; 4 – капсула нефрону
Рис. 3. Гістологічний препарат селезінки тієї ж померлої від COVID‑19:
1 – біла пульпа (лімфатичні вузлики); 2 – центральна артеріола лімфатичного вузлика; 3 – трабекула селезінки; 4 – червона пульпа; 5 – ішемічний інфаркт селезінки
Рис. 4. Гістологічний препарат легені хворої К., 27 р., яка загинула від грипу:
розлади мікроциркуляції, серозний ексудат в альвеолах
Усі наведені дані не залишають сумнівів, що патогенез і патогістологічна картина при тяжких і вкрай тяжких формах COVID‑19 і грипу дуже схожі, а відповідно, і патогенетична терапія цих клінічних варіантів COVID‑19 і грипу мають бути також фактично схожими або навіть тотожними в основних підходах і виборі фармакологічних засобів терапії!
Але необхідно зазначити й деякі відмінності COVID‑19 від грипу. Клінічна картина при тяжких формах грипу розвивається доволі швидко, нерідко навіть блискавично – від декількох годин до 1 рідше 2 діб. При COVID‑19 зазвичай розвиток клінічної картини відбувається набагато повільніше: від декількох до 7-14 діб. Клінічна картина при COVID‑19 менш маніфестна порівняно з грипом, але при тяжких формах і в разі летального висліду закономірно проходить спочатку стадію інтерстиційного набряку легень, а потім і альвеолярного набряку, що, як і при грипі, найчастіше закінчується смертю пацієнта. При COVID‑19 перебіг хвороби порівняно з грипом ніби «затягується» в часі, але однаково неухильно йде по тому ж шляху в плані як патогенезу, так і клінічної картини.
Крім того, грип порівняно з COVID‑19 має дуже короткий інкубаційний період.
З огляду на ці дані, можна стверджувати, що COVID‑19 по суті є «повільною формою грипу».
Але слід також вказати й на деякі значущі відмінності в патогенезі цих двох захворювань. Так, при грипі має місце низький рівень активності згортальної системи, що клінічно нерідко супроводжується кровотечами і робить украй небезпечним використання антикоагулянтів, які необхідні в разі застосування екстракорпоральних методів оксигенації. У хворих на COVID‑19, навпаки, спостерігається синдром дисемінованого внутрішньосудинного згортання (ДВЗ), який фактично «зупиняється» на стадії гіперкоагуляції! Зазвичай ця стадія «коагулопатії споживання» минає доволі швидко, закономірно переходячи в стадію гіпокоагуляції – кровотечу. Але при COVID‑19 стадія гіперкоагуляції затягується, коли споживаються і молекулярні фактори згортання, і тромбоцити. Клініцисти навіть виявили прогностичну особливість – чим нижчий рівень тромбоцитів у пацієнта з COVID‑19, тим тяжчим буде перебіг хвороби і серйозно погіршає прогноз для життя. Це підтверджується й даними гістологічного дослідження нирок і селезінки померлих. За таких обставин життєво необхідне використання антикоагулянтів у цієї групи хворих. Але пояснити таку ситуацію та її патомеханізми ми ще не можемо. Поки достовірно відомо те, що це ДВЗ-синдром «зупинився» на стадії гіперкоагуляції і «повільного» споживання факторів згортання.
За таких обставин, зважаючи на особливий ризик розвитку тромбоемболічних ускладнень при COVID‑19, передусім високу частоту тромбозів глибоких вен і тромбоемболії легеневої артерії, таким пацієнтам необхідно відстежувати рівень D-димеру, чий несприятливий прогностичний показник становить понад 150 нг/мл. Тоді необхідно негайно вдаватися до призначення антикоагулянтної терапії препаратами низькомолекулярних гепаринів, наприклад еноксапарином натрію з розрахунку 1 мг/кг (100 анти-Ха МО/кг) маси тіла 1 або 2 рази на добу підшкірно глибоко в ліву та праву передньобічні або задньобічні стінки живота поперемінно (1 мл розчину для ін’єкцій еквівалентний приблизно 10 000 анти-Ха МО еноксапарину). Важливо, що еноксапарин натрію не можна призначати як взаємозамінний (одиниця за одиницю) замість інших низькомолекулярних гепаринів. Зокрема, 1 мл іншого низькомолекулярного гепарину – фраксипарину (надропарину кальцію) відповідає приблизно 9500 анти-Xa МО препарату. Варто взяти до уваги і той факт, що ці засоби в профілактичних дозах суттєво не впливають на час кровотечі, загальні коагуляційні показники, а також на агрегацію тромбоцитів і зв’язування фібриногену з тромбоцитами. Еноксапарин натрію застосовують у середньому протягом 10-14 діб. Після відміни препарату за необхідності слід розпочати прийом прямих пероральних антикоагулянтів за 0-2 год (залежить від інструкції для медичного застосування конкретного засобу).
Іншою особливістю є також повільний, але неухильний прогрес саме стадії інтерстиційного набряку легень. Вона, на відміну від грипу, повільно переходить у стадію альвеолярного набряку. Але саме на цій стадії розвивається повна клінічна картина дихальної недостатності у вигляді ГРДС (частіше затяжного). При грипі ця стадія швидкоплинна (усього лише декілька годин), і хворий її ніби «проскакує», досягаючи стадії розгорнутого альвеолярного набряку, при якому прогноз для життя вкрай несприятливий.
Але якщо при грипі з інтерстиційним набряком, незважаючи на всю його швидкоплинність, можна ефективно боротися, не допускаючи переходу в альвеолярну стадію, що підтверджено нашою реальною практикою [5-9], то при COVID‑19 зупинити прогрес інтерстиційного набряку набагато складніше, навіть при використанні потужних швидкодіючих глюкокортикоїдів, зокрема дексаметазону, що фактично є препаратом вибору при набряках, пов’язаних зі стрімким запаленням.
Ще однією істотною патогенетичною відмінністю COVID‑19 від грипу є вже згаданий «цитокіновий шторм», який при грипі, імовірніше, не встигає розвинутися. Тож у разі небезпеки розвитку й прогресування SIRS слід невідкладно намагатися вгамувати зазначений «шторм». Обнадійливі результати демонструють перевагу імуносупресантів, які активно використовують у терапії автоімунного ревматоїдного артриту, – сарилумаб (Kevzara) і тоцилізумаб (Аctemra). Так, тоцилізумаб є рекомбінантним гуманізованим моноклональним антитілом до людського рецептора інтерлейкіну‑6 (ІЛ‑6) з підкласу імуноглобулінів. Цей засіб селективно зв’язується та пригнічує як розчинні, так і мембранні рецептори ІЛ‑6, що є багатофункціональним прозапальним цитокіном, який продукується різними типами клітин, включаючи Т- і В-клітини, моноцити та фібробласти. ІЛ‑6 залучений у різні фізіологічні процеси, такі як стимуляція секреції Ig, активація Т-клітин, стимуляція продукування білків гострої фази в печінці та стимуляція гемопоезу. Тож ІЛ‑6 відіграє важливу роль у патогенезі різних запальних захворювань, у тому числі й COVID‑19. Рекомендована доза тоцилізумабу для дорослої людини зазвичай становить не менше 4 мг/кг внутрішньовенно краплинно протягом щонайменше 1 год 1-2 рази на добу протягом 1-3 діб (1 флакон містить 200 мг / 10 мл, або 400 мг / 20 мл тоцилізумабу). Препарат слід розводити до 100 мл стерильним 0,9% розчином натрію хлориду.
Таким чином, отримані емпіричним шляхом дані підтверджують, що в патогенезі COVID‑19 одну з провідних ролей відіграє висока активність імунозапального процесу, у тому числі й автоімунного.
Відтак, можна з упевненістю стверджувати, що COVID‑19 по суті є «повільною формою грипу» з провідною патогенетичною ланкою – «повільним» інтерстиційним (а в подальшому вже й альвеолярним) набряком легень, що перебігає на тлі ДВЗ-синдрому в стадії гіперкоагуляції й агресивного цитокінового шторму.
З огляду на це та враховуючи наш ефективний досвід у невідкладній терапії геморагічного набряку легень за допомогою дексаметазону при грипі, а також власний клінічний досвід застосування дексаметазону в комплексній терапії тяжких форм COVID‑19, – необхідно розглянути й внести до чинних стандартів терапії COVID‑19 зміни, що регламентують застосування дексаметазону, яке ґрунтується на власному вітчизняному досвіді та власних клінічних дослідженнях, а не на віддалених рекомендаціях зарубіжних дослідників і ВООЗ, які майже впродовж усього періоду пандемії COVID‑19 фактично не лише заперечували, а й фактично забороняли застосування глюкокортикоїдів для лікування хворих на COVID‑19.
Наші ж експертні групи МОЗ зазвичай дублюють рекомендації зарубіжної медицини, які нерідко виявляються помилковими. Наприклад, у чергових офіційних рекомендаціях, регламентованих наказом МОЗ України від 16.06.2020 № 1411 «Про внесення змін до Стандартів медичної допомоги “Коронавірусна хвороба (COVID‑19)”», додаток 13 до Стандартів медичної допомоги «Коронавірусна хвороба (COVID‑19)», «Рання підтримувальна терапія за наявності ТГРС» дослівно зазначено: «Забороняється призначати системні кортикостероїди для лікування вірусної пневмонії або ГРВІ, якщо вони не показані з іншої причини».
Це новий черговий протокол терапії COVID‑19, датований 16.06.2020. Але зі ЗМІ ми дізнаємося, що Велика Британія, незважаючи на рекомендації ВООЗ, офіційно приймає дексаметазон «на озброєння» в терапії хворих на COVID‑19. Зрозуміло, що оснащеність медичного й дослідницького сектору Великої Британії істотно краща за українську. Але й там дотримувалися рекомендації ВООЗ та інших європейських країн і США, які забороняли застосовувати глюкокортикоїди й досі не дуже поспішають їх рекомендувати, хоча китайські медики ще в січні-лютому 2020 року неодноразово повідомляли про ефективність у терапії COVID‑19, щоправда не дексаметазону, а метилпреднізолону [10]. Крім цього, у зазначених рекомендаціях підходи, способи, засоби й дози препаратів практично збігаються з нашими, запропонованими для терапії геморагічних «пневмоній» і набряків легень ще 10 років тому [5-9] і рекомендованих нами в травні цього року [11].
Тепер ми можемо безпосередньо перейти до реалізації нашого досвіду у вигляді практичних рекомендацій.
Щодо терапії так званих геморагічних пневмоній, які по суті є набряком легень, – ураховуючи те, що SARS-CoV‑2 безпосередньо вражає альвеолоцити та ендотеліоцити, які є основною структурою альвеолярно-капілярної мембрани, що забезпечує газообмін, ефективність антивірусних препаратів на етапі інтерстиційного набряку легень, що вже розвивається, стає сумнівною, хоча вони й можуть якоюсь мірою знизити рівень очікуваної віремії, а отже – й токсинемії. Тому повністю відмовлятися від них навіть у пізні терміни початку етіотропного лікування все ж не можна. Як правило, антивірусна терапія ефективна в перші 24, максимум 48 і, рідко, 72 год від початку клінічних проявів.
Із групи противірусних препаратів із різним механізмом дії можна навести наступні: інгібітори вірусних полімераз (аналоги нуклеозидів і нуклеотидів) – рибавірин (Ribavirin), фавіпіравір (Favipiravir), фавілавір (Favilavir) і ремдесивір (Remdesivir); інгібітори вірусних протеаз – лопінавір+ритонавір (Lopinavirum+Ritonavirum); інтерферони (ІФН), зокрема й пролонговані (ІФН-α2a – Pegasys, ІФН-α2b – Pegintron), з акцентом на вищу ефективність β-ІФН (ІФН-β1а – Avonex, Rebif, Genfaxon, CinnoVex та ІФН-β1b – Betaseron). Уже навіть описані практично використовувані три- і двокомпонентні схеми терапії таких хворих.
Щоправда, застосування наведених засобів має доволі багато обмежень, коли очікуваний ефект від використання у хворого суттєво поступається ризику такої терапії, безпосередньо пов’язаної із загальновідомими побічними ефектами (токсичність) і ускладненнями. Наприклад, сьогодні утримуються від застосування ще донедавна популярних похідних 4-амінохіноліну (протималярійних гематошизотропних препаратів) – хлорохіну (делагіл – Delagil) і гідроксихлорохіну (Hydroxychloroquine), плаквеніл (Plaquenil), іммард (Immard) та ін.), оскільки поряд із цілковитим позбавленням доказової бази доведено достовірно вищу смертність у групі хворих, які їх отримували, порівняно з особами, лікованими за допомогою тільки патогенетичних і симптоматичних базисних засобів.
Дуже багато сподівань покладалося на згаданий вже ремдесивір (включений до протоколу лікування COVID‑19 в Україні), який, за даними американської компанії-розробника Gilead Sciences, має найбільші шанси показати позитивний результат у короткостроковій перспективі. Утім розробники довели, що цей лікарський засіб дає можливість прискорити одужання всього на 4 доби, а от зниження смертності виявилося дуже скромним – 8% проти 11,6% у контрольній групі, що фактично перебуває на межі статистичної похибки. Попри це, Управління з контролю якості харчових продуктів і медикаментів США (FDA) надало дозвіл застосовувати ремдесивір як препарат для екстреного використання. Та ейфорія щодо нього доволі швидко вщухла, адже китайські дослідники після проведеного у квітні масштабного плацебо-контрольованого дослідження встановили, що цей засіб практично ніяк не допомагає лікувати хворих на COVID‑19. За даними вчених, найважливіший параметр – смертність у тих, хто його приймав, статистично не відрізнялася порівняно з контрольною групою. А наданий авторитетною організацією дозвіл більше схожий на психологічний крок, покликаний заспокоїти суспільство й дати йому знак – мовляв, успіхи вже є.
Зазвичай пацієнтів ушпиталюють значно пізніше перших діб хвороби. Тому вирішальне значення в терапії пневмонії при COVID‑19 належить саме патогенетичним засобам, що мають істотні особливості та об’єктивні обмеження, пов’язані з патогенезом набряку легень, який перебігає на тлі масивного ураження ендотеліальної вистилки альвеол, мікроциркуляторного русла і високої активності цитокінового каскаду.
Перш за все навіть у початковій фазі цього набряку відбувається накопичення рідини і розширення альвеолярно-капілярної мембрани. Така ситуація відразу ж призводить до порушення дифузії кисню крізь цей бар’єр, хоча рівень дифузії вуглекислого газу залишається практично незмінним (його дифузійна здатність у 20-25 разів вища, ніж у кисню). При подальшому прогресуванні набряку порушується й дифузія вуглекислого газу. На цьому етапі такий набряк ще не виходить за межі інтерстицію і базальної мембрани альвеолоцитів і є по суті ще інтерстиційним. Незважаючи на відсутність пропотівання рідини в альвеоли, рівень гіпоксії може бути доволі значним і проявлятися наростаючими ознаками гострої дихальної недостатності у вигляді занепокоєння, відчуття нестачі повітря, швидко наростаючої задишки й ціанозу, хоча фізикальна картина в легенях доволі скупа і проявляється у вигляді жорсткого дихання, сухих хрипів, незначного аускультативного дифузного послаблення дихання. Зазначену гіпоксію можна зафіксувати за допомогою пульсоксиметра, який зареєструє падіння рівня сатурації крові киснем (нижче 96%). Рентґенологічно у фазі інтерстиційного набряку легень можна виявити тільки посилення легеневого малюнка. Але в цій ситуації нам допомагає комп’ютерна томографія, бо вона має вищу роздільну здатність і дає можливість виявити порушення в інтерстиційному просторі на різних етапах розвитку інтерстиційного набряку легень від вогнищевих до дифузних змін. Як зазначалося раніше, при COVID‑19 цей етап набряку легень досить тривалий, а розвиток альвеолярного набряку відстрочений.
Досвід показує, що саме момент переходу від інтерстиційного до альвеолярного набряку є критичним для хворих. Але при COVID‑19 поступово прогресуючий інтерстиційний набряк стає не менш небезпечним, оскільки хоч і поступово, але неухильно призводить до тяжкої гіпоксії з її вже незворотними наслідками.
Найбільш ефективною на цьому етапі розвитку набряку є патогенетична протинабрякова, ангіопротекторна та антигіпоксична терапія.
Незважаючи на скупість клінічних проявів, саме вони, й особливо їхня динаміка, здатні вказати на набряк легень, що розпочинається. Одним із таких симптомів є згадана раніше прогресуюча задишка, яку за жодних обставин не можна недооцінювати. Адже тільки на ранніх етапах інтерстиційного набряку легень надання невідкладної допомоги забезпечить видимий ефект від патогенетичної терапії. У разі прогресування до стадії альвеолярного набряку прогноз для життя хворого може стати вкрай несприятливим. Тому необхідно використовувати всі засоби інтенсивної терапії саме на ранніх етапах інтерстиційного набряку легень при COVID‑19.
Першочерговим завданням є дія на підвищену проникність капілярної ланки мікроциркуляції. Єдиними ефективними препаратами в цій ситуації, незважаючи на постійні дискусії про доцільність їх застосування, є глюкокортикоїди, які здатні блокувати провідні патогенетичні ланки набряку легень або ГРДС при COVID‑19. Вони мають виражену протинабрякову дію (найефективніший з них дексаметазон), мембраностабілізуючу (стабілізація мембран капілярних ендотеліоцитів і базальних мембран капілярів та альвеолоцитів), імуносупресивну (блокування імунних і автоімунних реакцій, що особливо важливо при цитокіновому штормі), антитоксичну, замісну й антистресову дію, а також сприяють репарації, стимулюючи клітинний геном.
Як показує досвід, добова доза глюкокортикоїдів має бути достатньо високою, вводитися тільки внутрішньовенно і в перерахунку на преднізолон має досягати не менше 300 мг/добу. Нагадаємо, що активність дексаметазону в 7,5 раза вища за таку преднізолону (1 ампула преднізолону містить 30 мг, а дексаметазону – 4 мг).
На ранніх етапах терапії перевагу треба віддавати дексаметазону з урахуванням його більш значущої протинабрякової дії в групі глюкокортикоїдів. Таке інтенсивне лікування зазвичай триває не більше 3-5 діб, використовується за життєвими показаннями і не може стати причиною імунодефіциту з наступними бактерійними ускладненнями.
При встановленні інтерстиційного набряку легень у хворих із тяжкими формами COVID‑19 екстрено починають внутрішньовенне струменеве (рідко-краплинне) введення водного розчину дексаметазону в початковій разовій дозі 90-120 мг у перерахунку на преднізолон, а потім через 1-3 год, залежно від первинного лікувального ефекту, наступна доза глюкокортикоїдів може бути збільшена до досягнення сумарної дози 300 мг у перерахунку на преднізолон, при цьому максимальна добова доза глюкокортикоїдів не має перевищувати 400 мг преднізолону.
Здебільшого за цей час вдається досягти очікуваного лікувального ефекту, а саме припинення прогресування або й регресу інтерстиційного набряку легень. Найбільшу ефективність методика має на початкових етапах зазначеного набряку. У разі відсутності чіткої позитивної динаміки терапія глюкокортикоїдами може бути продовжена до 3-5 діб. Дози і кратність введення дексаметазону визначають з урахуванням стану хворого і його динаміки. Зазвичай у наступні дні дози гормонів знижують, але кратність може зберігатися.
На жаль, у сучасній медицині поки немає методів ефективної терапії ушкоджень легеневих капілярів. Лікування таких хворих із ГРДС може бути тільки патогенетичним, з паралельним забезпеченням транспорту і дифузії кисню й вуглекислого газу в системі альвеолярно-капілярної мембрани або капіляр-штучної мембрани.
Особливістю протинабрякової терапії є те, що вона досить обмежена і жорстко пов’язана з об’ємом рідини, що вводиться з метою дезінтоксикації. Зазвичай парентерально вводять не більше 300-400 мл рідини, віддаючи перевагу дрібномолекулярним декстранам або нативним колоїдам, зокрема 10-20% розчину альбуміну. Щоправда, у таких випадках завжди варто зважати на небезпеку тромбоемболічних ускладнень, характерних для COVID‑19. Кристалоїдні розчини вводити не рекомендується через їх швидке проникнення в тканини, що неминуче призводить до посилення набряку.
Одночасно проводять заходи для «розвантаження» малого кола кровообігу. Використовують елементарні прийоми, які, попри їх простоту, можуть забезпечити позитивний ефект: це напівсидяче положення з опущеними ногами, відволікаючі гарячі ножні ванни, накладення венозних джгутів на кінцівки. Застосування гангліоблокаторів для «безкровного кровопускання», з метою зниження тиску в малому колі кровообігу і депонування крові на периферії, практично неможливе через небезпеку системного зниження артеріального тиску і порушення тканинної перфузії, що вже й без того страждає від гіпоксії. Така ж мотивація присутня і щодо звичайного кровопускання, оскільки ефективною при набряку легень може бути евакуація не менше 500 мл крові. Крім того, на тлі ДВЗ-синдрому цей метод дуже небезпечний. Для розвантаження малого кола кровообігу можна використовувати 2,4% розчин еуфіліну по 10 мл внутрішньовенно.
Як ефективний протинабряковий засіб доцільно використовувати фуросемід у дозах 60-120 мг на введення і за потреби застосовувати його й надалі під контролем гемодинаміки та ефективності комплексної терапії. Використання осмотичних діуретиків вважається небезпечним. Так, сечовина вільно проникає в інтерстиційний простір, тим самим посилюючи набряк тканин, а в разі застосування манітолу має місце фаза різкого підвищення внутрішньосудинного об’єму крові, що також може зумовити посилення набряку. Тому найбільш безпечним засобом, правда, уже онкотичної протинабрякової терапії, є 20% розчин альбуміну. Проте при прогресуванні набряку легень і його переході в альвеолярну фазу можливе застосування й осмотичних діуретиків – уже за життєвими показаннями. На думку деяких авторів, перевагу при набряку легень має сечовина за умови її введення у вигляді 30% розчину в дозі 1-1,5 г/кг зі швидкістю 30-60 крапель за хвилину. Проте ми вважаємо таку перевагу сумнівною.
Для усунення гіпоксії винятково важливу роль відіграє киснева терапія, від інгаляційної до екстракорпоральної. Інгаляційна оксигенотерапія по суті зводиться до збільшення парціального тиску кисню у вдихуваній хворим газової суміші. Застосування чистого кисню можливе, але лише впродовж короткого періоду часу, оскільки, як сильний окислювач, він сам додатково пошкоджує альвеолярно-капілярні мембрани. Найоптимальнішими і безпечнішими вважають повітряно-кисневі суміші з вмістом кисню не більше 60% за об’ємом (зазвичай 40-50%) і швидкістю введення через носові катетери 4-6 л/хв.
Клінічна практика показує, що використання ШВЛ із підвищеним тиском на видиху нерідко негативно впливало на стан хворих. Найбільш результативною на ранніх етапах виявляється терапія простою киснево-повітряною сумішшю через носові катетери, ефектно іменована «неінвазивною ШВЛ». При цьому можуть використовуватися кисневі концентратори, або сучасні апарати для ШВЛ. Відтак переведення хворого на ШВЛ має бути обґрунтоване і зумовлене неконтрольованим зниженням насичення артеріальної крові киснем. Основна мета оксигенотерапії – підтримка сатурації артеріальної крові киснем на рівні не нижче 90%. Критерії переведення пацієнтів із COVID‑19 на ШВЛ достатньо чітко описані в офіційних протоколах – «Стандарти медичної допомоги “Коронавірусна хвороба (COVID‑19)”», «Стандарт екстреної медичної допомоги “Коронавірусна хвороба (COVID‑19)”», Протокол «Надання медичної допомоги для лікування коронавірусної хвороби (COVID‑19)», які затверджені наступними наказами МОЗ: від 28.03.2020 № 722 «Організація надання медичної допомоги хворим на коронавірусну хворобу (COVID‑19)», від 02.04.2020 № 762 «Про затвердження протоколу “Надання медичної допомоги для лікування коронавірусної хвороби (COVID‑19)”», від 10.04.2020 № 852 «Про внесення змін до протоколу “Надання медичної допомоги для лікування коронавірусної хвороби (COVID‑19)”», від 16.06.2020 № 1411 «Про внесення змін до стандартів медичної допомоги “Коронавірусна хвороба (COVID‑19)”». Готується черговий наказ, який доповнює чинний протокол і дозволяє застосування дексаметазону.
Незважаючи на всі можливі негативні ефекти ШВЛ, хворих на COVID‑19 при прогресуючому інтерстиційному набряку легень і, особливо, при загрозі розвитку альвеолярного набряку, що супроводжується значною гіпоксією, необхідно перевести на ШВЛ із використанням її спеціальних режимів – з постійним позитивним тиском або підвищеним тиском при видиху. Використовуються також високочастотні режими ШВЛ, а також осциляторна модуляція дихання. Інші режими ШВЛ у хворих на COVID‑19 на сьогодні ще не розроблені.
На жаль, у разі значного пошкодження функції альвеолярно-капілярної мембрани будь-які варіанти ШВЛ, навіть із високим вмістом кисню у вдихуваній суміші, не можуть привести до адекватного насичення крові киснем і ефективного виведення вуглекислого газу. У цій ситуації залишається єдиний шлях, здатний забезпечити оксигенацію крові, – екстракорпоральна мембранна оксигенація (ЕКМО). Фактично це апарат «штучних легень». Розробка й практичне застосування таких апаратів було почато ще в 70-х роках минулого століття. Сьогодні вони стали ефективнішими і більш доступними для практичного використання, але їх застосування ще дуже дороге й обмежене, а ефективність залишається недостатньою. Проте варто зазначити, що саме розробка апаратів для ЕКМО та їх поєднання з використанням перфторану («штучної крові») може бути чи не єдиним реальним і перспективним засобом для хворих із пошкодженням альвеолярно-капілярних мембран легень. Альвеолярно-капілярний сектор легень має дуже високий регенераторний потенціал, тому ефективна тимчасова «заміна» його основних функцій ЕКМО, за відсутності подальшого пошкодження, уможливлює відновлення пошкоджених тканин цього життєво важливого органа.
Особливе значення ЕКМО має при альвеолярному важко керованому набряку легень, оскільки навіть масивна та інтенсивна терапія нерідко в цій ситуації виявляється безуспішною і потребує окремого розгляду.
За відсутності позитивної динаміки від застосування інтенсивної протинабрякової терапії і ШВЛ навіть на стадії інтерстиційного набряку легень необхідно вимушено використовувати ЕКМО, спершу як допоміжний екстрений засіб при використанні невідкладної протинабрякової терапії та апаратів ШВЛ для повнішого заміщення й ефективної модуляції газообмінної функції легень. Надалі нерідко необхідний повний перехід на ЕКМО.
На стадії декомпенсованого розгорнутого набряку легень ЕКМО залишається єдиним ефективним способом екстреної терапії.
ЕКМО здійснюють за допомогою відповідних апаратів, серед яких перевагу віддають мембранним оксигенаторам (МОКНУВ), які забезпечують найвищий рівень насичення крові киснем, максимальне виведення вуглекислого газу і мінімальний рівень ушкодження формених елементів крові (тромбоцитів і еритроцитів).
Застосування ЕКМО при геморагічній пневмонії також засноване на тому, що пошкодження легень при COVID‑19 є потенційно зворотним завдяки високій регенеративній активності їх альвеолярно-капілярного сегменту, а корекція гіпоксії дає можливість ефективно відновити газообмінну функцію легень, після чого ЕКМО може бути відмінена.
У хворого з пневмонією COVID‑19 на стадії інтерстиційного набряку легень при прогресуючій гіпоксемії впродовж декількох годин (зменшення парціального тиску кисню в артеріальній крові нижче 50 мм рт. ст. – РаO2, що приблизно відповідає сатурації 80-85% – SpO2) і вичерпанні можливостей і ресурсів інтенсивної протинабрякової терапії та ШВЛ із застосуванням різних режимів і навіть дихальної суміші зі 100% кисню як допоміжний спосіб екстреної замісної й моделюючої газообмінної функції легень використовують зовнішні апарати для штучної оксигенації крові, переважно МОКНУВ, не припиняючи протинабрякову терапію і ШВЛ.
За відсутності ефекту, а також під час переходу інтерстиційного набряку в альвеолярний ШВЛ у режимах корекції газообмінної функції легень припиняють як недоцільну, ураховуючи можливість механічного пошкодження легень і прямої токсичної дії високопроцентних кисневих сумішей на їх тканину, і застосовують МОКНУВ як основний екстрений засіб замісної та моделюючої газообмінної функції. У такій ситуації ШВЛ використовують тільки в режимі забезпечення функціонального спокою легень, а не корекції гіпоксемії (для максимального сприяння регенерації) з низьким піковим тиском газової суміші і низькою частотою вентиляції. Застосування ШВЛ у цьому випадку потрібне для того, щоб легені остаточно не «спалися», чому необхідно запобігти для повного і коректного відновлення легеневої тканини.
Підключення ЕКМО в кровоносну систему хворого проводять за вено-венозною або вено-артеріальною схемою, що, своєю чергою, вимагає спеціальної корекції гемостазу і постійного застосування антикоагулянтів. Але при COVID‑19 має місце ДВЗ-синдром із тривалою стадією гіперкоагуляції, що дещо спрощує застосування ЕКМО в цій групі пацієнтів.
Для забезпечення максимального насичення крові киснем в оксигенаторі та для максимального зменшення використання антикоагулянтів апарат МОКНУВ підключають за вено-венозною схемою (відмежування і повернення оксигенованої крові з венозного русла хворого з використанням великих периферичних вен), але можливе підключення і за вено-артеріальною. Ці способи підключення можуть бути виконані індивідуально для конкретного пацієнта.
У будь-якому разі проведення ЕКМО має здійснюватися тільки під ретельним динамічним контролем активності систем коагуляції та антикоагуляції. Можливий розвиток кровотечі в таких пацієнтів необхідно перевести з розряду абсолютних до розряду відносних протипоказань.
Після відновлення газообмінної функції легень, яка встановлюється за показниками стабілізації парціального тиску кисню (поступово до норми – 92-98 мм рт. ст. – РаO2, що приблизно відповідає сатурації 95-98% – SpO2) в артеріальній крові, при поступовому «відлученні» хворого від ЕКМО вона може бути повністю припинена.
За умови необхідної кваліфікації персоналу ЕКМО може бути застосована на базі звичайного стаціонарного відділення інтенсивної терапії і реанімації багатопрофільної лікарні. Та, на жаль, вартість цього методу дуже висока, а її доступність винятково обмежена передусім з огляду на потребу значного лікарського й технічного ресурсу.
У багатьох клінічних дослідженнях хворих на пневмонію COVID‑19 обнадійливі результати показує застосування оксиду азоту – селективного легеневого вазодилататора, який знижує опір легеневих судин, покращуючи відповідність вентиляції та перфузії тканини легень.
З огляду на згадану тропність SARS-CoV‑2 до ендотелію капілярів, не останнє місце в лікуванні може посісти використання ангіо- і кардіопротекторних засобів. Зокрема, багатообіцяючими видаються вітчизняні препарати кверцетину – квертин і корвітин.
Відомо, що кверцетин є свого роду пасткою для вільних радикалів і має здатність активувати ферменти власного антиоксидантного захисту організму. Він чинить протизапальну дію завдяки блокаді ліпооксигеназного шляху метаболізму арахідонової кислоти, зниженню синтезу лейкотрієнів, серотоніну та інших медіаторів запалення [12].
Сьогодні інтерес до кверцетину як засобу профілактики та лікування COVID‑19 при всій гостроті цієї проблеми знайшов свій відгук у багатьох науковців та клініцистів. Зокрема, у протоколі (EVMS Medical Group) ведення пацієнтів із COVID‑19 для зниження тяжкості перебігу захворювання в особливо вразливих групах пацієнтів (наприклад, в осіб віком понад 60 років), а також у хворих із легкою симптоматикою рекомендується застосовувати комбінацію кверцетину та вітаміну С по 250-500 мг двічі на добу. Таке лікування знижувало ризик пошкодження клітин, а також зменшувало вміст маркерів запалення [13, 14].
З огляду на ускладнення з боку серцево-судинної системи, спричинені впливом як самого коронавірусу, так і препаратів, які застосовують при лікуванні COVID‑19 [15-17], актуальними є дані про кардіопротекторний вплив кверцетину, отримані в низці доклінічних досліджень. Кардіопротекторна дія кверцетину проявляється багатьма позитивними ефектами, серед яких особливо значущими є обмеження зони некрозу міокарда, запобігання його реперфузійному ураженню; а також антиаритмічна, антиішемічна, антитромботична дія, встановлені при лікуванні гострого коронарного синдрому, гострого інфаркту міокарда та гострої серцевої недостатності [18]. Встановлено також його захисний вплив на ендотелій судин, що має неабияке значення, оскільки при COVID‑19 неминуче розвивається ендотеліальна дисфункція [19].
Окремим важливим питанням є призначення антибіотиків при цій патології. Не підлягає сумніву, що антибактеріальна терапія таких пацієнтів неприпустима, навіть зважаючи на «профілактичну» мету зазначеного лікування. Дуже чітким об’єктивним критерієм на користь антибіотикотерапії є рівень прокальцитоніну понад 0,1 нг/мл. За таких обставин перевага надається антибіотикам широкого спектра дії.
Література
- Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study / N. Chen, M. Zhou, X. Dong [et al.] // The Lancet. – 2020. – Vol. 395. – P. 507-513. www.thelancet.com Published online January 29, 2020 https://doi.org/10.1016/S0140-6736(20)30211-7
- Новый коронавирус, вызывающий заболевание человека / Л.Ф. Стовба, В.Н. Лебедев, А.А. Петров [и др.] // Проблемы особо опасных инфекций. – 2015. – Вып. 2. – С. 68-74.
- Gralinski L.E. Molecular pathology of emerging coronavirus infections / L.E. Gralinski, R.S. Baric // J. Pathol. – 2015. – Vol. 235. – P. 185-195. https://doi.org/ 10.1002/path.4454
- Pulmonary pathology of early-phase 2019 novel coronavirus (COVID‑19) pneumonia in two patients with lung cancer / S. Tian, W. Hu, L. Niu et al. // J. Thorac. Oncol. – 2020. – № 20. – Р. 30132-30135.
- Бондаренко А.М. Грип А/H1N1 – реалії та особливості / А.М. Бондаренко // Інфекційні хвороби. – 2009. – № 4. – С. 96-102.
- Копча В.С. Грипп: пневмония или отек легких? Особенности патогенеза и лечения / В.С. Копча, А.Н. Бондаренко // Здравоохранение Белоруссии. – 2011. – № 2. – С. 44-49.
- Патент 63098. Україна, МПК A61К 31/573 (2006.01). Спосіб лікування грипозного геморагічного набряку легень / А.М. Бондаренко, М.А. Андрейчин, В.С. Копча. – № u 2011 02908; Заявлено 12.03.2011; Опубл. 26.09.2011, Бюл. № 18.
- Копча В.С. Патогенетичне обґрунтування лікування хворих на грип та інші ГРВІ / В.С. Копча, Ю.В. Копча // Інфекційні хвороби – 2014. – № 4(78). – С. 64-70.
- Патент 126606. Україна, МПК А61Р 11/00 (2006). Cпосіб лікування ушкодження легень грипозної етіології / А.М. Бондаренко, Л.А. Бондаренко. – № u 2018 01041; Заявлено 05.02.2018; Опубл. 25.06.2018, Бюл. № 12.
- Попередження та лікування COVID‑19. Частина 2: Діагностика та лікування. – 2020. E-resources: https://donor.ua/pages/2335
- Бондаренко А.М. Роздуми стосовно лікувальної та профілактичної перспективності різних засобів при COVID‑19 / А.М. Бондаренко, В.С. Копча // Інфекційні хвороби. – 2020. – № 2(100). – С. 46-54.
- Перспективи вивчення застосування препаратів кверцетину в лікуванні COVID‑19 / І.А. Зупанець, О.А. Голубовська, А.В. Шкурба [та ін.] // Укр. мед. часопис. – 2020. – № 2(1). E-resources: https://www.umj.com.ua/article/177136/perspektivi-vivchennya-zastosuvannya-preparativ-kvertsetinu-v-likuvanni-covid‑19
- The effect of quercetin supplementation on selected markers of inflammation and oxidative stress / G. Askari, R. Ghiasvand, A. Feizi [et al.] // J. Res. Med. Sci. – 2012. – Vol. 6. – P. 637-641.
- A made-in-Canada solution to the coronavirus outbreak? / N. Taylor-Vaisey. – 2020. E-resources: https://www.macleans.ca/news/canada/a-made-in-canada-solution-to-the-coronavirus-outbreak/
- Coronavirus as a possible cause of severe acute respiratory syndrome / J.S. Peiris, S.T. Lai, L.L. Poon [et al.] // Lancet. – 2003. – Vol. 361. – P. 1319-1325.
- Handbook of COVID‑19. Prevention and Treatment / Т. Liang (Ed.). – Zhejiang University School of Medicine, 2020. – 60 p.
- Traditional chinese medicine in the treatment of patients infected with 2019-new coronavirus (SARS-CoV‑2): a review and perspective / Y. Yang, M.S. Islam, J. Wang [et al.] // Int. J. Biol. Sci. – 2020. – Vol. 16(10). – P. 1708-1717.
- Endothelial cell infection and endotheliitis in COVID‑19 / Z. Varga, A.J. Flammer, P. Steiger [et al.] // Lancet. – 2020. – Vol. 395(10234). – P. 1417-1418. doi: 10.1016/S0140-6736(20)30937-5
- Лук’янчук В.Д. Кінетика вільнорадикальних реакцій у щурів з медикаментозним гепатитом при застосуванні таблеток «Кверцетин» / В.Д. Лук’янчук, А.Г. Войтенко // Фармакологія та лікарська токсикологія. – 2008. – № 1-3. – С. 52-57.
Тематичний номер «Пульмонологія, Алергологія, Риноларингологія» № 3 (52), 2020 р.