24 січня, 2021
Основні напрями використання ітоприду гідрохлориду в лікуванні патології шлунково-кишкового тракту
 Актуальність проблеми порушень моторної функції шлунково-кишкового тракту (ШКТ) за останні десятиліття значно зросла, що пов’язано з великою поширеністю у світі та в Україні цієї патології. Удосконалення фармакотерапії порушень моторики ШКТ і широке впровадження сучасних лікарських засобів у клінічну практику є на сьогодні важливим завданням внутрішньої медицини.
Актуальність проблеми порушень моторної функції шлунково-кишкового тракту (ШКТ) за останні десятиліття значно зросла, що пов’язано з великою поширеністю у світі та в Україні цієї патології. Удосконалення фармакотерапії порушень моторики ШКТ і широке впровадження сучасних лікарських засобів у клінічну практику є на сьогодні важливим завданням внутрішньої медицини.
Як відомо, порушення моторної функції стравоходу, шлунка, кишечнику, жовчного міхура й біліарних сфінктерів є основою диспепcії [4]. Пацієнтів, які звертаються по медичну допомогу зі скаргами, що спостерігаються при цій патології, клініцисти розподіляють на 2 групи. До 1-ї групи належать особи з вираженими симптомами диспепсії, проте під час обстеження цих хворих не виявляються будь-які органічні чи морфологічні зміни. Таким пацієнтам зазвичай установлюють діагноз есенціальної, ідіопатичної, невиразкової чи функціональної диспепсії (ФД). У пацієнтів, які належать до 2-ї групи (зі встановленою органічною патологією), симптоми диспепсії зменшуються чи зникають при успішному лікуванні основного захворювання. У цьому випадку диспепсія має вторинний характер, але провідною патогенетичною ланкою розвитку симптомів є порушення моторної функції ШКТ. Найчастіші причини диспепсії вторинного характеру представлено в таблиці 1 [18].
Моторна функція ШКТ є важливим компонентом процесу травлення, що забезпечує механічну обробку їжі, її просування вздовж травного каналу в суворій відповідності до періодів хімічної переробки в різних відділах. Моторна активність шлунка проявляється рецептивним й адаптивним розслабленням, перистальтичними хвилями. Відомо, що в здорової людини натще періодично виникають перистальтичні скорочення стінки шлунка тривалістю близько 20 с. Після прийому їжі відбувається процес акомодації (розслаблення) фундального відділу шлунка, що сприяє прийому більшого об’єму їжі. Змішування їжі зі шлунковим соком відбувається за допомогою перистальтичних скорочень стінки шлунка, що забезпечують фазову й тонічну його діяльність. Евакуація шлункового вмісту здійснюється завдяки градієнту тиску, котрий існує між шлунком і дванадцятипалою кишкою (ДПК). Важливу роль у процесі евакуації відіграє антродуоденальна координація – синхронне розслаблення воротаря при скороченні антрального відділу шлунка [5, 9].
Регуляція моторики ШКТ має багато складових і є скоординованою. Стан центральної нервової системи, психоемоційний фон впливають на вегетативну нервову систему, при цьому змінюється активність непосмугованих м’язів і залоз внутрішньої секреції травної системи. Місцева регуляція моторики ШКТ здійснюється автономною (ентеральною) нервовою системою (ЕНС), яка локалізується в стінці травного каналу – від стравоходу до прямої кишки. ЕНС складається щонайменше з 10 млрд нейронів, які представлені сплетеннями Ауербаха та Мейснера. Регуляція ЕНС здійснюється на центральному, сегментарному рівнях і безпосередньо на місцевому. ЕНС бере участь у моторній, ендокринній і мікроциркуляторній регуляції ШКТ, імунних і запальних процесах. Реалізаторами моторної активності ШКТ є міоцити – клітини непосмугованих м’язів травного каналу, що мають різноманітний рецепторний апарат. Завдяки великій кількості рецепторів міоцит взаємодіє з багатьма нейронами та нейротрансмітерами, одна частина котрих діє безпосередньо на саму клітину, інша – опосередковано через нервову систему. Основними медіаторами ЕНС є ацетилхолін, норадреналін, серотонін, дофамін, оксид азоту, енкефаліни, простагландини, кініни, гістамін та ін. У регуляції моторної активності ШКТ також беруть участь інтерстиціальні клітини Кахаля, котрі є водіями стійкого ритму в різних відділах ШКТ. Клітини Кахаля не лише безпосередньо генерують повільні хвилі в непосмугованих м’язах травного каналу, але й виконують роль інтермедіаторів нейром’язової трансмісії (передачі імпульсів від нервової тканини на міоцити непосмугованих м’язів травного каналу) [8, 29].
Визначальну роль у розвитку моторної дисфункції ШКТ відіграють такі порушення: зміна чутливості та структури рецепторного апарату чи біоелектричних властивостей міоциту непосмугованих м’язів ШКТ, а також дисбаланс нейромедіаторів, нейропептидів, гастроінтестинальних гормонів. Наприклад, ацетилхолін, серотонін, гістамін, холецистокінін, ангіотензин, мотилін і гастрин стимулюють моторну функцію, а дофамін, норадреналін, глюкагон, вазоактивний інтестинальний поліпептид і соматостатин пригнічують її [9, 17].
Стимуляція волокон n. vagus із подальшим вивільненням ацетилхоліну, а також блокада дофамінових (D2) рецепторів призводять до посилення моторної активності шлунка, а стимуляція симпатичної нервової системи – до гальмування його моторики. Гастроінтестинальні пептиди (секретин, шлунковий інгібіторний пептид, холецистокінін) також гальмують моторику шлунка. У регуляції моторної активності біліарної системи теж беруть участь парасимпатичні та симпатичні відділи ЕНС, ендокринна система, що забезпечує синхронізовану послідовність скорочень і розслаблень жовчних шляхів і сфінктерного апарату [9]. Міоцити кишечнику містять різні рецептори: холінергічні, дофамінові, опіатні, 5-НТ4-рецептори тощо. Гуморальна регуляція здійснюється як на системному рівні, так і за рахунок секреції різних інтестинальних гормонів, які взаємодіють з ЕНС. Таким чином реалізується узгоджена робота різних відділів ШКТ. Водночас ураження одного відділу ШКТ унаслідок руйнування цих взаємозв’язків призводить до залучення в процес інших [29].
Розлади моторної функції ШКТ визначають особливості клінічної симптоматики та сприяють прогресуванню й тяжчому перебігу хвороби. Порушення моторики шлунка та ДПК (розлади акомодації шлунка, уповільнення евакуації вмісту зі шлунка, порушення ритму його перистальтики й антродуоденальної координації) є провідними патогенетичними факторами ФД [10, 21]. У 75% пацієнтів із ФД виявляються різноманітні порушення моторики ШКТ: уповільнення евакуаторної функції шлунка, зниження частоти й амплітуди перистальтики, порушення антродуоденальної координації, послаблення постпрандіальної моторики антрального відділу, порушення рецептивної й адаптивної релаксації шлунка, що призводить до порушення розподілення їжі в шлунку та спричиняє відчуття швидкого насичення їжею, порушення циклічної активності шлунка в період між процесами травлення – тахі-, брадигастрія, антральна фібриляція [18, 47].
Причинами дискомфорту, важкості у верхній половині живота можуть бути гастро- й дуоденостаз, які зумовлені послабленням моторики антрального відділу шлунка та порушенням антродуоденальної координації. Печія, відрижка, гіркота в роті, нудота, блювання нерідко є клінічними проявами гастроезофагеального й дуоденогастрального рефлюксів. Розлади акомодації спричиняють виникнення симптому раннього насичення їжею [4].
Залежно від того, на якому етапі розвитку хвороби виникають розлади моторної функції різних відділів ШКТ, усі захворювання, перебіг яких супроводжується таким порушенням, поділяють на захворювання, при котрих порушення моторної функції ШКТ виконують роль первинного патогенетичного фактора, та захворювання, при котрих приєднання цих порушень відбувається вторинно на тлі тривалого перебігу основного захворювання [45].
Первинні порушення моторики тих чи інших відділів травного каналу спостерігаються при гастроезофагеальній рефлюксній хворобі (ГЕРХ), дискінезіях стравоходу (дифузний і сегментарний езофагоспазм, кардіоспазм), дискінезіях жовчовивідних шляхів, функціональних гастроінтестинальних розладах, у тому числі при ФД, первинному (ідіопатичному) гастрапарезі, синдромі подразненого кишечнику (СПК), функціональних закрепах. Вторинні порушення моторної функції ШКТ можуть виникати в пацієнтів із ЦД (діабетичний гастропарез і синдром діабетичної кишкової псевдообструкції). Такі порушення зумовлені діабетичною нейропатією (ураженням нервових закінчень у стінці шлунка та кишечнику, що відповідають за нормальну перистальтику ШКТ). Послаблення моторної активності ШКТ відбувається при системній склеродермії внаслідок розростання сполучної тканини в стінці шлунка та кишечнику із заміщенням нею м’язових волокон і змінами судин. Вторинні порушення моторики ШКТ спостерігається також у разі гіпотиреозу, дерматоміозиту, амілоїдозу, захворювань центральної нервової системи (хвороба Паркінсона, розсіяний склероз), після травм спинного мозку. Часто клінічні ознаки гіпомоторної функції шлунка є першими проявами гіпотиреозу [22, 28].
Препаратами вибору для лікування порушень моторної функції ШКТ є прокінетики. Це велика група фармакологічних препаратів, які на різних рівнях і за допомогою різних механізмів посилюють моторну, а саме пропульсивну активність ШКТ і запобігають антиперистальтичним скороченням непосмугованих м’язів. Їхня прокінетична дія зумовлена впливом на різні рецептори: ацетилхолінові, дофамінові, рецептори мотиліну й серотоніну. Унаслідок застосування прокінетиків підвищується тонус нижнього стравохідного сфінктера, покращуються евакуаторна функція шлунка, антродуоденальна координація, продуктивна перистальтика кишок, скоротлива здатність жовчного міхура [5, 34].
Метааналіз 14 досліджень, які включали 1053 пацієнтів із ФД, показав вірогідно вищу ефективність прокінетиків (61%) порівняно з плацебо (41%) [11, 26].
Ідіопатичний гастропарез як порушення евакуаторної функції шлунка, що часто зумовлена нервово-психічними факторами, поряд зі звичайною психофармакологічною корекцією потребує застосування прокінетиків [30].
При обстипаційному варіанті СПК із закрепами, а також при функціональному закрепі спостерігається зменшення кількості високоамплітудних пропульсивних скорочень товстої кишки (high-amplitude propagated contractions, HAPCs), що свідчить про патогенетичне обґрунтування застосування прокінетиків. Лікування вторинних порушень моторної функції ШКТ за допомогою прокінетиків необхідно проводити на тлі адекватної терапії основного захворювання [17, 24].
У сучасній клінічній медицині виділяють такі класи прокінетиків [9, 22, 35]:
- агоністи холінергічних рецепторів і блокатори ацетилхолінестерази (АЦХ): карбахолін, фізостигмін, прозерин (не застосовуються в клінічній практиці через системну холінергічну дію);
- агоністи мотилінових рецепторів: антибіотики-макроліди – еритроміцин (застосовується у вигляді коротких курсів для лікування післяопераційного парезу шлунка та кишечнику), алемцинал, митемцинал, атилмотин (на стадії вивчення), ґрелін (має тяжкі побічні ефекти: проникає крізь гематоенцефалічний бар’єр, збільшує продукцію гормону росту, призводить до розвитку ожиріння й підвищує ризик акромегалії);
- агоністи опіоїдних рецепторів: альвімопан (ефективний у хворих у разі парезу кишечнику, після колектомії та гістероектомії);
- агоністи μ- та κ-опіоїдних рецепторів: тримебутин (може діяти як прокінетик за рахунок впливу на μ-опіоїдні рецептори та як спазмолітик за рахунок впливу на κ-опіоїдні рецептори), є ефективним у разі парезу кишечнику, СПК із болем і закрепами;
- агоністи 5НТ4-серотонінових рецепторів (цизаприд, тегасерод, прукалоприд): у сучасній клінічній практиці заборонено застосування цизаприду, що спричиняє подовження інтервалу Q-T і підвищує ризик злоякісних аритмій, а також тегасероду через підвищення ризику розвитку гострих серцево-судинних ускладнень (інфаркту міокарда, інсульту);
- антагоністи дофамінових рецепторів центральної та периферичної дії (метоклопрамід) і переважно периферичної дії (домперидон);
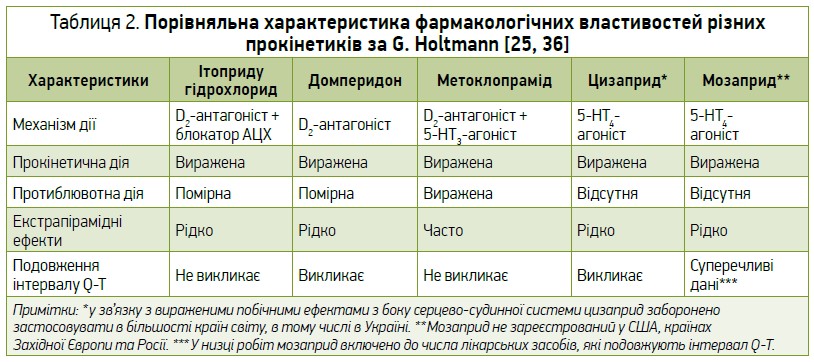
- ітоприду гідрохлорид – препарат із комбінованим механізмом дії (має властивості антагоніста периферичних дофамінергічних рецепторів 2 типу (D2-антагоніст) і блокатора АЦХ) (табл. 2).
Серед прокінетиків виділяють препарати І генерації: метоклопрамід і домперидон. Метоклопрамід є антагоністом дофамінових D2-рецепторів, серотонінових 5-НТ4-рецепторів, у високих дозах має здатність блокувати 5-НТ3-рецептори, що зумовлює його протиблювотну дію. Проте за рахунок високої проникності крізь гістогематичні бар’єри метоклопрамід часто зумовлює екстрапірамідні розлади (м’язовий гіпертонус, спазм м’язів обличчя, гіперкінези), спричиняє небажані прояви з боку центральної нервової системи (головний біль, сонливість, запаморочення, відчуття страху, занепокоєння, депресія), а також гормональні розлади (гіперпролактинемія, галакторея, порушення менструального циклу, гінекомастія, гіперальдостеронізм).
Домперидон є селективним блокатором периферичних D2-рецепторів, не проникає крізь гематоенцефалічний бар’єр, завдяки чому не має побічних ефектів, які притаманні метоклопраміду. Проте домперидон майже не впливає на тонус нижнього стравохідного сфінктера. Найбільш суттєвими побічними діями домперидону є гіперпролактинемія та пов’язані з нею гінекомастія, галакторея й аменорея. Частота гіперпролактинемії при стандартному курсі лікування становить 1,3%. Також можливий розвиток екстрапірамідних розладів, спазмів кишечнику, шкірних висипів, кропив’янки, свербежу, сухості в роті, головного болю, діареї. Крім того, домперидон має здатність блокувати калієві канали hERG (IKr) провідної системи серця, подовжувати фазу реполяризації шлуночків і збільшувати тривалість інтервалу Q-T, що зумовлює розвиток злоякісних аритмій. Зазначений ризик збільшується при одночасному прийомі препаратів, які метаболізуються в печінці, як і домперидон, за допомогою системи CYP3A4, у результаті чого підвищується концентрація домперидону в крові [28]. У деяких епідеміологічних дослідженнях було показано, що застосування домперидону може бути пов’язано з підвищенням ризику розвитку злоякісних шлуночкових аритмій або раптової смерті. Антациди й антисекреторні препарати знижують біодоступність антихолінергічних засобів і послаблюють дію домперидону [24].
Ітоприду гідрохлорид є прокінетиком із комбінованим механізмом дії. Цей лікарський засіб розроблено японською компанією Hokuriku Seiyaker Co. Ltd. Препарат застосовується для лікування пацієнтів із гастроентерологічними захворюванннями з 1995 року [24]. Ітоприду гідрохлорид є антагоністом D2-дофамінових рецепторів і блокатором АЦХ. Блокування D2-рецепторів сприяє збільшенню активності аденілатциклази та рівня циклічного аденозинмонофосфату в непосмугованих м’язах страховоду, шлунка, ДПК, унаслідок чого підвищується їхня моторна активність. Через те що щільність D2-рецепторів є вищою у верхніх відділах ШКТ, препарат діє більше на верхні відділи (стравохід, шлунок, ДПК) і підвищує також тонус м’язів тонкої й товстої кишок. Ітоприду гідрохлорид посилює тонус нижнього стравохідного сфінктера, в такий спосіб зменшує вірогідність виникнення гастроезофагеального рефлюксу. Засіб активує вивільнення ацетилхоліну та перешкоджає його деградації, пролонгує вплив, що супроводжується посиленням пропульсивної моторики шлунка та підвищенням перистальтичної активності тонкої й товстої кишок. Завдяки взаємодії з D2-дофаміновими хеморецепторами тригерної зони ітоприду гідрохлорид чинить протиблювотну дію. Ітоприду гідрохлорид не впливає на рівень гастрину сироватки крові, а також на кислотність. Модуляторний вплив на гіпоталамо-гіпофізарно-адреналову систему ітоприду гідрохлориду відбувається через підвищення концентрації соматостатину, мотиліну, зниження рівня холецистокініну й адренокортикотропного гормону [29]. Препарат метаболізується флавінозалежною монооксигеназою FMOs-FMO3 і не взаємодіє із системою цитохрому Р450 (з ізоферментами СYP2C19 і CYP2E1), що важливо при одночасному прийомі лікарських засобів, які конкурують за коферментну систему, й дає змогу знизити вірогідність небажаної взаємодії препаратів [23, 24].
Ітоприду гідрохлорид швидко та практично повністю всмоктується в ШКТ, його відносна біодоступність становить 60%, що спричинено метаболічними змінами при першому проходженні через печінку під дією флавінозалежної монооксигенази. На біодоступність препарату не впливає їжа. Зазначені механізми дії ітоприду гідрохлориду визначають його терапевтичне значення для лікування моторних розладів при різних захворюваннях ШКТ [25].
Ефективність ітоприду гідрохлориду в лікуванні пацієнтів із захворюваннями верхніх відділів ШКТ із проявами диспепсичного синдрому, зокрема ФД, має велику доказову базу [31]. Важливою перевагою ітоприду гідрохлориду порівняно з іншими прокінетиками є його високий профіль безпеки, про що було спеціально зазначено в Римських критеріях функціональних розладів ІV перегляду [11, 33]. У багатьох рандомізованих клінічних дослідженнях (РКД), які проводилися в Японії, Індії, Китаї, Австралії, деяких країнах Європи, вивчалася ефективність ітоприду гідрохлориду при ФД, хронічному гастриті, ГЕРХ [32, 46, 49].
Японськими дослідниками ще в 90-х роках ХХ ст. доведена ефективність ітоприду гідрохлориду при ФД у 80-90% пацієнтів. Пізніше в Індії було проведено низку досліджень, які показали, що застосування ітоприду гідрохлориду приводить до помірного полегшення чи повного зникнення симптомів у 73-100% пацієнтів із ФД. Побічні ефекти при лікуванні цим препаратом виникали рідко. У дослідженнях не було відзначено клінічно значущих змін на електрокардіограмі, насамперед збільшення інтервалу Q-T [37, 41, 51].
Результати рандомізованого подвійного сліпого плацебо-контрольованого дослідження щодо ефективності застосування препарату при ФД зі включенням 554 пацієнтів, яке було проведено в Австралії, свідчать про те, що через 8 тиж лікування клінічні симптоми диспепсії повністю зникли чи значно зменшилися в 57, 59 і 64% хворих, які отримували ітоприду гідрохлорид (у дозах 50, 100 та 200 мг 3 рази на добу відповідно). Аналіз кінцевої точки дослідження – усунення болю й відчуття переповнення – виявив, що пацієнти, котрі отримували ітоприду гідрохлорид, відповіли на лікування краще порівняно з групою плацебо (73% проти 63%; р=0,04). У дослідженні не було виявлено впливу ітоприду гідрохлориду на тривалість інтервалу Q-T, а також не було відзначено змін рівня пролактину в крові [37, 48].
Одним із перших європейських досліджень щодо вивчення оцінки ефективності ітоприду гідрохлориду (Ітомеду) стало відкрите клінічне дослідження, що було проведено в Словакії, за участю 91 пацієнта з ФД із періодом спостереження 84 дні. Результати дослідження продемонстрували значне зниження частоти основних диспепсичних симптомів: відчуття переповнення (із 71 до 55%), болю в епігастральній ділянці (з 91 до 49%), нудоти (з 51 до 6%), блювання (з 13 до 2%), зниження апетиту (з 55 до 18%), відходження газів (із 72 до 39%) [24].
Про високу ефективність ітоприду гідрохлориду в ліквідації симптомів ФД свідчать дослідження В. Т. Івашкіна та співавт. До однієї з робіт було включено 509 пацієнтів із ФД, які протягом 8 тиж приймали ітоприду гідрохлорид по 50 мг 3 рази на добу. Встановлено, що застосування препарату протягом 4 тиж сприяє повному зникненню скарг у 46,6% хворих і значному зменшенню їх вираженості в 47,8% пацієнтів. Лікування ітоприду гідрохлоридом характеризувалося хорошою переносимістю та відсутністю побічних явищ [10]. У проспективному відкритому багатоцентровому клінічному дослідженні ітоприду гідрохлорид продемонстрував ефективність і хорошу переносимість при лікуванні 94 пацієнтів із ФД. Причому ефективність препарату зберігалася протягом 4 тиж після завершення лікування [12].
У багатьох подвійних сліпих рандомізованих порівняльних дослідженнях ітоприду гідрохлорид продемонстрував високу клінічну ефективність і безпеку порівняно з цизапридом, метоклопрамідом, мозапридом і домперидоном [46]. У сліпому РКД порівнювали ефективність ітоприду гідрохлориду та метоклопраміду при лікуванні пацієнтів із ФД. Виявлено, що повна ліквідація симптомів і виражене полегшення відбулося в усіх пацієнтів, які отримували ітоприду гідрохлорид, і тільки в 53% осіб, які застосовували метоклопрамід. В іншому сліпому РКД оцінювали ефективність і переносимість ітоприду гідрохлориду порівняно з домперидоном при лікуванні пацієнтів із ФД. Повне зникнення симптомів і виражене полегшення спостерігали у 81% пацієнтів, які отримували лікування ітоприду гідрохлоридом, і в 70% хворих, які застосовували домперидон [14, 39].
У подвійному сліпому проспективному 4-фазному РКД проводили порівняльну оцінку ефективності та безпеки ітоприду гідрохлориду й цитрату мозаприду при лікуванні пацієнтів із ФД. У групі ітоприду 93% пацієнтів оцінили загальну клінічну ефективність препарату як «дуже добре» та «добре», а в групі мозаприду відповідний показник був вірогідно нижчим – 63%. За оцінкою лікарів, загальна переносимість ітоприду гідрохлориду була відмінною в 76% пацієнтів, мозаприду – у 26% осіб. У результаті дослідження доведено, що ітоприду гідрохлорид характеризується кращим профілем ефективності та безпеки порівняно з цитратом мозаприду [44].
Метааналіз 9 РКД, до котрого було включено 2620 хворих із ФД, які застосовували ітоприду гідрохлорид, і 1248 пацієнтів, які отримували плацебо або інші препарати (домперидон, цизаприд), показав, що ітоприду гідрохлорид вірогідно краще впливає на загальний стан хворих. Препарат також виявився ефективнішим порівняно з домперидоном щодо впливу на симптоми порушення моторики ШКТ (відчуття раннього насичення та дискомфорт після прийому їжі) [28, 38].
Нерідко в одного пацієнта поєднуються функціональні розлади ШКТ. Найчастіше спостерігаються поєднання ФД і СПК, ФД і дисфункції сфінктера Одді. Вітчизняними вченими Т. Д. Звягінцевою й А. І. Чернобай [9] проведено дослідження впливу ітоприду гідрохлориду на перебіг поєднаних функціональних захворювань ШКТ у 30 пацієнтів, у яких ФД поєднувалася із симптомами дисфункції сфінктера Одді за біліарним типом і СПК із закрепами. Дослідниками було доведено, що ітоприду гідрохлорид чинить універсальну прокінетичну дію, нормалізує моторику ШКТ, має високий профіль ефективності та безпеки, не спричиняє побічних ефектів. Лікування препаратом вірогідно підвищувало якість життя пацієнтів.
За останнє десятиліття отримано результати досліджень, які свідчать про позитивну терапевтичну дію ітоприду гідрохлориду при СПК із закрепами. За результатами експериментальних досліджень, які проведені на морських свинках, ітоприду гідрохлорид (на відміну від інших прокінетиків) стимулює як перистальтику, так і сегментарну активність кишечнику шляхом підвищення тиску в товстій кишці. Препарат стимулює контрактильну активність ШКТ від шлунка до товстої кишки та прискорює транзит хімусу, що дає можливість використовувати його для лікування пацієнтів із функціональними закрепами [1, 9].
В огляді досліджень нових препаратів для лікування закрепів S. Mozaffari та співавт. розглядають ітоприду гідрохлорид як один із найперспективніших препаратів. У ході досліджень відзначено, що ітоприду гідрохлорид не тільки прискорює випорожнення шлунка, але й скорочує час транзиту харчових мас тонкою кишкою. Варто зауважити, що домперидон і метоклопрамід не впливають на товстокишковий транзит і пропульсивну активність товстої кишки, а дані щодо впливу метоклопраміду на прискорення тонкокишкового транзиту після прийому їжі є суперечливими [25, 42].
Одним із перспективних напрямів використання ітоприду гідрохлориду є корекція порушень моторики жовчного міхура та жовчовивідних шляхів при їх гіпомоторній дисфункції. У клінічній практиці ефективність антагоністів дофамінових рецепторів (метоклопраміду, домперидону) для лікування таких функціональних розладів є недостатньою, тому що дофамін не є пріоритетним регулятором функцій жовчного міхура та жовчовивідних шляхів. Холіноміметичний компонент подвійного механізму прокінетичної дії ітоприду гідрохлориду за рахунок антихолінестеразної активності дасть змогу краще вплинути на регуляцію функції біліарного тракту [25, 33].
Вплив ітоприду гідрохлориду на моторну функцію жовчного міхура та жовчовивідних шляхів при їх гіпомоторній дисфункції було оцінено у 18 пацієнтів протягом 2 тиж. Було виявлено, що в більшості (78%) пацієнтів зникли больовий і диспепсичний синдроми, а також нормалізувалася моторна функція жовчного міхура за результатами ультразвукового дослідження. Дослідники зробили висновок, що ітоприду гідрохлорид є ефективним прокінетиком, використання котрого в схемах лікування пацієнтів із функціональними розладами біліарного тракту є патогенетично та клінічно обґрунтованим [16].
Проведено низку досліджень, які присвячені вивченню ефективності ітоприду гідрохлориду при лікуванні ГЕРХ. Застосування прокінетиків для лікування пацієнтів із ГЕРХ є патогенетично доцільним, оскільки за їх допомогою усувається регургітація вмісту шлунка в стравохід і тим самим знижується частота рецидивів захворювання. Одночасне застосування прокінетиків й антисекреторних препаратів, найперше інгібіторів протонної помпи, забезпечує проведення повноцінної патогенетичної терапії ГЕРХ [21]. Ітоприду гідрохлорид блокує минущі розслаблення нижнього стравохідного сфінктера, що є одними з найважливіших патофізіологічних маркерів патологічної регургітації. У низці порівняльних досліджень була показана вища ефективність ітоприду гідрохлориду порівняно з домперидоном при ФД і ГЕРХ [19, 43].
У дослідженні О. М. Мінушкіна та співавт. доведена ефективність монотерапії ітоприду гідрохлоридом, який застосовували в пацієнтів із ГЕРХ 0-1 стадії в дозі 50 мг 3 рази на добу протягом 4 тиж. У 90% пацієнтів печія була повністю усунена до кінця 1-го тижня, а після повного курсу лікування в усіх пацієнтів з ерозивною формою ГЕРХ відбулася епітелізація ерозій стравоходу. При цьому покращилися показники якості життя та загальний стан хворих, який оцінювали за допомогою візуально-аналогової шкали [20]. В іншому клінічному дослідженні ітоприду гідрохлорид застосовували в стандартній дозі 50 мг 3 рази на добу протягом 6-9 міс. Побічні явища й необхідність відміни препарату виникли лише в 1-2% хворих [28].
У відкритому проспективному РКД вивчали вплив ітоприду гідрохлориду на рефлюкс шлункового вмісту в 26 пацієнтів із ГЕРХ середнього ступеня тяжкості, що була підтверджена за допомогою 24-годинної рН-метрії. Упродовж 30 діб порівнювали ефективність ітоприду гідрохлориду в дозах 150 і 300 мг/добу. У пацієнтів, які отримували добову дозу 300 мг, була вірогідно меншою тривалість із pН <4 у стравоході (у % та в абсолютному значенні), індекс DeMeester був нижчим. Доведено, що терапія ітоприду гідрохлоридом у добовій дозі 300 мг є ефективною щодо зменшення патологічних рефлюксів у пацієнтів із ГЕРХ [23].
У клінічному дослідженні K. Inoue та співавт. засіб застосовували у хворих із ФД та супутніми симптомами ГЕРХ у дозі 50 мг 3 рази на добу протягом 8 тиж. На тлі прийому препарату відбулося зменшення вираженості печії в 56% пацієнтів, покращення ендоскопічної картини – в 34,6% учасників [27].
Пізніше були опубліковані дані Н. Б. Ліщук і співавт., в яких було показано, що додавання ітоприду гідрохлориду (Ітомеду) до терапії інгібіторами протонної помпи в пацієнтів зі слабокислим гастроезофагеальним рефлюксом підвищує ефективність лікування за рахунок позитивного впливу на моторику верхніх відділів ШКТ [15].
Ітоприду гідрохлорид може бути препаратом вибору при коморбідності ФД і ГЕРХ у пацієнтів похилого віку, а також в осіб з ожирінням [6, 7]. В онкологічній практиці при проведенні протипухлинної терапії було виявлено ефективність і безпеку застосування ітоприду гідрохлориду в складі комбінованої антиеметичної терапії для профілактики гострого блювання та нудоти, а також у вигляді монотерапії для усунення нудоти [25].
В одному з порівняльних РКД було показано, що застосування ітоприду гідрохлориду протягом 2 тиж у пацієнтів із постгастрорезекційними розладами сприяло вірогідному зменшенню скарг у 45,8% пацієнтів, тоді як домперидон був ефективним тільки у 18,8% хворих (р<0,05) [14].
При застосуванні в комплексному лікуванні ітоприду гідрохлориду в пацієнтів із ГЕРХ разом із СПК та закрепами спостерігалося зменшення частоти й вираженості клінічних симптомів. У низці досліджень було доведено, що при підготовці пацієнтів до колоноскопії відбувалося зниження вираженості й інтенсивності кишкових симптомів і спостерігалося покращення якості підготовки завдяки використанню ітоприду гідрохлориду [23].
Показано високу клінічну ефективність ітоприду гідрохлориду (Ітомеду) в складі комплексної терапії 107 пацієнтів із виразковою хворобою ДПК та порушеннями моторно-евакуаторної функції шлунка та ДПК. Дослідниками було доведено, що застосування Ітомеду в складі комплексної терапії виразкової хвороби ДПК прискорює усунення больового й диспепсичного синдромів, сприяє рубцюванню виразки в 97,8% пацієнтів і відновленню моторної функції гастродуоденальної зони шляхом покращення координації електричної активності між шлунком і ДПК, зниження частоти моторної активності шлунка та підвищення амплітуди електричних коливань ДПК. У разі застосування Ітомеду в пацієнтів із виразковою хворобою ДПК нормалізація порожнинного тиску в шлунку та ДПК забезпечує відновлення замикальної функції воротаря [3].
Порушення моторно-евакуаторної функції шлунка у хворих на ЦД розвиваються, зокрема, внаслідок хронічної гіперглікемії, коли сповільнюється евакуаторна функція шлунка й виникають тяжкі порушення антродуоденальної акомодації. Діабетичний гастропарез також є результатом генералізованої діабетичної полінейропатії, коли в процес залучається нервовий апарат стінки шлунка. Результати відкритого багатоцентрового дослідження за участю 743 пацієнтів із діабетичним гастропарезом продемонстрували значне поліпшення симптоматики на тлі комплексної терапії ітоприду гідрохлоридом і пантопразолом упродовж 3 тиж [23, 50].
Високу ефективність препарату при діабетичному гастропарезі в пацієнтів із ЦД 2 типу доведено у відкритому проспективному дослідженні. Дванадцяти пацієнтам з ознаками діабетичної полінейропатії без органічних уражень у верхніх відділах травного каналу було призначено ітоприду гідрохлорид у дозі 50 мг 3 рази на день протягом 2 тиж. Частота нормальних електрогастрографічних хвиль (3-cpm) значно збільшилася, що асоціювалося зі значним збільшенням евакуації радіоконтрастних міток зі шлунка [29, 40].
Опубліковано дані вітчизняних дослідників, які свідчать про ефективність застосування препарату у хворих на ЦД 2 типу з ознаками діабетичного гастропарезу. Застосування ітоприду гідрохлориду в дозі 50 мг 3 рази на добу протягом 6 тиж на тлі пероральної цукрознижувальної терапії сприяло нормалізації моторно-евакуаторної функції шлунка та досягненню кращої компенсації вуглеводного обміну (як прандіального, так і постпрандіального рівнів глікемії) [13]. У відкритому порівняльному паралельному проспективному рандомізованому дослідженні тривалістю 6 тиж за участю 34 дорослих пацієнтів із ЦД 1 типу та порушеннями моторно-евакуаторної функції шлунка було встановлено, що лікування ітоприду гідрохлоридом у сумарній добовій дозі 150 мг дало можливість прискорити швидкість евакуації їжі до ДПК у 71% випадків (за результатами дихального тесту). Таке лікування в цієї категорії пацієнтів супроводжувалося покращенням клінічної симптоматики [2].
Ітоприду гідрохлорид призначають дорослим по 1 таблетці (50 мг) 3 рази на добу до їди, не розжовуючи та запиваючи достатньою кількістю води. Рекомендована добова доза становить 150 мг. Середня тривалість курсу лікування – 2-4 тиж.
За період широкого клінічного використання ітоприду гідрохлорид показав хорошу переносимість і відсутність побічних ефектів у більшості випадків. Препарат не впливає на тривалість інтервалу Q-Т (на відміну від домперидону, мозаприду, цизаприду, тегасероду), має сприятливий профіль безпеки. У разі призначення препарату в звичайних терапевтичних дозах підвищення рівня пролактину крові спостерігається дуже рідко. Основними побічними ефектами при застосуванні ітоприду гідрохлориду виявилися тільки діарея (0,7% випадків), біль у животі (0,3%), головний біль (0,3%). Завдяки своїм фармакологічним особливостям ітоприду гідрохлорид не взаємодіє з лікарськими засобами, що метаболізуються системою цитохрому Р450. Перевагами ітоприду гідрохлориду є подвійний механізм дії, висока біодоступність, відсутність кумуляції препарату [23-26, 29].
Отже, застосування ітоприду гідрохлориду може бути корисним для стимуляції моторики ШКТ не тільки при лікуванні функціональних гастроінтестинальних розладів (функціональна диспепсія, СПК із закрепами, функціональний та опоїдно-індукований закреп, гіпомоторна дисфункція біліарного тракту та їх поєднання), а й у разі вторинних порушень моторно-евакуаторної функції за наявності органічної патології травного тракту чи захворювань інших органів і систем (ЦД, гіпотиреоз, системна склеродермія тощо), в тому числі при коморбідних станах.
Ітоприду гідрохлорид завдяки комбінованому подвійному механізму дії, впливу на моторну функцію всього ШКТ, відсутності значимих взаємодій з іншими лікарськими засобами та мінімальній кількості побічних ефектів має переваги над іншими прокінетиками. Застосування в широкій терапевтичній практиці ефективного й безпечного прокінетика ітоприду гідрохлориду дає можливість проводити повноцінне патогенетичне лікування багатьох захворювань внутрішніх органів, які супроводжуються порушенням моторно-евакуаторної функції ШКТ.
В Україні ітоприду гідрохлорид представлений кількома компаніями, серед яких лідером призначень лікарями є препарат Ітомед® виробництва чеської компанії PRO.MED.CS Praha a.s.
Список літератури знаходиться в редакції.
Медична газета «Здоров’я України 21 сторіччя» № 24 (493), 2020 р.