26 січня, 2021
Цереброкардіальний синдром при ішемічному інсульті
Дехто вважає, що ми відчуваємо серцем, бо воно стискається та завмирає при печалі й турботі. Однак серце не здатне розуміти й мислити. Це може лише мозок і саме він породжує наші почуття
Гіппократ
 Гострі порушення мозкового кровообігу (ГПМК) є проблемою медичного і соціального значення, оскільки становлять загрозу життю і здоров’ю населення у всьому світі [6, 14, 27]. Особливе місце серед ГПМК посідає ішемічний інсульт (ІІ), що пов’язано з його високою поширеністю, втратою працездатності та смертністю серед хворих. Широкий спектр модифікованих чинників ризику інсульту, як-то артеріальна гіпертензія, цукровий діабет, ожиріння, миготлива аритмія, при недостатній корекції або її відсутності значно погіршує перебіг інсульту і негативно впливає на його прогноз [24]. Найбільшу небезпеку, пов’язану з ризиком смерті, представляють кардіальні порушення, які розвиваються або поглиблюються у пацієнтів із ГПМК при формуванні цереброкардіального синдрому (ЦКС) [2].
Гострі порушення мозкового кровообігу (ГПМК) є проблемою медичного і соціального значення, оскільки становлять загрозу життю і здоров’ю населення у всьому світі [6, 14, 27]. Особливе місце серед ГПМК посідає ішемічний інсульт (ІІ), що пов’язано з його високою поширеністю, втратою працездатності та смертністю серед хворих. Широкий спектр модифікованих чинників ризику інсульту, як-то артеріальна гіпертензія, цукровий діабет, ожиріння, миготлива аритмія, при недостатній корекції або її відсутності значно погіршує перебіг інсульту і негативно впливає на його прогноз [24]. Найбільшу небезпеку, пов’язану з ризиком смерті, представляють кардіальні порушення, які розвиваються або поглиблюються у пацієнтів із ГПМК при формуванні цереброкардіального синдрому (ЦКС) [2].
Прояви та механізми розвитку ЦКС
При ураженні центральної нервової системи виникають минущі порушення діяльності серцево-судинної системи, а більш значущі зміни – зі сторони роботи серця. Комплекс кардіальних порушень, зумовлених гострим ураженням головного мозку, позначається терміном «цереброкардіальний синдром». Це поняття запропоноване в середині 50-х рр. минулого століття для позначення певних змін на електрокардіографії (ЕКГ), супутніх ураженню головного мозку [8]. За даними низки досліджень, ЦКС зустрічається у 15‑51% пацієнтів з ІІ [25].
Можливо, у деяких випадках прояви ЦКС відображають наявну, але приховану раніше кардіальну патологію. Серцеві порушення за рахунок розладів системної та церебральної гемодинаміки можуть збільшити ішемічне пошкодження головного мозку і погіршити прогноз пацієнта. Поява зазначених змін на ЕКГ при інсульті у хворих без первинної патології серця може ускладнити діагностичний пошук і лікування. Тому знання проявів ЦКС є необхідним для лікарів різного фаху (неврологів, кардіологів, терапевтів, реаніматологів), а їхня своєчасна діагностика дозволить скорегувати лікування осіб після перенесеного інсульту [8].
У механізмах розвитку ЦКС важлива роль належить токсичній, пошкоджувальній дії адреналіну й норадреналіну на кардіоміоцити. Робота серця регулюється центральною та вегетативною нервовими системами, ендокринними і гуморальними чинниками. Крім того, ритм серця залежить від стану компонентів провідної системи. Більше значення у розвитку ЦКС відводиться порушенню вегетативної регуляції з активацією симпатичної ланки і підвищеному виробленню гормонів наднирникових залоз, що спричиняє посилений викид у плазму крові катехоламінів та зміну морфофункціональних властивостей кардіоміоцитів. Унаслідок підвищення активації симпатичної нервової системи при ІІ підвищується утворення катехоламінів у пресинаптичних закінченнях нервових волокон. На додаток, збільшується кількість катехоламінів у системному кровотоку.
Окрім того, у плазмі крові хворих на ІІ було виявлене підвищення рівня адреналіну вдвічі і норадреналіну в 2,4 раза [1]. При цьому високий уміст катехоламінів відзначався впродовж близько трьох діб із поступовим зниженням до 40-го дня. Також встановлений зв’язок між рівнем катехоламінів у плазмі крові й виразністю змін на ЕКГ. Більше значення у розвитку ЦКС надається місцевій токсичній дії катехоламінів порівняно з їхнім системним ефектом [19].
Надмірна кількість катехоламінів викликає зміни β-адренорецепторів кардіоміоцитів, зниження скоротливої здатності міокарда. Гіперкатехоламінемія викликає вторинні пошкодження міокарда, які проявляються лізисом кардіоміоцитів та розвитком вогнищ некрозів (так званого адреналінового міокардиту) [21]. Катехоламіни збільшують вхід іонів кальцію у клітину і вихід калію, що спричиняє вкорочення потенціалу дії кардіоміоцітов, а це своєю чергою зумовлює зростання частоти серцевих скорочень (ЧСС) і може провокувати аритмії. Іони кальцію підвищують активність фосфоліпази всередині клітини, що викликає пошкодження мембран та утворення жирних кислот.
Надмірна кількість арахідонової кислоти призводить до підвищеного утворення вільних радикалів. Окрім того, вона здатна перетворюватися на простагландини, лейкотрієни і тромбоксани, які додатково пошкоджують клітини. Вільні радикали, простагландини і тромбоксан викликають спазм судин, підвищують агрегаційну здатність тромбоцитів, тим самим спричиняючи порушення мікроциркуляції. Ураження внутрішньоклітинних мембран призводить до зниження функції рибосом і синтезу білка, що ще більшою мірою порушує обмін речовин у клітині та зменшує її стійкість до пошкоджувальних чинників. У пацієнтів з ішемічною хворобою серця це може спричинити інфаркт міокарда, тоді як в осіб без атеросклерозу коронарних артерій кардіальна дисфункція потенційно зворотна. Важливу роль у зміні адренергічних структур і мембран кардіоміоцитів відіграє перекисне окислення ліпідів, яке активується при стресі, що може провокувати аритмії серця [8]. Як наслідок пошкодження клітин у крові, можуть підвищуватися міокардіальні ферменти.
З огляду на відмінність розташування у головному мозку центрів вегетативної регуляції, локалізація вогнища інсульту може чинити власний вплив на показники серцевих порушень. Відзначено, що при правопівкульовій локалізації інсульту частіше реєструються суправентрикулярні тахіаритмії, а при лівопівкульовій – шлуночкові [2]. Правобічна вегетативна стимуляція більшою мірою впливає на синусовий вузол, тому стимуляція або пригнічення правої половини довгастого мозку і гіпоталамуса – на надшлуночкову ектопічну активність [22]. Важливу роль у регуляції вегетативних функцій відіграє кора острівкової частки. Пошкодження різних її відділів спричиняє різні варіанти електрокардіографічних і клінічних проявів ЦКС [2, 8].
Порушення серцевого ритму в умовах порушеної авторегуляції мозкового кровотоку негативно впливають на репаративні процеси у зоні церебральної ішемії. Навіть помірне транзиторне кардіогенне зниження артеріального тиску додатково погіршує кровопостачання периінфарктної ділянки. Часта суправентрикулярна екстрасистолія може викликати зниження мозкового кровотоку на 7%, шлуночкова екстрасистолія – на 12%, шлуночкова пароксизмальна тахікардія – на 40‑75%. Тривалі суправентрикулярні пароксизмальні тахікардії спричиняють значне зниження ударного об’єму лівого шлуночка (ЛШ) із наступним погіршенням церебральної гемодинаміки [11, 18]. Відповідно до іншої теорії, у патогенезі ЦКС значну роль відіграє гіпомагнеземія [29].
Для ЦКС характерні зміни зубця Т, які характеризуються збільшенням його тривалості (основи) й амплітуди (висоти), інверсією (негативний зубець Т). Окрім того, можуть спостерігатися збільшення зубця U, підйом або депресія сегмента ST, що створюють картину «псевдоінфарктної» кривої. На відміну від інфарктних, зубці Т при ЦКС несиметричні, більшої амплітуди, широкі й динамічні. При цьому зворотна динаміка кінцевої частини шлуночкового комплексу не відображає позитивної динаміки ураження головного мозку [3, 8].
Останніми роками поняття ЦКС стало включати не тільки зміни на ЕКГ кінцевої частини шлуночкового комплексу, але й інші порушення з боку серця, що розвиваються при церебральному ураженні, як-от:
- порушення ритму серця;
- подовження інтервалу QT;
- порушення варіабельності серцевого ритму;
- систолічна й діастолічна дисфункція міокарда ЛШ.
З-поміж порушень ритму найчастіше зустрічаються: синусова брадикардія (рідше тахікардія), арешт синусового вузла, атріовентрикулярні блокади, шлуночкова або передсердна екстрасистолія, фібриляція передсердь (ФП), повільний атріовентрикулярний ритм. Іноді спостерігається порушення внутрішньошлуночкової провідності у вигляді минущих блокад однієї з ніжок пучка Гіса [4, 5, 7]. Для ЦКС характерна швидка зворотна динаміка, яка не відображає спрямованості церебрального процесу [12].
При цьому найпоширенішою аритмією у гострому періоді порушення мозкового кровообігу є ФП, що асоціюється з високою частотою виникнення кардіоемболій і значно підвищує частоту повторних інсультів [13, 23]. Крім того, при кардіоемболічному інсульті порівняно з атеротромботичним і гемодинамічним достовірно частіше зустрічаються ФП, шлуночкові екстрасистоли і блокади ніжок пучка Гіса [10, 13, 16]. Для даного типу інсульту характерні тяжчий перебіг і повільніше відновлення неврологічного дефіциту. Встановлено залежність між локалізацією вогнища ураження, пов’язаного з певним судинним басейном, і змінами за даними ЕКГ. Так, ФП і тахікардія частіше зустрічаються при локалізації вогнища у басейні лівої середньої мозкової артерії, а брадикардія і порушення міжпередсердної провідності – у вертебрально-базилярному [2, 16].
За даними інших досліджень, в осіб у гострому періоді інсульту без кардіальної патології в анамнезі збільшується надшлуночкова і шлуночкова ектопічна активність, що, ймовірно, зумовлено цереброгенним впливом. У найгострішій фазі ІІ реєстрували наростання надшлуночкової та шлуночкової ектопічної активності та зміни ЧСС, які залежали від розміру і локалізації ішемічного вогнища. Після закінчення гострого періоду інсульту ЦКС регресував у більшості хворих. Регрес неврологічного дефіциту в гострій фазі ІІ перебував у зворотному кореляційному зв’язку з частотою епізодів брадиаритмій [2, 13, 23].
Клінічні спостереження показали, що кардіальні пошкодження можуть розвиватися відразу або протягом декількох годин після перенесеної гострої церебральної катастрофи. При геморагічній трансформації ІІ, яка ускладнює перебіг інсульту в гострому періоді, було відзначено суттєво більшу кількість хворих із порушенням серцевого ритму, а саме із ФП [2, 15].
Нерідко проявом ЦКС є розвиток систолічної дисфункції з гіпокінетичними змінами стінок серця за даними ехокардіографії. Не меншу роль відіграє виникнення діастолічної дисфункції з наростанням кінцево-діастолічного тиску в ЛШ та активації симпатичної нервової системи, що спричиняє розвиток ендотеліальної дисфункції та гіперкоагуляції [26].
Діагностика ЦКС
Виявлення ЦКС є досить складним процесом. Фахівцями клініки Майо (Міннесота, США) запропоновано чотири критерії для його діагностики [23]:
- Порушення моторної активності стінки ЛШ, що виходять за межі кровопостачання однієї артерії.
- Відсутність обструкції відповідної коронарної артерії.
- Зміни на ЕКГ (транзиторний підйом сегмента ST або дифузні зміни зубця Т), що супроводжуються слабким підвищенням рівня тропонінів.
- Відсутність доведеної феохромоцитоми або міокардиту.
Проте дотепер не існує чітких рекомендацій щодо виявлення групи ризику раптової смерті серед пацієнтів, які перенесли ГПМК із ЦКС [2].
Слід зазначити, що зміни, які виникають при ЦКС, регресують значно швидше за неврологічний дефіцит і не корелюють із загальною тяжкістю стану хворого [20]. У біохімічному аналізі крові характерне підвищення кардіоспецифічної креатинфосфокінази. Однак її динаміка значно відрізняється від такої при інфаркті міокарда: концентрація даного ферменту не регресує відразу ж після ГПМК, а поступово збільшується протягом наступних чотирьох діб [17, 28].
Слід звертати особливу увагу на збільшення QT-інтервалу в пацієнтів з інсультом, оскільки це є несприятливим чинником, який провокує аритмогенні події. QT-інтервал, що перевищує 450 мс, вважається важливим предиктором таких ускладнень та асоційований із триразовим ризиком раптової серцево-судинної смерті [2].
Визначено ЕКГ-критерії оцінки тяжкості мозкової патології [9, 11]:
- легкий ступінь: тривалість ЕКГ-змін становить 1‑2 дні (ЕКГ-зміни відсутні або проявляються помірною синусовою тахі-/брадикардією, поодинокими екстрасистолами, помірною депресією зубця Т або сегмента ST);
- середній ступінь: тривалість – до 6‑7 днів (чіткі ознаки ішемії міокарда в певних зонах: негативний зубець Т, депресія або підйом сегмента ST >1 мм; відзначаються короткочасні пароксизми ФП або тахікардії);
- тяжкий ступінь – тривалість – 15‑20 днів і більше (часта екстрасистолія, пароксизмальна тахікардія і мерехтіння передсердь, фібриляція шлуночків, комбіновані порушення ритму, ознаки інфаркту міокарда).
Клінічне значення ЦКС полягає у тому, що він може виступати причиною діагностичних помилок і гіпердіагностики кардіальної патології в ситуаціях, коли її реально немає, та, відповідно, призводити до неправильного лікування.
Клінічний випадок ЦКС у хворих на ІІ із власного досвіду
Хворий Д., 57 р., поступив до ангіоневрологічного відділення ВМКЦ ЗР зі скаргами на порушення зору при погляді вліво й мови, запаморочення, хиткість при ході. Зі слів пацієнта, стан і самопочуття погіршилися раптово напередодні, коли з’явилися порушення зору у вигляді випадіння при погляді вліво, запаморочення, хиткість при ході. Наступного дня він самостійно звернувся у ВМКЦ ЗР і госпіталізований за невідкладними показаннями.
Тривалий час хворіє на гіпертонічну хворобу, цукровий діабет 2-го типу, подагру. У 2012 р. переніс ІІ у басейні лівої середньої мозкової артерії.
Неврологічний статус. Свідомість збережено – 15 балів за шкалою Глазго. Ізокорії, ністагму, диплопії не виявлено. Гомонімна геміанопсія зліва. Мова дизартрична. Правобічний геміпарез, гемігіпестезія. Глибокі рефлекси D>S. Стопна патологічна ознака Бабінського справа. Менінгеальних ознак немає.
Попередній діагноз. Цереброваскулярна хвороба. ІІ у басейні правої задньої мозкової артерії у вигляді лівобічної гомонімної геміанопсії, дизартрії. Наслідки ІІ (2012 р.) у басейні лівої середньої мозкової артерії у вигляді правобічного геміпарезу, гемігіпестезії. Хронічна ішемія мозку ІІІ стадії.
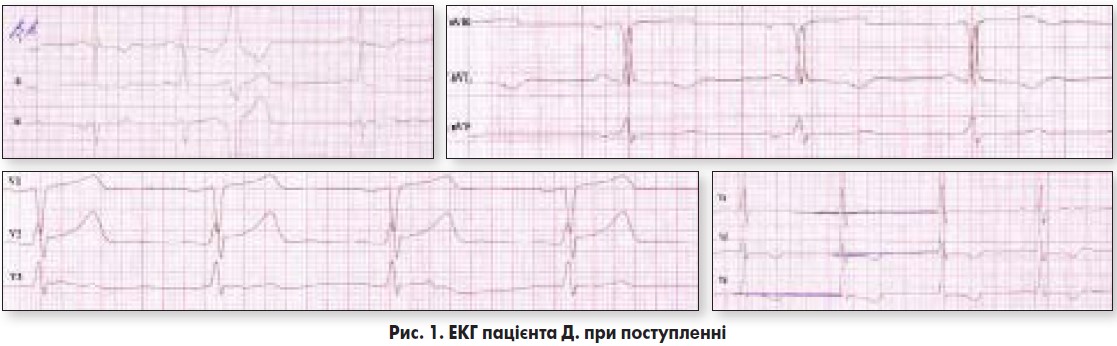
Клінічний і біохімічний аналізи крові – без відхилень від норми. ЕКГ при поступленні (рис. 1): ритм синусовий, неправильний, ЧСС – 75/хв, реєструються шлуночкові екстрасистоли, збільшення амплітуди зубця Т у відведенні V2, інверсія зубця Т у відведеннях І, ІІ, aVL, V5-V6, ознаки гіпертрофії ЛШ.
ЕКГ у динаміці (через три доби): ритм синусовий, правильний, ЧСС – 64/хв, екстрасистоли не реєструються, нормалізувалися сегмент S-T і зубець Т у грудних відведеннях (рис. 2).
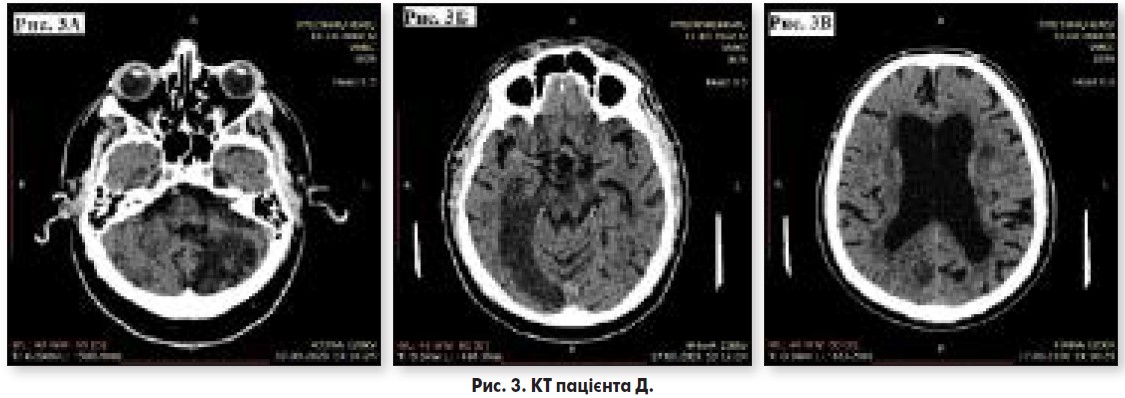
При комп’ютерній томографії головного мозку (рис. 3) у лівій півкулі мозочка візуалізуються гіперденсивні зони з чіткими контурами щільністю +3+12 од. Н (рис. 3А); у правій півкулі головного мозку простежується обширна ішемічна ділянка щільністю +15+24 од. (рис. 3Б). Шлуночкова система розширена: ІІІ шлуночок шириною до 1,7 см, бокові шлуночки шириною до 2,4 см (рис. 3В). Серединні структури не зміщені. Конвекситальні простори, борозни, щілини розширені в обох півкулях головного мозку, простежуються локальні ішемічні ділянки.
Заключення: КТ-ознаки розладу мозкового кровообігу за ішемічним типом у правій півкулі головного мозку, лікворних кіст лівої півкулі мозочка.
Описаний випадок демонструє типові прояви ЦКС, коли інфарктоподобні зміни ЕКГ були не проявом ураження серця, а відображенням залучення церебральних структур.
Висновки
Кардіальні порушення при ІІ є недостатньо вивченою галуззю кардіоневрології. Давно відомі прояви ЦКС у вигляді минущих інфарктоподобних змін на ЕКГ останніми роками поповнюються новими даними: фіксуються небезпечні для життя аритмії серця, зниження варіабельності ритму серця, порушення систолічної та діастолічної функції міокарда ЛШ, подовження інтервалу QT. Виразність кардіальних порушень пов’язана з тяжкістю церебральних розладів і преморбідним статусом пацієнтів. Інсульт може спричинити кардіальних порушення у хворих без попередньої серцевої патології, а також погіршити перебіг наявних захворювань серця. Основним механізмом у розвитку цих порушень вважається активація симпатоадреналової системи у відповідь на гостре церебральне пошкодження з токсичним впливом катехоламінів на серце з розвитком ЦКС.
Індивідуальний підхід до оцінки кардіальних порушень у хворих на ГПМК і знання закономірних змін із боку нейроендокринної, імунної систем, системи гемостазу дозволять забезпечити своєчасну діагностику ЦКС, оптимізувати лікувальні заходи і поліпшити прогноз. Вивчення даної патології у майбутньому може поповнитися новими знаннями про клінічні прояви ЦКС, що сприятиме зниженню несприятливих наслідків при інсульті.
Література
- Астраханцева С.П. Электрокардиографические изменения в острой стадии мозгового инсульта: автореф. дис. … канд. мед. наук. Л. – 1966. – 22 с.
- Басанцова Н.Ю. Цереброкардиальный синдром и его особенности у пациентов с острыми нарушениями мозгового кровообращения / Н.Ю. Басанцова, А.Н. Шишкин, Л.М. Тибекина // Вестник СПбГУ. Медицина. – 2017. – № 1. – С. 31‑47.
- Гусев Е.И. Неотложная электрокардиография / Е.И. Гусев, В.И. Скворцова, Л.В. Стаховская, В.В. Киликовский, Н.Ю. Айриян, М.И. Рейдерман. – М.: Медицина. – 2013. – 123 с.
- Дощицин В.Л. Практическая электрокардиография / В.Л. Дощицин. – М.: Медицина. – 1987. – С. 279‑281.
- Дегтярь Г.Я. Электрокардиографическая діагностика / Г.Я. Дегтярь. – М.: Медицина. – 1966. – 173 с.
- Инсульты. Руководство для врачей / под ред. Л.В. Стаховской, С.В. Котова. М.: МИА. – 2014. – 385 с.
- Исаков И.И. Клиническая электрокардиография / И.И. Исаков, М.С. Кушаковский, Н.Б. Журавлева. – Л.: Медицина. – 1984. – С. 51‑56.
- Лиманкина И.Н. Цереброкардиальный синдром / И.Н. Лиманкина // Вестник аритмологии. – 2009. – № 58. – С. 26‑34.
- Лис М.А., Солоненко Ю.Т., Добродей М.А. Электрокардиографические критерии оценки тяжести мозговой патологии // Рубрики: 76‑29‑30, 76‑29‑51 (январь 1996 г. – декабрь 1998 г). Тема НИР: «Проявления цереброкардиального синдрома при мозговой патологи различного генеза».
- Порядная О.В. Цереброкардиальный синдром в остром периоде инфаркта головного мозга / О.В. Порядная, Е.И. Шоломова // Бюллетень медицинских интернет‐конференций. – 2013. – Т. 3, № 3. – С. 503‑504.
- Прекина В.И. Цереброкардиальный синдром при ишемическом инсульте / В.И. Прекина, И.Ю. Чернова // Здоровье и образование в ХХI веке. – 2018. – № 20. – С. 40‑44.
- Рейдерман М.И. Неотложная электрокардиография / М.И. Рейдерман. – М.: Медицина. – 1993. – 123 с.
- Соколова А.А. Антикоагулянтная терапия у пациентов с фибрилляцией предсердий: состояние проблемы в рутинной клинической практике / А.А. Соколова, И.Л. Царев., Д.А. Напалков, В.А. Сулимов // Трудный пациент. – 2015. – № 7, Т. 13. – С. 36‑40.
- Суслина З.А. Практическая кардионеврология / З.А. Суслина, А.В. Фонякин. – М.: Има-пресс. – 2010. – 56 с.
- Тибекина Л.М. Геморрагическая трансформация при кардиоэмболическом инсульте / Л.М. Тибекина, Ю.А. Щербук // Вестн. С.-Петерб. ун-та. Серия 11. Медицина. – 2013. – Вып. 1. – С. 81‑93.
- Тибекина Л.М. Нарушения сердечного ритма у больных с ишемическим інсультом / Л.М. Тибекина // Вестн. С.-Петерб. ун-та. Серия 11. Медицина. – 2015. – Вып. 4. – С. 87‑99.
- Тибекина Л.М. Ранняя нейрореабилитация у больных с ИИ разного возраста / Л.М. Тибекина // Материалы конференции с международным участием «Биопсихосоциальные подходы в реабилитации больных». СПб. – 2015. – С. 83‑84.
- Фонякин А.В. Кардиологическая диагностика при ишемическом инсульте / А.В. Фонякин, З.А. Суслина, Л.А. Гераскина. – С-Пб.: Инкарт. – 2005.
- Campea M. Scientists look to heart disease and stroke-related disorders for clues to preventing and treating alzheimer’s / М. Campea // Alzheimer’s Assoc. Public Relations. – 2015. – Vol. 312. – P. 604‑629.
- Helms T. Prediction and personalised treatment of atrial fibrillation – stroke prevention: consolidated position paper of CVD professionals / T. Helms, G. Duong, В. Zippel-Schultz, R.R. Tilz, K.-H. Kuck, C.A. Karle // The EPMA Journal. – 2014. – Vol. 5. – P. 15‑29.
- Johnson R.H. Neurocardiology: The Interrelation ships Between Dysfunction in the Nervous and Cardiovascular System / R.H. Johnson, D.G. Lambie, JMK. Spalding // London, England: WB Saunders. – 1984. – Р. 66‑70.
- ane R.D. Supraventricular tachycardia in patients with right hemispere strokes / R.D. Lane, J.D. Wallace, P.P. Petrovsky // Stroke. – 1992. – Vol. 23. – P 362‑366.
- Madhavan M. Proposed Mayo clinic criteria for the diagnosis of Taco-Tsubo cardiomyopathy and long-term prognosis / М. Madhavan, А. Prosad // Herz. – 2010. – Vol. 35, Іssue 4. – P. 240‑244.
- Miki T. Diabetic cardiomyopathy: pathophysiology and clinical features / Т. Miki, S. Yuda, Н. Kouzu, Т. Miura // Heart Fail Rev. – 2013. – Vol. 18, № 2. – P. 149‑166.
- Natelson B.H. Neurocardiology. An interdisciplinary area for the 80’s / B.H. Natelson // Arch Neurol. – 1985. – Vol. 42. – P. 180‑184.
- Oliveira G.B.F. Cardiovascular disease burden: evolving knowledge of risk factors in myocardial infarction and stroke through population-based research and perspectives in global prevention / G.B.F. Oliveira, А. Avezum, L. Roever // Front Cardiovasc Med. – 2015. – Vol. 2. – P. 32‑47.
- Samuels M. The Brain-Heart Connection / М. Samuels // Circulation. – 2007. – Vol. 116, № 3. – P. 77‑84.
- Shames J. Association of Atrial Fibrillation and Stroke: Analysis of Maccabi Health Services Cardiovascular Database / J. Shames, S. Weitzman, Y. Nechemya, A. Porath // Isr Med Assoc J. – 2015. – Vol. 17, № 8. – P. 486‑491.
- van den Bergh W.M. Electrocardiographic Abnormalities and Serum Magnesium in Patients With Subarachnoid Hemorrhage / W.M. van den Bergh, А. Algra, G.J. Rinkel // Stroke. – 2004. – 35 с.