6 квітня, 2021
Особливості ведення хворих із НПЗП-індукованою гастропатією
Випадок тривалого лікування літньої пацієнтки з коморбідною патологією. Акцент на цитопротекцію
 Обговорюються ризики розвитку несприятливих явищ в осіб похилого віку з коморбідною патологією, що виникають на тлі тривалого застосування нестероїдних протизапальних препаратів (НПЗП) з метою купірування больового і запального суглобового синдромів у поєднанні з прийомом препаратів інших лікарських груп (зокрема ацетилсаліцилової кислоти та антитромбоцитарних засобів), які використовуються для лікування супутніх захворювань серцево-судинної системи. На основі клінічного прикладу запропонована стратегія профілактики і лікування НПЗП-гастропатії, що виникла на тлі тривалого прийому комбінації препаратів, які створюють несприятливий ефект на слизову оболонку гастродуоденальної зони. Продемонстровано високу клінічну ефективність схеми лікування з використанням пантопразолу – інгібітора протонної помпи (ІПП) з найбільш тривалим кислотосупресивним ефектом і низьким потенціалом несприятливих міжлікарських взаємодій у поєднанні з колоїдним субцитратом вісмуту, що володіє вираженою цитопротекторною дією на слизову оболонку гастродуоденальної зони.
Обговорюються ризики розвитку несприятливих явищ в осіб похилого віку з коморбідною патологією, що виникають на тлі тривалого застосування нестероїдних протизапальних препаратів (НПЗП) з метою купірування больового і запального суглобового синдромів у поєднанні з прийомом препаратів інших лікарських груп (зокрема ацетилсаліцилової кислоти та антитромбоцитарних засобів), які використовуються для лікування супутніх захворювань серцево-судинної системи. На основі клінічного прикладу запропонована стратегія профілактики і лікування НПЗП-гастропатії, що виникла на тлі тривалого прийому комбінації препаратів, які створюють несприятливий ефект на слизову оболонку гастродуоденальної зони. Продемонстровано високу клінічну ефективність схеми лікування з використанням пантопразолу – інгібітора протонної помпи (ІПП) з найбільш тривалим кислотосупресивним ефектом і низьким потенціалом несприятливих міжлікарських взаємодій у поєднанні з колоїдним субцитратом вісмуту, що володіє вираженою цитопротекторною дією на слизову оболонку гастродуоденальної зони.
Розвиток несприятливих ефектів на тлі прийому НПЗП найчастіше спостерігається в ділянках гастродуоденальної зони і перш за все – в антральному відділі шлунка з найбільш високою щільністю рецепторів простагландинів. Крім небажаних гастроінтестинальних побічних ефектів, що виникають внаслідок застосування НПЗП, особливо при їх тривалому прийомі, можуть розвиватися ефекти, що впливають на інші органи і системи.
Ускладнення, пов’язані з прийомом НПЗП
Усі НПЗП можуть викликати ускладнення з боку шлунково-кишкового тракту (ШКТ): диспепсію, виразки, кровотечу, перфорацію верхніх і нижніх відділів ШКТ, залізодефіцитну анемію внаслідок ураження тонкої кишки (НПЗП-ентеропатія), загострення і ускладнення запальних захворювань кишечнику.
Ускладнення з боку серцево-судинної системи: дестабілізація артеріальної гіпертензії та серцевої недостатності, підвищення ризику так званих кардіоваскулярних катастроф (інфаркту міокарда, ішемічного інсульту) і ймовірності смерті, пов’язаної з кардіоваскулярними ускладненнями [9, 12].
Негативний вплив на функцію нирок і печінки (особливо при наявності їх захворювань), у ряді випадків – розвиток серйозних нефро- і гепатотоксичних реакцій [11].
Підвищується ризик кровотечі після хірургічних втручань і травматичних медичних маніпуляцій.
Можуть викликати гематологічні ускладнення, шкірні алергічні реакції і бронхоспазм [16].
Ризик розвитку ускладнень, пов’язаних із роботою зазначених органів і систем, значно відрізняється при використанні різних НПЗП.
У літньому віці кількість лікарських препаратів, які приймає людина, збільшується, а це підвищує ризики виникнення міжлікарських взаємодій і побічних ефектів. Так, при одночасному використанні НПЗП та інгібіторів ангіотензинперетворюючого ферменту (АПФ) зростає ризик підвищення артеріального тиску за рахунок зниження антигіпертензивного ефекту препарату. Застосування одночасно з НПЗП антитромботичних препаратів (ацетилсаліцилової кислоти, клопідогрелю), похідних варфарину та інших антикоагулянтів, селективних інгібіторів зворотного захоплення серотоніну і глюкокортикостероїдів підвищує ризик шлунково-кишкових кровотеч. Прогнозуючи можливі ускладнення на тлі прийому НПЗП, необхідно враховувати фактори ризику: стать і вік пацієнта, наявність виразкової хвороби (виразки) та її ускладнень в анамнезі, коморбідної патології, хелікобактерної інфекції, спектр препаратів, що приймаються, дози і тривалість прийому НПЗП, їх селективність, поєднання з іншими препаратами, що мають аналогічні несприятливі ефекти на слизову оболонку кишечнику.
Як приклад персоніфікованого підходу до ведення пацієнтів похилого віку з коморбідною патологією, змушених тривалий час приймати НПЗП, розглянемо наступний клінічний випадок.
Клінічний випадок
Пацієнтка Д., 63 роки, з надмірною масою тіла (індекс маси тіла – 29,7 кг/м2). З приводу двостороннього гонартрозу тривалістю близько 3 років, займаючись самолікуванням, під час рецидивів захворювання приймала різні за тривалістю курси НПЗП (ібупрофен) для купірування суглобового больового і запального синдромів. Крім того, з приводу гіпертонічної хвороби за рекомендацією лікаря на постійній основі приймає інгібітори АПФ, кардіомагніл, циклами статини. До гастроентеролога звернулася вперше зі скаргами на періодичний дискомфорт і біль в епігастрії, нудоту, зрідка печію, що виникли протягом останнього місяця на тлі прийому ібупрофену (400-600 мг/добу протягом 3 місяців). Із гастропротективною метою ніяких препаратів не приймала.
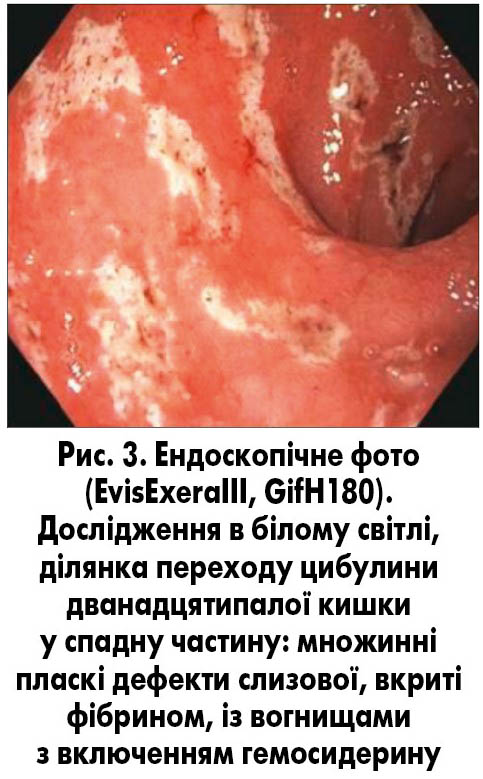
При ендоскопічному дослідженні у хворої виявлені ерозії в антральному відділі шлунка (рис. 1), взяті 3 біоптата слизової оболонки. У ділянці пілоричного каналу – зони кишкової метаплазії (рис. 2). Взяті 2 біоптата з цієї ділянки слизової оболонки шлунка. При огляді дванадцятипалої кишки в цибулині і зацибулинному відділі виявлено множинні пласкі дефекти слизової оболонки, вкриті фібрином, очагово з включенням гемосидерину (рис. 3). Виконаний під час ендоскопії швидкий уреазний тест виявився негативним.
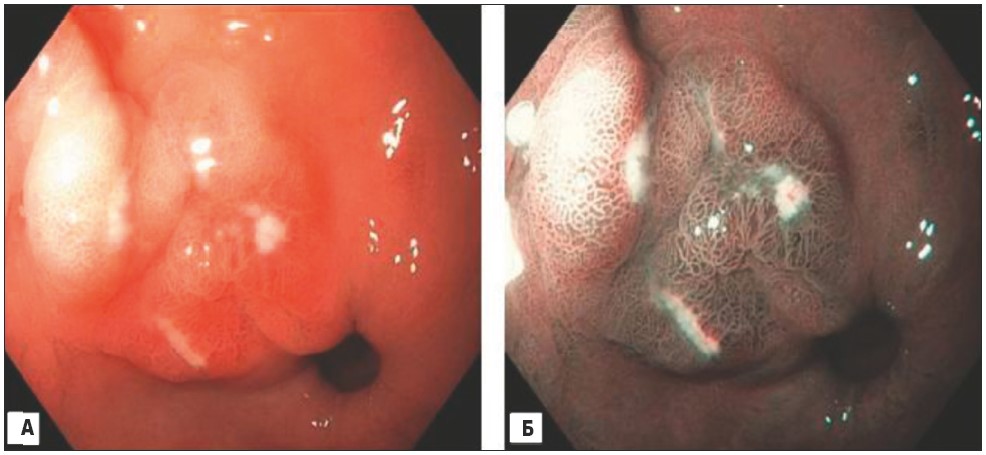 Рис. 1. Ендоскопічне фото (EvisExeraIII, GifH180): А – дослідження в білому світлі, антральний відділ шлунка по великій кривизні: визначається велика кількість пласких полігональних дефектів слизової (ерозії), у центрі яких є відкладення фібрину; Б – той же відділ, дослідження в режимі NBI (Narrowbandimaging): перифокально навколо дефектів слизової антрального відділу явища застійної гастропатії з повнокровними судинами підслизової, ямковий малюнок регулярний, у центрі ерозій – відкладення фібрину
Рис. 1. Ендоскопічне фото (EvisExeraIII, GifH180): А – дослідження в білому світлі, антральний відділ шлунка по великій кривизні: визначається велика кількість пласких полігональних дефектів слизової (ерозії), у центрі яких є відкладення фібрину; Б – той же відділ, дослідження в режимі NBI (Narrowbandimaging): перифокально навколо дефектів слизової антрального відділу явища застійної гастропатії з повнокровними судинами підслизової, ямковий малюнок регулярний, у центрі ерозій – відкладення фібрину
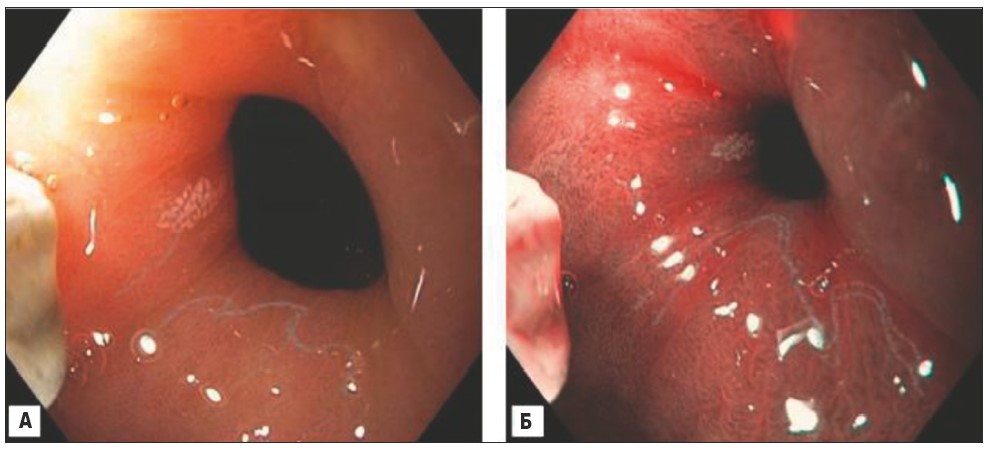 Рис. 2. Ендоскопічне фото (EvisExeraIII, GifH180): А – у зоні пілорусу в білому світлі; Б – той же відділ у режимі NBI (Narrowbandimaging): визначається ямковий малюнок, характерний для кишкової метаплазії (обведено лінією)
Рис. 2. Ендоскопічне фото (EvisExeraIII, GifH180): А – у зоні пілорусу в білому світлі; Б – той же відділ у режимі NBI (Narrowbandimaging): визначається ямковий малюнок, характерний для кишкової метаплазії (обведено лінією)
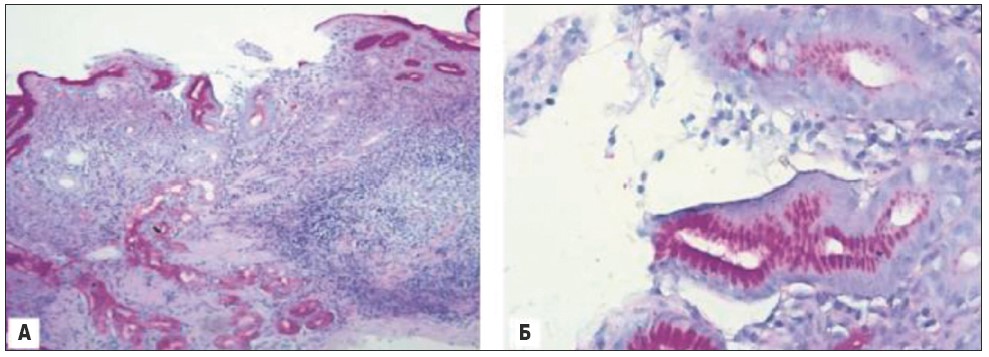
 При патоморфологічному дослідженні біоптатів антрального відділу шлунка відзначений нерівномірно виражений набряк строми, множинні ділянки ерозії, на поверхні яких розташовані гемолізовані еритроцити, слиз, злущені клітини, атрофія залоз, у частині залоз – кишкова метаплазія різного ступеня вираженості, клітинна інфільтрація слабо виражена, переважно – лімфогістіоплазмоцитарна, гіперплазія лімфоїдних фолікулів, у ділянці власної пластинки – помірно виражений склероз (рис. 4).
При патоморфологічному дослідженні біоптатів антрального відділу шлунка відзначений нерівномірно виражений набряк строми, множинні ділянки ерозії, на поверхні яких розташовані гемолізовані еритроцити, слиз, злущені клітини, атрофія залоз, у частині залоз – кишкова метаплазія різного ступеня вираженості, клітинна інфільтрація слабо виражена, переважно – лімфогістіоплазмоцитарна, гіперплазія лімфоїдних фолікулів, у ділянці власної пластинки – помірно виражений склероз (рис. 4).
При оцінці функціонального стану слизової відзначено, що в ділянках ерозії й атрофії знижена і/або відсутня секреція слизу (рис. 5А), поза цими ділянками секреція слизу і розподіл келихоподібних клітин збережені (рис. 5Б).
Проведено лікування: пантопразол (Нольпаза, КРКА) 40 мг 2 р/добу протягом 8 тижнів, потім 40 мг 1 р/добу протягом 4 тижнів. На 4 тижні призначений прийом колоїдного вісмуту субцитрату (Улькавіс, КРКА) у добовій дозі 480 мг, розділеній на 4 прийоми. Вибір препарату пояснюється тим, що він показав ефективність у клінічному дослідженні як препарат високої якості, що має сертифікат біоеквівалентності оригінальному препарату [1].
До кінця 2-го тижня прийому препаратів Нольпаза та Улькавіс больовий і диспептичний синдроми були купірувані. Прийом ібупрофену продовжений по 400 мг/добу через наявність больового і запального суглобового синдромів (купірувані до кінця 4-го тижня одночасного прийому гастроцитопротекторів і НПЗП). Далі у разі рецидиву остеоартрозу колінних суглобів для купірування загострення рекомендований прийом НПЗП разом із препаратом Нольпаза 40 мг одноразово вранці за 30 хвилин до їди.
Від контрольного ендоскопічного дослідження пацієнтка відмовилася. З урахуванням виявлених морфологічних змін (кишкової метаплазії) рекомендований ендоскопічний огляд 1 раз у 2-3 роки або у разі відновлення симптомів диспепсії та інших подібних явищ.
 Рис. 4. Патоморфологічне дослідження біоптатів з антрального відділу шлунка: А – слизова шлунка з ерозіями, на поверхні – обривки залоз, слабо виражена, переважно лімфогістіоплазмоцитарна клітинна інфільтрація, злущені клітини, атрофія залоз, у частині залоз – кишкова метаплазія різного ступеня вираженості, гіперплазований лімфоїдний фолікул , склероз у ділянці власної пластинки; Б – слизова шлунка з ерозіями, на поверхні слиз і гемолізовані еритроцити. Забарвлення гематоксиліном та еозином
Рис. 4. Патоморфологічне дослідження біоптатів з антрального відділу шлунка: А – слизова шлунка з ерозіями, на поверхні – обривки залоз, слабо виражена, переважно лімфогістіоплазмоцитарна клітинна інфільтрація, злущені клітини, атрофія залоз, у частині залоз – кишкова метаплазія різного ступеня вираженості, гіперплазований лімфоїдний фолікул , склероз у ділянці власної пластинки; Б – слизова шлунка з ерозіями, на поверхні слиз і гемолізовані еритроцити. Забарвлення гематоксиліном та еозином
* Збільшення у 100 разів
Рис. 5. Патоморфологічне дослідження біоптатів з антрального відділу шлунка: А – у слизовій шлунка в ділянці ерозії відсутність секреції слизу, зниження ступеня інтенсивності секреції в частині залоз із ознаками атрофії, збереження секреції у незмінених залозах; Б – у слизовій оболонці шлунка в ділянці ерозії відсутність секреції слизу, збереження секреції у незмінених залозах. PAS-реакція
* Збільшення у 400 разів
Вибір препаратів для профілактики і лікування НПЗП-гастропатій
Клінічні особливості НПЗП-гастропатії (перебіг якої в описаному випадку довго був безсимптомним), наявність поєднаного медикаментозного навантаження (НПЗП у комбінації з препаратами інших груп), пов’язаного з лікуванням коморбідної патології у літньої пацієнтки, змушують більш ретельно обирати як профілактичні, так і лікувальні засоби для запобігання розвитку диспепсії та ерозивно-виразкових уражень ШКТ. З урахуванням існуючих рекомендацій найбільш оптимальними для вирішення цих завдань визнані ІПП. Найкращим препаратом цієї групи є пантопразол, що володіє тривалою здатністю пригнічувати шлункову секрецію і має найменший потенціал несприятливих міжлікарських взаємодій.
У розглянутих клінічних прикладах у схемах лікування пацієнтів, окрім ІПП, з успіхом був використаний колоїдний субцитрат вісмуту. Сполуки вісмуту знайшли широке застосування у медичній практиці; сьогодні найчастіше використовують колоїдний субцитрат [3].
Усебічний аналіз механізмів дії колоїдного субцитрату вісмуту, його особливостей фармакокінетики і фармакодинаміки, ролі у підвищенні ефективності схем ерадикаційної терапії та канцеропревенціі висвітлений у статтях Г.Д. Фадєєнко та Я.В. Нікіфорової [7, 8].
Гастропротективна дія сполук вісмуту пов’язана із простагландин-опосередкованим механізмом. Встановлено, що вісмуту трикалію дицитрат збільшує синтез і секрецію цитопротективних класів простагландинів і, відповідно, простагландинозалежну продукцію бікарбонату в слизовій оболонці верхніх відділів ШКТ, що підвищує регенераторний потенціал слизової і буферну ємність слизу. Солі вісмуту також стимулюють вироблення епідермального фактору росту на ділянках пошкодженої слизової оболонки, що стимулює зріст епітеліальних клітин і репаративно-регенеративні процеси.
Підвищення захисту слизової оболонки зумовлено також зниженням активності пепсину, зв’язуванням солей жовчних кислот, утворенням щільного альбумінату на поверхні виразкового дефекту на слизовій оболонці ШКТ і поліпшенням мікроциркуляції [14].
Антимікробна дія вісмуту трикалію дицитрату зумовлена зниженням рухливості H. pylori й адгезії до епітеліальних клітин, порушенням цілісності та функції цитоплазматичної мембрани, пригніченням ферментативних систем (уреази, каталази, алкогольдегідрогенази, ліпази/фосфоліпази) H. pylori, порушенням метаболізму нікелю, заліза і цинку, пригніченням синтезу АТФ, білка і компонентів мембран, проникненням в епітеліоцити з подальшим впливом на бактерії всередині клітин [13].
Препарати вісмуту займають важливе місце в сучасних стратегіях ерадикаційної терапії. Квадротерапія на основі вісмуту вважається кращою терапією 1-ої лінії, особливо в регіонах із високою резистентністю до кларитроміцину і метронідазолу. Додавання вісмуту трикалію дицитрату до потрійної терапії збільшує ймовірність ерадикації H. pylori більш ніж на 15% [15].
Доведено, що препарати вісмуту запобігають розвитку як первинної, так і вторинної резистентності до антибіотиків. Важливою перевагою вісмутовмісної терапії є її висока ефективність щодо ерадикації навіть мультирезистентних штамів H. pylori. Саме завдяки такій ефективності виявилося можливим призначення лікування без визначення чутливості бактерії до антибіотиків [15]. Це особливо актуально для нашої країни. Тому препарати вісмуту знайшли широке застосування у схемах антихелікобактерної терапії, особливо у регіонах із високою поширеністю антибіотикорезистентних штамів H. pylori [6].
Одним із механізмів, що підвищують резистентність H. pylori до антибіотиків, є формування біоплівки. У такому вигляді колонії мікроорганізму виживають при значно більш високих концентраціях препаратів. Тільки у формі колоїдного субцитрату вісмут розчиняється у воді та здатний проникнути у біоплівку й забезпечити знищення мікроорганізму [10].
Завдяки високій розчинності у воді (у десятки разів вище, ніж у інших сполук вісмуту) й утворенню колоїдних частинок, які преципітують у кислому середовищі шлунка, а потім ефективно пенетрують у шлунковий слиз, створюються дуже високі локальні концентрації колоїдного субцитрату вісмуту, які легко проникають у заглиблення слизової оболонки і захоплюються епітеліоцитами. Швидкий розвиток бактерицидного ефекту шляхом безпосереднього контакту з бактеріями дозволяє впливати на кокові форми і бактерії, що знаходяться всередині клітин, які не доступні для інших антибактеріальних засобів.
Ефективність антихелікобактерної дії препаратів вісмуту базується також на зменшенні адгезії H. pylori до епітеліальних клітин. Антиадгезивна активність колоїдного субцитрату вісмуту проявляється при концентрації, у 1000 разів меншій порівняно з іншими вісмутовмісними субстанціями. Таким чином, саме колоїдний субцитрат вісмуту має найбільшу активність при мінімальній концентрації.
Вісмут, який є важким металом, може мати побічну дію на організм людини. Однак унікальна лікувальна форма препарату не дозволяє вісмуту вивільнитися з потужної колоїдної структури, що забезпечує його низьку біодоступність (у 10 разів меншу, ніж у неколоїдних розчинних солей вісмуту) і є основою його безпечного впливу. Але при вираженому зниженні кислотної продукції в шлунку можливе збільшення всмоктування вісмуту в кишечнику і поява небажаних побічних ефектів у вигляді потемніння язика і темної облямівки на яснах. Єдиним важливим недоліком препарату, про який слід попереджати пацієнтів, є випорожнення чорного кольору, що може маскувати мелену або імітувати її.
Деякі факти дозволяють говорити про позитивний вплив колоїдного субцитрату вісмуту на слизову оболонку шлунка при хронічній патології. Помічено, що вісмут перешкоджає прогресуванню атрофії, сприяє регенерації слизової оболонки шлунка, зменшуючи стадію хронічного гастриту, а з точки зору канцеропревенції забезпечує індукцію проліферації епітелію слизової шлунка не тільки на стадії легкої (III), але й вираженої атрофії (III-IV) за класифікаційними критеріями системи OLGA [5].
Результати віддаленого спостереження (через 18 місяців після лікування) за станом слизової шлунка у пацієнтів із атрофічним гастритом після ерадикації H. pylori із застосуванням препаратів вісмуту свідчать про поліпшення процесів регенерації в слизовій оболонці [2].
Усе зазначене визначає переваги колоїдного субцитрату вісмуту при його комплексному впливі на цитопротекцію і дозволяє препарату бути ефективним і безпечним компонентом не тільки антихелікобактерної терапії, але й терапії постерадикаційного хронічного гастриту, а також засобом профілактики розвитку і прогресування канцерогенезу [8].
Питання надійної профілактики пошкоджень слизової шлунка і дванадцятипалої кишки, що виникають при лікуванні НПЗП, залишається предметом дискусій. ІПП найбільш ефективно запобігають появі виразок шлунка і дванадцятипалої кишки, асоційованих із НПЗП. Пацієнти можуть отримувати ІПП за показаннями настільки довго, наскільки вимагає клінічна ситуація. Слід враховувати переваги окремих представників цього класу препаратів (пантопразол – Нольпаза), що дозволяють нівелювати теоретичні та потенційні ризики побічних ефектів при тривалому застосуванні.
Важливими компонентами комбінованої терапії, що підвищують потенціал захисного механізму слизової оболонки шлунка від агресивної дії НПЗП, є цитопротекторні препарати, а саме – колоїдний субцитрат вісмуту.
Фармацевтична еквівалентність, подібні структурні й фізико-хімічні властивості двох таблетованих форм вісмуту трикалію дицитрату, висока терапевтична ефективність препарату Улькавіс, продемонстрована в клінічному дослідженні, підтверджує його терапевтичну еквівалентність із референтним лікарським засобом [4].
Список літератури знаходиться в редакції.
Статтю надано ТОВ «КРКА Україна».
Вперше опубліковано: Сучасна гастроентерологія, № 5 (115), 2020.
Тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія» № 1 (59) 2021 р.