10 квітня, 2021
Патогенетична терапія нусінерсеном у пацієнтів зі спінальною м’язовою атрофією
 Спінальна м’язова атрофія (СМА) – рідкісне генетичне захворювання з широким фенотиповим спектром, що було вперше описане ще у 1890-х рр. Проте до початку ХХІ ст. не існувало патогенетичної терапії СМА, тож лікування було зосереджене на оптимізації тих чи інших клінічних проявів. Завдяки розумінню патофізіології захворювання та досягненням у галузі генетичної терапії, нині з’явилися нові перспективні агенти, застосування яких дозволяє збільшити тривалість та поліпшити якість життя пацієнтів.
Спінальна м’язова атрофія (СМА) – рідкісне генетичне захворювання з широким фенотиповим спектром, що було вперше описане ще у 1890-х рр. Проте до початку ХХІ ст. не існувало патогенетичної терапії СМА, тож лікування було зосереджене на оптимізації тих чи інших клінічних проявів. Завдяки розумінню патофізіології захворювання та досягненням у галузі генетичної терапії, нині з’явилися нові перспективні агенти, застосування яких дозволяє збільшити тривалість та поліпшити якість життя пацієнтів.
Епідеміологія та патогенез
СМА, або проксимальна спінальна міотрофія – генетичне захворювання з автосомно-рецесивним типом успадкування, за якого відбувається дегенерація клітин у передньому розі спинного мозку з асоційованим руйнуванням α-моторних нейронів. Клінічно це проявляється прогресувальною слабкістю та атрофією проксимальних м’язів, що насамкінець призводить до знерухомлення пацієнта.
Захворюваність на СМА коливається від 1:6000 до 1:11 тис. та варіює залежно від етнічної належності, становлячи 8:100 тис. для європейців, 0,89:100 тис. для афроамериканців та 0,96:100 тис. для мулатів і метисів (Burr, Reddivari, 2021).
Причиною виникнення СМА є гомозиготна делеція у гені виживання мотонейронів 1 (SMN1), яка призводить до дефіциту білка виживання мотонейронів (SMN). Недостатність цього білка викликає дисфункцію та атрофію мотонейронів, що призводить до прогресувальної атрофії поперечно-посмугованої мускулатури й тяжких ускладнень із боку інших органів і систем, що є загрозою життю. Ген SMN2 практично ідентичний SMN1 і також продукує білок SMN, проте нуклеотидна заміна у 7-му екзоні зумовлює його виключення при сплайсингу (вилученні інтронів із попередника матричної РНК при процесингу). В результаті синтезується функціонально дефектний білок SMN, що провокує розвиток СМА (Li, 2020).
Клінічні прояви
СМА неоднорідна за формою, а її прояви варіюють від тяжкої генералізованої слабкості з дихальною недостатністю, що призводить до смерті протягом декількох тижнів після народження, до легкої проксимальної слабкості, що розвивається у дорослому віці. Більш ранні прояви зазвичай пов’язані з погіршенням функції та прогнозу: класифікація підтипів СМА визначається віком дебюту, а також клінічною вагомістю та очікуваною тривалістю життя.
Існує чотири основних типи СМА (I‑IV), при цьому 0 підтип проявляється в утробі матері, викликаючи смерть протягом перших місяців життя, а IV тип – у дорослому віці та характеризується легкою слабкістю, не впливаючи на тривалість життя (Burr, Reddivari, 2021).
Найтяжчою формою є СМА I типу. Вона маніфестує у дітей віком до 6 міс., які не досягають можливості сидіти самостійно. За природного перебігу хвороби пацієнти неухильно втрачають здатність рухатися. При тяжчому варіанті СМА I типу («слабкий I тип») пацієнти вмирають або потребують перманентної штучної вентиляції легень до досягнення двох років. У разі менш тяжкого перебігу («сильний I тип») хворі можуть доживати до дорослого віку за умов адекватної вентиляційної та медикаментозної підтримки (Shokuhfar et al., 2020).
При СМА II типу (проміжна СМА) захворювання дебютує у віці 7‑18 міс. Діти можуть сидіти, а в деяких випадках навіть стояти незважаючи на відсутність здатності ходити. Найчастішим клінічним проявом початку захворювання є відставання в оволодінні базовими руховими навичками. Особи зі СМА II типу характеризуються короткою очікуваною тривалістю життя, яка, проте, може варіювати від 2 до 40 років (Kaufmann et al., 2011).
Дебют СМА IIIa підтипу припадає переважно на вік 1,5‑3 роки, тоді як СМА IIIb підтипу найчастіше розвивається після 3-го року життя. Нерідко у дітей зберігається здатність сидіти, стояти і пересуватися щонайменше до пубертатного періоду, коли у багатьох пацієнтів з’являються значні труднощі при ходьбі. У хворих відзначаються м’язова гіпотонія і слабкість різного ступеня виразності з переважним залученням до патологічного процесу проксимальних груп м’язів. Пошкодження нейронів, що іннервують бульбарну мускулатуру, зустрічається рідше, ніж тяжчі форми СМА. Перебіг захворювання характеризується відносною стабільністю; тривалість життя пацієнтів зі СМА III типу нерідко порівнянна з такою у загальній популяції.
Серед загальних симптомів СМА слід виділити такі, як:
- глибока гіпотонія;
- прогресувальна м’язова слабкість зі збереженням функції лицьових м’язів;
- відсутність або ослаблення глибоких сухожильних рефлексів;
- дрібний тремор та контрактури.
Діти зі СМА, в яких спостерігається м’язова слабкість від помірної до тяжкої та/або тяжкий сколіоз, схильні до вищого ризику гіповентиляції та дихальної недостатності (Shokuhfar et al., 2020).
Переваги залучення олігонуклеотидів
Протягом тривалого часу лікування СМА полягало у підтримці хворих із раннім залученням педіатричних фахівців з паліативної допомоги, особливо для I (зокрема 0 підтипу) і II типів. Нещодавно були розроблені нові методи лікування, які демонструють суттєві перспективи у боротьбі з цим захворюванням (Ludolph, Wurster, 2019).
З огляду на дані генетичних досліджень, корекція сплайсингу екзонів 7 у SMN2 є перспективним підходом для терапії СМА. Було розроблено кілька стратегій, які включають, зокрема, застосування химерних або біфункціональних антисмислових олігонуклеотидів (Li, 2020).
Використання антисмислових олігонуклеотидів як метод лікування розладів центральної нервової системи (ЦНС) має певні переваги, оскільки їм притаманні висока цільова специфічність, низька токсичність та системний вплив, а також тривалий період напіввиведення (Li, 2020). До того ж їх ефекти є оборотними на відміну від інших варіантів генетичної терапії, які пов’язані з безліччю незворотних змін.
Нусінерсен – перший новий препарат на основі олігонуклеотидів, схвалений Управлінням із контролю за якістю харчових продуктів і лікарських засобів США (FDA) та Європейським агентством з лікарських засобів (EMA) для терапії всіх типів СМА. Він специфічно зв’язується з репресором в екзоні 7 SMN2, модулює механізм дефектного сплайсингу РНК та забезпечує виробництво повнорозмірного функціонального білка SMN2. Оскільки нусінерсен не проникає через гематоенцефалічний бар’єр, єдиним ефективним способом введення є пряма інтратекальна (ІТ) ін’єкція, яка не потребує корегування дози; для всіх пацієнтів можна використовувати фіксовану дозу 12 мг/5 мл. ІТ-ін’єкції нусінерсену забезпечують повний розподіл препарату по всій спинномозковій рідині (СМР) у тканини ЦНС, які є мішенями його терапевтичної дії.
Середні мінімальні залишкові концентрації нусінерсену в СМР збільшуються приблизно в 1,4‑3 рази після багаторазового введення, досягаючи рівноважного стану орієнтовно протягом 24 міс. При додаткових уведеннях препарату після досягнення рівноважного стану подальшого накопичення у СМР або тканинах ЦНС не очікується.
Схема терапії нусінерсеном передбачає введення чотирьох навантажувальних доз (перші три вводять що 14 днів, а четверту – через 30 днів). Застосування підтримувальних доз починають через 4 міс. після четвертої дози, які вводять що 4 міс. (Shokuhfar et al., 2020).
Ефективність та переносимість одноразового ІТ‑введення нусінерсену
Ефективність та сприятливий профіль безпеки нусінерсену було переконливо продемонстровано у клінічних випробуваннях за участю пацієнтів зі СМА різних типів при тривалих періодах спостереження. Зокрема, вивчали ефективність одноразової болюсної ІТ-ін’єкції 5 мл нусінерсену, після чого проводили стандартну люмбальну пункцію (ЛП) у міжхребцевому проміжку між остистими відростками L3 і L4 (Chiriboga et al., 2016). Ефективність нусінерсену оцінювали у чотирьох групах пацієнтів, що отримували різні дози препарату (1, 3, 6, 9 мг). Другу ЛП проводили на 8-й день у групах із дозуванням 1, 3 і 6 мг та на 8-й або 29-й день у групі з дозою 9 мг.
Із 28 учасників 24 осіб включили у довгострокове розширене дослідження для оцінки стану через 9‑14 місяців. Імуногенної відповіді після одноразового IT-введення дози нусінерсену не було встановлено. Небажані явища спостерігалися у дітей зі СМА III типу, дітей старшого віку та при використанні голки 21-го або 22-го розміру (на відміну від 24-го розміру) (Hachе et al., 2016).
Нусінерсен було виявлено через годину в плазмі та через сім днів у СМР після введення. Після оцінок через 9‑14 місяців концентрації нусінерсену в ЦНС все ще зберігалися на певній верхній межі (1 нг/мл).
Аналіз рівнів білка SMN у зразках СМР показав, що в групах пацієнтів, які отримували дози 1 чи 3 мг, змін не було. Проте у групах, учасники яких отримували по 6 і 9 мг нусінерсену, концентрації білка SMN виявилися більш ніж удвічі вищими через 9‑14 місяців після застосування порівняно з вихідним рівнем.
Поліпшені результати функціонального аналізу були продемонстровані у групі з дозою 9 мг на 85-й день. Показник за розширеною шкалою оцінки моторних функцій при СМА лікарні Хаммерсміта (HFMSE) порівняно з вихідним підвищувався в середньому на 3,1 бала. Подальше поліпшення спостерігалося через 9‑14 місяців – оцінка за HFMSE збільшилася в середньому на 5,8 бала (показники за HFMSE варіюють від 0 до 66, причому вищі вказують на кращу рухову функцію порівняно з вихідним рівнем).
Загалом не було виявлено проблем із безпекою, які обмежували б дозування, що дозволило зосередити увагу на дозах нусінерсену понад 9 мг.
Застосування нусінерсену в немовлят у досимптомному періоді СМА
Ефективність та безпеку нусінерсену вивчали у поточному відкритому дослідженні фази ІІ NURTURE за участю 25 дітей із генетично підтвердженою СМА, які вперше отримали нусінерсен у досимптомному періоді (De Vivo et al., 2019). Було продемонстровано стійкість ефекту препарату з середнім періодом спостереження 2,9 року. При останньому відвідуванні середній вік дітей становив 34,8 (25,7‑45,4) міс. і перевищував очікуваний вік появи симптомів СМА I або II типу. Усі пацієнти були живі та не потребували трахеостомії або постійної вентиляції легень.
Всі 25 учасників навчилися сидіти без опори, 23 із 25 (92%) – ходити зі сторонньою допомогою, а 22 із 25 (88%) – самостійно. У восьми немовлят спостерігалися побічні ефекти, які дослідники вважали ймовірно пов’язаними з нусінерсеном, але загалом препарат добре переносився протягом усього періоду спостереження.
Таким чином, було продемонстровано важливість скринінгу новонароджених та проактивного лікування нусінерсеном одразу після встановлення генетичного діагнозу СМА у несимптомних немовлят.
Виживаність та рухові функції на тлі терапії нусінерсеном у симптомних немовлят
Подвійне сліпе рандомізоване та фіктивно-контрольоване клінічне дослідження ENDEAR являло собою 13-місячне вивчення ефективності та безпеки нусінерсену в немовлят віком до 7 міс. із генетично підтвердженою СМА та дебютом симптомів у віці до 6 міс. (Finkel et al., 2017). Пацієнти зі СМА І типу були рандомізовані до груп ІТ-введення нусінерсену (n=80) і контролю (n=41) з імітацією процедури. Вихідні характеристики між групами були порівнянними за винятком того, що учасники, які отримували нусінерсен, мали більш ранній початок симптомів і значніший тягар хвороби порівняно з контрольною групою.
Проміжний аналіз показав, що пацієнти у групі нусінерсену мали значно вищий рівень рухової реакції порівняно з учасниками контрольної групи (41 та 0% відповідно; р<0,001), що спонукало до дострокового припинення дослідження. Остаточний аналіз продемонстрував, що серед хворих при застосуванні нусінерсену в 51% мала місце моторна відповідь порівняно з відсутністю такої у контрольній групі. Найпоширенішим здобутком було досягнення повного контролю над рухами голови (22%), за яким слідувала здатність перевертатися (10%), самостійно сидіти (8%) і стояти (1%). Пацієнти у групі нусінерсену мали на 47% нижчий ризик смерті порівняно з контрольною групою.
Небажані явища виникали з однаковою частотою в обох групах. Більшість із них відповідали тим, що зазвичай спостерігаються у немовлят зі СМА і про які повідомлялося у попередніх дослідженнях. Водночас жодних серйозних побоювань із приводу безпеки ІТ-ін’єкцій відзначено не було. Також виявлено, що несприятливі ефекти, пов’язані з синдромом пост-поперекової пункції, у дітей зустрічаються рідше, ніж у дорослих.
Тож дослідники дійшли висновку, що нусінерсен ефективний для поліпшення рухової функції (р=0,005) і загальної виживаності (р=0,004) у немовлят зі СМА. Це вельми показово з огляду на те, що у групі нусінерсену від початку було більше пацієнтів, які перебували на штучній вентиляції легень, ніж у контрольній групі. Результати аналізу підгруп, основані на тривалості захворювання (≤13,1 vs >13,1 тижня), дозволяють припустити, що ранній початок терапії нусінерсеном може максимізувати її ефективність (Finkel et al., 2017).
У дослідженні CHERISH 126 дітей зі СМА, в яких симптоми проявилися у віці понад 6 міс., були випадковим чином розподілені у співвідношенні 2:1 для ІТ-введення нусінерсену в дозі 12 мг або фіктивної процедури (контрольна група) на 1, 29, 85 і 274-й дні. Як наслідок, у 57% дітей, що отримували нусінерсен, порівняно з 26% у контрольній групі спостерігали зростання показників за шкалою HFMSE щонайменше на 3 бали (р<0,001). Окрім того, загальна захворюваність і частота небажаних явищ у цих групах були зіставними – 93 і 100% відповідно (Mercuri et al., 2018).
Застосування нусінерсену у дітей старшого віку і дорослих пацієнтів із деформацією хребта
У дітей старшого віку і дорослих внаслідок нервово-м’язової слабкості розвивається тяжкий сколіоз. Прогресування сколіозу зазвичай потребує хірургічного втручання, метою якого є знерухомлення суміжних хребців за рахунок їх зрощування та застосування кісткового алотрансплантату для стабілізації (спондилодез). У таких пацієнтів сколіоз та/або спондилодез виключають застосування стандартного трансламінарного підходу для отримання ІТ-доступу. Замість цього доцільно розглянути використання трансфорамінальної ЛП для ін’єкції нусінерсену під контролем рентгеноскопії, що зарекомендувала себе як безпечний та успішний альтернативний підхід у дорослих і дітей із тяжким сколіозом хребта, а також інтерламінарним кістковим спондилодезом, коли класичний інтерламінарний підхід неможливий або протипоказаний. Цей метод супроводжується мінімальними небажаними явищами без серйозних ускладнень (Shokuhfar et al., 2020).
Внаслідок вивчення ефективності й безпеки трансфорамінальної ІТ-доставки нусінерсену за участю 28 хворих на кістковий спондилодез (середній вік – 24,1±9,8 року) із середнім або пізнім початком СМА дослідники дійшли висновку, що таке введення нусінерсену є безпечним у пацієнтів із деформацією хребта. Використання конусно-променевої комп’ютерної томографії допомагає окреслити анатомію та оптимізувати траєкторію голки під час першого контакту, тож цей метод можна використовувати вибірково для подальших процедур (Weaver et al., 2020; Cordts, 2020).
Клінічний випадок
Пацієнт Н., 13 років, направлений до неврологічної клініки через прогресувальну м’язову слабкість проксимальних відділів кінцівок.
Анамнез. Народився в результаті кесаревого розтину. У віці трьох років був поставлений діагноз СМА з пізнім початком.
Клініко-лабораторне обстеження. Підвищений рівень креатинкінази (312 мкм/л), показник за шкалою HFMSE – 29 балів, результат тесту 6-хвилинної ходьби (6MWT) – 87,5 м. Початкове значення сумарного потенціалу дії м’яза (CMAP) до лікування становило 5,1 і 4,4 мВ в обох загальних малогомілкових нервах. Форсована життєва ємність легень (ФЖЄЛ) – 4,65 л (114%), об’єм форсованого видиху за першу секунду маневру форсованого видиху (ОФВ1) – 3,55 л (103%), ОФВ1/ФЖЄЛ – 89%.
Молекулярно-генетичне дослідження. Виявлено гомозиготну делецію в екзонах 7 і 8 гена білка SMN1.
Діагноз. Наявність СМА підтверджено.
Терапія. У віці 15 років – ІТ-ін’єкція нусінерсену. Після 14 місяців лікування пацієнт показав значне клінічне поліпшення: за шкалою HFMSE – 32 бали, результат 6MWT – 113 м. Значення CMAP в обох загальних малогомілкових нервах – 5,9 і 4,6 мВ. Контрольний аналіз функції легень показав поліпшення ФЖЄЛ – 5,26 (129%) та і ОФВ1 – 3,8 л (110%).
Таким чином, клінічний випадок демонструє безпеку й ефективність терапії нусінерсеном у пацієнтів із пізнім початком СМА без серйозних побічних ефектів (Park et al., 2021).
Висновки
Поява нусінерсену як першої патогенетичної терапії стала початком нової ери лікування СМА. Продемонстровано переконливу ефективність та сприятливий профіль безпеки нусінерсену в клінічних дослідженнях за участю пацієнтів зі СМА різних типів при тривалому періоді спостереження. В Україні нусінерсен представлений препаратом Спінраза (компанія «Янссен»).
Інтратекальне введення препарату нусінерсен (Спінраза) дозволяє істотно змінити перебіг хвороби, поліпшити виживаність пацієнтів та надати можливість набуття нових рухових навичок із мінімальним ризиком небажаних явищ та без серйозних ускладнень.
CP-219394
Практичний досвід терапії СМА препаратом нусінерсен: огляд наукових публікацій
Рекомендації з регулярної клінічної оцінки пацієнтів зі СМА
Згідно з міжнародними стандартами щодо догляду, надано такі рекомендації щодо регулярної клінічної оцінки пацієнтів зі СМА [1,2]:
- оцінка рухових функцій за шкалами CHOP INTEND, HINE, діапазону руху;
- антропометричні вимірювання, як-то довжина ліктьової кістки, вага, окружність голови і грудної клітки, на 0, 15, 30, 60-й дні і потім кожні 4 місяці;
- нічна оксиметрія і транскутанний моніторинг (до початку терапії, потім кожні 6 місяців);
- рентген грудної клітки у положенні лежачи, за потреби – кожні 6 місяців.
Знання, якими повинні володіти батьки, опікуни чи законні представники дитини до початку терапії нусінерсеном
Перед початком терапії нусінерсеном батьки / опікуни / законні представники дитини мають [1]:
- бути поінформовані про безпеку препарату, оцінку співвідношення ризику й користі від лікування та що від нього очікувати;
- розуміти можливі небажані явища, пов’язані з процедурою люмбальної пункції;
- володіти навичками догляду за дитиною з діагнозом СМА, як-от вміння користуватися мішком Амбу, відкашлювачем, проведення дихальної реабілітації, розтягувань.
Рекомендовані терапевтичні заходи перед кожною ін’єкцією препарату нусінерсен
Перед кожною ін’єкцією нусінерсену необхідно проводити [3]:
- аналіз згортання крові – коагулограма (для контролю розвитку тромбоцитопенії, порушення коагуляції);
- аналіз на визначення білка в сечі (для контролю виникнення нефротоксичності);
- обстеження на предмет гідроцефалії у пацієнтів зі зниженим рівнем свідомості.
Лікування і моніторинг стану пацієнтів між ін’єкційними дозами нусінерсену
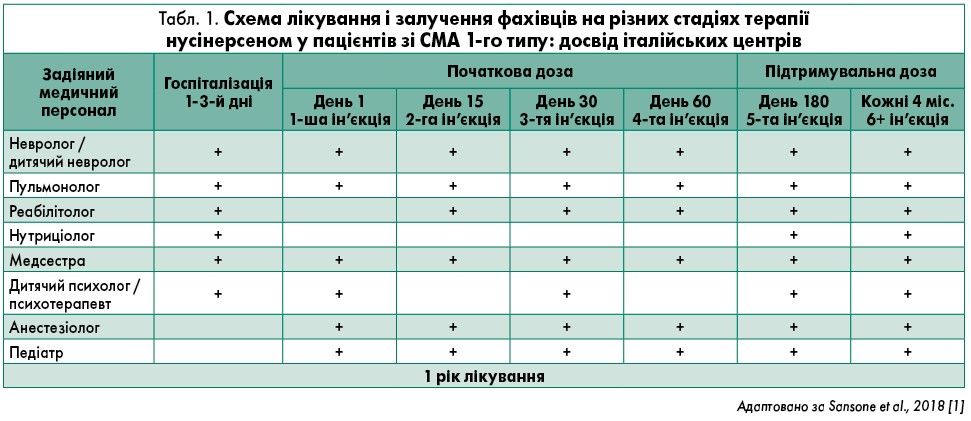
Схему лікування і залучення фахівців на різних стадіях терапії нусінерсеном у пацієнтів зі СМА 1-го типу неведено у таблиці 1.
Після отримання ін’єкції нусінерсену пацієнт має перебувати під наглядом медичної команди протягом декількох годин. Необхідно вести ретельний контроль стану хворого та негайно сповіщати лікаря про будь-які його зміни. Також потрібно забезпечити прямий контакт батьків пацієнта з лікарем (наприклад, за допомогою телефонного зв’язку) для щотижневого відстеження стану хворого, зокрема інформування про дотримання дієти, проведення реабілітаційних процедур, контролю дихальної функції [1].
Профіль безпеки препарату нусінерсен
Найпоширеніші несприятливі явища пов’язані з люмбальною пункцією. Більшість із них були зареєстровані протягом 72 год після виконання процедури. Частота розвитку і тяжкість цих подій узгоджуються з передбачуваними при люмбальній пункції. У клінічних дослідженнях препарату нусінерсен жодних тяжких ускладнень, асоційованих із люмбальною пункцією, як-то серйозні інфекції, не спостерігалося [3‑5].
Несприятливі явища, пов’язані з люмбальною пункцією, наведені в таблиці 2.
Протокол спостереження за пацієнтами після інтратекального введення препарату нусінерсен: дані клінічного дослідження ENDEAR
Згідно з результатами клінічного дослідження ENDEAR (дитяча маніфестація СМА), доступні такі положення протоколу спостереження за пацієнтами після інтратекального (ІТ) введення нусінерсену [7, 8]:
- контроль загального стану пацієнта (артеріальний тиск, пульс, частота дихання, температура тіла, пульсоксиметрія) через 1, 2, 4, 6 год після введення препарату;
- контроль неврологічного стану хворого, як-от оцінка психічного статусу, рівня свідомості, сенсорного, рухового функціонування, функції черепних нервів, рефлексів, через 3, 6 год після введення препарату;
- перебування пацієнта у стаціонарі під наглядом протягом 24 год після застосування першої ін’єкції препарату та не менш ніж 6 год – після введення наступних доз.
Вимоги щодо забезпечення пульмонологічної допомоги пацієнтам зі СМА
При наданні пульмонологічної допомоги пацієнтам зі СМА мають бути враховані такі вимоги [6]:
- необхідність залучення фахівця-пульмонолога на всіх стадіях терапії;
- наявність технічного оснащення для неінвазивної вентиляції легенів;
- наявність устаткування для механічного очищення дихальних шляхів (інсуфлятор-ексуфлятор/відкашлювач).
Надання медичної допомоги пацієнтам зі СМА
Стандартна мульдисциплінарна команда із забезпечення медичної допомоги пацієнтам зі СМА представлена на рисунку.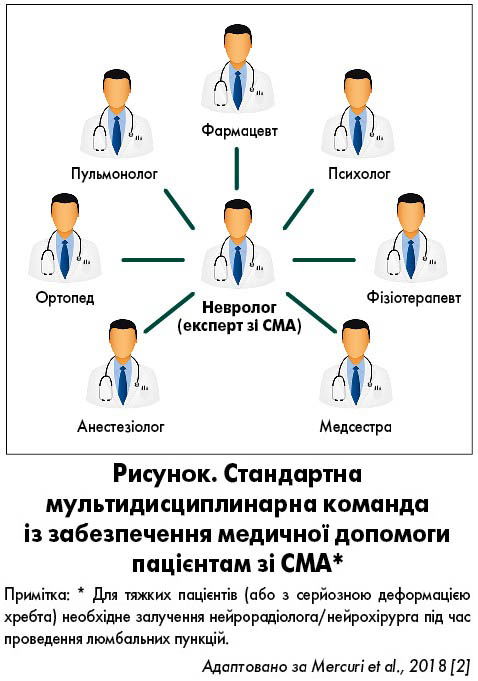
Вимоги з функціонального оснащення центрів, де здійснюють інтратекальні ін’єкції [2]:
- кабінет для проведення ІТ-ін’єкцій;
- протокол виконання ІТ-ін’єкцій;
- кабінет для моніторингу стану пацієнта після проведення процедури;
- протокол виконання седації/анестезії при ІТ-ін’єкціях;
- реанімація / відділення інтенсивної терапії.
Література
- Sansone V.A. et al. Intrathecal nusinersen treatment for SMA in a dedicated neuromuscular clinic: an example of multidisciplinary and integrated care // Neurol Sci. – 2019. – 40 (2). – Р. 327‑332.
- Mercuri E. Finkel R.S. et al. Diagnosis and management of spinal muscular atrophy: Part 1: Recommendations for diagnosis, rehabilitation, orthopedic and nutritional care // Neuromuscul Disord. – 2018. –28 (2). – Р. 103‑115; doi: 10.1016/j.nmd.2017.11.005. Epub 2017 Nov 23. PMID: 29290580.
- Spinraza Summary of Product Characteristics. Інструкція для медичного застосування препарату нусінерсен в Україні (UA/17852/01/01).
- Термін кращого вживання із MedDRA. Медичний словник нормативно-правової діяльності.
- Claborn M.K. et al. Nusinersen: A Treatment for Spinal Muscular Atrophy // Ann Pharmacother. – 2019. – 53. – Р. 61‑69.
- Finkel R.S. Mercuri E. et al. Diagnosis and management of spinal muscular atrophy: Part 2: Pulmonary and acute care; medications, supplements and immunizations; other organ systems; and ethics // Neuromuscul Disord. – 2018. – 28 (3). – Р. 197‑207; doi: 10.1016/j.nmd.2017.11.004. Epub 2017 Nov 23. PMID: 29305137.
- Arevalo-Rodriguez I., Ciapponi A., Roqué i Figuls M., Muñoz L., Bonfill Cosp X. Posture and fluids for preventing post-dural puncture headache // Cochrane Database Syst Rev. –2016. – 3 (3). – CD009199; doi: 10.1002/14651858.CD009199.pub3. PMID: 26950232; PMCID: PMC6682345.
- Finkel R.S. et al. ENDEAR Study Group. Nusinersen versus Sham Control in Infantile-Onset Spinal Muscular Atrophy // N Engl J Med. – 2017. – 2. – 377 (18). – Р. 1723‑1732; doi: 10.1056/NEJMoa1702752. PMID: 29091570.
Тематичний номер «Неврологія, Психіатрія, Психотерапія» № 1 (56) 2021 р.