29 травня, 2021
Додаткові терапевтичні можливості кардіопротекції при COVID-19
Пандемія коронавірусної хвороби (COVID‑19), з якою людство зіткнулося вперше, стала нечуваним викликом для системи охорони здоров’я в усьому світі. Незважаючи на те що провідними клінічними проявами COVID‑19 є симптоми ураження органів дихання, до патологічного процесу при цьому захворюванні залучаються й інші органи та системи, що за тяжкого перебігу може зумовлювати розвиток поліорганної недостатності з фатальними наслідками. Зокрема, разом із респіраторною системою «мішенями» при COVID‑19 часто стають серце та судини.
У пацієнтів із COVID‑19 можуть розвиватися такі серцево-судинні ускладнення, як серцева недостатність, міокардит, перикардит, васкуліт, порушення серцевого ритму тощо. Встановлено, що вже на ранніх термінах перебігу COVID‑19 у 8-28% пацієнтів відзначається підвищення рівня в крові такого високоспецифічного кардіомаркера, як тропонін I, яке відображає розвиток ушкодження міокарда (Shi S. et al., 2020) і наразі вважається найнадійнішим його індикатором (Lippi G. et al., 2020). Підвищення рівня тропоніну I або його динамічне збільшення під час госпіталізації пов’язано з 5-кратним збільшенням ризику виникнення потреби в штучній вентиляції легень, а також із підвищенням ризику загрозливих для життя порушень серцевого ритму (як-от фібриляція шлуночків і шлуночкова тахікардія), 5-кратним збільшенням смертності. Підвищення рівня тропоніну I при COVID‑19 є вираженішим у пацієнтів із супутніми серцево-судинними захворюваннями (ССЗ), аніж у хворих без них (55 порівняно з 13% відповідно). Водночас кількість смертей була меншою серед пацієнтів, у яких не відзначалося підвищення рівнів тропоніну I (4,5-26%), і більшою – у хворих із підвищенням рівнів тропоніну I (51-61%) (Guo T. et al., 2020; Zhou F. et al., 2020; Shi S. et al., 2020).
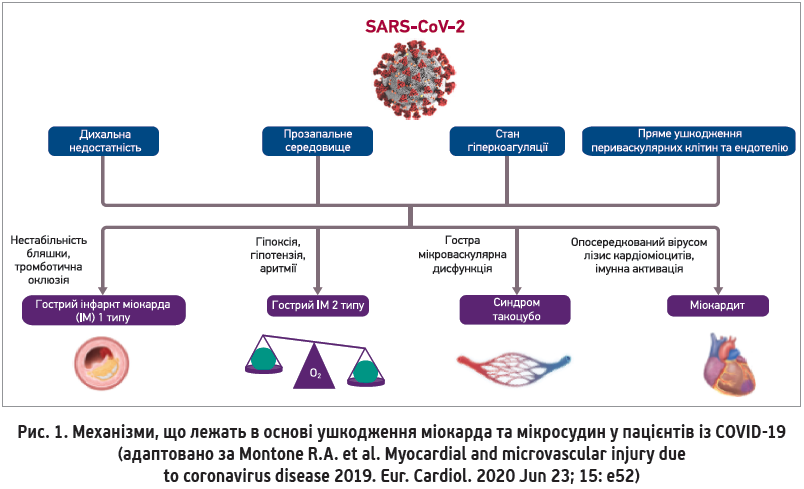
Отже, в пацієнтів із COVID‑19 ураження міокарда є досить частим і прогностично значимим ускладненням. Ушкодження міокарда та мікросудинне ураження в інфікованих SARS-CoV‑2 пацієнтів можуть спричиняти різноманітні (як ішемічні, так і неішемічні) механізми, за реалізації яких також з’являються різні клінічні наслідки (рис. 1).
Зокрема, ішемія міокарда може з’являтися внаслідок дисбалансу між постачанням кисню та потребою в ньому (ІМ 2 типу). Розвиток цього ускладнення в пацієнтів із COVID‑19 можуть зумовлювати декілька різних механізмів. Наприклад, спричинені септичним станом гіпотензія та гіпоксемія внаслідок порушення дихальної функції зумовлюють зменшення постачання кисню до серця, спричиняючи в такий спосіб розвиток гострого ушкодження міокарда, особливо в пацієнтів із фоновим хронічним коронарним синдромом (Wu C. et al., 2020). Підвищена потреба міокарда в кисні може бути наслідком стійких/рецидивних порушень серцевого ритму, про які повідомлялося в 16,7% усіх госпіталізованих пацієнтів із COVID‑19, а також у 44,4% хворих, які потребують переведення до відділення реанімації та інтенсивної терапії (Wang D. et al., 2020). Однак у деяких пацієнтів, госпіталізованих щодо COVID‑19, може з’являтися гострий ІМ 1 типу внаслідок того, що в них уже наявні бляшки в коронарних артеріях, які стають нестабільними через надмірну запальну активацію, зумовлену інфекцією SARS-CoV‑2. Оклюзії коронарних артерій також сприяє гіперкоагуляційний стан (Bikdeli B. et al., 2020).
Іншим важливим механізмом, відповідальним за ураження міокарда в пацієнтів із COVID‑19, є мікросудинна дисфункція. Мікросудинні порушення в таких хворих можуть бути наслідком надмірної системної запальної реакції та пов’язаної з нею ендотеліальної дисфункції. Крім того, передбачається й прямий вплив вірусу SARS-CoV‑2 на мікросудини, оскільки ключові клітинні рецептори, з якими він зв’язується (рецептори АПФ‑2), також експресуються на поверхні ендотеліоцитів (Varga Z. еt al., 2020). У дослідженні L. Chen і співавт. (2020) продемонстровано, що перицити в серці характеризуються високим рівнем експресії АПФ‑2, підтверджуючи в такий спосіб гіпотезу про те, що ушкодження перицитів унаслідок вірусної інфекції може спричиняти дисфункцію ендотеліоцитів у капілярах і мікросудинні порушення. Також добре відомо, що гостра коронарна мікросудинна дисфункція може спричиняти дебют синдрому такоцубо (Crea F. et al., 2020; Montone R. et al., 2020).
Ушкодження міокарда також може бути наслідком запального процесу – міокардиту. Слід зазначити, що в серії клінічних випадків (150 пацієнтів із COVID‑19), під час оцінки яких було повідомлено про 68 випадків смерті, 7% летальних наслідків були пов’язані з гострим міокардитом із недостатністю кровообігу (Ruan Q. et al., 2020).
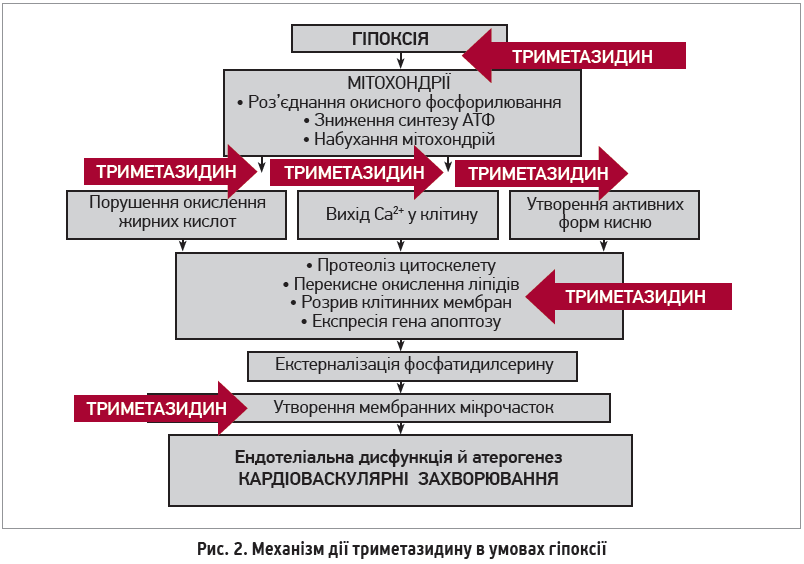
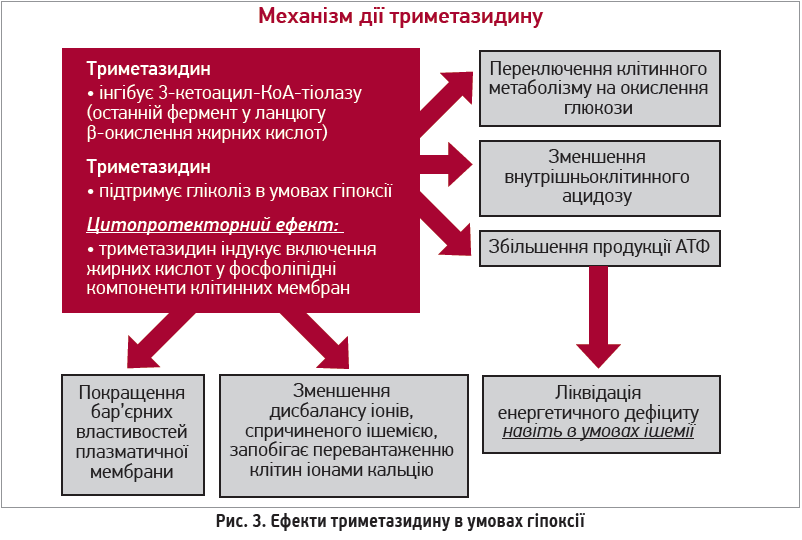
Із метою зменшення частоти розвитку ураження міокарда у хворих на COVID‑19 нещодавно було запропоновано використання лікарських засобів, які покращують мікроциркуляцію. Ця стратегія може бути особливо актуальною для тих пацієнтів, які вже мають фактори ризику наявної ендотеліальної дисфункції – чоловіча стать, куріння, гіпертензія, цукровий діабет, ожиріння та підтверджене ССЗ (Kuster G. M. et al., 2020; Montone R. A. et al., 2020). Під час установлення діагнозу COVID‑19 хворим із підтвердженою ІХС або іншими ССЗ рекомендується продовжувати раніше призначене лікування. Превентивне призначення кардіологічних препаратів пацієнтам, які їх раніше не приймали, наразі не рекомендується, але висловлюється думка про те, що деякі метаболічні лікарські засоби (зокрема, триметазидин) потенційно здатні полегшувати перебіг ускладнень із боку серця при COVID‑19 (Medvegy M., Simonyi G., 2021). Триметазидин являє собою конкурентний інгібітор 3-кетоацил-КоА‑тіолази (3-KAT) – останнього ферменту, що бере участь в окисненні жирних кислот. Стимуляція окиснення глюкози на тлі прийому триметазидину сприяє покращенню балансу між гліколізом та окисненням глюкози з подальшим зменшенням продукції лактату та внутрішньоклітинного ацидозу, наявного в ситуаціях міокардіальної ішемії або серцевої недостатності. В умовах ішемії процес отримання клітинами енергії шляхом окиснення глюкози потребує менше кисню (порівняно з β-окисненням жирних кислот). Механізм «перемикання» з окиснення вільних жирних кислот на окиснення глюкози дає можливість отримувати додатково 15% енергії, зменшуючи в такий спосіб споживання кисню (Medvegy M., Simonyi G., 2021). Триметазидин також має додаткові сприятливі біохімічні властивості: може сприяти збереженню внутрішньоклітинних рівнів фосфокреатину й аденозинтрифосфату, зменшувати перенавантаження кальцієм і вільнорадикальне ушкодження клітин, а також пригнічувати апоптоз (рис. 2). Усі ці біохімічні характеристики зумовлюють його сприятливі клінічні ефекти при серцевій недостатності (як ішемічного, так і неішемічного генезу), які були доведені в метааналізі 17 досліджень (955 пацієнтів): порівняно з плацебо триметазидин достовірно збільшував фракцію викиду, покращував функціональний стан за класифікацією Нью-Йоркської асоціації серця (NYHA) та толерантність до фізичного навантаження (Gao D. et al., 2011). Цікаво, що в експериментальних дослідженнях було продемонстровано: триметазидин знижував рівні прозапальних цитокінів у сироватці крові та в тканині серця, а також зменшував макрофагальну інфільтрацію міокарда (Chen J. et al., 2015) Ефекти триметазидину в умовах гіпоксії відображено на рисунку 3.
Отже, застосування триметазидину може розглядатись як перспективна допоміжна кардіопротекторна стратегія, спрямована на зменшення ризику ушкодження міокарда при COVID‑19. Наразі можливості призначення триметазидину з метою попередження гострого ушкодження міокарда в пацієнтів, госпіталізованих із COVID‑19, уже вивчаються під час відкритого рандомізованого інтервенційного дослідження PREMIER, яке було розпочато в грудні 2020 року (Gowdak L. H.W., InCor Heart Institute, ідентифікаційний номер дослідження в базі ClinicalTrials.gov: NCT04760821). До випробування залучено 80 пацієнтів (віком ≥18 років) із середньотяжким або тяжким гострим респіраторним дистрес-синдромом (ГРДС), спричиненим інфекцією SARS-CoV‑2. Хворі основної групи отримують стандартне лікування при ГРДС і триметазидин (35 мг 2 р/добу за швидкості клубочкової фільтрації (ШКФ) >60 мл/хв, 35 мг 1 р/добу – за ШКФ 30-60 мл/хв), контрольної – лише стандартне лікування. Гостре ушкодження міокарда в цьому дослідженні визначають за підвищенням рівня високочутливого серцевого тропоніну I. За допомогою цього випробування автори мають на меті довести, що використання триметазидину разом зі стандартною терапією зменшує ступінь гострого ураження міокарда в госпіталізованих із ГРДС хворих на COVID‑19.
Ще одним перспективним аспектом кардіопротекції у хворих на COVID‑19 (особливо в тих, які вже мають супутні ССЗ) може бути обмеження негативних наслідків надмірної активації симпатоадреналової системи, адже гострий психоемоційний стрес, який переживають пацієнти з COVID‑19, стає потужним фактором, що зумовлює надмірну активацію симпатичної нервової системи (СНС), клінічним маркером якої є збільшення частоти серцевих скорочень (ЧСС). Відомо, що тривала симпатична активація (т. зв. симпатичний овердрайв) асоційована з підвищенням ризику серцево-судинних ускладнень (зокрема, коронарних подій, розвитку серцевої недостатності, раптової серцевої смерті тощо). Тривожність, яка дуже часто розвивається при COVID‑19, здатна ще більше посилювати ураження міокарда, зумовлене симпатичною активацією, гіпертензією та несприятливими метаболічними змінами (Medvegy M., Simonyi G., 2021). Також відомо, що активація СНС і стимуляція адреноцепторів на тлі гострого психоемоційного стресу вносять вагомий внесок у розвиток дисфункції ендотелію, що зумовлює послаблення вазопротекції, а також сприяє зменшенню перфузії та розвитку ішемії (Poitras V. J.; Pyke K. E., 2013). Саме тому з метою пригнічення стійкої активації СНС доцільним є застосування β-адреноблокаторів, які конкурентно зв’язуються з β-адренорецепторами та блокують у такий спосіб зв’язування з ними адреналіну й норадреналіну. Препаратом вибору в цій клінічній ситуації може бути класичний, всебічно вивчений за допомогою низки клінічних досліджень кардіоселективний β-адреноблокатор бісопролол (Конкор®), який зменшує потребу міокарда в кисні за рахунок зменшення ЧСС та ударного об’єму, а також має антиаритмічні властивості. Крім того, важливою перевагою бісопрололу є те, що він виводиться з організму двома шляхами: 50% біотрансформується в печінці з утворенням неактивних метаболітів і виводиться нирками, 50% – нирками в незміненому вигляді, що дає змогу впевнено застосовувати його в пацієнтів, які мають супутні порушення функції нирок і печінки.
Під час пандемії COVID‑19 заслуговують на увагу й сучасні можливості нутритивної підтримки нормального енергетичного обміну речовин на клітинному рівні, якої насамперед потребують особи з уже наявними порушеннями в роботі серцево-судинної системи. Сьогодні з цією метою все ширше застосовується дієтична добавка Танікор, яка містить одразу три активні інгредієнти, що чинять сприятливий вплив на серцево-судинну систему людини: L‑аргінін, L‑карнітин та інозин. Так, добре відомо, що амінокислота L‑аргінін, яка є субстратом для утворення оксиду азоту (NO), здатна покращувати мікроваскулярну функцію шляхом посилення ендотелійзалежної вазодилатації (Melik Z. et al., 2017). Дані експериментальних і клінічних досліджень чітко демонструють позитивний вплив L‑аргініну на ендотелій при патологічних станах, асоційованих із його дисфункцією та зниженим синтезом NO (Cylwik D. et al., 2005). L‑карнітин здійснює транспортування в мітохондрії жирних кислот, які є субстратом для енергетичного обміну на рівні клітини, а також має потужні антиоксидантні властивості (Pekala J. et al., 2011; Ribas G. et al., 2014). Метаболіт аденозину (інозин) має здатність індукувати дилатацію коронарних артерій (Aviado D. M., 1983).
Отже, враховуючи ймовірність розвитку в пацієнтів із COVID‑19 мікросудинної дисфункції та опосередкованого різними патофізіологічними механізмами ушкодження міокарда, можна вважати доцільним превентивне використання допоміжних кардіопротекторних стратегій із застосуванням засобів, які мають доведений позитивний вплив на стан серцево-судинної системи.
Підготувала Вікторія Новікова
Медична газета «Здоров’я України 21 сторіччя» № 8 (501), 2021 р.