23 липня, 2021
Найкраще з ASCO-2021
(4-8 червня)

 Традиційний конгрес ASCO, який вважається найважливішою щорічною подією в галузі онкології, вдруге відбувся у віртуальному форматі. Проте це не завадило донести до дослідників і клініцистів найвагоміші досягнення минулого року. Для форумів ASCO, що проходять із 1964 р., визначилася своєрідна ієрархія доповідей, яку формують авторитетні експерти. Найвизначніші, за їх оцінкою, досягнення презентуються на Президентському симпозіумі (цього року таких доповідей було 5). Про істотні успіхи за основними типами злоякісних пухлин і їх лікуванням повідомляють на пленарних засіданнях у формі презентацій, при цьому чим менший номер презентації, тим важливішими вважають результати (цього року було 215 усних доповідей на понад 20 секціях). Решту представляють у формі стендових доповідей (1910) або публікацій (понад 2000). Пропонуємо увазі читачів лише доповіді, у яких аналізувалися вже зареєстровані в Україні препарати.
Традиційний конгрес ASCO, який вважається найважливішою щорічною подією в галузі онкології, вдруге відбувся у віртуальному форматі. Проте це не завадило донести до дослідників і клініцистів найвагоміші досягнення минулого року. Для форумів ASCO, що проходять із 1964 р., визначилася своєрідна ієрархія доповідей, яку формують авторитетні експерти. Найвизначніші, за їх оцінкою, досягнення презентуються на Президентському симпозіумі (цього року таких доповідей було 5). Про істотні успіхи за основними типами злоякісних пухлин і їх лікуванням повідомляють на пленарних засіданнях у формі презентацій, при цьому чим менший номер презентації, тим важливішими вважають результати (цього року було 215 усних доповідей на понад 20 секціях). Решту представляють у формі стендових доповідей (1910) або публікацій (понад 2000). Пропонуємо увазі читачів лише доповіді, у яких аналізувалися вже зареєстровані в Україні препарати.
Рак грудної залози
Президентський симпозіум відкривало повідомлення про прорив в ад’ювантній терапії значної групи хворих на рак грудної залози (РГЗ). PARP-інгібітор олапариб схвалено Управлінням з контролю якості харчових продуктів і лікарських препаратів США (FDA) за багатьма показаннями. Зокрема, він рекомендований хворим на метастатичний HER2-негативний РГЗ із зародковою мутацією BRCA1 або BRCA2, які раніше отримували хіміотерапію (ХТ) у (нео)ад’ювантному або паліативному режимі, а також після прогресування на тлі гормонотерапії при гормонопозитивному захворюванні. У рандомізованому дослідженні ІІІ фази OlympiA вперше продемонстровано ефективність олапарибу в ад’ювантному режимі у хворих із високим ризиком рецидиву. Препарат застосовували упродовж 1 року після завершення місцевого лікування і ХТ (не менше 6 циклів із використанням антрациклінів і/або таксанів). Загалом рандомізовано 1836 пацієнтів (у тому числі 1509 з потрійним негативним РГЗ). При попередньому проміжному аналізі з медіаною спостереження 2,5 року 3-річна виживаність без інвазивної хвороби (iDFS) становила 85,9% у групі олапарибу проти 77,1% у групі плацебо, а 3-річна виживаність без віддалених метастазів – 87,5 та 80,4% відповідно (Tutt et al. Abstr. LBA1. N. Engl. J. Med. 2021 Jun 24; 384(25): 2394‑2405).
У пацієнтів з потрійним негативним РГЗ, які мають залишкову інвазивну хворобу після завершення неоад’ювантної ХТ, існує дуже високий ризик рецидиву, що знижується при ад’ювантному застосуванні капецитабіну. У дослідженні EA1131 (рандомізовано 401 хворого) порівняли ефективність ад’ювантної терапії капецитабіном і препаратами платини. Трирічна iDFS у групі платини становила 40 проти 44% у групі капецитабіну. Натомість токсичність першого типу лікування була вищою. Вважають, що застосування препаратів платини в ад’ювантній терапії хворих на потрійний негативний РГЗ залишається експериментальним (I. Mayer et al. Abstr. 605).
Інгібітори CDK4/6 впевнено зайняли своє місце в паліативній терапії запущеного РГЗ. Їх комбінація з гормонотерапією істотно поліпшила результати лікування. Вже отримані 5-річні результати спостереження у відомих рандомізованих дослідженнях. Раніше остаточний аналіз загальної виживаності (ЗВ), визначений протоколом дослідження PALOMA‑3, який проводився з медіаною спостереження 44,8 міс, показав покращення ЗВ при застосуванні комбінації фулвестранту з палбоциклібом у другій лінії гормонотерапії порівняно з гормонотерапією + плацебо (медіана ЗВ 34,9 проти 28,0 міс; відносний ризик – ВР – 0,814). На конгресі ASCO‑2021 повідомлені результати з довшою медіаною спостереження – 73,3 міс. Продовжують спостерігати поліпшення ЗВ з ВР 0,806. П’ятирічна ЗВ становила 23,3% у групі комбінованої терапії проти 16,8% у групі фулвестранту. Ця різниця спостерігалась у більшості підгруп, за винятком пацієнтів, які були резистентними до гормонотерапії або попередньо отримували паліативну хіміотерапію (рис. 1; M. Cristofanilli et al. Abstr. 1000; серед співавторів презентації – Ігор Бондаренко).
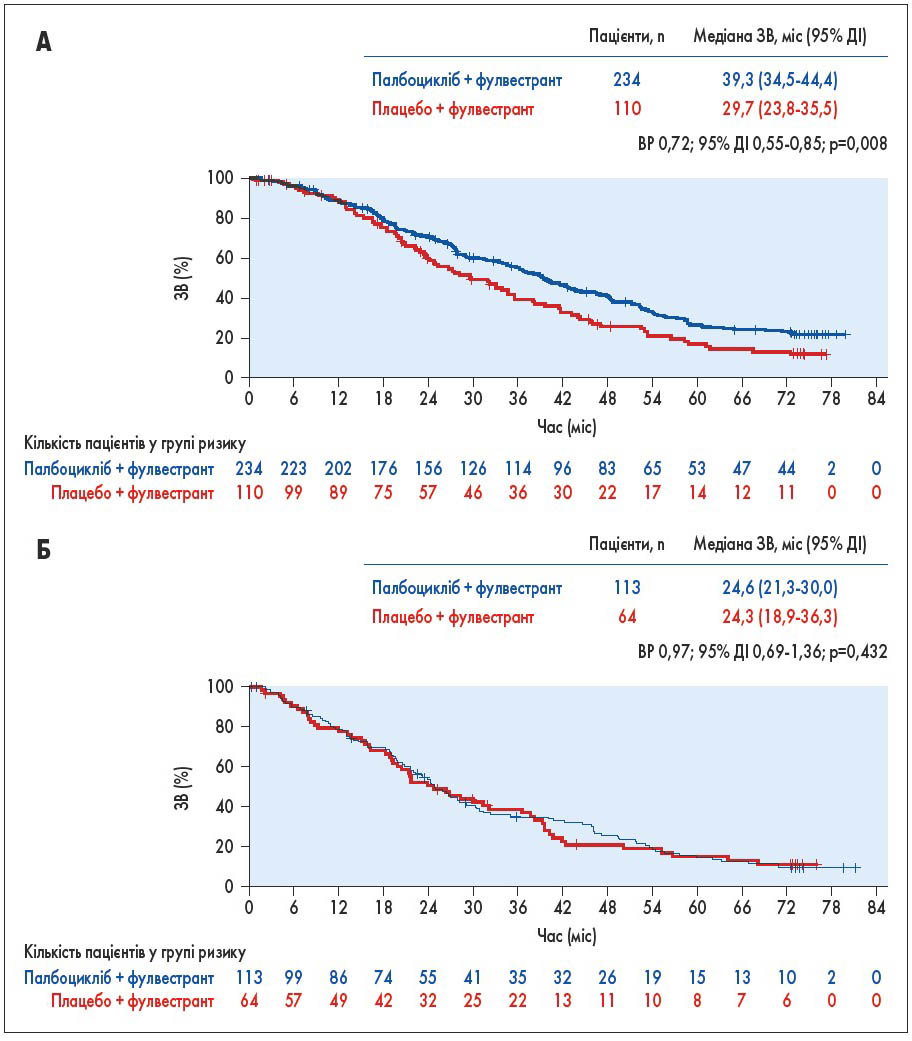 Рис. 1. Дослідження PALOMA-3: ЗВ залежно від попереднього проведення ХТ (Б) або без неї (А)
Рис. 1. Дослідження PALOMA-3: ЗВ залежно від попереднього проведення ХТ (Б) або без неї (А)
Оновлено результати ЗВ у дослідженні MONALEESA‑3. У ньому порівнювали комбінацію інгібітору CDK4/6 з фулвестрантом та фулвестрант у першій та другій лініях лікування хворих у постменопаузі з HR+/HER2-негативним РГЗ (медіана спостереження 56,3 міс). У загальній групі медіана ЗВ склала 53,7 проти 41,5 міс (рис. 2). У групі першої лінії терапії медіана не досягнута проти 51,8 міс (ВР 0,64), а у другій лінії дорівнювала 39,7 проти 33,7 міс (ВР 0,78). Слід зауважити, що за умовами протоколу після попереднього підтвердження ефективності рибоциклібу хворі з групи плацебо почали отримувати комбіновану терапію, це, безумовно, відобразилося на поліпшенні виживаності у контрольній групі (D. Slamon et al. Abstr. 1001).
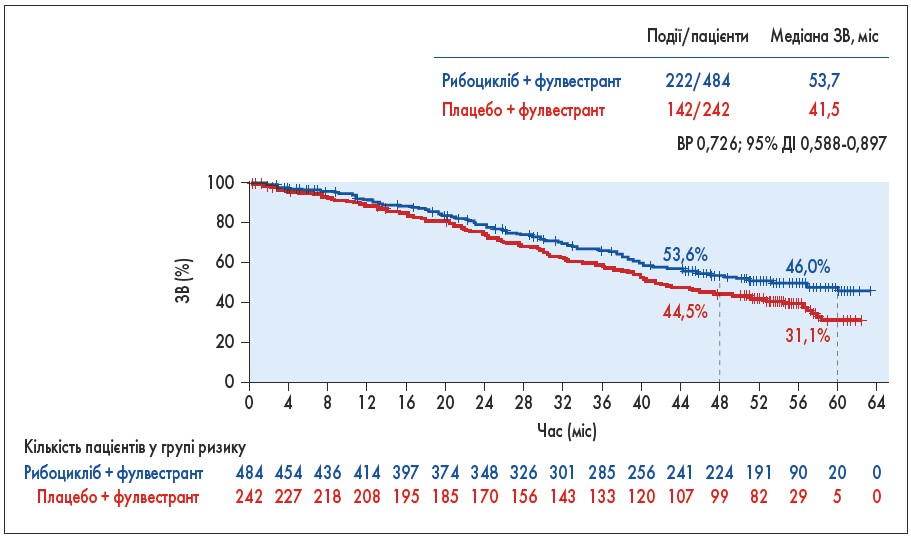 Рис. 2. Оновлені результати дослідження MONALEESA-3: перевага ЗВ підтримується при застосуванні комбінації рибоцикліб + фулвестрант проти плацебо + фулвестрант (>1 року покращення середньої ЗВ для загальної популяції)
Рис. 2. Оновлені результати дослідження MONALEESA-3: перевага ЗВ підтримується при застосуванні комбінації рибоцикліб + фулвестрант проти плацебо + фулвестрант (>1 року покращення середньої ЗВ для загальної популяції)
Недрібноклітинний рак легені
Ад’ювантна ХТ на основі препаратів платини забезпечує лише помірні 5-річні переваги щодо виживаності (4-5%) після радикальної операції з приводу недрібноклітинного раку легені (НДРЛ) ранніх стадій. У рандомізованому дослідженні IMpower010 (включено 1280 хворих, при цьому 1269 отримували ад’ювантну ХТ на основі цисплатину; рандомізовано після ХТ 1005 пацієнтів) вивчали роль однорічної ад’ювантної терапії атезолізумабом (16 тритижневих циклів у дозі 1200 мг) проти спостереження. Первинною кінцевою точкою була виживаність без ознак хвороби (disease-free survival, DFS). Медіана спостереження становила 32,8 міс. Атезолізумаб продемонстрував статистично значущу перевагу DFS порівняно зі спостереженням у пацієнтів з II‑IIIA стадією та PD-L1 TC ≥1% (медіана не досягнута у групі атезолізумабу проти 35,3 міс у групі спостереження; рис. 3; ВР 0,66) і всіх рандомізованих пацієнтів з II‑IIIA стадією (42,3 проти 35,3 міс; ВР 0,79). Вважають, що ці результати можуть змінити стандарт лікування хворих на НДРЛ II-IIIA стадії з PD-L1 TC ≥1% (H. Wakelee et al. Abstr. 8500; серед співавторів презентації – Ігор Винниченко та Олександр Голобородько).
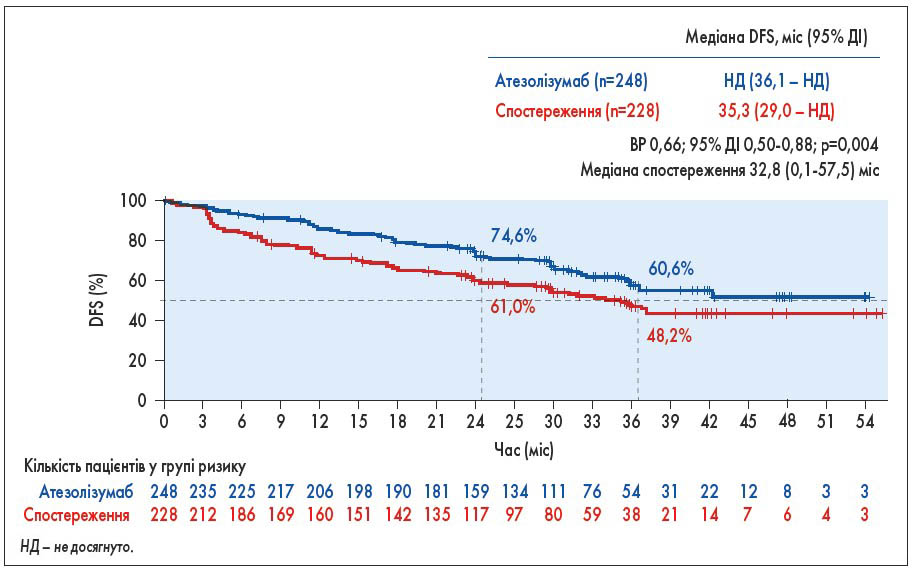 Рис. 3. Дослідження IMpower010: DFS у хворих на НДРЛ II-IIIA стадії з PD-L1 TC ≥1% (первинна кінцева точка)
Рис. 3. Дослідження IMpower010: DFS у хворих на НДРЛ II-IIIA стадії з PD-L1 TC ≥1% (первинна кінцева точка)
Сучасним стандартом лікування нерезектабельного НДРЛ ІІІ стадії є хіміопроменева терапія, після якої призначають однорічну консолідаційну терапію дурвалумабом (препарат не зареєстровано в Україні). У дослідженні ІІ фази KEYNOTE‑799 вивчають ефективність пембролізумабу в комбінації з хіміопроменевою терапією при нерезектабельному НДРЛ III стадії (перше введення пембролізумабу перед початком опромінення, наступні два на тлі хіміопроменевої терапії і ще 14 інфузій пембролізумабу в підтримуючій фазі). Ефективність склала близько 70% незалежно від гістологічної будови пухлини та експресії PD-L1. У понад 75% пацієнтів із відповіддю на лікування ефект тривав ≥12 міс; 12-місячна виживаність без прогресування (ВБП) становила >65%, а 12-місячна ЗВ >80%. Вважають, що застосування пембролізумабу є потенційним новим ефективним методом лікування у цій групі пацієнтів (Jabbour et al. Abstr. 8512).
Варіанти першої лінії лікування запущеного чи метастатичного НДРЛ без драйверних мутацій і з низькою експресією пухлиною PD-L1 (від 1 до 49%) включають різні схеми застосування лише імунотерапії або її поєднання з ХТ. Не зрозуміло, чи досягають вибрані підгрупи пацієнтів з низькою експресією пухлиною PD-L1 кращих результатів при застосуванні комбінованої хіміоімунотерапії. Під егідою FDA проведено ретроспективний комплексний аналіз, у якому порівнювали ЗВ і ВБП при використанні вказаних вище підходів до лікування. Загалом із 8 рандомізованих досліджень було вибрано 2108 пацієнтів з НДРЛ та експресією PD‑L1 1-49%. Цей зведений аналіз показав, що у пацієнтів, які отримували хіміоімунотерапію (n=639), ВБП і ЗВ були більшими (рис. 4), ніж в осіб, котрі отримували лише імунотерапію (n=529): медіана ВБП – 7,7 проти 4,2 міс (ВР 0,60), а медіана ЗВ – 21,4 проти 14,5 міс (ВР 0,68). Ці переваги підтверджено для пацієнтів віком 65-74 років та тих, хто має помірно порушений загальний стан за шкалою ECOG PS=1, але не виявлено різниці у віковій групі 75 років і старше, де комбіноване лікування не поліпшувало результатів порівняно з лише ХТ (Akinboro et al. Abstr. 9001).
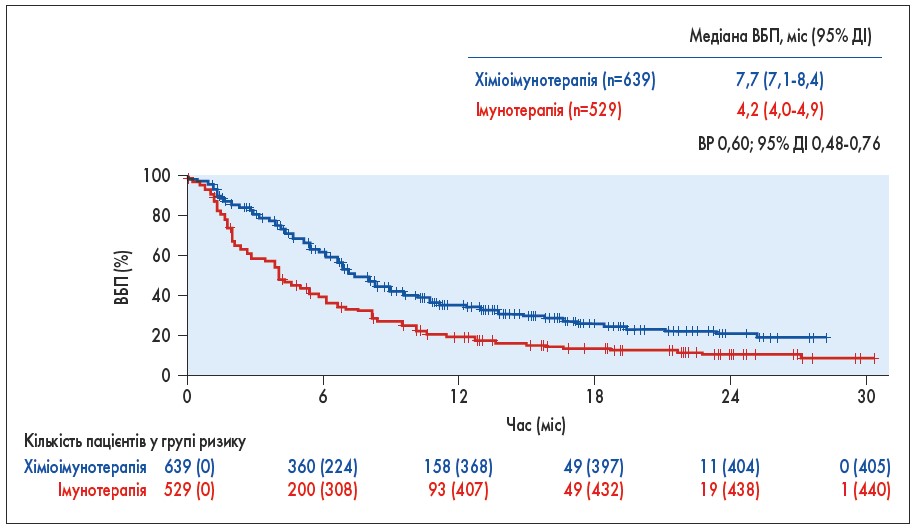 Рис. 4. Об’єднаний аналіз FDA даних щодо ВБП у першій лінії хіміоімунотерапії або імунотерапії при запущеному НДРЛ та експресії PD-L1 від 1 до 49%
Рис. 4. Об’єднаний аналіз FDA даних щодо ВБП у першій лінії хіміоімунотерапії або імунотерапії при запущеному НДРЛ та експресії PD-L1 від 1 до 49%
Результати деяких досліджень давали підстави вважати, що поява імуноопосередкованих побічних реакцій (irAE) є маркером покращення результатів імунотерапії НДРЛ. Проведено комплексний аналіз даних рандомізованих досліджень IMpower130, IMpower132 та IMpower150, у яких оцінювали ефективність атезолізумабу з ХТ (± бевацизумаб) у першій лінії лікування НДРЛ (всього проаналізовано дані 2503 хворих). irAE будь-якого ступеня спостерігались у 48% (група атезолізумабу) та 32% (контрольна група) пацієнтів. irAE 3-5 ступенів мали місце в 11 та 5% відповідно. У хворих, які отримували атезолізумаб і в них розвинулися irAE, ЗВ була вища, ніж за відсутності irAE (ВР 0,69). Водночас найкращі показники були у разі розвитку irAE 1-2 ступенів (коли можна було відновити імунотерапію), а найгірші – при ≥3 (можливо, через переривання чи припинення прийому препарату; M. Socinski et al. Abstr. 9002).
Багато презентацій було присвячено проблемі, яка загострилася (чи була штучно загострена) останнім часом, – це расові відмінності в лікуванні і його результатах при різних типах пухлин. Наприклад, при НДРЛ молекулярно-генетичне тестування (NGS) проводять 39,8% хворих із чорним кольором шкіри проти 50,1% із білим (р<0,0001). Участь у клінічних дослідженнях беруть відповідно 1,9 проти 3,9% таких пацієнтів (р=0,0002). Вважають, що ці відмінності можуть впливати на виживаність, через що слід покращити доступ і проведення відповідних тестів на біомаркери у хворих на НДРЛ обох рас (D. Bruno et al. Abstr. 9005).
Онкоурологія
Ще одне оприлюднене на Президентському симпозіумі дослідження, важливе і для українських онкологів, присвячене раку нирки. У 2020 р. у світі зафіксовано 179 000 випадків смерті через це захворювання. Стандартом лікування локорегіонарного нирковоклітинного раку (НКР) є нефректомія. Стандартної ад’ювантної терапії, підтвердженої доказами високого рівня, дотепер не встановлено. Дослідження ад’ювантної терапії анти-VEGF засобами (наприклад, сунітинібом) та біотерапії цитокінами (інтерферонами, інтерлейкіном‑2) дали неоднозначні та негативні результати відповідно. Рецидив захворювання після радикальної операції виникає майже у 50% пацієнтів, що призводить до скорочення тривалості їх життя. Фактори ризику розвитку рецидиву включають стадію/розмір пухлини, ураження лімфатичних вузлів, ядерний ступінь. Ефективна періоперативна терапія НКР для зменшення цього ризику досі не розроблена.
У дослідженні KEYNOTE‑564 (994 хворих) вивчали роль ад’ювантної однорічної терапії пембролізумабом (проти плацебо) при світлоклітинному НКР із середньовисоким і високим ризиком. Медіана спостереження становила 24,1 міс. Під час першого попереднього проміжного аналізу було встановлено, що медіана DFS (первинна кінцева точка) не досягнута в обох групах, але ВР склав 0,68 на користь пембролізумабу. Розрахункова DFS за 24 міс становила 77,3% для пембролізумабу та 68,1% для плацебо (рис. 5). Орієнтовна частота ЗВ протягом 24 міс становила 96,6% для пембролізумабу та 93,5% для плацебо. KEYNOTE‑564 є першим дослідженням ІІІ фази з позитивними результатами при використанні інгібітору контрольної точки як ад’ювантної терапії НКР. Ці результати дають можливість вважати пембролізумаб потенційним новим стандартом ад’ювантного лікування пацієнтів з НКР (T. Choueiri et al. Abstr. LBA5).
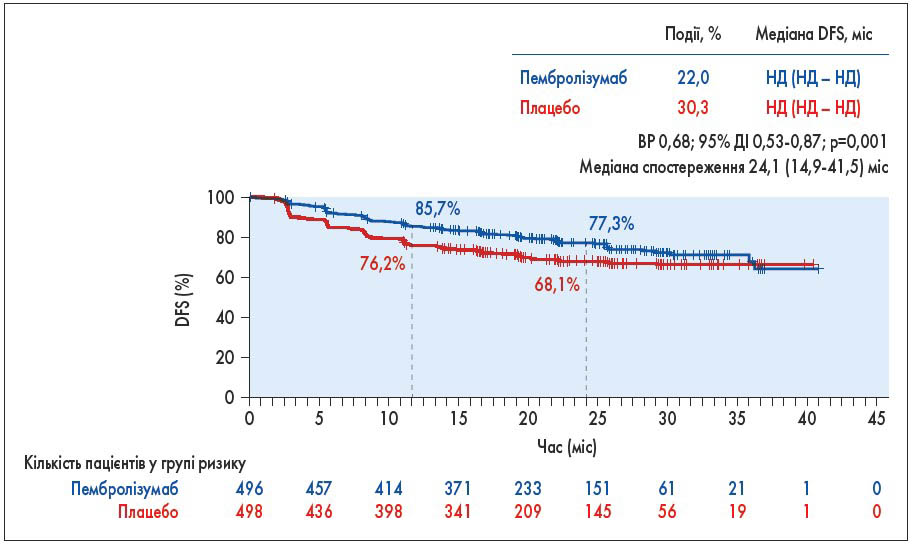 Рис. 5. Дослідження KEYNOTE-564: DFS
Рис. 5. Дослідження KEYNOTE-564: DFS
Раніше повідомлялися результати першого проміжного аналізу рандомізованого багатоцентрового відкритого дослідження ІІІ фази KEYNOTE‑426, присвяченого метастатичному світлоклітинному НКР (включено 861 пацієнта), в якому комбінація пембролізумабу з акситинібом істотно покращила ЗВ, ВБП і безпосередню ефективність порівняно зі стандартною монотерапією сунітинібом. При тривалішому спостереженні (медіана 30,6 міс) вища ефективність комбінації утримувалася. На форумі ASCO‑2021 представлено результати остаточного аналізу з найдовшим на сьогодні спостереженням за пацієнтами, котрим проводили імунотерапію анти-PD‑1/L1 засобами у поєднанні з інгібітором VEGF/VEGFR, – медіана його склала 42,8 міс (на цей час померли 418 хворих). Медіана ЗВ у групі комбінованої терапії становила 45,7 проти 40,1 міс у групі сунітинібу (ВР 0,73; р<0,001) (рис. 6). ЗВ протягом 42 міс становила 57,5% в групі комбінованої терапії проти 48,5% у групі сунітинібу; ВБП за цей час дорівнювала відповідно 25,1 проти 10,6%. На ЗВ, мабуть, вплинуло те, що після прогресування хвороби другу лінію лікування інгібітором PD‑1/L1 отримували 48,7% хворих контрольної групи проти лише 10,2% групи пембролізумабу з акситинібом (B. Rini et al. Abstr. 4500; серед співавторів презентації Віктор Стусь, Ігор Винниченко, Анна Крижанівська).
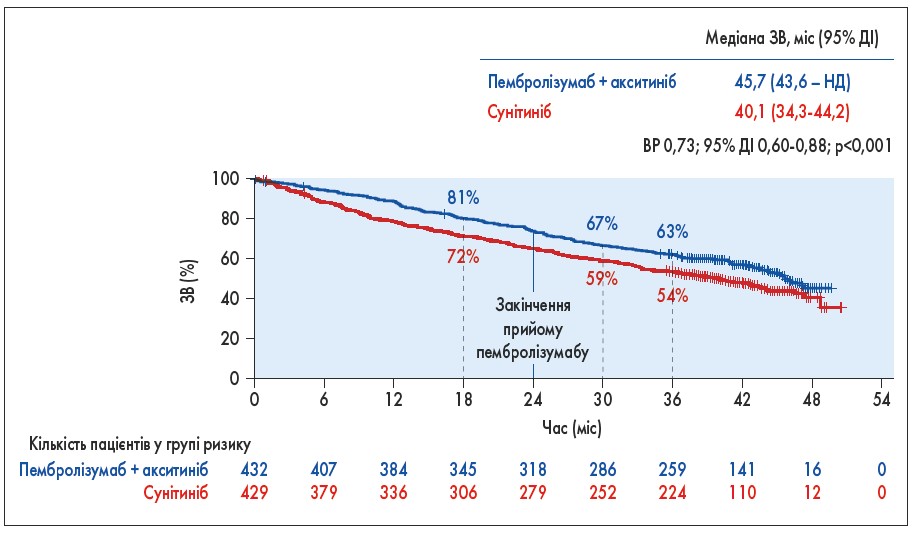 Рис. 6. Дослідження KEYNOTE-426: ЗВ
Рис. 6. Дослідження KEYNOTE-426: ЗВ
На підставі результатів дослідження II фази KEYNOTE‑052 пембролізумаб схвалений FDA для лікування пацієнтів з місцевим запущеним або метастатичним уротеліальним раком, які не підлягають ХТ, що містить цисплатин, і пухлини яких експресують PD-L1 (CPS ≥10). На конгресі ASCO‑2021 повідомили результати 5-річного спостереження. Об’єктивний ефект у загальній групі склав 28,9% при медіані тривалості ефекту 33,4 міс та медіані ЗВ 11,3 міс. У пацієнтів з CPS ≥10 (ефективність 47,3%; медіана тривалості ефекту не досягнута, а медіана ЗВ – 18,5 міс), як видається, частіше досягається відповідь на застосування пембролізумабу, ніж у пацієнтів з CPS <10 (ефективність 20,7%), що вже відображено у рекомендаціях FDA (P. O’Donnell et al. Abstr. 4508).
Пембролізумаб затверджений для використання при запущеному уротеліальному раку після ХТ на основі платини (тобто при платинорезистентності) на основі результатів дослідження III фази KEYNOTE‑045. На форумі ASCO‑2021 повідомили, що при монотерапії пембролізумабом утримувалося покращення ЗВ (медіана 10,1 міс при застосуванні пембролізумабу проти 7,2 міс при вибраній дослідником ХТ), загального ефекту (21,9 проти 11,0%) та його тривалості (29,7 проти 4,4 міс). Оновлені дані узгоджуються з попередніми, які зумовили схвалення пембролізумабу при платинорезистентному або платинорефрактерному уротеліальному раку (J. Bellmunt et al. Abstr. 4532).
Історично склалося, що андрогендеприваційна терапія була стандартним методом лікування чоловіків із метастатичним гормоночутливим раком передміхурової залози. Упродовж останніх років показано, що її поєднання з ХТ доцетакселом, новими гормональними засобами або променевою терапією покращує ЗВ, і ці підходи стали новими стандартами лікування. Однак не відомо, чи може поєднання цих нових методів лікування додатково до андрогендеприваційної терапії ще більше покращити результати. Дослідження ІІІ фази PEACE‑1 (рандомізовано 1173 пацієнти) проведене для оцінювання ефективності додавання абіратерону та/або опромінення до стандартної терапії у таких пацієнтів. З’ясувалося, що додавання абіратерону до стандартної гормонотерапії + доцетаксел значно подовжувало радіологічну ВБП: медіана склала 4,5 міс при застосуванні абіратерону проти 2,2 міс при стандартному лікуванні (ВР 0,54). Дослідники дійшли висновку, що додавання абіратерону до андрогендеприваційної терапії + доцетаксел – це потенційний новий стандарт допомоги пацієнтам із первинним метастатичним гормоночутливим раком передміхурової залози (K. Fizazi et al. Abstr. 5000).
Онкогінекологія
Рак шийки матки є поширеною причиною смерті від злоякісних пухлин у жінок у всьому світі (щорічно фіксують 570 000 діагнозів та 311 000 випадків смерті). Стандартним методом лікування місцевого запущеного захворювання є хіміопроменеве лікування. Однак у значної частини пацієнток виникають рецидиви, вони помирають внаслідок прогресування метастатичного захворювання. У метааналізі (2008) результатів двох рандомізованих досліджень було повідомлено про абсолютну перевагу 5-річної ЗВ у 19% (ВР 0,46; р=0,00002) при додаванні ад’ювантної ХТ після завершення хіміопроменевої терапії. У презентованому на Президентському симпозіумі рандомізованому дослідженні OUTBACK (включено 926 пацієнток із місцевим запущеним раком шийки матки IB1‑IVA стадії) також оцінювали доцільність доповнення хіміопроменевої терапії (40-45 Гр за 20-25 фракцій з брахітерапією + ХТ цисплатином по 40 мг/м2 площі поверхні тіла щотижнево) ще 4 циклами ад’ювантної ХТ (карбоплатин + паклітаксел). Виживаність через 5 років спостереження була зіставною у тих, хто отримував ад’ювантну ХТ, порівняно з контрольною групою – як безрецидивна виживаність (63 проти 61%; ВР 0,87), так і ЗВ (72 проти 71%; ВР 0,91). Таким чином, у дослідженні OUTBACK не підтверджено висновків попереднього метааналізу, і його автори вважають недоцільним проведення ад’ювантної ХТ у таких хворих, хоч допускають необхідність інших ґрунтовних досліджень у цьому напрямі (L. Mileshkin et al. Abstr. LBA3).
Майже десять років тому на основі результатів дослідження GOG‑0218 додавання до стандартної ХТ бевацизумабу в дозі 15 мг/кг маси тіла через кожні 3 тижні упродовж 15 міс у першій лінії лікування після оперативного втручання стало стандартом, але оптимальна тривалість застосування бевацизумабу залишалася не відомою. У дослідженні ENGOT/GCIG (рандомізовано 927 жінок) порівнювали 15-місячне лікування бевацизумабом (контрольна група) з 30-місячним. Медіана ВБП склала 24,2 проти 26,0 міс (ВР 0,99), а ЗВ – 54,3 проти 60,0 міс (ВР 1,04). Таким чином, триваліше лікування бевацизумабом не покращує ні ВБП, ні ЗВ у пацієнток із первинним епітеліальним раком яєчника, маткових труб або первинним перитонеальним раком (J. Pfisterer et al. Abstr. 5501).
Важливу для щоденної практики проблему аналізували у дослідженні TOTEM. Наскільки доцільним є інтенсивне спостереження з регулярними оглядами і застосуванням різних обстежень (у нашій традиції – диспансеризація) після радикального лікування? Відомо, що приблизно у 20% пацієнток рак ендометрія рецидивує після радикального лікування, в більшості випадків – упродовж 3 років від початку терапії, а рецидиви часто є симптомними (від 40 до 91% пацієнток). Донедавна рекомендації щодо спостереження за такими пацієнтками були суперечливими. Як наслідок – витрачаються величезні інвестиції клінічних ресурсів на основі обмежених даних за відсутності доказових досліджень. У рандомізованому дослідженні TOTEM порівняли 5-річну ЗВ у пацієнток після радикального лікування раку ендометрія, які перебували під інтенсивним або мінімальним спостереженням. Інтенсивне спостереження не покращило ЗВ порівняно з мінімальним, у тому числі у пацієнток із високим ризиком розвитку рецидиву. Дослідники припускають, що немає необхідності регулярно призначати вагінальну цитологію, лабораторні або візуалізаційні дослідження додатково до мінімального режиму спостереження (Zola et al. Abstr. 5506).
Шлунково-кишковий тракт
Блокада PD‑1 має клінічну користь при солідних пухлинах із мікросателітною нестабільністю (MSI-H) або дефіцитом виправлення помилок реплікації (dMMR) після попередньої терапії, у тому числі при метастатичному колоректальному раку (мКРР). У дослідженні III фази KEYNOTE‑177 (включили 307 хворих) порівнювали безпеку й ефективність застосування у першій лінії пембролізумабу та ХТ (на вибір дослідника – mFOLFOX6 або FOLFIRI через кожні 2 тижні ± бевацизумаб) при мКРР з MSI-H або dMMR. Раніше повідомлялися результати другого проміжного аналізу, згідно з якими у групі пембролізумабу порівняно з ХТ значно подовжувалася ВБП (ВР 0,60; р=0,0002) при меншій частоті серйозних побічних ефектів. На конгресі ASCO‑2021 представлено остаточний аналіз ЗВ через 12 міс після другого проміжного аналізу. Медіана спостереження склала майже 4 роки в обох групах. Медіана ЗВ за цей час у групі пембролізумабу не була досягнута, а у групі ХТ становила 36,7 міс (рис. 7). Ця різниця не досягла статистичної значущості, що пов’язують із застосуванням після прогресування у другій лінії у більшості (60%) пацієнтів з групи ХТ анти-PD‑1/L1 препаратів. Таким чином, ці дані ще раз підтверджують застосування пембролізумабу як нового стандарту першої лінії у хворих на мКРР з MSI-H/dMMR (T. Andre et al. Abstr. 3500).
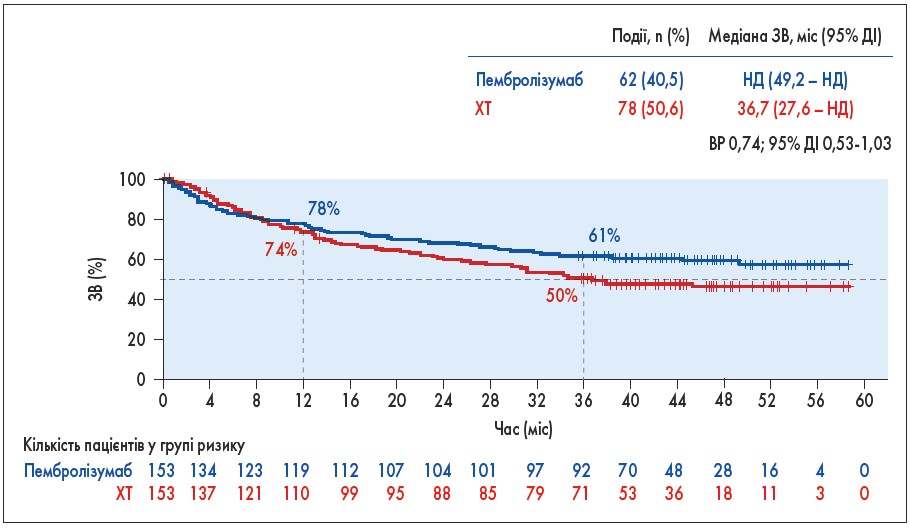 Рис. 7. Дослідження KEYNOTE-177: остаточний аналіз ЗВ
Рис. 7. Дослідження KEYNOTE-177: остаточний аналіз ЗВ
Цікаву практичну проблему вивчали британські онкологи у дослідженні FOCUS4 (254 пацієнти з мКРР, у яких після 16-тижневої першої лінії паліативної терапії не було прогресування; цікаво, що згідно з британським стандартом у першій лінії не призначали бевацизумаб, тобто це близька до української рутинної практики клінічна ситуація). Хворих рандомізували у групу підтримуючої терапії капецитабіном і активного спостереження. З’ясувалося, що застосування тактики «канікул» у лікуванні не вплинуло на ЗВ – її медіана склала 14,8 проти 15,2 міс (ВР 0,98; R. Adams et al. Abstr. 3504).
Метастатичний рак жовчних шляхів – це дуже складний для лікування злоякісний процес. Стандартною першою лінією є комбінація гемцитабіну з цисплатином. Потенційну другу лінію вивчали у рандомізованому дослідженні IIB фази NIFTY (178 хворих). У контрольній групі застосовували комбінацію фторурацилу з лейковорином, а в основній її доповнювали ліпосомальним іринотеканом. Медіана ВБП за даними засліпленої оцінки становила 1,4 проти 7,1 міс (ВР 0,56; p=0,0019), а медіана ЗВ – 5,5 проти 8,6 міс (ВР 0,68; р=0,0349) на користь досліджуваного підходу. Автори вважають, що ці дані дають підстави рекомендувати комбінацію ліпосомального іринотекану з фторурацилом і лейковорином як стандартну терапію другої лінії при прогресуванні метастатичного раку жовчних шляхів (C. Yoo et al. Abstr. 4006).
Трастузумаб + ХТ є стандартним методом першої лінії лікування HER2-позитивного метастатичного раку шлунка та шлунково-стравохідного з’єднання. У двох дослідженнях ІІ фази поєднання такої терапії з пембролізумабом показало перспективну ефективність і безпеку. На форумі ASCO‑2021 повідомлено перші результати рандомізованого подвійного сліпого плацебо-контрольованого дослідження ІІІ фази KEYNOTE‑811, в якому оцінюють, чи додавання пембролізумабу до стандартного лікування покращує його ефективність. Проаналізовано дані перших 264 рандомізованих пацієнтів (набір усіх запланованих 692 хворих закінчився наприкінці червня 2021 р.). Частота підтвердженого об’єктивного ефекту (повне і часткове регресування) становила 74,4% для комбінації пембролізумабу зі стандартним лікуванням проти 51,9% у контрольній групі (різниця склала 22,7%, р=0,00006; Y. Janjigian et al. Abstr. 4013; серед співавторів презентації – Олексій Колесник). Ці дані дали можливість FDA 5 травня 2021 р. затвердити цей метод лікування HER2-позитивного метастатичного раку шлунка та шлунково-стравохідного з’єднання.
На відміну від детального обговорення онкологічних наслідків расових відмінностей, іншій актуальній проблемі сьогодення – пандемії COVID‑19 – на конгресі ASCO приділили значно менше уваги. Зокрема, як і слід було очікувати, у США пандемія призвела до зменшення кількості хворих на КРР ранніх стадій серед вперше виявлених і збільшення – із запущеними стадіями: із I стадією 22% у 2019 р. проти 16% у 2020 р.; із IV – 6% у 2019 р. проти 18% у 2020 р. Подібна ситуація спостерігається і щодо РГЗ: з І стадією – 64 проти 51%; із IV – 2 проти 6% (J. Zhou et al. Abstr. 6501).
Меланома
Пембролізумаб є одним із затверджених стандартів ад’ювантної терапії меланоми шкіри (за висновками дослідження KEYNOTE‑054, які повідомлялися раніше). На конгресі ASCO‑2021 представлено результати застосування пембролізумабу при прогресуванні хвороби (без метастазів у мозку). Проводився перехід від плацебо до пембролізумабу (155 пацієнтів) або повторно застосовувався пембролізумаб (20 хворих, у яких рецидив виник через ≥6 міс після закінчення однорічної ад’ювантної терапії). У першій підгрупі медіана ВБП склала 8,5 міс, у другій – 4 міс Дослідники дійшли висновку, що результати ВБП та безпосередній об’єктивний ефект пембролізумабу при його застосуванні після плацебо в KEYNOTE‑054 такі самі, як у попередніх дослідженнях (KEYNOTE‑006, CheckMate 067) у пацієнтів із запущеною меланомою (A. Eggermont et al. Abstr. 9500).
Україна посіла важливе місце у міжнародних дослідженнях із пошуку нових ефективних методів лікування злоякісних пухлин. Це певною мірою відобразилося на конгресі ASCO. Принаймні, серед співавторів 18 презентацій чи публікацій є українські онкологи. Крім названих вище, це дослідження нових препаратів: плінабуліну (Abstr. 533 і Abstr. 546 – Григорій Адамчук; Abstr. 547 – Ігор Бондаренко), тезетакселу (Abstr. 1061 – Ігор Бондаренко, Ярослав Шпарик, Євген Готько), риндодестранту (Abstr. 1063 – Дінара Риспаєва), рукапарибу (Abstr. 5517 – Ярослав Шпарик, Ігор Бондаренко, Валентин Свінціцький), бозутинібу (Abstr. 7009 – Ірина Дягіль), селіноксору (Abstr. 8019 і Abstr. 8024 – Мар’яна Сімонова, Ірина Крячок, Галина Пилипенко), цеміплімабу (Abstr. 9078 і Abstr. 9085 – Ігор Бондаренко), JTX‑4014 (TPS9137 – Олег Кобзєв, Юрій Остапенко, Григорій Урсул, Василь Бойко, Віктор Парамонов), біосиміляру бевацизумабу MB02 (E15003 – Дмитро Трухін, Ігор Бондаренко, Сергій Шевня), вакцини imu‑131 (E16065 – Дінара Риспаєва).
Таким чином, конгрес ASCO‑2021 продемонстрував істотні досягнення у лікуванні злоякісних пухлин. Поступ триває, незважаючи на труднощі, які пов’язані з пандемією, різними соціальними, політичними та економічними негараздами. Можна з упевненістю сказати, що презентовані на форумі ASCO‑2021 підходи до лікування дадуть можливість вплинути на тривалість і якість життя пацієнтів зі злоякісними пухлинами.
Тематичний номер «Онкологія, Гематологія, Хіміотерапія» № 3 (70) 2021 р



